比较两种血红蛋白A2测定方法对轻型α地中海贫血的诊断性能
王展强 杨华文 黄基伟 李亚红 曹东林 雷达
广东省第二人民医院检验医学部(广州 510317)
α 地中海贫血(α 地贫)是由于α 珠蛋白基因缺陷导致的遗传性溶血性贫血[1]。随着α 珠蛋白基因缺陷数量的增加,相应临床症状逐渐加重[2-3],其中中间型和重型地贫患者只能依赖输血维持生命[4-5]。血红蛋白A2(hemoglobin A2,HbA2)是产前诊断中α 地贫筛查的重要指标之一[6-8],结合血常规可初步判断患者是否携带地贫基因[9],并能节约社会医疗资源[10]。近年来高效液相色谱法(high performance liquid chromatography,HPLC)和毛细管区带电泳(capillary zone electrophoresis,CZE)广泛应用于HbA2 的检测[11-12],多项研究比较了HPLC 和CZE 对HbA2 的检测性能[13-15],但尚无研究比较这两种方法检测HbA2 对α 地贫的诊断性能及其截断值,本研究拟收集2019-2021年期间到本单位进行α 地贫筛查患者的临床信息,比较CZE(法国赛比亚公司的Sebia 全自动电泳仪)和HPLC(美国伯乐公司的血红蛋白分析系统)两种方法测定的HbA2 对轻型α 地贫的诊断性能及截断值,为产前诊断中α 地贫筛查提供诊断依据。
1 资料与方法
1.1 病例资料选取2019年1月至2021年12月在广东省第二人民医院进行α 地贫筛查的患者纳入研究,收集患者临床信息包括血常规、HbA2 和α 地贫基因结果等,根据α 地贫基因结果分为对照组和轻型α地贫组。
1.2 纳入与排除标准轻型α 地贫组纳入标准:(1)年龄在18~60 岁之间;(2)α 地贫基因结果为轻型。对照组纳入标准:(1)年龄在18~60 岁之间;(2)α 地贫基因结果为阴性。排除标准:(1)携带β 地贫基因缺陷(突变/缺失);(2)α 地贫基因结果为静止型、中间型和重型;(3)合并有缺铁性贫血或其他基础性疾病如高血压、糖尿病等。
1.3 研究方法
1.3.1 血常规检测按照说明书使用Sysmex 全自动血球仪(型号:XN-3000,日本希思美康公司)及其配套试剂检测全血样本,获取红细胞的红细胞平均体积(mean corpuscular volume,MCV)和红细胞平均血红蛋白量(mean corpuscular hemoglobin,MCH)。
1.3.2 HbA2 的检测按照说明书使用血红蛋白分析系统(型号:VariantⅡ,美国伯乐公司)和Sebia全自动电泳仪(型号:APILLARYS OCTA3,法国赛比亚公司)及其相应配套试剂检测全血样本,获取患者HbA2 的含量。
1.3.3 α地贫基因检测按照说明书使用EZHighTMDNA Extraction Kit 提取全血样本DNA;按照说明书使用α 地贫基因检测试剂盒(中国亚能生物)对α 地贫基因进行分型测定,其中采用跨越断裂点PCR 原理检测α-地贫基因缺失位点(包括东南亚缺失型(--SEA/αα)、3.7缺失型(-α3.7/αα)、4.2缺失型(-α4.2/αα)),采用PCR-反向点杂交原理检测α-地贫基因突变位点(包括Hb CS(CD142),TAA→CAA;Hb WS(CD122),CAC→CAG 和Hb QS(CD125),CTG→CCG)。
1.4 统计学方法使用SPSS 19.0 进行统计分析。参数资料采用均数加减标准差进行描述并使用独立样本t检验进行统计分析。采用ROC 曲线分析HbA2 对轻型α 地贫的诊断性能及截断值。P<0.05 为差异有统计学意义。
2 结果
2.1 人群特征本研究共纳入1 887 例受检者,其中共有1 176 例受检者使用HPLC 检测HbA2(含218例轻型α地贫患者,占18.54%,表1);另有711 例受检者使用CZE 检测HbA2(含169 例轻型α 地贫患者,占23.77%,表1)。在使用HPLC 检测HbA2的218 例轻型α 地贫患者中,共有214 例诊断为东南亚缺失型,其他双重杂合突变的轻型α 地贫有4 例;而使用CZE 检测HbA2 的169 例轻型α 地贫患者中,共有165 例诊断为东南亚缺失型,其他双重杂合突变有3 例。
收集上述受检者的临床信息并分析,结果显示与对照组相比,轻型α 地贫组的MCV、MCH 和HbA2 在HPLC 和CZE 检测的人群中均降低(表1),这提示轻型α 地贫患者呈小细胞低色素性贫血,同时α 地贫基因的缺陷也导致HbA2 含量下降。2.2 CZE 的特异度和灵敏度均优于HPLC根据α 地贫基因结果,计算不同HbA2 截断值诊断轻型α 地贫的灵敏度和特异度,根据尤登指数选择最佳的截断值。结果显示使用HPLC 检测HbA2 时,当HbA2 为2.8%时,尤登指数最大,为0.383,对应的灵敏度和特异度分别为82.6%和55.7%(表2);使用CZE 检测HbA2 时,当HbA2 为2.6%时,尤登指数最大,为0.485,对应的灵敏度和特异度分别为91.1%和57.4%(表2),这提示当HbA2 分别取上述截断值时,CZE 诊断轻型α 地贫的特异度和灵敏度均优于HPLC。
表1 人群特征Tab.1 Characteristics of the study population ±s
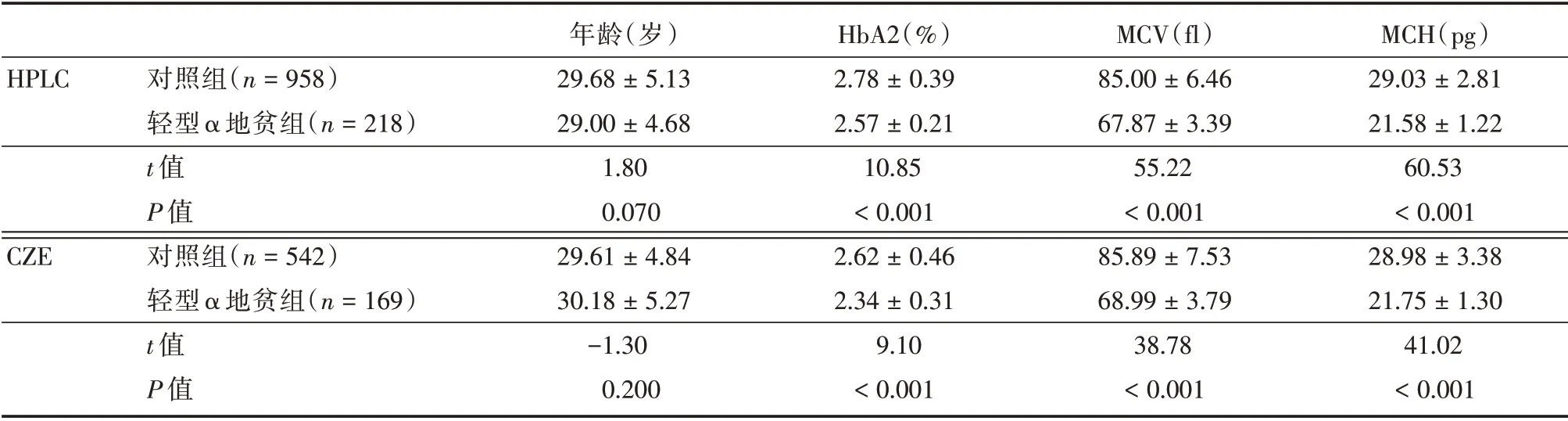
表1 人群特征Tab.1 Characteristics of the study population ±s
HPLC CZE对照组(n=958)轻型α 地贫组(n=218)t 值P 值对照组(n=542)轻型α 地贫组(n=169)t 值P 值年龄(岁)29.68±5.13 29.00±4.68 1.80 0.070 29.61±4.84 30.18±5.27-1.30 0.200 HbA2(%)2.78±0.39 2.57±0.21 10.85<0.001 2.62±0.46 2.34±0.31 9.10<0.001 MCV(fl)85.00±6.46 67.87±3.39 55.22<0.001 85.89±7.53 68.99±3.79 38.78<0.001 MCH(pg)29.03±2.81 21.58±1.22 60.53<0.001 28.98±3.38 21.75±1.30 41.02<0.001

表2 HbA2 在轻型α 地贫诊断中的截断值Tab.2 The cut-off point of HbA2 in the diagnosis of α-thalassemia trait
2.3 CZE的诊断性能优于HPLC根据不同HbA2截断值对应的特异度和灵敏度,分别绘制HPLC 和CZE 的ROC 曲线,结果显示使用HPLC 检测HbA2时,HbA2 诊断轻型α 地贫ROC 曲线AUC 为0.715(95%CI:0.682~0.747,P<0.001,图1A);而使用CZE 检测HbA2 时,AUC 为0.786(95%CI:0.751~0.821,P<0.001,图1B),这提示CZE 的诊断性能优于HPLC。

图1 受试者工作曲线Fig.1 Receiver operating characteristic curve
3 讨论
α 地贫好发于东南亚、地中海、南亚、中东和非洲等热带和亚热带地区[16-17]。在我国广东、广西地区α地贫携带率最高,分别为9.46%和14.13%[18],此外,香港、台湾、福建、江西、云南和贵州等地区的α 地贫发病情况也较为严峻[19]。在产前诊断中开展地贫筛查可降低地贫患儿的出生率,是阻止中间型和重型地贫患儿出生的有效措施,有利于提高人口质量[20-21]。本文通过收集2019-2021年期间本单位地贫筛查患者的临床信息,首次通过回顾性研究比较了这两种方法检测HbA2 对轻型α 地贫的诊断性能和截断值。本研究发现与对照组相比,轻型α 地贫患者的MCV、MCH 和HbA2 含量降低,HPLC 和CZE 两种方法检测HbA2 对轻型α 地贫均有较好的诊断性能,其截断值分别为2.8%和2.6%,同时本研究首次发现使用CZE 检测HbA2 时,对轻型α 地贫的诊断性能优于HPLC。
由于珠蛋白基因缺陷,珠蛋白合成障碍,α 地贫患者的红细胞相关参数异常,本研究发现与对照组相比,轻型α 地贫组的MCV、MCH 和HbA2 均降低,这与前人的研究结果相一致[6,22-23]。然而有研究指出缺铁性贫血患者的MCV、MCH 与地贫患者差异无统计学意义[24],因此使用上述指标进行地贫筛查时应与缺铁性贫血相鉴别。同时本研究发现使用HbA2 诊断轻型α 地贫时,CZE 的截断值为2.6%,这与多项研究较为接近[6-7];而HPLC 的截断值为2.8%,远远低于前人的研究[25],这可能是由于在该研究中没有区分静止型α 地贫和轻型α 地贫的缘故。此外,在本研究中CZE 的截断值低于HPLC(2.6%vs.2.8%),这可能是由于其他血红蛋白变异体对CZE 的影响小于HPLC 如HbE 等[26],当使用HPLC 无法区分HbA2 与其他血红蛋白变异体时,CZE 则能够更好地区分,使得CZE 测得的HbA2 更接近真实值[15]。
本研究依然存在以下不足,首先,本研究纳入的研究人群较大,无法同时使用两种方法检测同一患者的HbA2,无法比较两种方法检测结果的一致性;其次,本研究仅限于18~60 岁人群中轻型α地贫患者,未对其他年龄段和亚型进行研究分析;最后,本研究属于回顾性研究,仅能收集到目前存在的数据,无法全面反映轻型α 地贫患者的状态。因此,为了解决上述问题,还需要进行更深入的前瞻性临床研究。此外,本研究发现CZE 的诊断性能优于HPLC,如何将CZE 测得的HbA2 与血常规结合以建立一套低成本、低漏诊率和高特异度的地贫筛查流程并向临床推广应用还需要进一步研究。

