心房肌细胞外泌体miR-130在房颤发病中的作用机制
黄江伟 江鑫 蒋长荣 龚慧琴 齐明旭
南华大学附属南华医院1心血管内科,2急诊科(湖南衡阳 421002)
心房颤动(atrial fibrillation,AF)是最常见的心律失常之一,会导致患者发生血栓栓塞事件和心力衰竭的风险增加[1]。心房心肌纤维化是发生在AF 心脏重构中的特征性表现[2]。因此,阐明心房纤维化的潜在机制可能对AF 的临床管理有帮助。炎性细胞在心房纤维化过程中起重要作用。在此过程中,活化的巨噬细胞可以通过传递趋化因子和促炎细胞因子与心肌细胞和成纤维细胞等其他细胞进行交流,从而促进心房纤维化的发展[3]。外泌体(exosomes,Exo)是内吞来源的微小膜结合囊泡(30~100 nm),来源于多泡体的腔膜,并可以在病理和正常条件下通过传递mRNA、蛋白质和微小RNA(microRNA,miRNA)介导器官、组织和细胞水平的微通信[4]。最近研究表明,外泌体与AF 相关,为AF 的预防、诊断和治疗带来了新的视角[5-6]。miRNA 是一种转录后调节基因表达的内源性RNA,大量存在于外泌体中[7]。其中,miR-130 是一种广泛参与调节各种生理和病理过程的miRNA。已经表明miR-130 可以促进心肌肥大,并且敲低心肌细胞中miR-130 可减轻梗死诱导的心肌损伤[8-9]。此外,最近研究发现血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)处理的心肌细胞通过转移外泌体调节M1 巨噬细胞极化[10]。基于此,本研究探讨了AngⅡ对心房肌细胞外泌体中miR-130水平的影响,以及心房肌细胞外泌体是否是将miR-130 递送至巨噬细胞的有效途径。
1 材料与方法
1.1 小鼠心房肌细胞的分离鉴定参照文献方法[11]分离心房肌细胞。具体操作为:获取48 只新生C57BL/6 小鼠心脏,用预冷的0.01 mol/L PBS 清洗3 次,去除血迹。将心脏切成小块(1 mm×1 mm× 1 mm),并在含有2 g/L Ⅱ型胶原酶和2.5 g/L 胰蛋白酶的消化缓冲液中于37 ℃消化20 min,然后用吸管轻轻分散。将细胞悬液通过200 目铜网过滤,在室温下以110 ×g离心5 min。通过成纤维细胞和心肌细胞的不同壁黏附持续时间实现小鼠心房肌细胞与成纤维细胞的分离。细胞在含有10%胎牛血清(FBS;美国Gibco 公司)和青霉素-链霉素(100 IU/mL)的Dulbecco 改良Eagle 培养基(DMEM;美国Gibco 公司)中培养。对于心房肌细胞的处理,用AngⅡ(1 μmol/L)或等体积的PBS 作为对照处理细胞48 h。
1.2 外泌体分离鉴定从用PBS 或AngⅡ处理的小鼠心房肌细胞的细胞培养基中收集外泌体。首先,将上清液以2 000×g离心20 min 以去除细胞碎片。然后,将上清液以10 000 ×g离心30 min。接下来,将上清液再次以100 000×g离心70 min。所有离心工作均在4 ℃下进行。离心后,收集最终沉淀物,随后将外泌体重新悬浮在0.01 mol/L PBS溶液中。外泌体在50 μL 放射免疫沉淀分析缓冲液(上海Beyotime公司)中裂解。通过蛋白质印迹分析外泌体阳性标志物,包括CD63(60 KD)、Hsp70(70 KD)和TSG101(46 KD),和阴性标志物Calnexin(90 KD)的表达。同时,分别使用HT7800透射电子显微镜(TEM,日本Hitachi公司)和NanoSight NS300纳米粒子跟踪分析(NTA,上海Malvern Instruments公司)测量外泌体的形态和直径。外泌体在4 ℃下用2.5%戊二醛固定过夜。第二天,将外泌体加载到碳支持膜涂层网格上,并用磷钨酸水溶液染色1 min。最后,使用80 kV的TEM分析外泌体的形态。
1.3 流式细胞术检测进行流式细胞术分析以分析CD163 阳性巨噬细胞和CD86 阳性巨噬细胞的百分比。将巨噬细胞重悬于PBS 中,然后与5 μL FITC 标记的抗CD86(美国Becton Dickinson 公司)或5 μL PE 标记的抗CD163(Becton Dickinson)在室温下孵育30 min。最后,使用BD AccuriTMC6 流式细胞仪(BD Biosciences)分析阳性细胞。
1.4 巨噬细胞培养和诱导人单核细胞白血病细胞系THP-1 获自中国科学院昆明动物研究所。所有细胞均在完全培养基中于37 ℃和5% CO2的培养箱中培养。对于THP-1 的诱导,从用PBS 或AngⅡ处理的心房肌细胞中获得外泌体。然后,将THP-1 细胞与80 μg/mL 外泌体一起孵育24 h,以诱导M1 或M2 巨噬细胞极化。接下来,使用流式细胞术法和qRT-PCR 法测量巨噬细胞的极化。
1.5 qRT-PCR 检测使用miRCURYTMRNA 分离试剂盒(丹麦Exiqon公司)从外泌体中分离总RNA,并使用TRIzol 试剂(美国Invitrogen 公司)从细胞中分离总RNA。使用逆转录系统试剂盒(大连Takara 公司)将RNA 逆转录为cDNA。使用SYBR Green PCR Master Mix(Thermo Fisher Scientific)在PRISM 7500实时PCR系统(美国Applied Biosystems公司)上进行qRT-PCR。根据经典的2-ΔΔCt方法分析基因的相对表达水平,U6 作为miR-130 的内部参考。mRNA 的相对表达水平采用GAPDH 为内部参考。引物序列见表1。

表1 引物序列Tab.1 Primer sequence
1.6 细胞转染表达miR-130 shRNA 的慢病毒(sh-miR-130)及对照(sh-Ctrl)购自上海GenePharma 公司,用于抑制miR-130 在小鼠心房肌细胞和心房肌细胞衍生的外泌体中的表达。使用LipofectamineTM2000 试剂(美国Invitrogen 公司)将shmiR-130 和sh-Ctrl 转染到心房肌细胞中。
1.7 动物和分组处理雄性C57BL/6 小鼠,体质量20~22 g,6~8 周龄,购自上海斯莱克实验动物有限责任公司。动物被关在笼子里,室温为26 ℃,光照/黑暗循环12 h。给小鼠喂食标准食物制剂并随意提供水。将小鼠随机分为四组:假手术组(Sham)、横向主动脉弓缩窄术(transverseaortic constriction,TAC)组、TAC+sh-miR-130 组和TAC+sh-Ctrl 组。对TAC+sh-miR-130 组 和TAC+sh-Ctrl 组 小鼠施用携带sh-miR-130、sh-Ctrl 慢病毒载体。在手术前通过尾静脉注射将病毒载体以75 μL(3.5 ×1011 GC/mL)的终体积一次性递送给小鼠。7 d 后,所有雄性小鼠按照分组及标准程序进行TAC 或假手术[12]。手术后3 周处死所有动物,收集它们的心脏并准备进行进一步的组织学分析。
1.8 超声心动图在TAC 或假手术后3 周,使用配备30 MHz 中心频率运行的实时显微可视化扫描探头的Vevo 2100系统(加拿大VisualSonics公司)进行超声心动图检查。用异氟醚(1%)麻醉小鼠。计算左心室射血分数(ejection fraction,EF)和左心室缩短分数(shortening fraction,FS),以此反应左心室收缩/舒张功能。
1.9 组织病理学小鼠心脏组织用4%多聚甲醛固定,石蜡包埋,切片厚度为5 μm。进行苏木精-伊红(H&E)染色(北京Biosharp 公司)以观察心脏的病理变化。Masson 三色染色(北京Solarbio 公司)用于检查左心室组织中胶原沉积的变化。从每个切片中选择随机视野并在光学显微镜(日本Olympus 公司)下观察。通过Image-Pro Plus 软件获取和分析每个切片的一张图像。
1.10 免疫荧光染色将每只大鼠的三个心房切片与诱导型一氧化氮合酶(iNOS)(1∶500;武汉赛维尔生物科技有限公司)或CD163(1/500;英国Abcam 公司)和CD68(1∶3 000;武汉赛维尔生物科技有限公司)在4 ℃下孵育过夜。随后,与荧光素(FITC/CY3)缀合的二抗在室温下避光孵育1 h。将载玻片用PBS 清洗3 次,在4,6-二氨基-2-苯基吲哚(DAPI;1∶1;武汉赛维尔生物科技有限公司)中孵育,然后干燥并盖上盖玻片进行评估。用Eclipse C1 荧光显微镜(日本Nikon 公司)捕获了5 个随机非重叠区域的荧光信号。所有图像均通过Image-Pro Plus 6.0 软件进行分析。
1.11 统计学方法使用SPSS 20.0 软件进行统计分析。进行Studentt检验以分析两个独立组之间的数据,单向方差分析和Tukey 事后检验以检验多组之间的数据。P<0.05 为差异有统计学意义。所有实验至少重复3 次。
2 结果
2.1 心房肌细胞衍生的外泌体的表征在光学显微镜下观察分离的心房肌细胞(图1A)。为了鉴定,小鼠心房肌细胞用抗α-肌节肌动蛋白(α-SCA)染色(图1B)。外泌体来源于PBS 或AngⅡ处理的小鼠原发性心房肌细胞,分别称为PBS-Exo 和AngⅡ-Exo。在TEM 下,PBS-Exo 和AngⅡ-Exo 均表现出球形形态,直径分布在30~150 nm 之间,具有细胞膜状结构(图2A-B)。与细胞相比,PBS-Exo和AngⅡ-Exo 对外泌体标志物CD63、HSP70 和TSG101 呈阳性,而对Calnexin 呈阴性(图2C)。这些数据证实,外泌体有效地从PBS 或AngⅡ处理的心房肌细胞中分离出来。
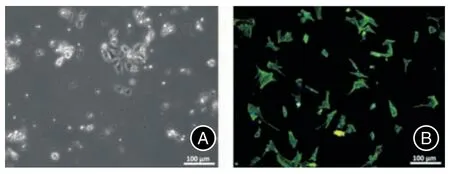
图1 小鼠心房肌细胞的鉴定Fig.1 Identification of mouse atrial myocytes
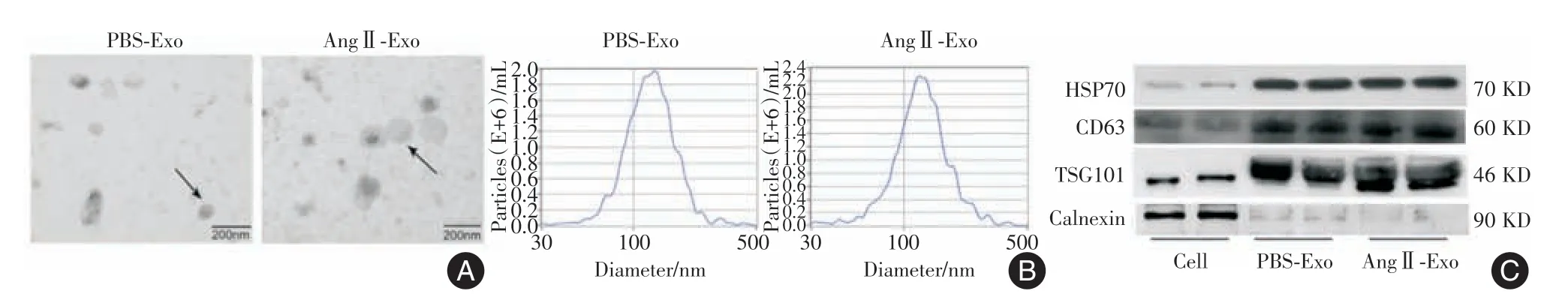
图2 外泌体鉴定Fig.2 Exosome identification
2.2 AngⅡ-Exo 促进M1 巨噬细胞极化将PBSExo 和AngⅡ-Exo 与THP-1 细胞一起孵育。与PBSExo 组相比,AngⅡ-Exo 可以显著增加巨噬细胞中iNOS 和TNF-α mRNA 的表达(P<0.05),并降低了巨噬细胞中Arg-1 和IL-10 mRNA 的表达(P<0.05,图3A)。CD86 和CD163 分别是M1 巨噬细胞和M2巨噬细胞的标志物。与PBS-Exo组相比,AngⅡ-Exo促进了M1 巨噬细胞极化并限制了M2 巨噬细胞极化(P<0.05,图3B)。

图3 AngⅡ-Exo 促进了M1 巨噬细胞极化Fig.3 AngⅡ-Exo promotes M1 macrophage polarization
2.3 AngⅡ-Exo 通过转移miR-130 促进M1 巨噬细胞极化miR-130 的表达水平在AngⅡ-Exo(图4A)以及AngⅡ-Exo 处理的巨噬细胞中上调(P<0.05,图4B)。心房肌细胞、sh-miR-130-Exo和THP-1细胞中miR-130 的表达水平被sh-miR-130 处理下调(P<0.05,图4C)。此外,使用PKH67 来标记shmiR-130 处理的心房肌细胞衍生的外泌体,并发现这些外泌体可以被THP-1 细胞有效吞噬(图4D)。降低AngⅡ-Exo 中miR-130 的表达可以抑制iNOS和TNF-α 的表达(P<0.05),同时促进Arg-1 和IL-10 的表达(P<0.05,图4E)。此外,miR-130 的敲低下调了M1 巨噬细胞的百分比(P<0.05),但上调了M2 巨噬细胞的百分比(P<0.05,图4F)。

图4 AngⅡ-Exo 通过转移miR-130 促进M1 巨噬细胞极化Fig.4 AngⅡ-Exo promotes M1 macrophage polarization by transferring miR-130
2.4 miR-130 参与体内心脏纤维化和巨噬细胞极化调节在有或没有sh-Ctrl 对照处理的TAC 小鼠中miR-130 的水平显著升高,并且在TAC 小鼠中在注射sh-miR-130 后显著降低(P<0.05,图5A)。与TAC组相比,TAC+sh-miR-130组小鼠的EF、FS显著提高(P<0.05),并且HW/BW 和HW/TL 比率显著降低(P<0.05,图5B-F)。TAC 小鼠心脏中的心肌紊乱且尺寸变大。相比之下,sh-miR-130 明显改善了TAC小鼠心脏的结构并减小了心肌的大小、纤维化水平(P<0.05,图5G)。此外,与假手术组相比,TAC 组小鼠左心房组织的iNOS+/CD68+巨噬细胞增加(P<0.05)。TAC+sh-miR-130 组小鼠左心房组织的iNOS+/CD68+巨噬细胞较TAC 组显著降低(P<0.05),并且CD163+/CD68+巨噬细胞显著增加(P<0.05,图5H-I)。
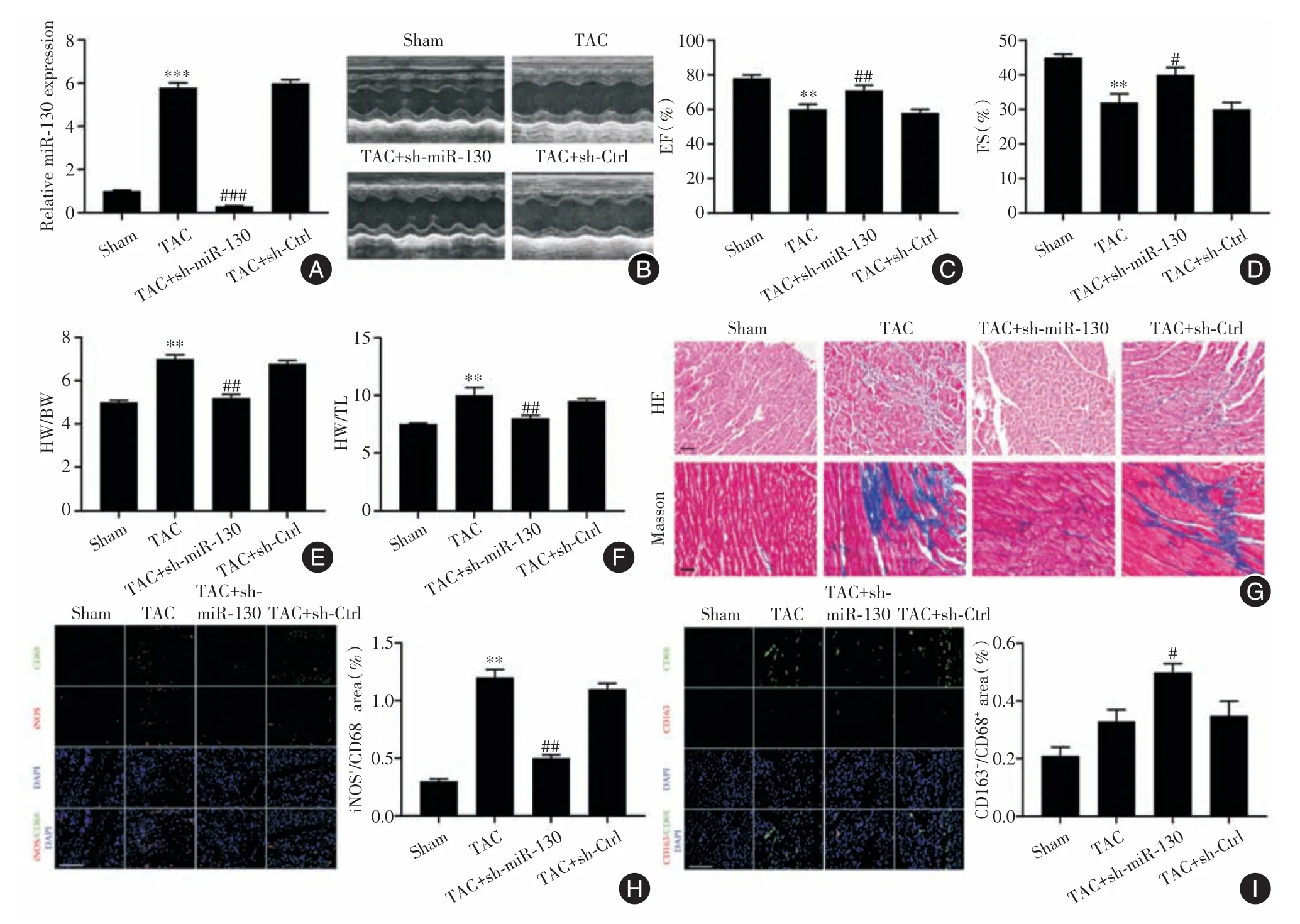
图5 miR-130 在体内心脏纤维化和巨噬细胞极化中的作用Fig.5 The role of miR-130 in cardiac fibrosis and macrophage polarization in vivo
3 讨论
AF 是一种日益普遍的医疗保健问题,会产生许多危害,主要是不良的心血管和脑血管事件[1]。因此,探索AF 的发病机制,寻找治疗AF 的新靶点非常必要。AngⅡ通过诱导心房纤维化和心房重塑参与AF的发病机制[13]。在本研究中,与PBS处理的心房肌细胞相比,AngⅡ处理的心房肌细胞分泌的外泌体中miR-130 的表达更高,其被递送到受体巨噬细胞中以减少M2 型细胞因子(Arg-1 和IL-10)的产生。这些结果表明源自心房肌细胞的外泌体miR-130 抑制M2 巨噬细胞极化。之前的一项研究报告称,miR-130 促进M1 极化并抑制M2 极化,从而调节癌症进展,本研究结果与其一致[14]。
越来越多的证据表明,外泌体是不同细胞之间的重要信使,其通过携带lncRNA、miRNA、mRNA和其他分子参与多种生物过程,并在包括AF 在内的许多疾病的发展中发挥关键作用[15-16]。然而,外泌体和外泌体miRNA 在AF 发展中的作用仍未完全阐明。本研究证明了miR-130 在AngⅡ-Exo 中表达增加。AngⅡ-Exo 可以通过转移miR-130 促进巨噬细胞向M1 极化并抑制M2 极化。巨噬细胞是AF 发展中的关键炎症细胞。研究表明M1 巨噬细胞比例的上调和M2 巨噬细胞的下调均可能导致炎症反应的恶化,并促进心房纤维化和AF 发展。例如,ZAMAN 等发现巨噬细胞有助于抵抗远端心肌的重塑[17-18],心脏巨噬细胞的数量增加与小鼠的年龄呈正相关。本研究进一步表明抑制AngⅡ-Exo中miR-130 的表达通过抑制M2 巨噬细胞极化来促进巨噬细胞炎症因子的释放。基于这些发现,笔者认为外泌体miR-130可能是AF的潜在治疗靶点。
已显示miRNA 可调节整个基因表达网络,并在AF 中发挥重要作用[19-21]。miR-130 是一种肿瘤促进因子,研究发现其参与各种癌症的进程[22-24]。miR-130 可以增加由I/R 损伤诱导的心肌细胞凋亡[25]。此外,miR-130 通过调节内皮一氧化氮合酶的表达和一氧化氮的产生参与AF 的发病机制[8]。这些研究表明miR-130 不仅与癌症有关,而且与心脏病有关。更重要的是,miR-130 与胶原蛋白1 和胶原蛋白3 的合成有关,这促进了心脏纤维化的形成[8]。本研究发现miR-130 在AngⅡ处理的TAC小鼠和心房肌细胞衍生的外泌体中表达上调,表明miR-130 对心脏纤维化的调节作用。此外,miR-130 敲低抑制了心脏纤维化模型中的纤维化,并抑制了心房组织中M1 巨噬细胞极化。这些结果证实AngⅡ刺激心房肌细胞衍生的外泌体通过转移miR-130 促进M1 巨噬细胞极化,进而促进了心脏炎症环境的形成,加速了心脏纤维化。
总之,本研究证明,在AngⅡ处理的心房肌细胞衍生的外泌体中miR-130 的表达水平升高,并且外泌体通过转移miR-130 促进了M1 巨噬细胞极化。该研究表明miR-130 是AF 的潜在治疗靶点,应进一步深入了解miR-130 促进心肌纤维化的分子机制。

