基于TGF-β1/Smads信号通路探讨抗纤益心方对心肌纤维化时相性对扩张型心肌病模型大鼠的影响*
聂恒,黄斌,苏帆
1.河南中医药大学第二附属医院/河南省中医院,河南 郑州 450000; 2.河南中医药大学,河南 郑州 450046
扩张型心肌病(dilated cardiomyopathy,DCM)为临床常见的原发性心肌病,该病发病隐匿,多数患者出现明显心衰症状时才得以确诊,错过了最佳治疗时期,且发病率逐年升高,严重威胁人类健康[1]。研究表明,心肌纤维化导致的心室重构是DCM发病的重要病理基础,而转化生长因子-β(transforming growth factor-β,TGF-β)/Smads信号通路在心肌纤维化的变化过程中发挥着重要的作用[2]。抗纤益心方为河南省中医院心病科临床治疗DCM的经验方,具有益气活血的功效,能改善患者症状,提高其生活质量[3]。研究表明,抗纤益心方能够抑制DCM模型大鼠的心室重构[4],但此机制仍需进一步的探讨。本研究通过观察DCM大鼠模型心肌纤维化过程中及抗纤益心方干预后大鼠超声心电图、活性因子及心肌纤维化相关指标,明确TGF-β1/Smads信号通路在心肌纤维化中的时相性变化及抗纤益心方对TGF-β1/Smads信号通路的干预效果,以便选择合适的时间用药,既减轻患者的治疗花费,又能最大效率的治疗疾病,开拓DCM研究思路,为临床治疗提供根据。
1 材料
1.1 动物SPF级Wistar 健康雄性大鼠140只,体质量100~120 g,购于北京维通利华实验动物技术有限公司,合格证号:SCXK (京) 2012-0001,所有实验动物饲养于河南省中医院中心实验室动物饲养中心,22~25 ℃、50%湿度自由摄食、饮水,正常饲养1周后进行模型制备。本实验获得实验动物伦理委员会批准。
1.2 药物与试剂抗纤益心方干浸膏(由党参,黄芪,茯苓,白术,丹参,益母草,川芎,红花,赤芍,泽兰组成,河南省中医院制剂室提供);呋喃唑酮片(福建省三明天泰制药有限公司,批号:20150505);贝那普利片 (常州制药厂,批号:20150308)。戊巴比妥钠[中国医药(集团)上海化学试剂公司,批号:20150204];RIPA裂解液(美国Sigma公司,批号:20150703);TGF-β1、GAPDH抗体(美国BD公司,批号:20140623、20150203);羊抗兔二抗(美国CST公司,批号:20150601);免疫组化试剂盒(上海长岛生物有限公司,货号:D-3005);trizol(美国Invitrogen公司,批号:15596-026);PCR试剂盒、TaKaRa逆转录试剂盒(日本Takara Bio公司,货号:RR430A、RR036A);蛋白提取试剂盒、BCA检测试剂盒(南京建成生物研究所,批号:20150508、20150126)。
1.3 仪器彩色多普勒超声检测仪(德国西门子股份公司,型号:Acuson Cypress);石蜡切片机(湖北慧达仪器公司,型号:HD-325);组织包埋机(湖北慧达仪器公司,型号:HD-310);荧光显微镜(奥林巴斯,型号:CKX41);凝胶电泳仪(美国Bio-Rad公司,型号:164-5070)。
2 方法
2.1 动物模型复制及分组、给药采用呋喃唑酮水溶液(700 mg·kg-1)喂养大鼠复制DCM模型。将模型制备成功的大鼠随机分为造模组、模型对照组及给药组(小剂量抗纤益心方组、大剂量抗纤益心方组贝那普利组、联合用药组),造模组又分为空白对照组及模型2周组、4周组、6周组、8周组、10周组、12周组、14周组、16周组,每组10只大鼠。所有组全程给予呋喃唑酮饮水喂养,造模组、模型对照组不给予药物干预,给药组均于造模6周后开始给药,连续8周:小剂量抗纤益心方组、大剂量抗纤益心方组、贝那普利组分别给予抗纤益心方4.7 g·kg-1、抗纤益心方18.8 g·kg-1、贝那普利10.125 mg·kg-1,联合用药组每日给予抗纤益心方18.8 g·kg-1+贝那普利10.125 mg·kg-1。
2.2 大鼠一般状况开始造模后每天观察大鼠的活跃度、皮肤毛发、精神状况、平均饮食和饮水量等,并于每周检测体质量变化。
2.3 大鼠超声心动图各组大鼠共140只在其对应时间点,以体积分数1%戊巴比妥钠(50 mg·kg-1)腹腔内注射麻醉后行心脏超声心动图检测左心室收缩末期内径(left ventricular end systolic diameter,LVDs)、左心室舒张末期内径(left ventricular end diastolic diameter,LVDd)。取3个测量值后取平均值计算射血分数(ejection fractions,EF)及左室质量指数(left ventricular mass index,LVMI)。
2.4 心肌取材、处理及保存用体积分数1%戊巴比妥钠(50 mg·kg-1)腹腔注射麻醉大鼠后,迅速打开胸腔,以祛酶剪刀剪除大鼠心脏,1‰DEPC水冲洗残留血液,去除大血管、心外膜脂肪组织,放于祛酶锡箔纸上,将左心室分割两份。一份置于10%中性福尔马林中保存24 h,然后经酒精逐梯脱水,二甲苯透明,用熔点为60 ℃及54 ℃的石蜡浸透4 h,石蜡包埋备用。另一份以祛酶锡箔纸包裹,标记相应大鼠编号后,浸入液氮罐,1 h后转入-80 ℃冰箱存放,待检。
2.4.1 HE染色观察大鼠心肌病理形态将上述已经过脱水、透明、浸蜡、包埋的心肌组织进行切片、脱洗、HE染色,显微镜下观察病理学形态变化。
2.4.2 免疫组化检测心肌组织Ⅰ型胶原、Ⅲ型胶原、TGF-β1的表达取大鼠心肌组织石蜡切片脱蜡和水化后,用PBS(pH 7.4)冲洗3次,每次3 min。每张切片加入1滴过氧化物酶阻断溶液,用来阻断内源性过氧化物酶活性,室温孵育10 min。PBS(pH 7.4)冲洗3次,每次3 min。除去PBS液,每张切片加1滴非免疫性动物血清,室温孵育10 min。除去血清,每张切片加1滴稀释的一抗,4 ℃过夜。取出放至室温,PBS冲洗3次,每次3 min。除去PBS液,每张切片加1滴生物素标记的二抗,室温孵育 30 min。PBS冲洗3次,每次3 min。除去PBS液,每张切片加1滴亲和素-过氧化物酶,室温孵育 30 min。PBS冲洗3次,每次3 min。除去PBS液,每张切片加2滴新鲜配制的DAB溶液。自来水冲洗,苏木素复染,乙醇脱水,二甲苯透明,中性树胶封固。在图像分析系统上随机选取相等的5个高倍视野(×400),每张片子测量OD值后取平均值。染色质含量的高低即阳性染色度的强弱和平均光密度呈正相关。
2.4.3 RT-PCR检测大鼠心肌TGF-β1/Smads信号通路相关基因的mRNA表达量将各组大鼠心肌组织50 mg运用Trizol法提取总RNA,依照试剂盒固定的步骤进行实验,用DU800检测RNA的OD值;用逆转录试剂盒将RNA转录成cDNA(逆转录程序为37 ℃×15 min,85 ℃×5 s),再进行RT-PCR扩增。PCR引物序列见表1,PCR结果采用ΔCT法对数据进行统计分析。

表1 引物序列
2.4.4 Western Blot法检测大鼠心肌TGF-β1/Smads通路相关蛋白表达量取各组大鼠心肌组织30 mg进行剪碎后结合400 μL单去污剂裂解液(含PMSF)加入匀浆器中进行匀浆,然后离心5 min后,取上清置于-20 ℃。采用Bradford蛋白浓度测定试剂盒测定蛋白浓度,后进行电泳、转膜,以含5%脱脂奶粉的TBST 溶液室温封闭2 h后加入一抗,室温下孵育1~2 h后,PBS漂洗15 min,连续4次,同上法加入二抗,显影后用凝胶成像分析系统进行分析。
3 结果
3.1 大鼠一般状况造模组:随着造模时间延长,各组大鼠逐步开始出现活动少,反应迟钝,饮食少,毛发疏松无光泽,体质量减轻等;模型对照组大鼠活动度减弱,进食、饮水减少,体质量减轻,毛色萎黄,大便性状不一,时溏时常,取材时部分大鼠可见腹腔积液,下肢水肿;各给药组较模型对照组大鼠更加活跃,症状恢复较好。结果表明,各给药组均可明显改善大鼠的生活质量,减轻症状。
3.2 大鼠超声心动图与空白对照组比较,模型2周组、模型4周组、模型6周组大鼠EF无明显差异(P>0.05),模型8周组、模型10周组EF显著性降低(P<0.05),模型12周组、模型14周组、模型16周组EF极显著性降低(P<0.01)。与空白对照组比较,模型2周组、模型4周组大鼠LVDd、LVDs无明显差异(P>0.05),模型6周组、模型8周组大鼠LVDd、LVDs显著性升高(P<0.05),模型10周组、模型12周组、模型14周组、模型16周组大鼠LVDd、LVDs极显著性升高(P<0.01)。与模型对照组比较,联合用药组大鼠EF显著性升高(P<0.05),LVDs、LVMI显著性降低(P<0.05);贝那普利组LVDs、LVMI显著性降低(P<0.05);大剂量抗纤益心方组LVMI显著性降低(P<0.05)。见表2、表3、表4。

表2 造模组各组左室射血分数及左室内径比较

表3 各组大鼠左室射血分数及左室内径比较

表4 各组大鼠LVMI比较
3.3 比较各组大鼠心肌组织病理形态变化观察造模组结果可以得出:造模成功后,随着时间的延长心肌纤维排列逐渐紊乱、变形断裂、间质增生水肿等;观察治疗组结果可以得出:抗纤益心方及贝那普利治疗后,心肌纤维排列及组织细胞形态均明显改善。见图1、图2。

注:A:空白组;B:造模4周组;C:造模6周组;D:造模8周组;E:造模16周组图1 造模各组大鼠心肌病理学损伤变化(HE染色,×200)
3.4 免疫组化检测大鼠心肌Ⅰ型胶原、Ⅲ型胶原、TGF-β1的表达与模型对照组比较,大剂量抗纤益心方组、贝那普利组及联合用药组Ⅰ型胶原、Ⅲ型胶原及TGF-β1显著降低(P<0.05)见表5,图3、图4、图5。

注:A:模型对照组;B:小剂量抗纤益心方组;C:大剂量抗纤益心方组;D:贝那普利组;E:联合用药组图2 各治疗组大鼠心肌病理学变化(HE染色,×200)

表5 SP法测各组大鼠心肌内Ⅰ型胶原、Ⅲ型胶原、TGF-β1表达

注:A:模型对照组;B:小剂量抗纤益心方组;C:大剂量抗纤益心方组;D:贝那普利组;E:联合用药组图3 免疫组化检测I型胶原(×400)
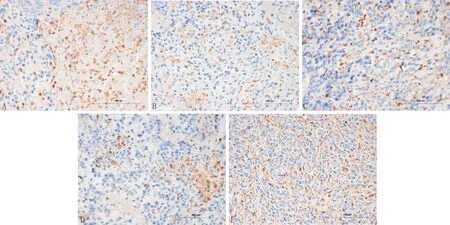
注:A:模型对照组;B:小剂量抗纤益心方组;C:大剂量抗纤益心方组;D:贝那普利组;E:联合用药组图4 免疫组化检测大鼠心肌Ⅲ型胶原变化(×400)
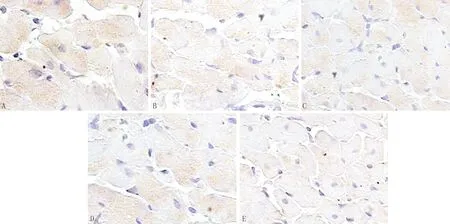
注:A:模型对照组;B:小剂量抗纤益心方组;C:大剂量抗纤益心方组;D:贝那普利组;E:联合用药组图5 免疫组化检测大鼠心肌TGF-β1变化(×400)
3.5 RT-PCR法检测大鼠左心室TGF-β1、Smad2、Smad3、Smad4、Smad7mRNA结果与空白对照组比较,模型4周组TGF-β1mRNA显著升高(P<0.05),模型6周组、模型8周组、模型10周组、模型12周组、模型14周组、模型16周组TGF-β1mRNA极显著性升高(P<0.01);模型6周组Smad7mRNA显著降低(P<0.05),Smad2mRNA、Smad3mRNA、Smad4mRNA显著升高(P<0.05),模型8周组、模型10周组、模型12周组、模型14周组、模型16周组Smad7 mRNA极显著降低(P<0.01),Smad2mRNA、Smad3mRNA、Smad4mRNA极显著升高(P<0.01)。与模型对照组比较,小剂量抗纤益心方组Smad7mRNA显著升高(P<0.05);大剂量抗纤益心方组与贝那普利组TGF-β1mRNA、Smad2mRNA、Smad3mRNA、Smad4mRNA显著降低(P<0.05),Smad7mRNA显著升高(P<0.05);联合用药组Smad2mRNA、Smad3mRNA显著降低(P<0.05),TGF-β1mRNA、Smad4mRNA极显著性降低(P<0.01),Smad7mRNA极显著升高(P<0.01)。见表6、表7。

表6 造模组大鼠左心室TGF-β1、Smad2、Smad3、Smad4、Smad7基因表达变化

表7 治疗组大鼠左心室肌TGF-β1、Smad2、Smad3、Smad4、Smad7基因表达变化
3.6 Western Blot检测大鼠左心室TGF-β1,Smad2、Smad3、Smad4、Smad7蛋白表达结果与空白对照组比较,模型6周组TGF-β1显著升高(P<0.05),模型8周组、模型10周组、模型12周组、模型14周组、模型16周组TGF-β1极显著性升高(P<0.01);模型4周组Smad7显著降低(P<0.05),模型6周组、模型8周组、模型10周组、模型12周组、模型14周组、模型16周组Smad7极显著降低(P<0.01)。与模型对照组比较,小剂量抗纤益心方组Smad7显著升高(P<0.05),TGF-β1显著降低(P<0.05);大剂量抗纤益心方组Smad7极显著升高(P<0.01),TGF-β1、Smad2、Smad3、Smad4显著降低(P<0.05);贝那普利组Smad7极显著升高(P<0.01),TGF-β1极显著性降低(P<0.01),Smad2、Smad3、Smad4显著降低(P<0.05);联合用药组Smad2、Smad3、TGF-β1、Smad4极显著性降低(P<0.01),Smad7极显著升高(P<0.01)。见表8、表9及图6、图7。

表8 造模组大鼠左心室肌TGF-β1、Smad2、Smad3、Smad4、Smad7蛋白表达值

表9 治疗组大鼠左心室肌TGF-β1、Smad2、Smad3、Smad4、Smad7蛋白表达值
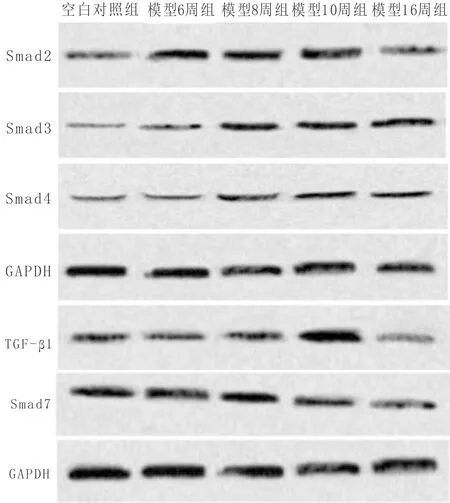
图6 各模型组大鼠左心室Smad2、Smad3、Smad4、Smad7、TGF-β1蛋白表达
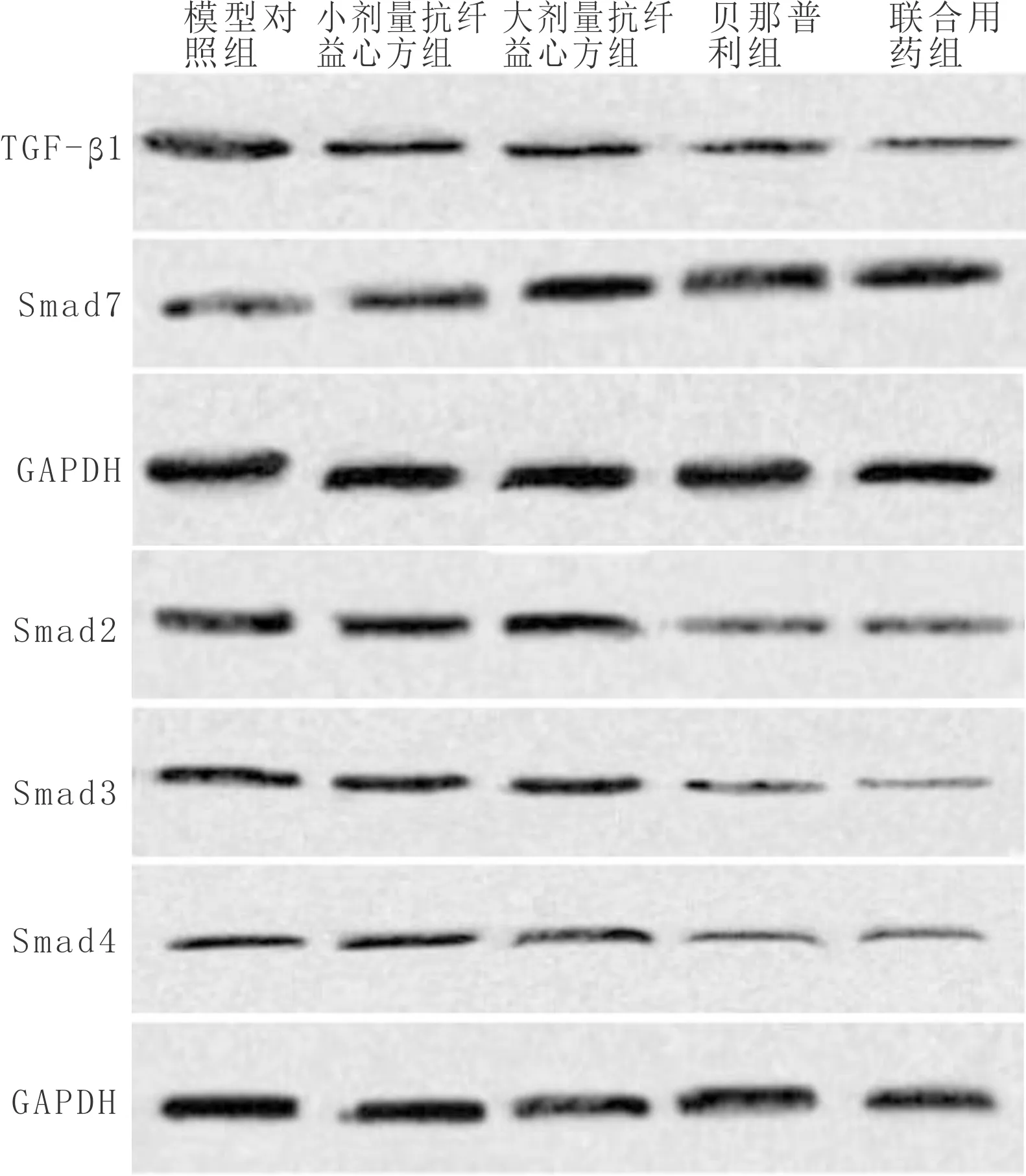
图7 各给药组大鼠左心室Smad2、Smad3、Smad4、Smad7、TGF-β1蛋白表达
4 讨论
扩张型心肌病主要表现为心室扩张以及收缩功能减弱,1985年美国某地区流行病学调查显示,DCM患病率为36.5/10万;2002年中国分层整群抽样调查显示,DCM患病率约为19/10万,且近几年发病率仍逐渐升高,严重影响患者生命健康[5]。DCM病因复杂,感染、自身免疫及遗传均可导致其发生[6],虽然DCM的病因及发病机制尚待明确,但不管是由于病毒感染,还是家族遗传,或者自身免疫反应,又或其他因素所致,其发生发展过程中均会出现细胞间质广泛纤维化而致的心室重构。
本研究通过灌胃呋喃唑酮水溶液制备DCM大鼠模型,与空白对照组比较,DCM模型组大鼠LVIDs、LVIDd升高,LVEF降低,心肌细胞形态破碎,排列疏松,出现大量的炎性细胞浸润,说明DCM模型大鼠出现左心室的扩张,收缩功能降低,且心肌组织伴有炎症损伤,符合以往DCM模型典型特征[7],提示DCM模型复制成功。
中医认为本病病机属本虚标实,多以气虚为本,血瘀、水湿为标[8],故临床多用益气活血利水等方法[9]。抗纤益心方是河南省中医院心病科临床治疗DCM的经验方,研究表明其能有效的改善临床患者的症状及心功能[10],抗纤益心方中由黄芪、党参、白术、茯苓、丹参等中药组成,黄芪、党参等益气生血,茯苓健脾安神,白术补气健脾,丹参活血化瘀,对于DCM气虚下陷的症状有明显改善[4]。王振涛[10-11]研究表明,抗纤益心方在改善扩张型心肌病患者症状有明确的疗效。曾垂义等[12]的临床观察表明,抗纤益心方在改善扩张型心肌病患者心衰症状同时还能有效控制患者血压。本研究结果显示,与模型对照组比较,各抗纤益心方组大鼠射血分数升高、左室内径及各室壁厚度降低、LVMI降低,提示抗纤益心方可有效改善DCM大鼠的心功能。
心室重构中基础的病变是多种因素引起的心肌组织纤维化[13],在诸多要素中,TGF-β作为在促纤维化过程中不可或缺的因子,依据靶细胞的不同,TGF-β对细胞增殖分化表现出促进或抑制的双重作用[14]。现已明确,TGF-β与细胞外基质积淀有重要的联系,在目前组织纤维化治疗中常被选为作用靶点[15],其在肺纤维化[16]、肝胆胰纤维化[17]、血管纤维化[18]、肾小管纤维化[19]等领域均有明确的研究证实其密切关系。与正常的心脏比较,TGF-β1在心肌纤维化进程中活性显著上升。TGF-β1一旦被释放,与细胞表面活性受体结合后经过一系列作用形成Smad2-Smad3-Smad4转录复合体,然后进入细胞核,这就是TGF-β/Smad信号传导通路[20]。多项研究表明,TGF-β/Smads信号通路的作用在心肌纤维化里有着显著意义[21-22]。齐静等[23]发现心衰大鼠左心室TGF-β1及Smad3表达上调,提示可能与心肌纤维化有关。张娟娟[24]发现,高血压左心室肥厚患者血清中TGF-β1明显高于健康人,且血清中的浓度与高血压进程正相关。李庆敏等[25]在对铁皮石斛抑制心衰气虚证大鼠心肌纤维化的研究中发现其作用可能与铁皮石斛下调Gal-3、TGF-β、Smad3蛋白表达有关。孟慧等[26]认为,保元汤能通过调控TGF-β1来防治慢性心力衰竭。尽管已有多项研究表明,TGF-β1/Smads信号通路在心肌纤维化中发挥作用,但是在其发生发展过程中,此信号通路激活的时相性还不明确,该通路在心衰大鼠模型心肌纤维化的什么时间段开始被激活,在激活之后又能持续作用多长时间,这些对药物的发挥效用有一定的作用。
本研究通过实验发现观察不同时间点DCM大鼠模型TGF-β1/Smads信号通路的表达,相关结果表明其在6周左右激活,8~10周进入高峰期,12周后进入平台期,具有明确的时间节点。
本研究通过比较各组大鼠左心室TGF-β1、Smad2、Smad3、Smad4、Smad7基因及蛋白表达发现,与模型对照组比较,小剂量抗纤益心方组无显著性差异、大剂量抗纤益心方及贝那普利组有显著性差异、联合用药组有非常显著性差异。
以上研究结果明确了DCM大鼠心肌纤维化过程中,TGF-β1/Smads信号通路在6周左右激活,于8~10周达到高峰期,12周后达到平台期。而中药复方抗纤益心方能够有效地抑制扩张型心肌病大鼠心肌纤维化进展,其作用机制与抑制心肌Ⅰ型胶原、Ⅲ型胶原、TGF-β1的表达,并进一步激活Smads信号通道,上调Smad7蛋白表达以及下调Smad2、Smad3、Smad4蛋白表达有关。使用中药复方抗纤益心方及时尽早地干预扩心病大鼠,能够通过激活TGF-β/Smads信号通路充分有效地抑制DCM大鼠心肌纤维化进展,联用ACEI制剂效果更佳。这也表明在扩张型心肌病患者的治疗中抗纤益心方应当选择合适的时间点及时介入。

