C-Cu2O复合电极用于电化学还原CO2制甲醇
代灵英,苏永庆,古铭岚,王晗雪,张咪
(云南师范大学 化学化工学院,云南 昆明 650500)
大气中CO2含量逐年升高,导致了严重的环境问题,降低大气中的CO2浓度迫在眉睫[1]。电化学还原CO2是一种非常有效的途径[2],其产物主要取决于催化剂和介质[3]。Cu、Mo和Ru及其混合物是将CO2电化学转化为CH3OH的活跃材料[4],Cu是唯一能产生潜在化学混合物的材料[5-6],且发现Cu2O颗粒沉积到碳布电极上对CO2还原为CH3OH的催化能力强[7]。本课题组前期对CH4电化学氧化制CH3OH的研究中,80% C2H5OH(体积分数)的碱性电解液中CH3OH法拉第效率较高[8]。为配合在同一电解池中既能进行甲烷的氧化,又能进行CO2的还原制备CH3OH,本文以含KOH的C2H5OH溶液为电解液,以C-Cu2O复合电极为阴极,对CO2电化学还原为CH3OH进行研究。
1 实验部分
1.1 材料与仪器
无水乙醇、KOH、(NH4)2S2O8、聚乙烯吡咯烷酮均为分析纯;CO2(纯度99.5%);Cu片(99.9%)。
CHI660E电化学工作站;GC-2014C气相色谱仪;FlexSEM1000扫描电子显微镜。
1.2 C-Cu2O复合电极的制备
取尺寸4 cm×3 cm 的Cu片制成Cu电极,用无水乙醇和蒸馏水各超声波清洗30 min,借鉴文献[9]的方法制备C-Cu2O复合电极,即将清洗后的Cu电极浸泡于配制好的前驱体溶液中(2.5 mol/LNaOH和0.125 mol/L(NH4)2S2O8组成的混合液)30 min,得到附着于Cu电极表面的Cu(OH)2微球,取出后用蒸馏水反复清洗3次后,将其浸泡于一定浓度的聚乙烯吡咯烷酮还原溶液中3 h,将Cu(OH)2微球还原为Cu2O的同时进行非金属元素碳的掺杂,取出后用双蒸水反复冲洗3次,随后用氮气(N2)干燥得到表面附着C-Cu2O微球的Cu片,即得到C-Cu2O复合电极。
1.3 实验方法与过程
电化学还原CO2制备CH3OH的装置示意图见图1,由电化学工作站和一室型电解池组成,工作电极(阴极)为制备的C-Cu2O电极,辅助电极(对电极)为Pb电极,参比电极为饱和甘汞电极。
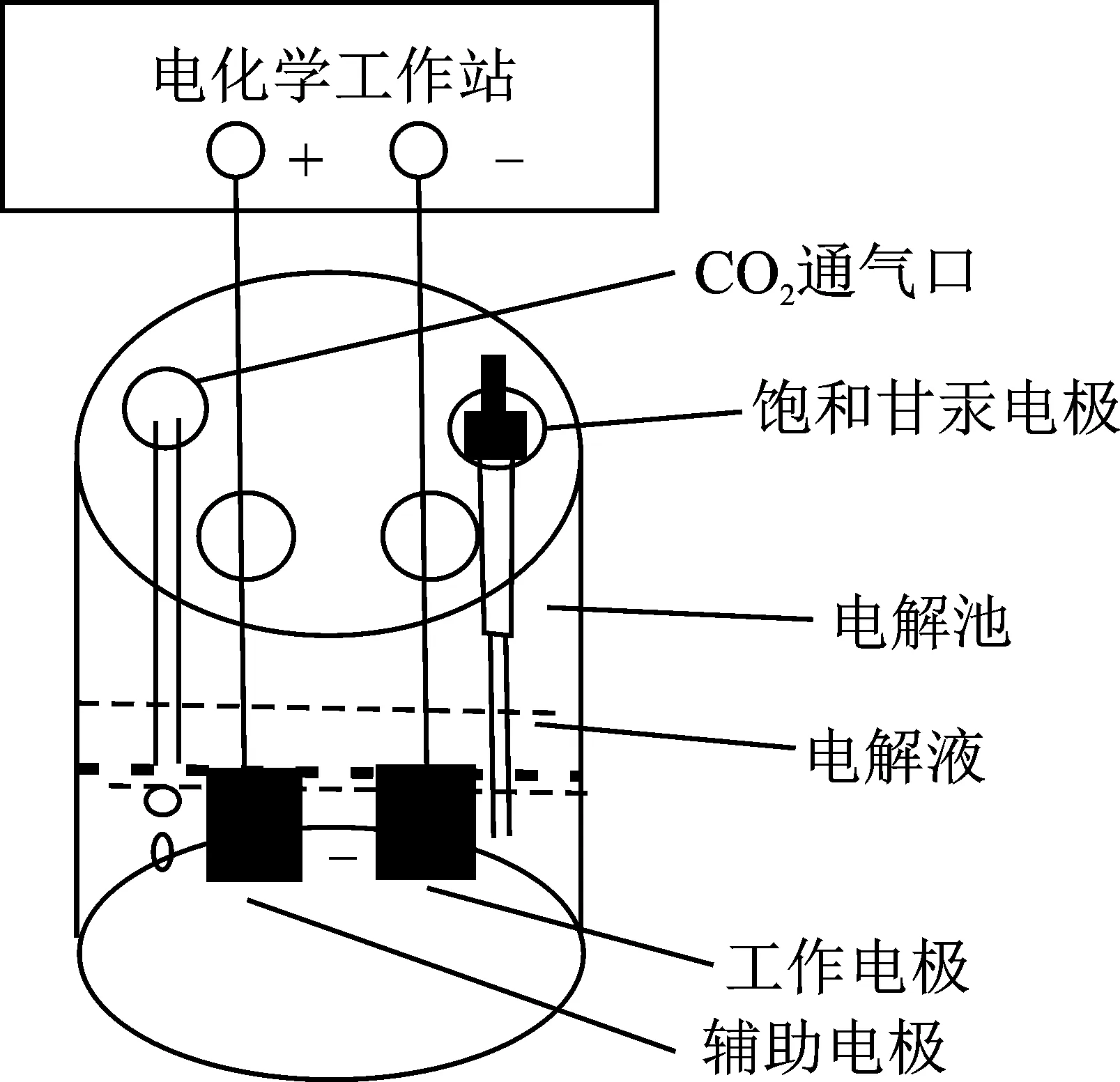
图1 实验装置图Fig.1 Diagrammatic sketch of experimental device
在CO2的阴极还原为CH3OH的理论研究中[4],1 mol CO2需要6 mol的电子才能生成1 mol的CH3OH,其反应方程如下:
酸性条件:CO2+6H++ 6e-→ CH3OH+H2O
碱性条件:CO2+H2O+ 6e-→ CH3OH+6OH-
根据LSV曲线上的拐点,选择出电解电位值,再以该电解电位值及其附近值进行恒电位电解实验,以计算CO2转化为CH3OH的电流效率(法拉第效率)。实验中产生的CH3OH使用气相色谱(GC)来检测分析,根据GC图中CH3OH峰位置和峰面积与绘制的CH3OH标准体积分数曲线进行比对,计算出样品中CH3OH的体积分数、摩尔数,以及CO2转化为CH3OH所需的电量,再与通入的电量(由电化学工作站直接读出)进行比较,得出电化学还原CO2制CH3OH的法拉第效率,计算公式如下:
式中η——法拉第效率;
V——溶液总体积,mL;
v——甲醇的体积百分含量,%;
ρ——甲醇的密度,g/mL;
M——CH3OH的摩尔质量,g/mol;
Z——电极转移数(Z=6);
F——法拉第常数,96 500 C/mol;
Q——通入的电量,C。
在本课题组前期实验研究中[9-10],电解液、CO2的流速、电解电位是对甲醇的产率主要影响因素,在含3 g/L KOH的80% C2H5OH(体积分数)碱性电解液中,CO2的流速为10 min/mL时,生成CH3OH的法拉第效率较高,因此,本文选择其附近的点作为实验的条件。
2 结果与讨论
2.1 C-Cu2O复合电极进行表征
利用SEM和EDS对所制备C-Cu2O复合电极进行表征,见图2和图3。

图2 C-Cu2O复合电极表面的SEM图Fig.2 SEM of C-Cu2O composite electrode surface
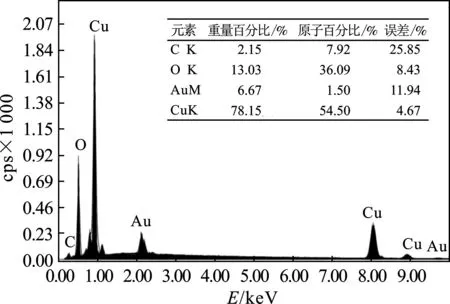
图3 C-Cu2O复合电极的EDS分析Fig.3 EDS analysis of C-Cu2O composite electrode
图2为C-Cu2O复合电极的SEM图(×10.00k),电极表面为夹杂着不规则的球型颗粒的网状结构,经EDS分析,见图3,其组成为Cu、O、C三种元素(Au是样品制备过程中喷金带入的),与文献[8]的结果一致,表明电极表面具有C-Cu2O组成。从图中Cu(54.50%)和O(36.09%)的原子比来看,Cu2O几乎覆盖了整个表面,电极表面的网状结构极大地增加了微观表面积,同时拥有了更丰富的CO2吸附位点来进行CO2的催化还原,进而提高CO2的催化还原甲醇的法拉第效率。
2.2 LSV曲线的测定
LSV(线性扫描伏安)曲线上的拐点是判断电极反应的重要参数。使用电化学工作站,采用图1的一室型电解池进行 LSV测试,电解液为 KOH/乙醇溶液,乙醇的浓度为80%(体积分数),KOH的质量为3 g/L。将100 mL电解液加入一室型电解池,以流速为30 min/mL通 CO2约30 min 达饱和后,进行线性伏安扫描实验,测得LSV曲线见图4。
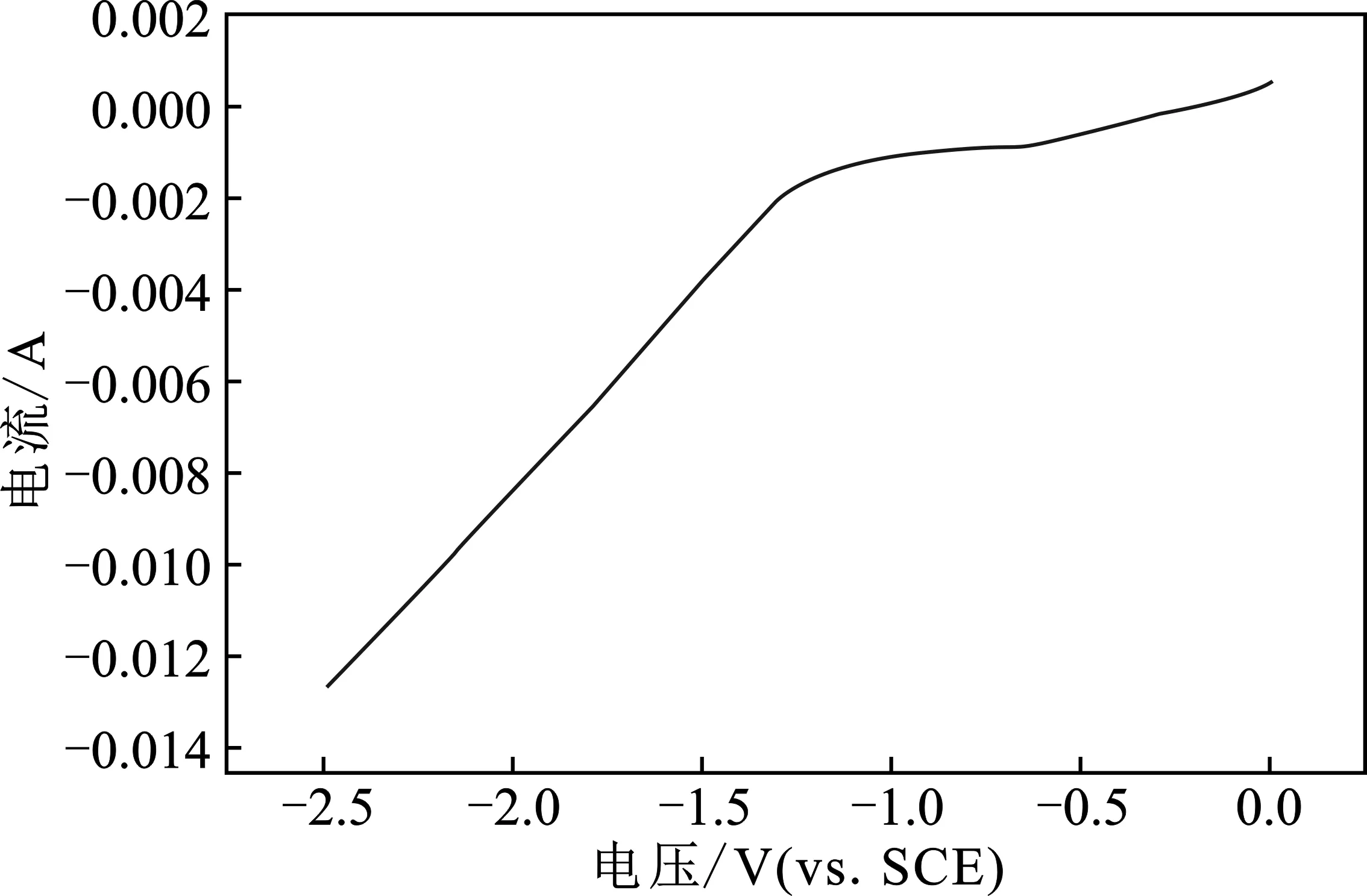
图4 C-Cu2O电极LSV曲线图Fig.4 LSV curve of C-Cu2O electrode
由图4可知,在-1.2~-1.0 V(vs.SCE)之间,LSV曲线出现了拐点,表明在该电解电位下,CO2发生了还原反应。
2.3 CO2的阴极还原
本文研究的目标产物是CH3OH,要对电解后的电解液中CH3OH进行气相色谱仪检测分析,为此,首先使用气相色谱仪分别测定了纯CH3OH溶液、无CH3OH的饱和CO2的KOH(3 g/L)/乙醇(体积分数80%)电解液,以及含CH3OH(体积分数10%)饱和CO2的KOH(3 g/L)/乙醇(体积分数80%)电解液,结果分别见图5~图7。
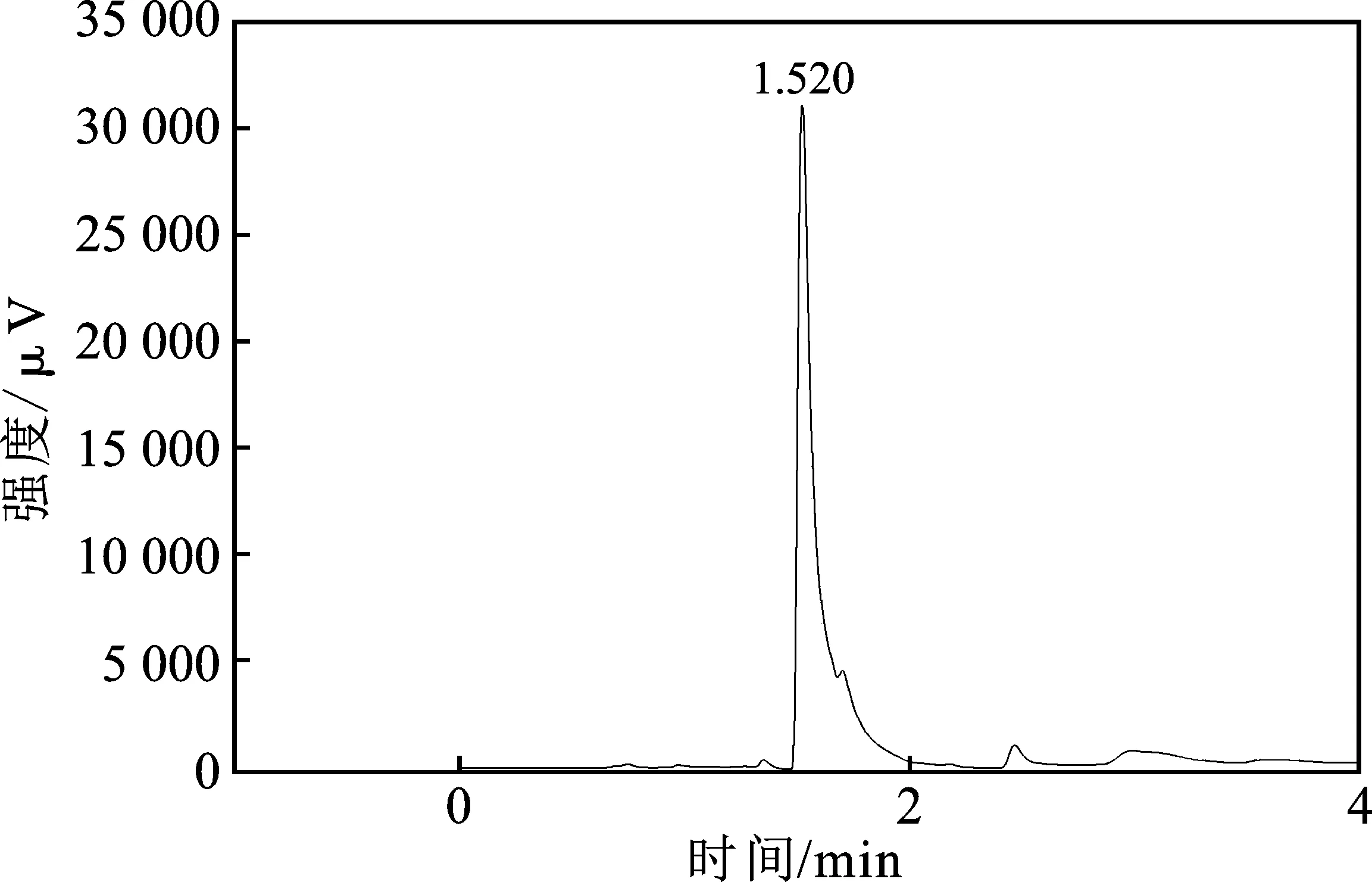
图5 纯甲醇溶液的GC图Fig.5 GC of pure methanol solution
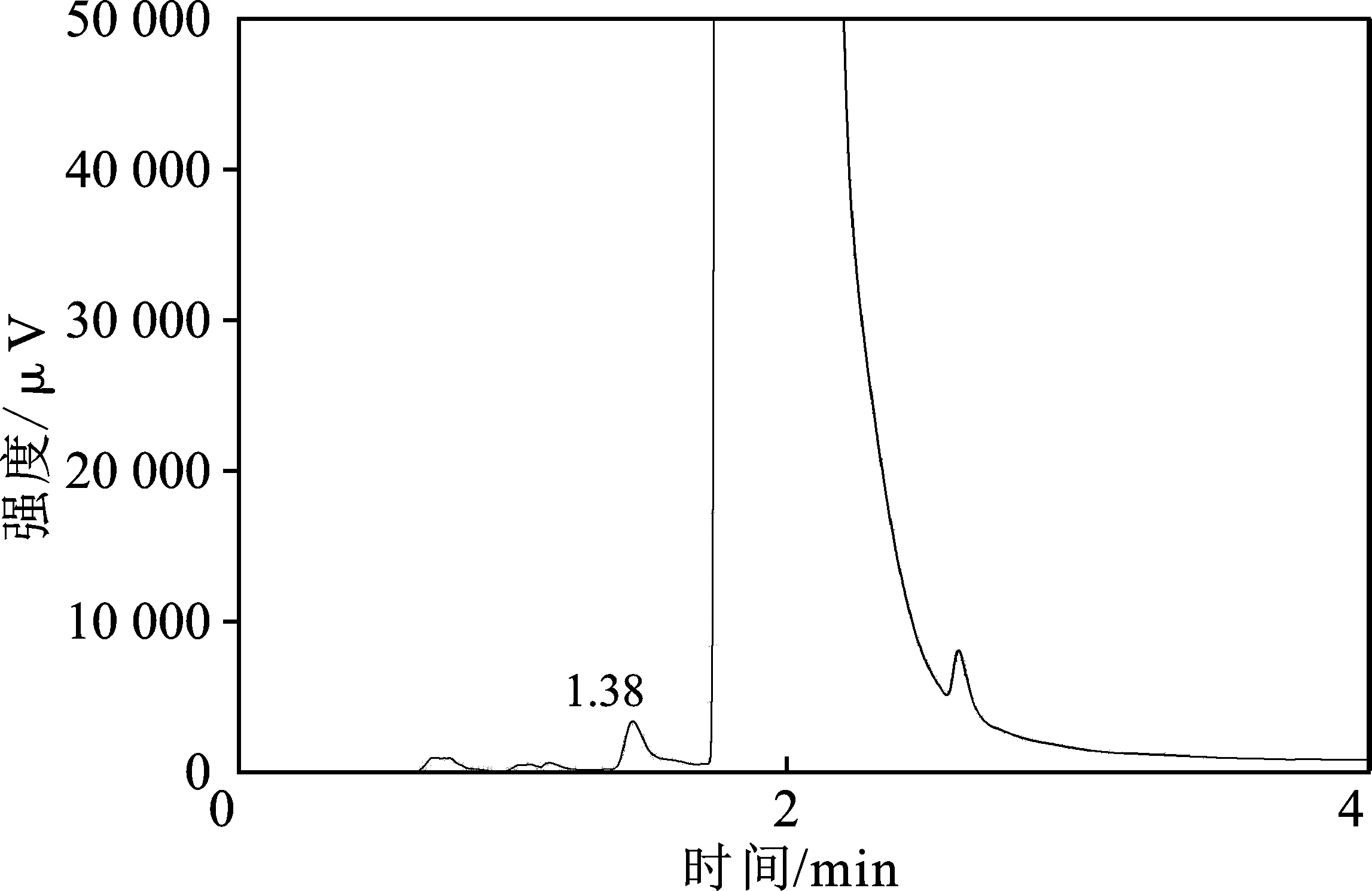
图6 饱和CO2的KOH/乙醇溶液的GC图Fig.6 GC of CO2-saturated KOH/ethanol solution
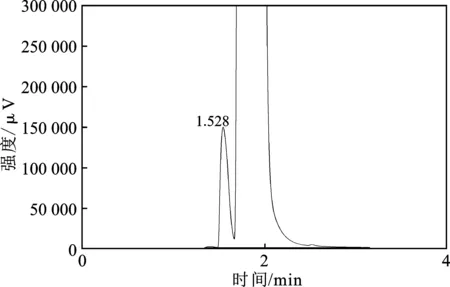
图7 饱和CO2的KOH/乙醇和甲醇混合溶液的GC图Fig.7 GC of CO2-saturated KOH/ethanol and methanol mixed solution
由图可知,CH3OH的出峰位置在 1.52 min 附近。
以C-Cu2O为工作电极,Pb电极为辅助电极,饱和甘汞电极为参比电极,电解液为 KOH(3 g/L)/乙醇溶液(体积分数80%),将100 mL电解液加入一室型电解池,通入流速10 mL/min的CO2,在 -1.1 V(vs.SCE)电解电压下电解3 h。将电解后的电解液进行气相色谱分析,结果见图8。
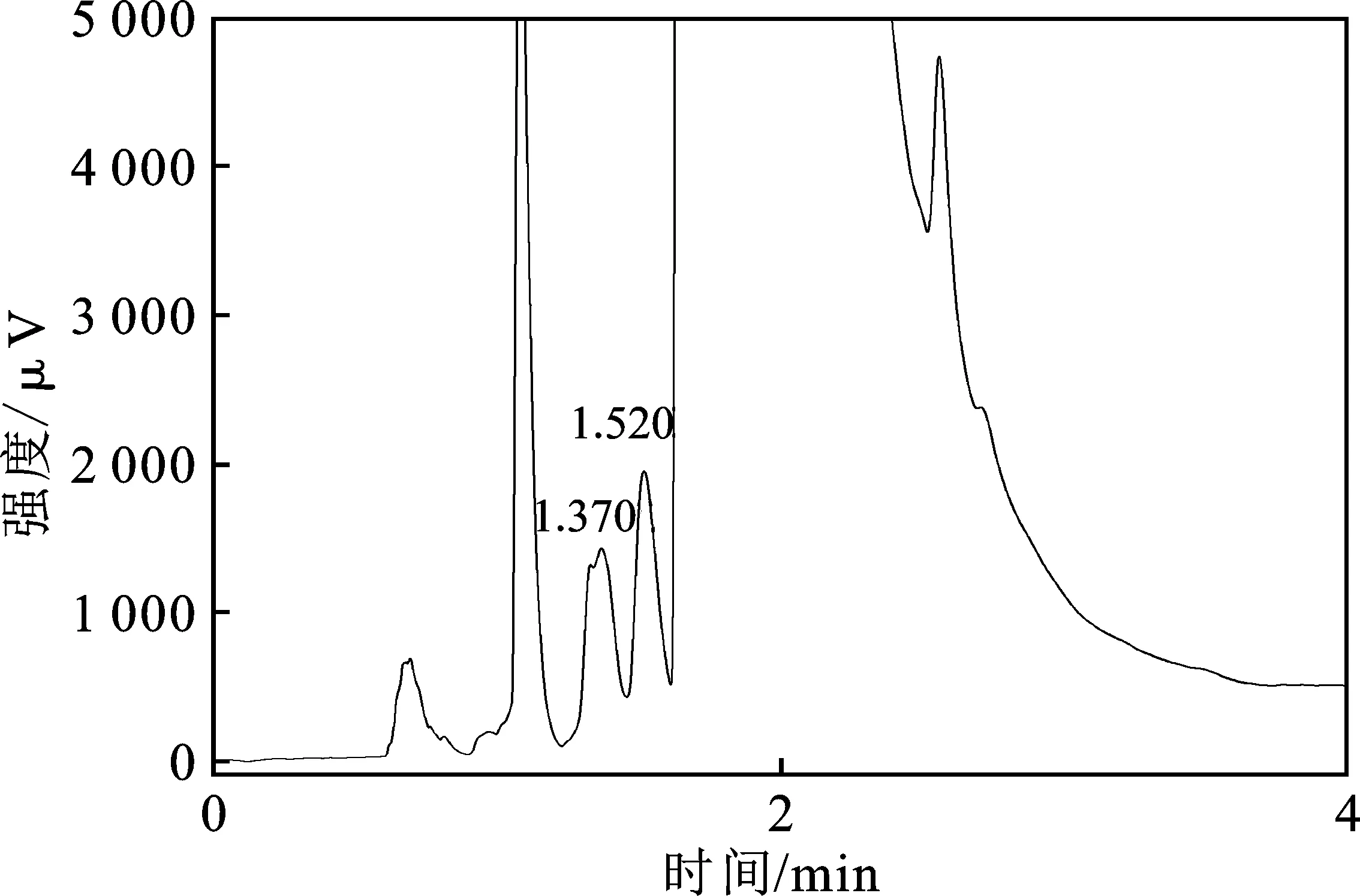
图8 C-Cu2O电极电解产物GC图Fig.8 GC of electrolytic products by C-Cu2O electrode
由图8可知,在1.52 min出现了CH3OH峰,表明电解后的电解液中有CH3OH产生。
2.4 CO2阴极还原的工艺优化
为了研究C-Cu2O电极在CO2的阴极还原为CH3OH的效果和工艺条件,以C-Cu2O电极为阴极,在图1的一室型电解池进行恒电位电解实验。采用L9(34)正交设计实验,对电解液中无水乙醇的浓度和KOH的含量、CO2的流速、电解电压对CO2还原为CH3OH的影响进行研究,所取因素和水平见表1,L9(34)正交设计和实验结果见表2。
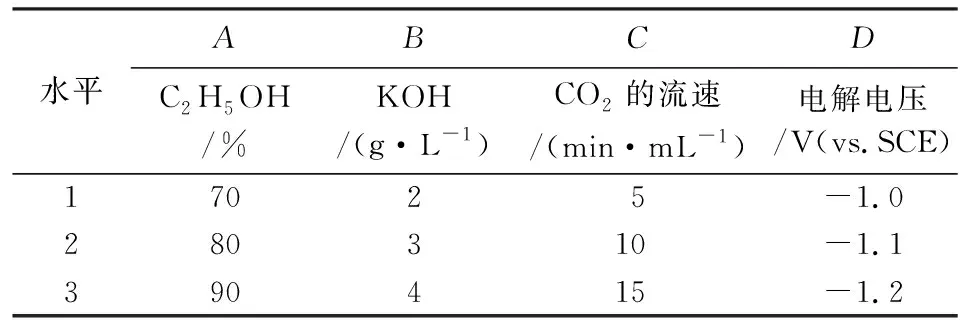
表1 因素水平表Table 1 Factor and level table
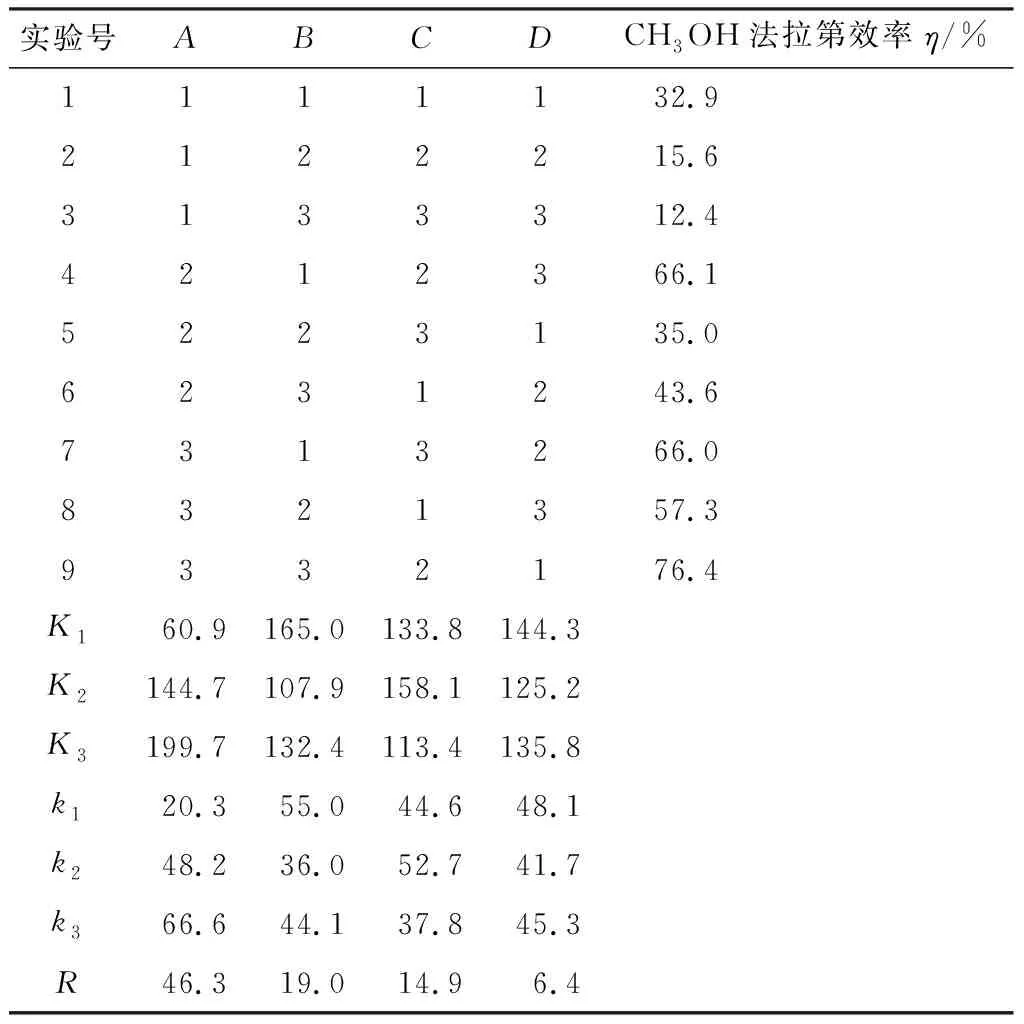
表2 L9(34)正交设计和实验数据分析Table 2 L9(34) orthogonal design and experimental data analysis
R值越大,说明该因素对实验的影响越大,由表2可知,影响CH3OH产率的因素为A(乙醇浓度)>B(KOH的量)>C(CO2流速)>D(电解电压),并得出电化学还原CO2制CH3OH的最优条件为:A3B1C2D1,即乙醇浓度 90%,KOH的量为2 g/L,CO2流速为10 min/mL,电解电压-1.0 V(vs.SCE),但在最优条件下的实验并没有在表2中出现,因此,进行最优条件下的追加实验,结果表明CH3OH的法拉第效率为82%。
3 结论
由纯Cu制备的C-Cu2O复合电极,其微观表面呈现出网状结构,极大地增加了微观表面积,同时拥有了更丰富的CO2吸附位点来进行CO2的催化还原。在-1.2~-1.0 V(vs.SCE)电解电压下,CO2能被阴极还原为CH3OH。通过正交设计实验,得到了CO2阴极还原为CH3OH的最佳工艺条件,即电解液组成为:C2H5OH浓度90%(体积分数),KOH的量为2 g/L;在100 mL 电解液中,CO2流速 10 min/mL,电解电压 -1.0 V(vs.SCE)时,CH3OH的法拉第效率为82%。

