利用外显子测序在高度近视家系中鉴定一个新的NYX基因错义突变
刘书言,邓妮妮,陈金卯,田 奇,彭凤兰
(1. 广西医科大学基础医学院,南宁 530021;2. 玉林爱尔眼科医院,玉林 537000;3. 广西医科大学第一附属医院眼科,南宁 530021;4. 中南大学生命科学学院医学遗传学研究中心,长沙 410008;5. 长沙卫生职业学院基础医学部,长沙 410205)
近视主要表现为屈光不正以及眼轴延长,占全球视力损伤患者总数的48.7%[1-2],是最常见的人类眼部疾病之一。从世界范围看,美国和欧洲人群中近视发生率在20%~30%,而亚洲人群中近视的发生率高达70%[3-7]。高度近视也称病理性近视,主要是指近视度数小于或等于-6.00 m-1或眼轴长度超过26 mm的屈光不正,且伴有进行性眼轴延长,眼底视网膜和脉络膜呈萎缩性退行性病变[8-10]。流行病学资料表明,高度近视在亚洲国家更为普遍,其发病率高达10%~24%,远高于西方国家的2.8%~4.6%[11]。我国近视人数多达6亿,其中高度近视患者占总近视人数的近30%[12]。
高度近视的高发病率、高致盲率及其严重危害性一直是国际社会研究的热点。目前对于近视的病因学研究尚无肯定的结论,主要以环境因素和遗传因素为主[8,13]。家系研究表明,父母近视的发生率与子代近视的发生率呈正相关,而双生子研究证明,近视的遗传度在0.50~0.96之间,且同卵双生子的屈光不正和屈光因素一致性比异卵双生子高[14-16]。这些数据提示,高度近视具有明显的遗传基础。高度近视具有多种遗传方式,包括常染色体显性遗传、常染色体隐性遗传以及伴X连锁遗传,且具有高度的遗传异质性。传统的研究方法是通过连锁分析定位遗传性疾病家系的致病基因位点区间,基于聚合酶链式反应(polymerase chain reaction,PCR),寻找与家系疾病共分离的基因突变。这种方法存在耗时长、人力物力损耗大、无法大规模高效富集基因组片段等诸多弊端。随着新一代测序技术的进步,外显子组测序和靶向外显子捕获测序得到了快速发展,为寻找高度近视致病基因及其突变位点提供了契机。
外显子组测序是利用序列捕获技术,将全基因组外显子区域DNA捕捉并富集后进行高通量DNA测序的基因组分析方法。它只需针对外显子区域的DNA序列即可,且对常见和罕见变异具有高灵敏度,可发现绝大部分疾病外显子区域的相关变异,仅需要对约1%的基因组进行测序,覆盖度更深、数据准确性更高,更加简便、经济、高效,被认为是鉴定孟德尔疾病致病基因最为有效的策略之一,也被运用于寻找单基因病及多基因复杂疾病的致病基因和易感基因等的研究和临床诊断中。目前,已通过外显子组测序确定的高度近视致病基因主要有ZNF644、SCO2、LEPREL1、LRPAP1、CTSH、SLC39A5、P4HA2和GLRA2[17-27]。
人类NYX基因位于Xp11.4染色体上,有2个外显子,编码长度为481个氨基酸的糖基化磷脂酰肌醇锚锭蛋白(nyctalopin),属于亮氨酸富集蛋白(small leucine-rich proteoglycan,LSRP)家族成员[28-30]。nyctalopin主要在视网膜突触层表达,对转化受体电位阳离子通道亚家族M成员1(transient receptor potential cation channel, subfamily M, member 1,TRPM1)的正常表达很重要[31]。有研究报道,NYX基因突变可能导致先天性静止性夜盲症(congenital stationary night blindness of the complete,CSNB1);也有研究发现,NYX基因的突变与高度近视相关[22,28,32-36]。本研究中,我们收集到一个遗传三代的高度近视家系,通过外显子测序鉴定出NYX基因一个新的错义突变c.790A>T(p.N264Y)在该家系中与高度近视表型共分离。
1 材料与方法
1.1 研究对象
本研究的家系来自中国广西一个具有X连锁遗传的三代高度近视家庭。先证者在南宁爱尔眼科医院进行了视力、屈光、裂隙灯、眼底检查和视网膜电图(electroretinogram,ERG)等一系列的眼科检查。其他家庭成员的视力、屈光、裂隙灯检查和抽血均由专业的医生和护士上门完成。所有成员均没有其他已知的眼部疾病或系统性疾病,并排除了早产儿视网膜病变、马凡综合症和Stickler综合症等能导致近视表型的遗传性疾病。
1.2 外显子测序分析
采用苯酚-氯仿法从全血样本中提取DNA[25]。选取先证者的DNA进行全外显子组测序,对测序的结果进行严格的生物信息学分析。将外显子组测序产生的原始数据比对到参考基因组hg19上[37],然后用SAMTOOLS(http://SAMTOOLS.sourceforge.net/)进行单核甘酸多态性(single nucleotide polymorphism,SNP)和插入缺失标记(insertion-deletion,INDEL)检测[38]。过滤过程如下 :1)删除数据库中高频率变异;2)删除纯和变异;3)删除对照中的变异;4)保留两个患者共有而正常对照没有的变异。
1.3 突变的筛查与验证
对外显子组测序得到的候选基因突变位点序列设计引物,利用Sanger测序验证所有家族成员中该突变位点与表型的共分离状态,并在正常对照、1000Genomes、 ESP6500和ExAc等数据库中进行突变筛查,排除携带该位点的突变。使用primer3(http://primer3.ut.ee/)设计PCR引物[39]。测序结果与参考基因组hg19进行比对(http://genome.cse.ucsc.edu)[40-41]。错义突变的功能预测及潜在的疾病风险预测工具为Polyphen-2(http://genetics.bwh.harvard.edu/pph2/)[42]、SIFT(scale-invariant feature transform,http://sift.jcvi.org/www/SIFT_seq_submit2.html)[43]和Mutation Taster(http://www.mutationtaster.org/)[44]。
2 结果与分析
2.1 家系临床特征分析
本研究共采集该高度近视家系17个成员的DNA样本(图1)。家系中没有女性患者,所有的男性患者在10岁以前都有近视史,近视度数从-5.25~-8.00 m-1不等。家系图提示可能为X连锁遗传。先证者(M33022)表现出视乳头周围萎缩斑、视网膜变薄呈现豹纹状眼底、可透见脉络膜粗大血管、中心凹光反射消失等典型的高度近视眼底特征(图2)。同时,先证者患有严重的弱视和眼球震颤,我们两次检测都无法获得稳定的视网膜电图。先证者及家人没有夜盲症的临床表现。除了M33029个体患有内斜视外,其他受试者的视光检查均正常(表1)。
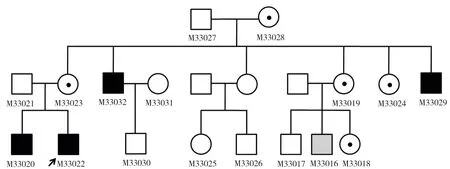
图1 X-连锁遗传高度近视家系的系谱结构图Fig. 1 The pedigree structure of the family with X-linked high myopia
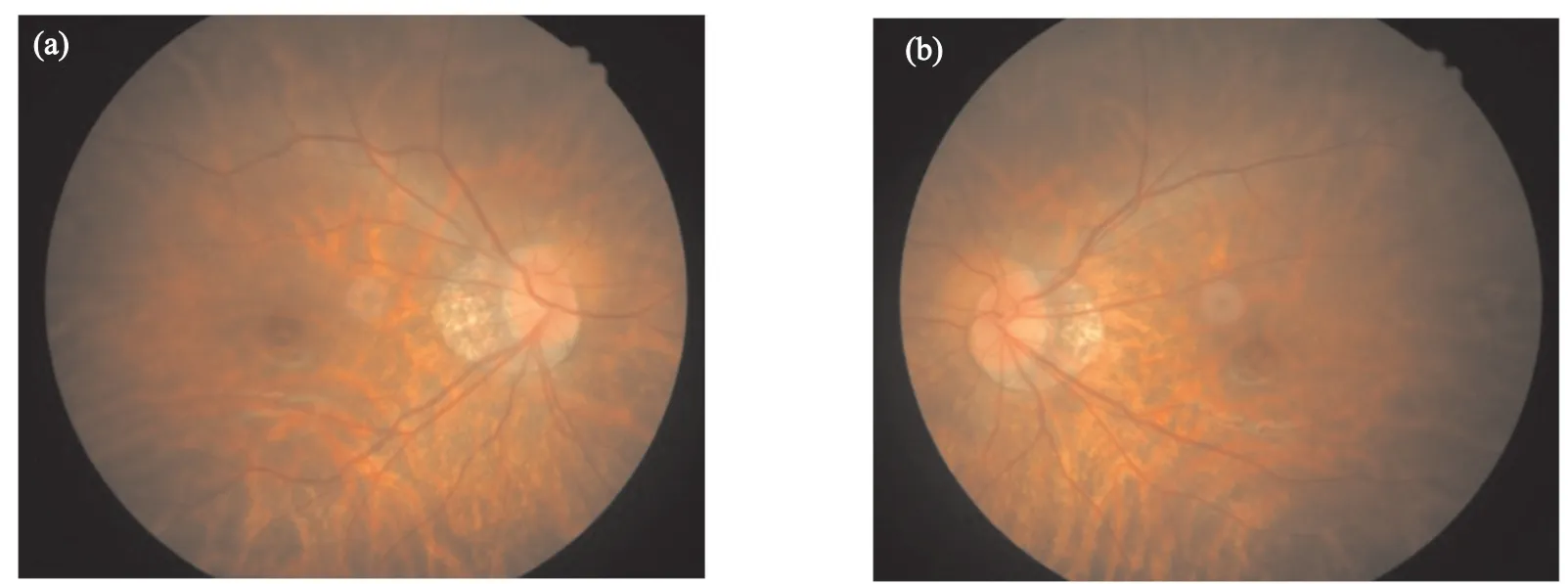
图2 先证者(M33022)眼底照片Fig. 2 Fundus photographs of the proband (M33022)
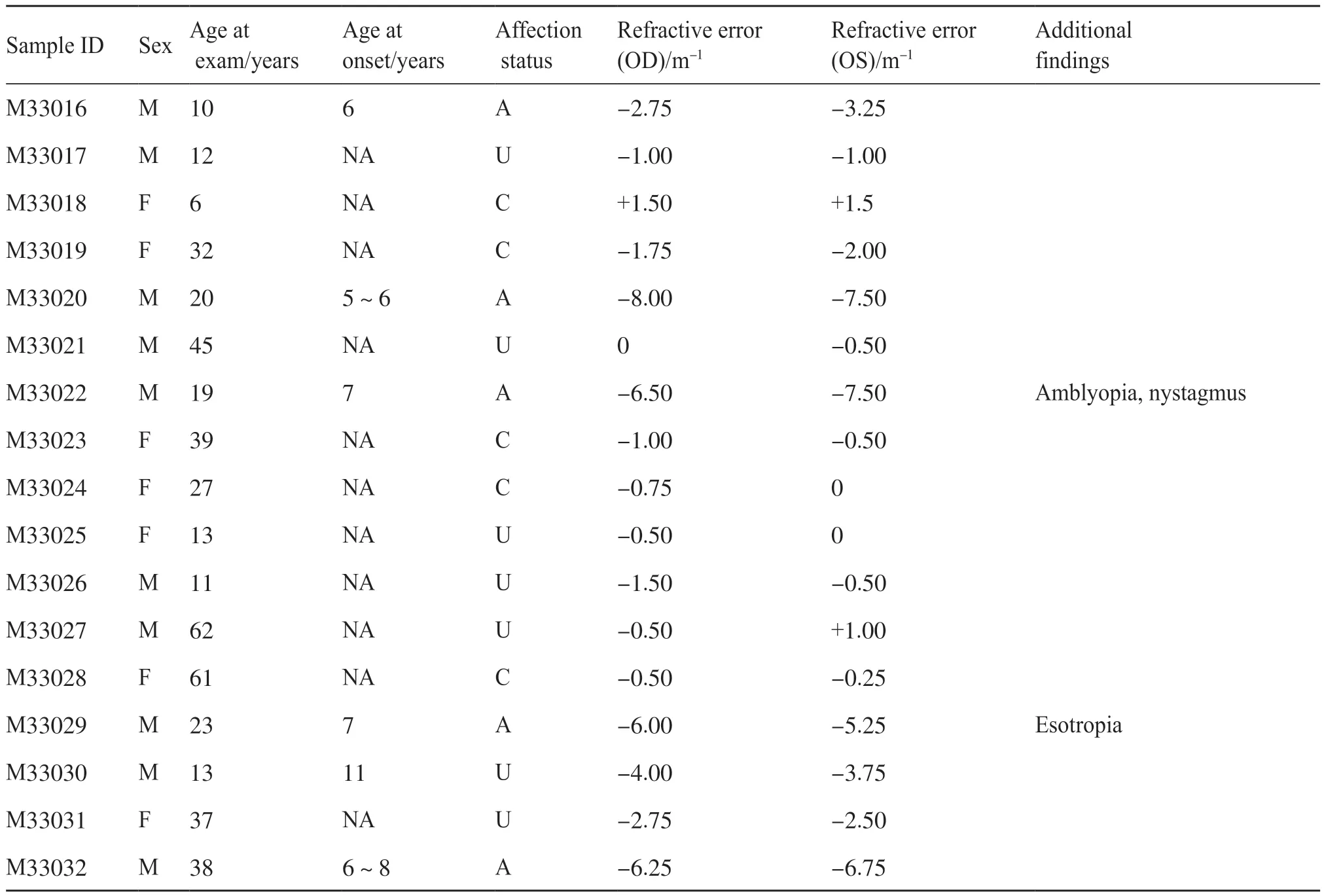
表1 高度近视家系成员的临床特征Tab. 1 Clinical features of the family members with high myopia
2.2 突变筛查结果
通过对先证者(M33022)进行外显子测序发现,位于Xp11.4上NYX基因2号外显子790位点的A突变为T,该变异导致nyctalopin第264位的Asn突变为Tyr。对家系成员进行PCR测序,发现NYX基因c.790A>T突变与家系中高度近视患者共分离(图3)。同时,测序未发现其他已知高度近视致病基因在家系中共分离。对100例对照进行PCR,然后测序,查询1000Genomes、ESP6500和ExAc数据库,排除该突变为已知SNP。通过对人类、东非狒狒、普通狨猴等17个物种NYX基因编码的氨基酸序列进行比对,发现第264位的Asn在不同物种中都是保守的(图4)。SIFT软件预测p.N264Y是有害的,而polyphen-2软件也预测其可能有害。因此,我们认为NYX基因c.790A>T(p.N264Y)的突变可能是导致这个家族高度近视的原因。
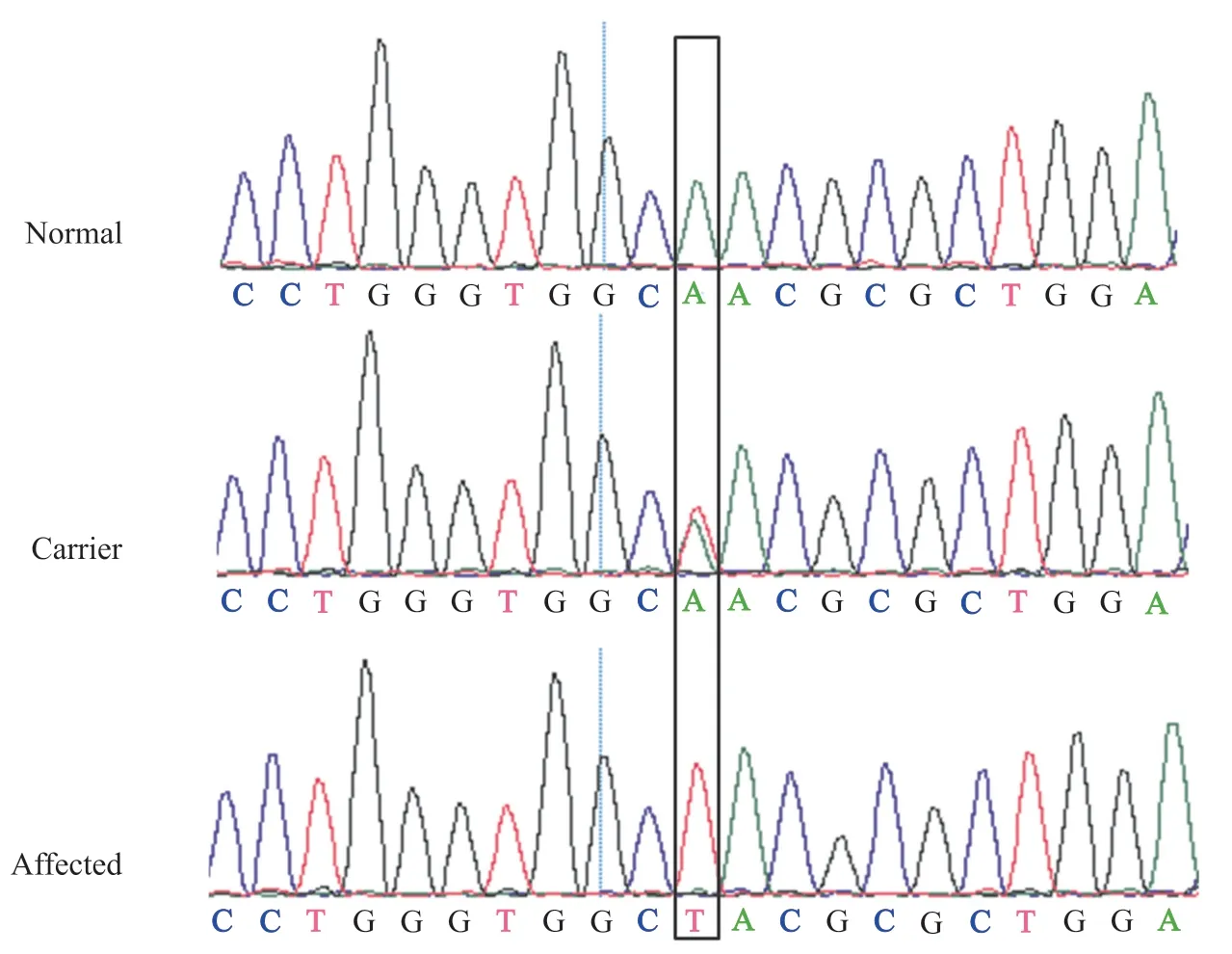
图3 正常人、携带者和高度近视患者在NYX基因c.790A>T位点的测序结果Fig. 3 Sequence of the region encompassing the NYX c.790A>T mutation in unaffected individual, obligatory carrier, and affected individual

图4 不同物种NYX基因编码氨基酸序列比对Fig. 4 Multiple sequence alignment for the NYX amino acid sequence
3 讨论
在该高度近视家系中,我们检测出NYX基因的一个新突变c.790A>T(p.N264Y),该突变在家系中与高度近视患者共分离。其中,M33016右眼近视度数为 -2.75 m-1,左眼近视度数为 -3.25 m-1,未达到高度近视的诊断标准,由于样本采集时仅为6岁,推测其高度近视表型可能还未充分显现。另外,M33030个体测序显示其在该位点序列为野生型,样本采集时年龄为13岁,但是他的右眼为 -4.00 m-1,左眼为 -3.75 m-1,属于中度近视。据监护人反映,该个体长期沉迷网络游戏,这可能是其近视的主要原因。
NYX基因编码的细胞表面蛋白具有11个连续的典型富含亮氨酸重复片段(leucine rich repeats,LRRs)[45-46]。p.N264Y突变位于第8个富含亮氨酸重复片段的第22个氨基酸,该氨基酸在17个物种中都是保守的。SIFT和polyphen-2软件预测p.N264Y是有害变异。有研究报导,NYX基因c. 792C>G突变引起的第264位Asn变为Lys与静止性夜盲症的发生有关[30]。多个报道表明,同一氨基酸突变为不同氨基酸后可引起不同临床表型。例如:RHO基因p.G90D突变引起类似夜盲症的症状,而p.G90V则表现为典型的视网膜色素变性[47-48];FGFR3基因p.K650M的突变引起I型致死性异型增生,p.K650E突变引起Ⅱ型致死性异型增生,p.K650Q/N的突变则引起轻度的增生[49-51]。我们的研究表明,静止性夜盲症与高度近视之间存在复杂的关系,这有助于我们了解NYX基因型与表型的关系。
到目前为止,有3个研究涉及到6个NYX基因位点的突变与高度近视有关,分别是c.144C>G[20]、c.572_573GC>AA[20]、c.529_530GC>AT[26,34]、c.626G>C[34]、c.121delG[34]和 c.335T>C[34]。c.144C>G突变是在一个双眼均近视-12.00 m-1的8岁男孩患者基因中发现的,c.572_573GC>AA突变是在一个双眼近视均为-6.50 m-1的46岁男性患者基因中发现的,c.529_530GC>AT突变分别在一位46岁男性患者(右眼-10.50 m-1,左眼-9.00 m-1)和一位15岁男性患(右眼-21.00 m-1,左眼-20.00 m-1)中发现,c.626G>C突变是在一个5岁小男孩患者(右眼-9.00 m-1,左眼-10.00 m-1)中发现的,c.121delG突变是在一位31岁男性高度近视患者(右眼-16.00 m-1,左眼-9.50 m-1)中发现的,c.335T>C突变是在一位11岁的小男孩患者(右眼-10.00 m-1,左眼-11.00 m-1)中发现的。以上6个与高度近视相关的突变位点均在中国人群中发现,c.790A>T也是在中国人群中发现的。这些研究结果表明,种族群体之间特定的遗传变异在很大程度上导致了个体表型的差异[52]。
NYX基因c.790A>T突变既没有在100名无亲缘关系的正常对照中检测到,也没有在相关的数据库中发现,说明该突变是罕见位点突变,是高度近视的危险因素。虽然生物信息学软件也预测该位点的突变是有害的,但我们的研究尚缺乏试验证据证明该变异能够引起蛋白质功能的改变,需要进一步的研究来阐明p.N264Y突变引起高度近视的作用机制,这也是我们下一步将继续开展的工作。
本文在一个三代高度近视家系中发现了错义突变的NYX基因c.790A>T(p.N264Y),并且NYX蛋白质第264位氨基酸的变化可导致不同的表型。该发现扩大了NYX基因的突变谱,为进一步阐明其基因型-表型关系提供了有用的信息。

