链霉菌Ahn75菌剂助剂的筛选及对水稻稻瘟病的防效研究
付祖姣,刘宇波,郭照辉,杨 华,罗容珺,刘 欢,毕世宇,肖 蓉,胡 展,刘万钧
(湖南省微生物研究院,长沙 410009)
水稻是我国主要的粮食作物,常因稻瘟病(Rice blast)的侵害导致稻谷减产、稻米品质下降,程度严重时甚至稻谷绝收。稻瘟病是由半知菌类丛梗孢科、梨形孢属稻梨孢菌(Magnaporthe oryzae)侵染水稻引起的病害,因侵染时期和部位的不同可分为苗瘟、叶瘟、节瘟、穗颈瘟、谷粒瘟[1]。目前,水稻稻瘟病主要依靠化学农药进行防治,但化学农药的长期施用易诱发稻瘟病病原菌的抗药性,且化学农药对环境、土壤会造成一定的污染,给食品安全和人类健康也带来较大的隐患[2]。因此,开发新型高效生物农药,减少化学农药的施用,是满足人类健康需求和可持续农业发展的必要手段。
内生链霉菌(endophyticStreptomyces)是新型的水稻稻瘟病生防资源,其独特的内生生境赋予了它丰富的抗生素生产能力和抗病能力。有研究人员从水稻中分离到了内生吸水链霉菌(Streptomyces hygroscopicus)OsiSh-2,通过其分泌的抗生素、铁载体和多种膜降解酶能抑制稻瘟病的生长和繁殖,从而有效降低水稻叶瘟的发病率[3-5]。Patel等[6]发现,高粱内生链霉菌SS1、SS5和SS8不仅能抑制水稻稻瘟病病原菌的生长,诱导水稻防御基因的表达上调,还能显著促进水稻茎的生长。Ahn75是从海南水稻茎中分离的一株内生灰褐色链霉菌(Streptomyces griseobrunneus),该菌株能高效抑制水稻稻瘟病菌的生长和孢子萌发,喷施水稻后能定殖在水稻的茎、叶和根部[7],并有效降低水稻稻瘟病的发病率,提高稻谷产量,是一株具有较强生防和促生潜力的内生链霉菌,可用于水稻的药肥研制。但是,目前市场上还未见有效果较好的放线菌制剂出现,且内生放线菌的田间防效与其定殖量密切相关,而其定殖水平又受环境、天气和水稻生育期等多种因素的影响[8]。筛选能有效促进放线菌孢子萌发、改善菌剂物理性能的助剂,对于提高放线菌的定殖水平和生防效果意义重大。
灰褐色链霉菌Ahn75在体外能高效抑制水稻稻瘟病病原菌12个不同生理小种的生长,同时具有固氮、解钾、产铁载体等促生长性能,还具有较强的镉、砷和铅耐受性能,是一株具有较大应用潜力的生防菌株[9]。本研究以灰褐色链霉菌Ahn75为研究对象,通过分析不同的营养物、分散剂、润湿剂、紫外保护剂和稳定剂等对Ahn75孢子萌发、菌剂稳定性和抗病效果的影响确定Ahn75菌剂的助剂优化配比,为放线菌Ahn75菌剂的研制和产业化提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株
拮抗菌株 Ahn75(登录号 :CCTCC No. M 2019890)是本研究组从海南水稻健康茎中分离的内生链霉菌。
1.1.2 水稻品种
选择超优千号系列‘湘两优900’用于稻瘟病拮抗菌株Ahn75的盆栽防效研究。该水稻品种是湖南年丰种业科技有限公司和湖南省杂交水稻研究中心培育的第五期超级稻高品质软米,稻瘟病综合指数为5.3~5.8,穗瘟损失率最高级7级。
1.1.3 培养基
ISP2(international streptomyces program 2)培养基[10]:1%麦芽提取物(malt extract)、0.4%酵母提取物(yeast extract)、0.4%葡萄糖,pH 7.2。固体培养基添加1.5%的琼脂,115℃高压灭菌20 min,用于放线菌的培养。
燕麦培养基[11]:30 g 燕麦片用纯水煮沸 1 h,4层纱布过滤除去沉淀,加入100 mL榨取的新鲜西红柿汁和15 g琼脂粉,纯水定容至1 000 mL,pH 7.2,115℃高压灭菌20 min。将其用于水稻稻瘟病病原真菌稻梨孢的孢子制备。
1.1.4 助剂
营养物质包括丙氨酸(alanine)、组氨酸(histi-dine)、酵母提取物、麦芽提取物、蛋白胨(peptone)、叶面肥(foliar fertilizer);分散剂包括木质素磺酸钠(sodium lignosulfonate)、木质素磺酸钙(calcium lignosulfonate)、Morwet D425、吐温80(Tween 80);润湿剂包括拉开粉(Nekal)、Morwet EFW、十二烷基硫酸钠(dodecyl sulfate,sodium salt,SDS);紫外保护剂包括糊精(dextrin)、维生素C(VC)、维生素B2(VB2)、荧光素钠(sodium fluorescein);稳定剂包括羧甲基纤维素钠(carboxymethylcellulose sodium)、海藻酸钠(sodium alginate)、海藻酸钾(potassium alginate)、黄原胶(xanthan gum)。所有助剂均为市售分析纯或工业纯。
1.2 研究方法
1.2.1 放线菌孢子悬浮液的制备
放线菌的孢子具有比菌丝更强的抗逆性能,且生存时间较长,故本文选择放线菌的孢子作为主要活性成分,用于放线菌剂助剂的筛选。
将放线菌Ahn75接入ISP2培养基,28℃培养3~5 d,待培养皿上布满孢子,用称量勺刮取孢子粉至无菌的10 mL离心管中,用水溶液悬浮,配制Ahn75的孢子悬浮母液。对孢子悬浮母液进行十倍梯度稀释并涂布ISP2平板,3 d后统计平板菌落数,计算孢子悬浮母液中孢子的含量。使用时用无菌水将孢子悬浮液稀释至合适的含量。
1.2.2 放线菌孢子促萌发营养物质的筛选
丙氨酸、组氨酸等游离氨基酸和叶面肥可促进农作物生长,常用作肥料或肥料添加剂,而麦芽提取物、酵母提取物和蛋白胨常用作放线菌、细菌培养的C/N源。本研究选择这些可促进农作物生长或促进微生物生长的营养物质作为研究对象,分析它们对Ahn75孢子萌发的影响,筛选适合放线菌孢子萌发的最佳营养助剂。配置5.00%氨基酸、5.00%叶面肥、1.00%麦芽提取物、1.00%蛋白胨、0.50%酵母提取物的营养物质水溶液,均121℃高压灭菌20 min。在 1.5 mL EP 管中分别加入 50 μL无菌的营养物质水溶液、5 μL 109CFU/mL的孢子悬浮液、445 μL无菌水,混匀,28℃静置培养,分别在24 和48 h取10 μL培养液滴于载玻片上,盖上盖玻片,在相差显微镜下观察孢子的萌发情况,随机统计6个视野中萌发和未萌发的孢子数,并根据公式计算孢子的萌发率。空白对照采用等体积无菌水替代营养物质,其他处理方法与样品处理一致。每个处理重复3次。
孢子萌发率按以下公式计算[12]:孢子萌发率(%)=萌发孢子数/(未萌发孢子数+萌发孢子数)×100。
1.2.3 放线菌菌剂润湿剂、分散剂的筛选
放线菌菌剂最佳分散剂、润湿剂根据刘振华等[13]、李姝江等[14]、王剑等[15]的研究选择吐温80、木质素磺酸钠、木质素磺酸钙、Morwet D425、拉开粉、Morwet EFW、SDS进行筛选。将不同种类的分散或润湿剂以0.50%的质量分数加入ISP2培养基中,进行高压灭菌后制备该培养基的固体平板,然后取0.1 mL 102和103CFU/mL的孢子悬浮液分别涂布于含有不同润湿剂、分散剂的ISP2平板上28℃培养36~48 h。对照为不加其他物质的ISP2平板,其余操作与处理一致。每个处理重复3个平板,记录每个平板的菌落形成单位数(CFU值)。孢子萌发率(%)=处理平板上的菌落数/对照平板上的菌落数×100。
根据含有不同润湿剂、分散剂平板上孢子萌发率水平的高低筛选有助于放线菌孢子萌发的最佳润湿剂和分散剂。
1.2.4 放线菌菌剂紫外保护剂的筛选
根据王剑等[15]、罗洋等[16]的研究分别检测糊精、VC、VB2、荧光素钠等紫外保护剂对链霉菌Ahn75孢子萌发及其对紫外线耐受性能的影响,筛选对Ahn75孢子萌发抑制小且可有效保护孢子抗紫外线照射的保护剂。
试验先将不同的紫外保护剂以0.50%的质量分数加入ISP2培养基中,并制备该培养基的固体平板,然后取 0.1 mL 102和 103CFU/mL的孢子悬浮液涂布于该平板上,28℃培养36~48 h。对照为不加其他物质的ISP2平板。每个处理重复3个平板,记录每个平板的菌落形成单位数(CFU值)并根据1.2.3方法计算孢子的萌发率。
选择萌发水平最高的紫外保护剂,分别以不同的质量浓度加入ISP2培养基中进行孢子萌发试验,筛选紫外保护剂的最佳促萌发质量浓度。
同时,将各紫外保护剂分别按最佳促萌发质量分数加入102~103CFU/mL的孢子悬浮液中,混合均匀后在超净工作台紫外灯(254 nm,15 W 光强,120 lx)下35 cm处照射2 min,取0.1 mL孢子悬浮液涂布于ISP2平板上,28℃培养36~48 h,记录每个平板的菌落形成单位数(CFU值)。对照1取0.1 mL不加紫外保护剂且未经紫外线照射的孢子悬浮液涂布ISP2平板,对照2取0.1 mL不加紫外保护剂但经紫外线照射2 min的孢子悬浮液涂布ISP2平板。每个处理重复3次,统计每个平板的菌落形成单位数(CFU值),并根据1.2.3方法计算孢子萌发率,分析不同紫外保护剂处理下,孢子在紫外线照射下的萌发水平。
1.2.5 放线菌菌剂稳定剂的筛选
根据张建萍等[17]的研究,选择羧甲基纤维素钠、海藻酸钠、海藻酸钾、黄原胶等作为放线菌制剂的稳定剂材料,分别将不同稳定剂以0.15%的质量分数加入ISP2培养基中,并制备该培养基的固体平板。取 0.1 mL 102和103CFU/mL 的孢子悬浮液涂布于该平板上,28℃培养36~48 h,记录每个平板的菌落形成单位数(CFU值)。对照采用等体积无菌水代替稳定剂。计算不同稳定剂下Ahn75孢子的萌发率,分析不同稳定剂对孢子萌发的影响。
将稳定剂与109CFU/mL的孢子悬浮液混匀,在0~60 min内的不同时间吸取悬浮液中段液体,测定其在370 nm 波长处的吸光值,根据时间和吸光值的变化绘制图表,并分析不同稳定剂对孢子悬浮液的稳定性能。
1.2.6 润湿剂和紫外保护剂质量分数的优化
将促萌发效果最佳的润湿剂、分散剂分别以0.01%、0.02%、0.05%、0.10%、0.25%、0.50%的质量分数加入ISP2固体培养基中,将最佳紫外保护剂分别按0.01%、0.02%、0.05%、0.10%、0.25%、0.50%、1.00%的质量分数加入ISP2固体培养基中,按1.2.3的方法进行孢子萌发率的检测,分析润湿剂、分散剂和紫外保护剂的最佳促萌发含量。
1.2.7 盆栽试验
将水稻种子在纯水中浸泡30 min,剔除空秕粒后倒掉纯水,用75%的乙醇表面消毒5 min,然后用1% NaClO浸泡5 min,无菌水清洗3~5次。将表面消毒后的种子装入双层塑料滤水篮的上层,加无菌水浸没水稻种子,30℃催芽1 d。将催芽的种子转移至每盆装有800 g泥土的陶瓷盆中,每盆2颗,每个处理重复3次,以无菌水处理为空白对照。所有盆栽在自然状态下培养。
分别将各种助剂按最佳质量浓度与Ahn75孢子悬浮液混合,制备含有不同助剂的Ahn75菌剂,保持菌剂中Ahn75孢子含量不低于1×108CFU/mL。同时,按王玉双等[18]的方法在燕麦培养基上培养水稻稻瘟病病原真菌稻梨孢菌株,待菌株充分产孢后,每皿用5 mL无菌水洗下孢子,制成每毫升105个病原真菌孢子的悬浮液。
将分蘖期水稻盆栽移至温室中,分别将上述Ahn75菌剂喷施于不同的盆栽,空白处理以等体积纯水代替。5 d后,将制备的稻瘟病孢子悬浮液喷施于所有盆栽,并保持90%以上湿度24 h以上,10 d后依据国际稻瘟病圃IRBN的标准统计各处理水稻叶瘟发病情况[19],并根据以下公式计算水稻叶瘟发病率和病情指数,评估助剂协同Ahn75防治水稻叶瘟的效果。
发病率(%)=(发病株数/调查总株数)×100;
病情指数 =[ Σ( 各病级植株数 × 各级代表数值)/调查总植株数×最高级别值]×100;
发病率防治效果(%) =[(对照发病率-处理发病率)/对照发病率]×100;
病情指数防治效果(%)=[(对照病指数-处理病指数)/对照病指数]×100。
1.2.8 数据统计和分析
采用Excel软件对数据进行处理和统计,采用SPSS19.0软件(Duncan法)对不同处理间的差异进行0.05和0.01水平显著性分析。数值采用平均值±标准差()表示。
2 结果与分析
2.1 营养物质对放线菌孢子萌发的影响
分别检测丙氨酸、组氨酸、麦芽提取物、酵母提取物、蛋白胨、水稻叶面肥对链霉菌Ahn75孢子萌发的影响,结果显示,与对照相比,营养物质对Ahn75孢子的萌发有不同程度的促进作用(图1、表1)。培养24 h后,叶面肥处理下的孢子萌发显著,肉眼可见培养液中有明显的菌丝团出现,相差显微镜下可观察到数团菌丝球。通过统计萌发孢子和未萌发孢子数量可得出叶面肥培养下的孢子萌发率达到(54.33±11.43)%。此外,与对照相比较,蛋白胨、酵母提取物、丙氨酸、组氨酸和麦芽提取物均能显著促进链霉菌孢子的萌发,但其促进水平显著低于叶面肥(表1)。当培养时间延长至48 h时,酵母提取物的促孢子萌发效果与叶面肥相当,均达到90%以上。两者之间的萌发率经过统计分析,差异不显著。其次为蛋白胨,0.10%的质量分数下培养的孢子萌发率为(67.92±8.29)%。0.50%组氨酸对孢子萌发的影响与0.10%的麦芽提取物效果相当,并优于0.50%的丙氨酸(表1)。综合显微观察和统计的结果,可选择叶面肥或酵母提取物作为Ahn75的营养助剂。
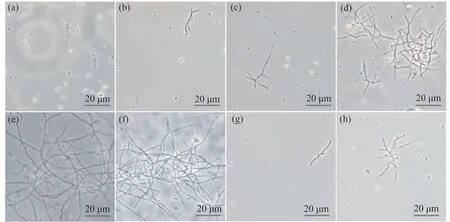
图1 不同营养物质对Ahn75孢子萌发的影响(400×)Fig. 1 Effects of different nutrients on Ahn75 spore germination (400×)
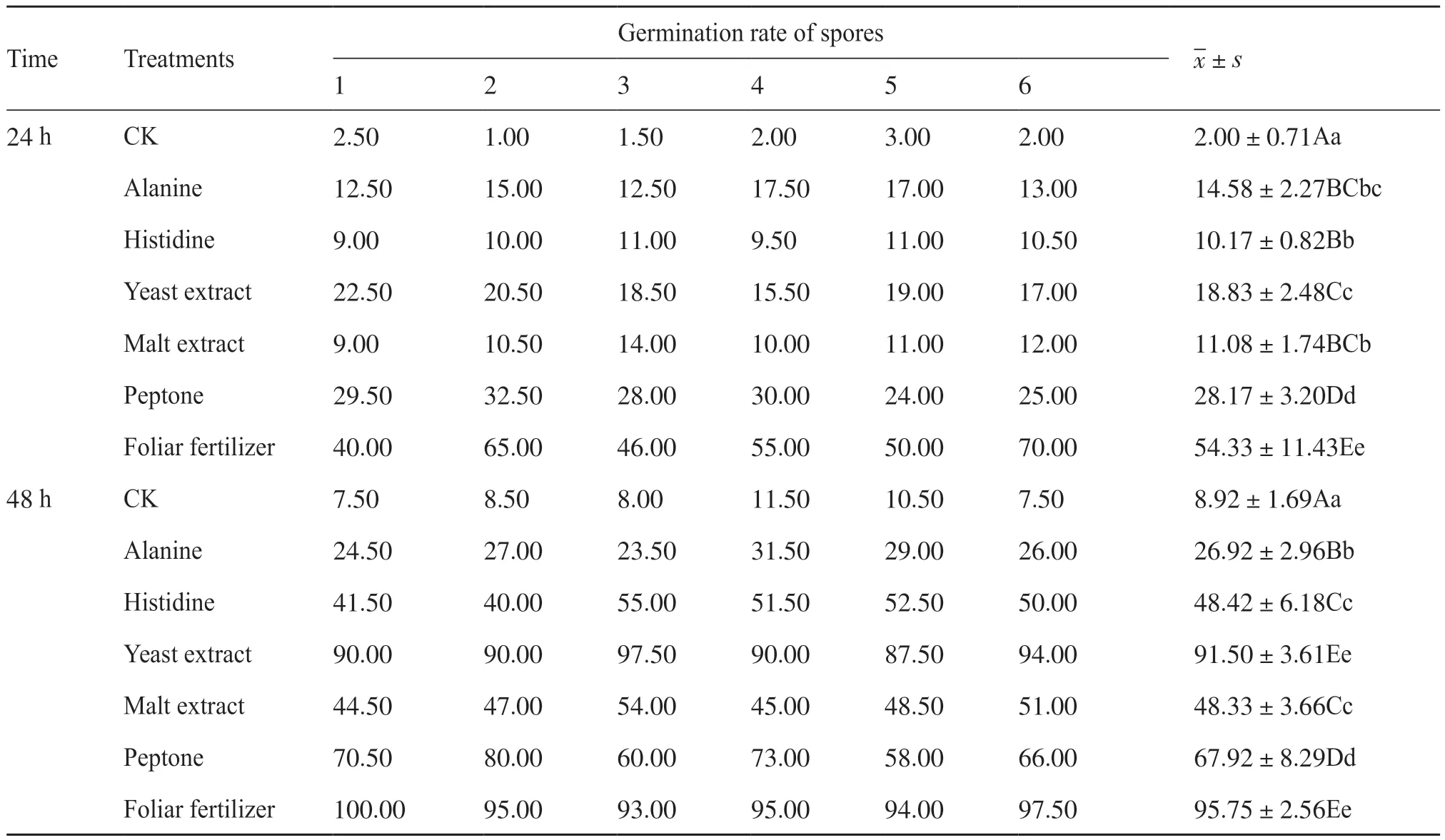
表1 不同营养物质培养下链霉菌Ahn75孢子的萌发水平Tab. 1 The germination levels of Streptomyces Ahn75 spores cultured with different nutrients unit: %
2.2 不同润湿剂、分散剂对放线菌孢子萌发的影响
分别检测4种分散剂和3种润湿剂对链霉菌Ahn75孢子萌发率的影响,结果显示(表2),液体分散剂吐温80、木质素磺酸钠、木质素磺酸钙在0.50%的质量分数下均与Ahn75孢子具有较佳的生物相容性,孢子萌发率为93.50%~94.73%,其中吐温80表现最佳,但三者处理下的孢子萌发率与对照的统计学分析显示差异不显著(P>0.05),而0.50% Morwet D425则完全抑制了孢子的萌发,培养4 d后,孢子萌发率依然为0。在润湿剂中,3种被检润湿剂对孢子萌发均有一定程度的抑制,其中,0.50%拉开粉对孢子萌发影响最小,其2 d的萌发率为(89.78±5.28)%;0.50% SDS处理下,孢子萌发率虽然与拉开粉处理下的孢子萌发率没有显著性差异,但其萌发时间与对照和拉开粉相比延长了2 d;而Morwet EFW则完全抑制了链霉菌孢子的萌发,培养4 d后的孢子萌发率依然为0。因此,上述7种分散润湿剂中,吐温80作为易获得且对孢子萌发影响小的物质,可选作Ahn75孢子的分散剂。
在此基础上,本文继续考察了不同质量分数的吐温80对Ahn75孢子萌发的影响,结果显示(表3),当吐温80的质量分数为0.050%时,Ahn75孢子萌发率最高,达到(124.49±4.92)%,比对照萌发水平提高了24.49%。因此,吐温80为Ahn75孢子分散剂的最佳质量分数为0.050%。

表3 不同质量分数的吐温80处理下Ahn75孢子的萌发水平Tab. 3 The germination levels of Ahn75 spores treated with different concentrations of Tween 80 unit: %
2.3 不同紫外保护剂对放线菌孢子萌发及紫外保护的影响
分别检测了4种常规紫外保护剂对Ahn75链霉菌孢子萌发的影响,结果显示(表4),糊精和荧光素钠能显著促进Ahn75孢子的萌发(P<0.05),其中糊精的促萌发效果最显著(P<0.01),在0.50%糊精处理下,Ahn75孢子萌发率达到(141.77±4.76)%,比对照孢子萌发率提高了41.77%,而VC和VB2对孢子萌发的影响差不多,低于对照和其他处理,但与对照相比差异不显著(P>0.05)。
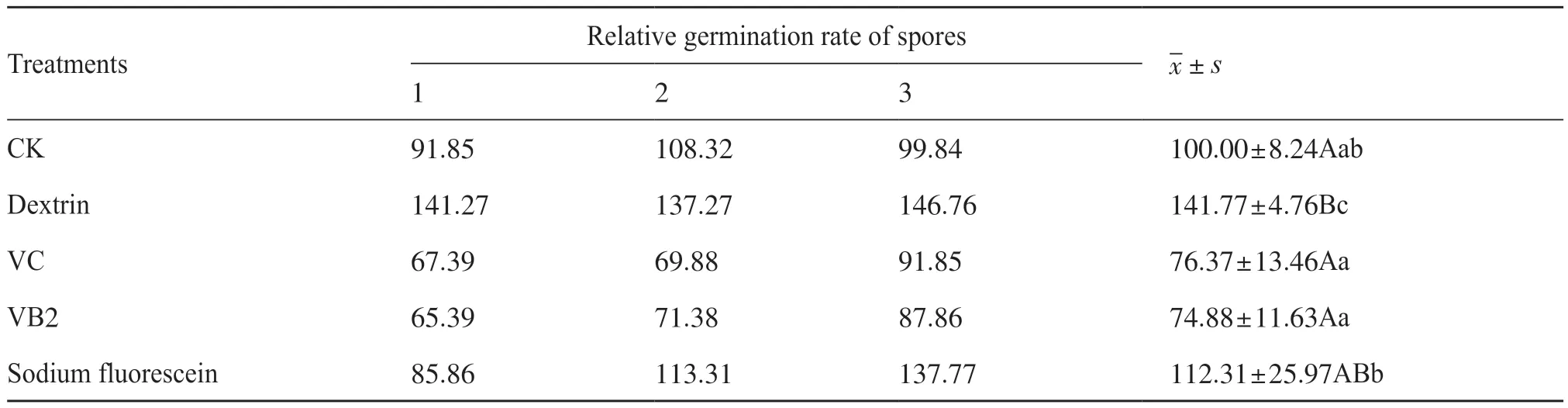
表4 不同紫外保护剂处理下Ahn75孢子的萌发水平Tab. 4 The germination levels of Ahn75 spores treated with different UV protective unit: %
通过检测不同质量分数糊精对Ahn75孢子萌发的影响,发现糊精质量分数在0.50%以上时,能显著促进Ahn75孢子的萌发,且1.00%的糊精比0.50%的糊精具有更显著的促孢子萌发效果(表5)。因此,可选择质量分数为1.00%的糊精作为紫外保护剂。

表5 不同质量分数的糊精处理下Ahn75孢子的萌发水平Tab. 5 The germination levels of Ahn75 spores treated with different concentrations of dextrin unit: %
考虑到紫外保护剂对菌剂更重要的作用是其对功能菌株的紫外保护功能,故本研究继续考察了各紫外保护剂在质量分数为1.00%时Ahn75孢子紫外线照射后的萌发水平,结果如表6所示。从表6中可知,与未经紫外线照射的对照1相比,经紫外线照射2 min后的对照2孢子萌发率显著降低(P<0.01),存活率仅为(45.31±3.93)%,但添加了糊精并经紫外线照射后的孢子萌发率比未添加紫外保护剂但经紫外线照射的CK2孢子萌发率显著提高(P<0.05),说明糊精能有效保护Ahn75孢子免受紫外线照射的伤害。此外,VB2的添加与CK2相比,孢子萌发差异不显著,而VC和荧光素钠的添加使Ahn75孢子萌发率显著降低。由此可见,VB2、VC和荧光素钠不能保护Ahn75孢子免受紫外线伤害。
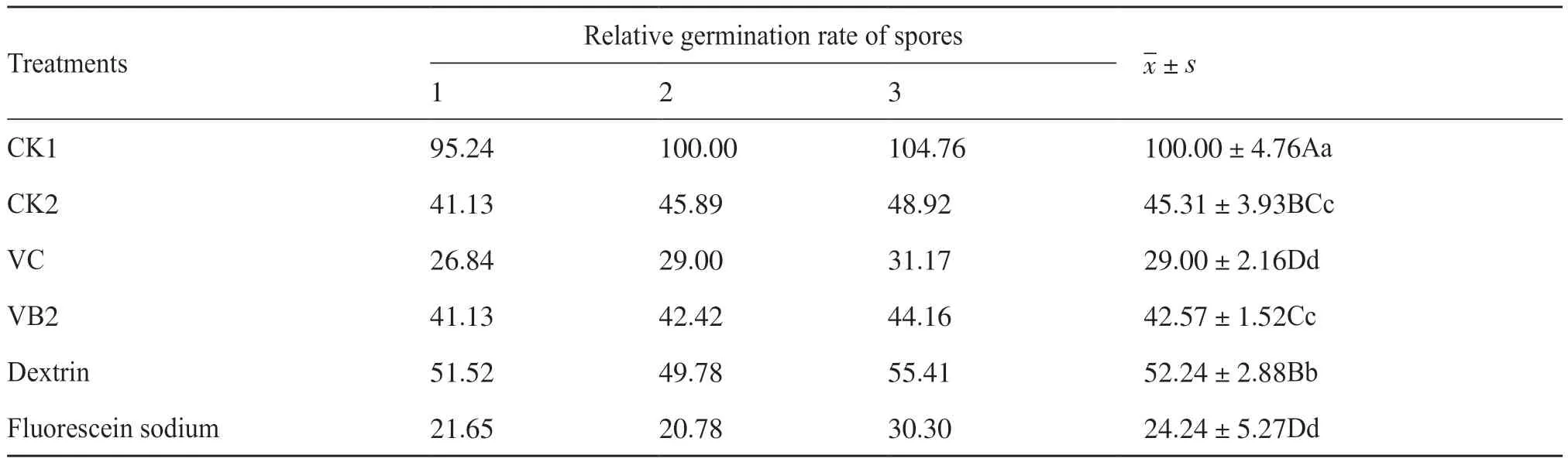
表6 不同紫外保护剂对Ahn75孢子抗紫外线保护水平Tab. 6 The UV protection levels of different UV protective on Ahn75 spores unit: %
综合各紫外保护剂对Ahn75孢子萌发及紫外线保护的水平,本文选择糊精作为Ahn75菌剂的紫外保护剂。
2.4 不同稳定剂对放线菌孢子萌发及孢子悬浮液稳定性的影响
分别检测羧甲基纤维素钠、海藻酸钠、海藻酸钾和黄原胶4种稳定剂与Ahn75孢子的生物相容性,结果显示,4种稳定剂中,海藻酸钠对链霉菌孢子的生物相容性最佳,当用质量分数为0.15%的海藻酸钠处理时,Ahn75孢子萌发率为(97.67±17.59)%,其次为海藻酸钾和羧甲基纤维素钠,黄原胶处理下孢子萌发率最低(表7)。但各稳定剂处理后的孢子萌发率经统计学分析,差异均不显著。
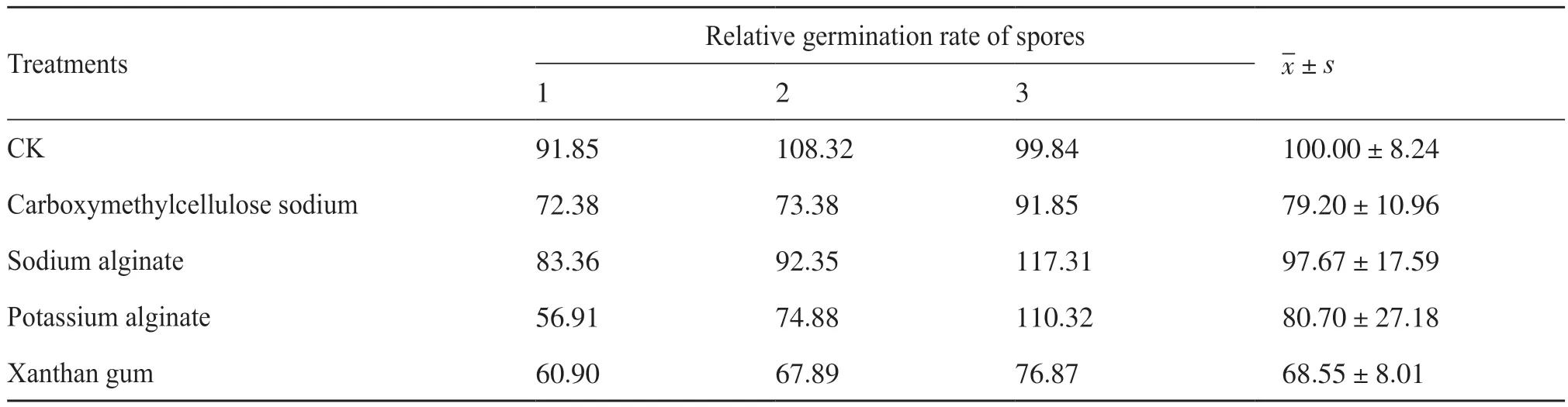
表7 不同稳定剂处理下Ahn75孢子的萌发水平Tab. 7 The germination levels of Ahn75 spores treated with different stabilizers unit: %
根据生物相容性结果,本文选择羧甲基纤维素钠、海藻酸钠和海藻酸钾三种稳定剂,分析了它们对孢子悬浮剂的稳定性能,结果如图2所示。从图2可看出,加入海藻酸钠后,孢子悬浮液在370 nm处的吸光度值下降最缓慢,30 min后才降至最低值,而加入羧甲基纤维素钠和海藻酸钾后,孢子悬浮剂的吸光度值分别在2 min和15 min内降至最低值。该结果说明,加入海藻酸钠的孢子悬浮液的稳定性维持时间最长,其次为羧甲基纤维素钠和海藻酸钾。
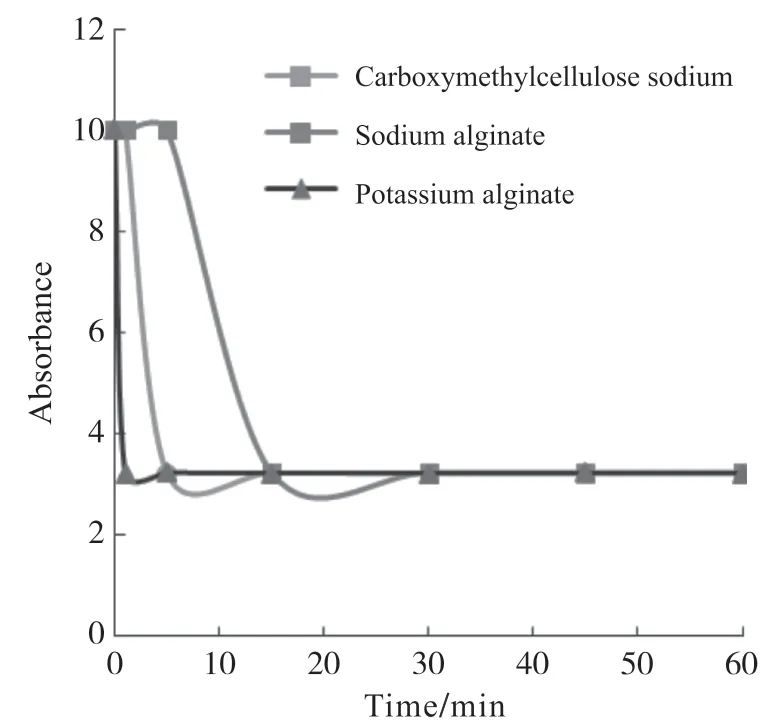
图2 不同稳定剂处理下Ahn75孢子悬浮液的吸光度变化曲线Fig. 2 The absorbance curves of Ahn75 spore suspension mixed with different stabilizers
综合稳定剂和Ahn75孢子的生物相容性及其对孢子悬浮液的稳定水平,可选择海藻酸钠作为Ahn75孢子的稳定剂。
2.5 Ahn75菌剂对水稻稻瘟病的生物防效
考虑到吐温的分散促萌发效果较好,本文将Ahn75菌剂以适量孢子和0.05%的吐温水溶液进行基本配置,然后分别将叶面肥或酵母提取物、糊精和海藻酸钠按最佳含量与Ahn75孢子吐温悬浮液混合,配制成含0.50%叶面肥、0.05%酵母提取物、1.00%糊精、0.15%海藻酸钠和混合助剂的Ahn75菌剂。分蘖期喷施处理盆栽水稻,发现叶面肥等助剂均能显著降低水稻叶瘟的发病率和病情指数(表8),其中叶面肥、酵母提取物和混合助剂对叶瘟发病率的影响最显著,生物防效达25.91%~31.81%,而酵母提取物、糊精和混合助剂对叶瘟病情指数影响最显著,生物防效达31.36%~38.06%。

表8 添加不同助剂的Ahn75菌剂处理后水稻叶瘟发病情况Tab. 8 Incidence of rice leaf blast treated with Ahn75 agents with different adjuvants unit: %
3 讨论
利用生防微生物活体对植物病害进行生物防治,不仅可以避免化学农药和农用抗生素造成的自然选择压力,还可增加土壤有益微生物的丰度,有效改善土壤的微生态结构,其前景广阔[20]。但微生物制剂的防效受田间环境和定殖水平等因素影响存在不稳定性[21]。选择合适的微生物助剂,除了可改善微生物产品的分散性、悬浮率、稳定性等性能[13],还能增加制剂的表面张力和渗透能力[21],最终提高功能微生物的药效[22],是潜力巨大的微生物产品能否走向市场最为关键的一步。
不过,对于以活菌为主要有效成分的微生物产品来说,功能微生物在制剂中的存活水平是其发挥作用的前提。为了更好地利用水稻内生链霉菌Ahn75阻断稻瘟病病原菌孢子在水稻叶片上的传播,本研究以Ahn75的孢子为研究对象,通过液体和固体两种培养方式检测了不同助剂对链霉菌孢子萌发的影响,分析了紫外保护剂和稳定剂对孢子悬浮液性能的影响,并评估了各助剂对Ahn75生物防效的影响。研究发现,营养物质普遍能促进链霉菌孢子的萌发,以营养成分丰富的叶面肥、酵母提取物的促萌发效果最显著,而常用于放线菌和细菌培养的营养成分蛋白胨和麦芽提取物以及叶面肥中常出现的促生长氨基酸组氨酸和丙氨酸虽也能促进孢子的萌发,但效果却远低于叶面肥和酵母提取物,可能营养物质丰富的营养成分更有助于孢子的萌发。此外,在几种被检的其他助剂中,大部分物质对Ahn75的孢子未表现出显著的促萌发和抑制萌发作用,但分别可用于分散剂和紫外保护剂的吐温和糊精却具有显著的促孢子萌发作用。吐温80是一种最常用的乳化剂,它不仅可以降低悬浮液的表面张力,提高孢子在水中的分散度, 而且能促进某些真菌孢子的萌发[23]。张拥军等[24]也发现糊精与粘帚霉孢子具有较好的生物相容性,且能有效保护其孢子免受紫外线的伤害。而两个润湿剂候选物质Morwet D425和EFW却表现出了与其他研究者不一致的结果。本研究发现,Morwet D425和EFW以0.50%的质量分数存在时能完全抑制Ahn75孢子的萌发。潘以楼等[25]也发现,Morwet D425和EFW在12.5~100.0 g/L的质量浓度下能完全杀灭短小芽孢杆菌TW-2的菌体和芽胞。但也有研究发现,Morwet D425和EFW与枯草芽孢杆菌B99-2、B5具有较好的生物相容性,并被用于这两株生防菌可湿性粉剂的助剂[16,26]。由此可知,同样的助剂不一定适配不同的功能微生物,对于每一种功能微生物来说,都需要筛选最合适的助剂。
此外,本文还进一步通过盆栽试验证实了助剂对Ahn75孢子悬浮液的增效作用,特别是酵母提取物和混合助剂对链霉菌孢子抗稻瘟病的增效作用显著高于其他单一助剂。综合考虑各助剂对菌剂抗病性能和物理性状的作用,可以确定将酵母提取物、吐温、糊精和海藻酸钠一起与链霉菌孢子进行复配,是生产链霉菌菌剂的最佳选择。
本文在微生物制剂主要性能检测中发现,虽然助剂与链霉菌孢子生物相容性都表现出较好的效果,但助剂对菌剂性能,特别是抗紫外线性能和稳定性能的改善还有待加强。与化学农药和其他微生物菌剂相比,该菌剂对水稻稻瘟病的防治效果还达不到市场应用需求。可能原因有三:一是拮抗菌株接种频率过低,菌株在水稻内部定殖数量可能有限,导致能在水稻体内发挥作用的功能菌株丰度较低;二是本次助剂筛选范围不够广,可用助剂的使用质量分数有待进一步优化,特别是紫外保护剂对菌株的紫外防护功能还有待提升,能促进链霉菌孢子定殖水稻组织的助剂还有待进一步筛选;三是内生链霉菌定殖水稻的最佳时期和环境条件等有待进一步探究,获得内生菌定殖水稻的最佳条件可使用最少量的菌剂达到最大的生物防效,不仅节约了微生物菌剂的成本,还能提高其生物防效。
未来农业生产中生物产品的施用将主要依赖于无人机作业,以避免传统人工喷施劳动强度大、效率低等问题。因此,为潜在生防微生物菌株筛选能提高微生物液体菌剂的分散性、稳定性、环境耐受性和定殖力的助剂将是未来生物制剂的主要研究方向之一。

