基于网络药理学和分子对接探讨丹参-郁金治疗多囊卵巢综合征的作用机制
孔鑫靓 刘雁峰
(北京中医药大学东直门医院,北京,100700)
多囊卵巢综合征(Polycystic Ovarian Syndrome,PCOS)是一种以生殖内分泌紊乱和代谢失调为主要特征的妇科常见疾病,在育龄期女性中发病率为5%~10%[1],且具有逐年上升的趋势。由于PCOS持续性无排卵或稀发排卵的特点,其导致的不孕症发病率高达50%~80%[2],同时,PCOS并发的糖脂代谢异常、高雄激素血症等疾病严重危害女性的身心健康。现阶段主要围绕调整月经周期、降低雄激素水平、促排卵、预防并发症等方面采用口服药物、手术、调整生活方式等方法进行治疗,取得了一定成效。但由于西医治疗方法具有一定局限性与不良反应,中医及中西医结合治疗逐渐成为越来越多PCOS患者的选择。
在中医学中并无PCOS专篇记载。根据其症状,散见于“闭经”“崩漏”“月经先后无定期”“不孕”等疾病的描述中。中医认为,女性生理节律由肾-天癸-冲任-胞宫轴所司职,而肾在其中起到了主导作用;同时,“女子以肝为先天”,肝藏血,女子经、带、胎、产皆以血为用。且肝肾同属下焦,肾精肝血互生互补,泉源不竭;肝主疏泄,肾主封藏,一藏一泻,使子宫藏泻有期,月经按时来潮。而针对PCOS患者来说,肾虚是其基本病机,肝郁则是其重要的病机环节[3]。肾精虚衰,天癸乏源,肝气郁结,疏泄失常,而致气血运行受阻,冲任胞脉空虚失养,月事不节甚至闭经。且现代研究表明,情志因素与PCOS发病关系密切,而情志不畅多由于肝气郁结所致,所以郁被认为是引起及加重PCOS的重要因素之一[4]。导师刘雁峰教授常以补肾解郁调冲作为治疗大法贯穿PCOS患者的治疗过程中,取得了良好的效果。补肾解郁调冲大法中,丹参-郁金是发挥疏肝解郁、活血化瘀作用的核心药对。丹参味苦,性微寒,具有活血通经、解郁除烦的作用;郁金气味苦辛,性寒,又入血气,具有活血化瘀、解郁清心的功效。丹参-郁金具有多种活性成分,而网络药理学可以筛选出药物的核心化合物,进而预测药物作用于疾病的靶点、参与的通路,更为具象地展现中药“多成分-多靶点”的作用机制。本研究通过对丹参-郁金核心成分、作用于PCOS的靶点及相关通路的分析,以期探究其干预治疗PCOS的作用机制,为进一步实验研究及临床应用提供参考。
1 资料与方法
1.1 丹参-郁金活性成分和靶点筛选 在中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)(https://tcmspw.com/tcmsp.php)中分别检索丹参、郁金的化学成分,以口服生物利用度(Oral Bioavailability,OB)≥30%、类药性(Drug Likeness,DL)≥0.18的参数条件进行筛选,收集丹参、郁金的活性成分并将活性成分编号。通过Uniprot数据库(https://www.uniprot.org/)获得与药物活性成分相关的靶点蛋白信息并将其转化为靶点基因,筛选来自人类的靶点基因,最终获得丹参-郁金药物靶点基因库。
1.2 PCOS疾病靶点的筛选 通过GeneCards数据库(https://www.genecards.org/)设置检索词为“polycystic ovary syndrome”,获取PCOS相关的疾病靶点信息,选取相关度Score值≥中位数的靶点作为PCOS的疾病靶点。在人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM)https://www.omin.org/)检索同上关键词,将获取的靶点信息补充至GeneCards数据库获取的疾病靶点中,excel去重后获得最终PCOS疾病靶点数据库。
1.3 药物-成分-共同靶点网络的构建 利用R语言将药物靶点基因库与PCOS疾病靶点数据库取交集,绘制韦恩图,得到丹参-郁金治疗PCOS的潜在作用靶点,运用Cytoscape 3.7.2软件构建药物-成分-共同靶点图,节点为成分和靶点,边为节点间关系。边表示成分与共同靶点的直接联系,度值表示连接该节点的边的条数。成分及靶点在图上呈现的面积随度值增加而增大,度值及面积越大表示该节点与其他节点的连接越广泛,可能起到枢纽作用。
1.4 蛋白质-蛋白质相互作用(PPI)网络的构建 在STRING(https://string-db.org/)数据库中上传共同靶点,限定属性为“Homo sapiens”,以置信度分数score≥0.400(中置信度)为条件进行筛选,隐藏无关联节点,得到共同靶点蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络图,并在Cytoscape 3.7.2中进行可视化展示。节点度值越高,节点直径越大、颜色越深;节点间的相互作用越强,边越粗、颜色越深。
1.5 基因本体(Gene Ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG富集分析 将共同靶点上传至DAVID数据库进行GO功能和KEGG通路富集分析。使用条形组合图对GO功能富集结果进行可视化展示,使用气泡图对KEGG功能富集分析结果进行可视化展示。
1.6 分子对接验证 分子对接前,使用Cytoscape中Network Analyze功能对药物-成分-共同靶点网络进行拓扑分析,根据该网络各个节点的度值(Degree)、紧密度(Closeness)和介度(Betweenness)确定药物的主要活性成分及核心靶点蛋白。通过Pubchem数据库下载主要化合物数据的mol2格式,通过Chem3D对所下载的化合物进行能量最小化,并转化为pdb格式,将小分子化合物导入AutoDock Tools-1.5.6软件删除水分子并添加原子电荷、分配原子类型,将所有柔性键默认可旋转,最后保存为pdbqt文件。从PDB数据库(http://www.rcsb.org)数据库下载PDB格式文件,采用Pymol 2.3软件删除蛋白分子中的无关小分子后,将蛋白分子导入AutoDock Tools-1.5.6软件删除水分子、添加氢原子以及设置原子类型,最后保存为pdbqt文件,作为对接配体。以靶蛋白作为受体,以处理后的化合物作为小分子配体,根据小分子与靶点的作用位点确定的Grid Box的中心位置以及长宽高,最后通过AutoDock vina和python脚本进行批量对接,对分子对接结果进行分析,化合物与蛋白的结合作用可视化采用Pymol软件。通过Pubchem数据库下载19个化合物数据的mol2格式,通过Chem3D对所下载的化合物进行能量最小化,并转化为pdb格式,将小分子化合物导入AutoDock Tools-1.5.6软件删除水分子并添加原子电荷、分配原子类型,将所有柔性键默认可旋转,最后保存为pdbqt文件。从PDB数据库下载丝氨酸/苏氨酸蛋白激酶(PDB ID:6SB0),丝裂原激活的蛋白激酶3(PDB ID:4QTB),丝裂原激活的蛋白激酶1(PDB ID:4QP2),白细胞介素6(PDB ID:2HMH),细胞肿瘤抗原P53(PDB ID:1JSP),血管内皮生长因子A(PDB ID:4KZN)的晶体结构PDB格式文件,采用Pymol 2.3软件删除蛋白分子中的无关小分子后,将蛋白分子导入AutoDock Tools-1.5.6软件删除水分子、添加氢原子以及设置原子类型,最后保存为pdbqt文件。将处理后的19个化合物作为小分子配体,5种蛋白靶点作为受体,根据小分子与靶点的作用位点确定的Grid Box的中心位置以及长宽高,最后通过AutoDock vina和python脚本进行批量对接,对分子对接结果进行分析,化合物与蛋白的结合作用可视化采用Pymol软件。
2 结果
2.1 丹参-郁金活性成分和靶点 收集共收集到丹参、郁金的活性成分共80个,其中丹参活性成分为65个,郁金活性成分为15个。2种药物各活性成分的作用靶点去重后共获得157个药物靶点,对已知作用靶点的活性成分以中药名首字母进行编号(如丹参中已知作用靶点的活性成分命名为DS1、DS2等,郁金中已知作用靶点的活性成分命名为YJ1、YJ2等)。
2.2 PCOS疾病靶点的筛选 获得靶点1 847个。
2.3 药物-成分-共同靶点网络的构建 得到共同靶点93个,即丹参-郁金治疗PCOS的潜在作用靶点。见图1。共有220个节点、1 007条边。见图2。活性成分编号为DS9的luteolin Degree值为56,编号为DS57的tanshinone iia Degree值为41,编号为DS53的salviolone Degree值为38,编号为YJ1的beta-sitosterol Degree值为37,编号为YJ3的naringenin Degree值为37,位于前5位。见表1。

图1 PCOS与丹参-郁金共同靶点韦恩图
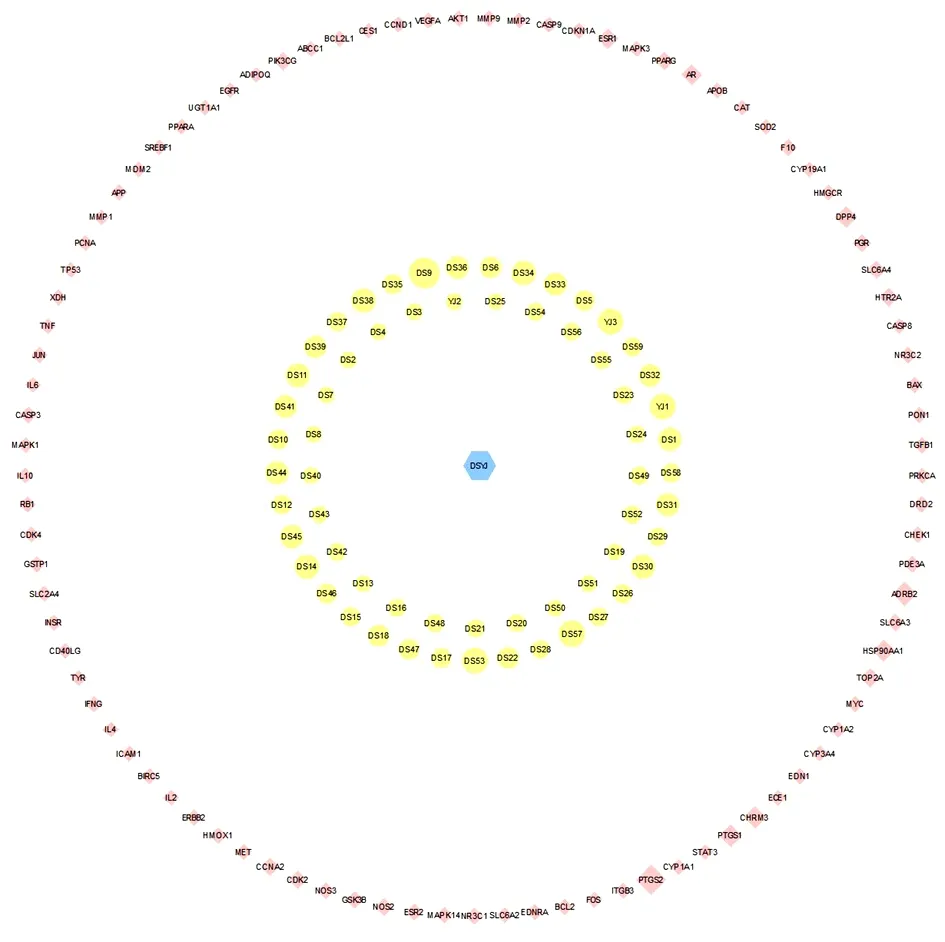
图2 丹参-郁金治疗PCOS的药物-成分-共同靶点
2.4 PPI网络的构建 共有92个节点,1 481条边,节点度数平均为32.2。AKT1(75)、TP53(69)、IL6(67)、VEGFA(66)、MAPK3(65)、MAPK1(63)为度值最高的前6位,这些节点可能是丹参-郁金治疗PCOS发挥作用的关键节点。见图3。
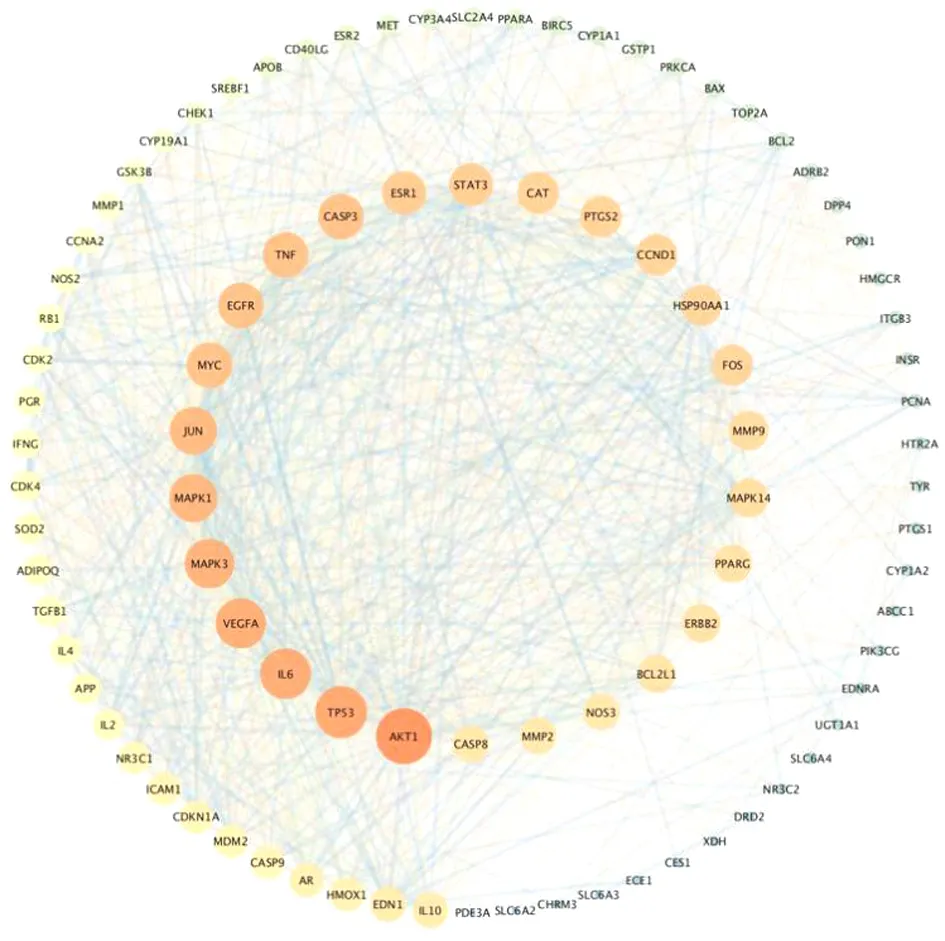
图3 92个共同靶点PPI网络
2.5 GO功能和KEGG通路富集分析 获得生物过程(Biological Process,BP)分析199个条目,细胞组分(Cellular Component,CC)分析26个条目,分子功能(Molecular Function,MF)分析43个条目,KEGG通路121个条目。在BP分析中,主要参与的功能过程有RNA聚合酶Ⅱ启动子转录的正调控、脂多糖介导的信号通路、DNA模版转录调控、一氧化氮生物合成过程的正调控、凋亡过程的调控、对γ辐射的反应等;在CC分析中,主要包含胞质、细胞核、细胞外间隙、质膜外侧、树突轴、膜筏、内质网膜、细胞质核周区、转录因子复合物、梭形小体10个条目;在MF分析中,主要参与的功能过程有蛋白质同源二聚活性、血红素结合、蛋白质异构化活性、类固醇结合、细胞因子活性、药物结合、跨膜受体蛋白酪氨酸激酶活性、相同蛋白结合、序列特异性DNA结合、RNA聚合酶Ⅱ转录因子活性,配体激活序列特异性DNA结合等。见图4。前10个条目见图5。经分析,富集通路主要是信号转导相关通路(HIF-1信号通路、FoxO信号通路、PI3K-AKT信号通路、T细胞受体信号通路等)、疾病通路(癌症信号通路、乙型肝炎、子宫内膜癌等)等。大多数基因主要富集在癌症信号通路、肝炎信号通路、PI3K/AKT信号通路。
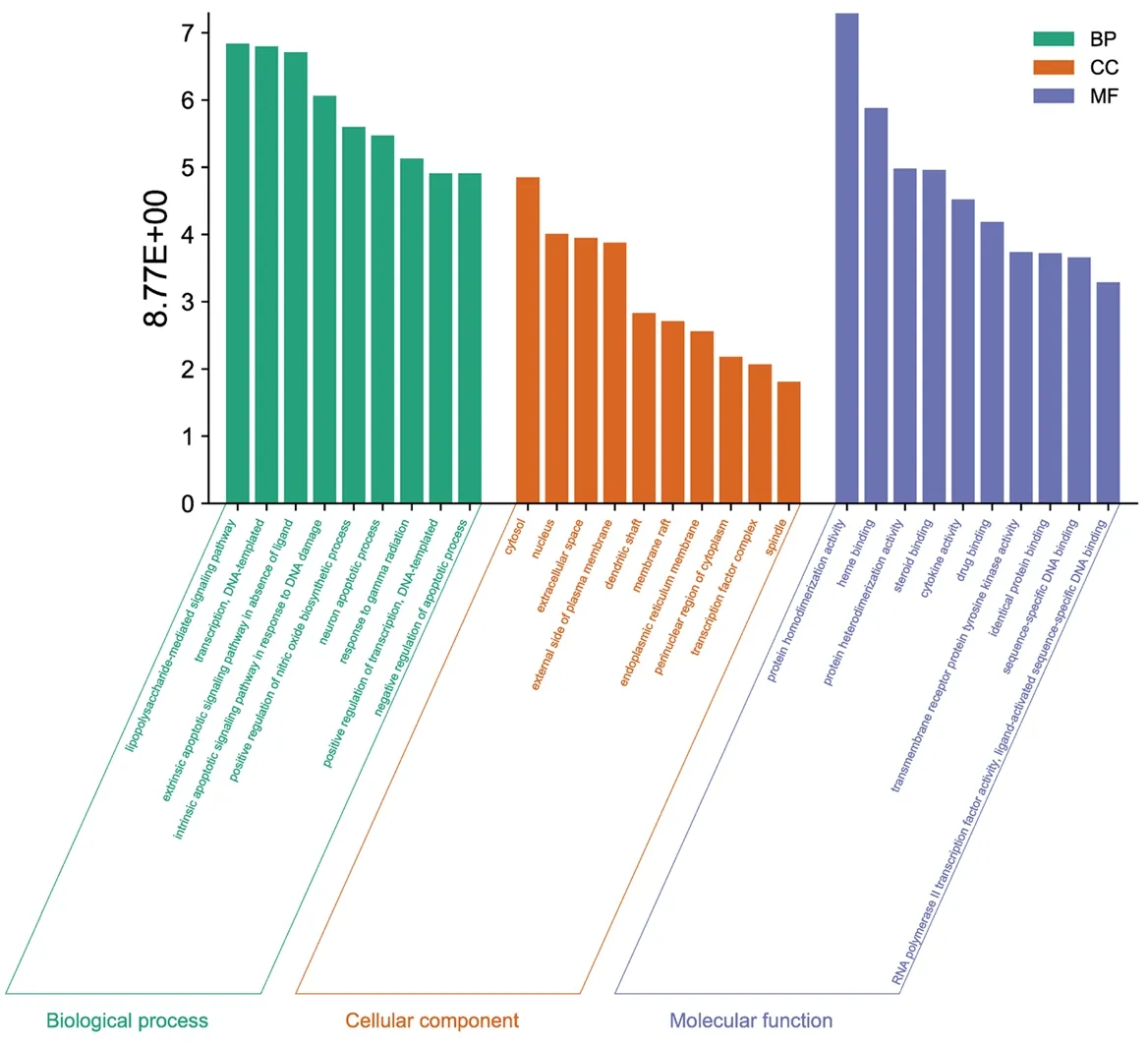
图4 GO功能富集分析各部分前10个条目

图5 KEGG通路富集分析前20个条目
2.6 分子对接 分子对接前,根据拓扑学分析筛选出丹参-郁金的19种核心成分,分别是木犀草素、丹参酮、柚皮素、β谷甾醇、4-亚甲基米松、二氢氰酸盐、异胰淀素、隐丹参酮、2-异丙基-8-甲基菲-3,4-二酮、丹参新醌、丹参新酮、表丹参螺缩酮内脂、异安息香酮Ⅱ、丹参螺内酯等。根据拓扑学分析,PPI网络中心度值(Degree)中位数2倍值为63、结构中心性(Betweenness Centrality)中位数为0.003 403 625、接近中心性(Closeness Centrality)中位数为0.596 727 725,满足上述参数值的靶点有AKT1(Degree=75)、TP53(Degree=69)、IL-6(Degree=67)、VEGFA(Degree=66)等6个靶点。见表2。

表2 核心靶点蛋白拓扑学参数信息
核心作用靶点与其亲和力最强的化合物的分子对接结果见表3。丹参-郁金核心作用靶点蛋白与其亲和力最强的化合物结合能均大于4.25 kcal/mol(1 cal=4.184 J)。
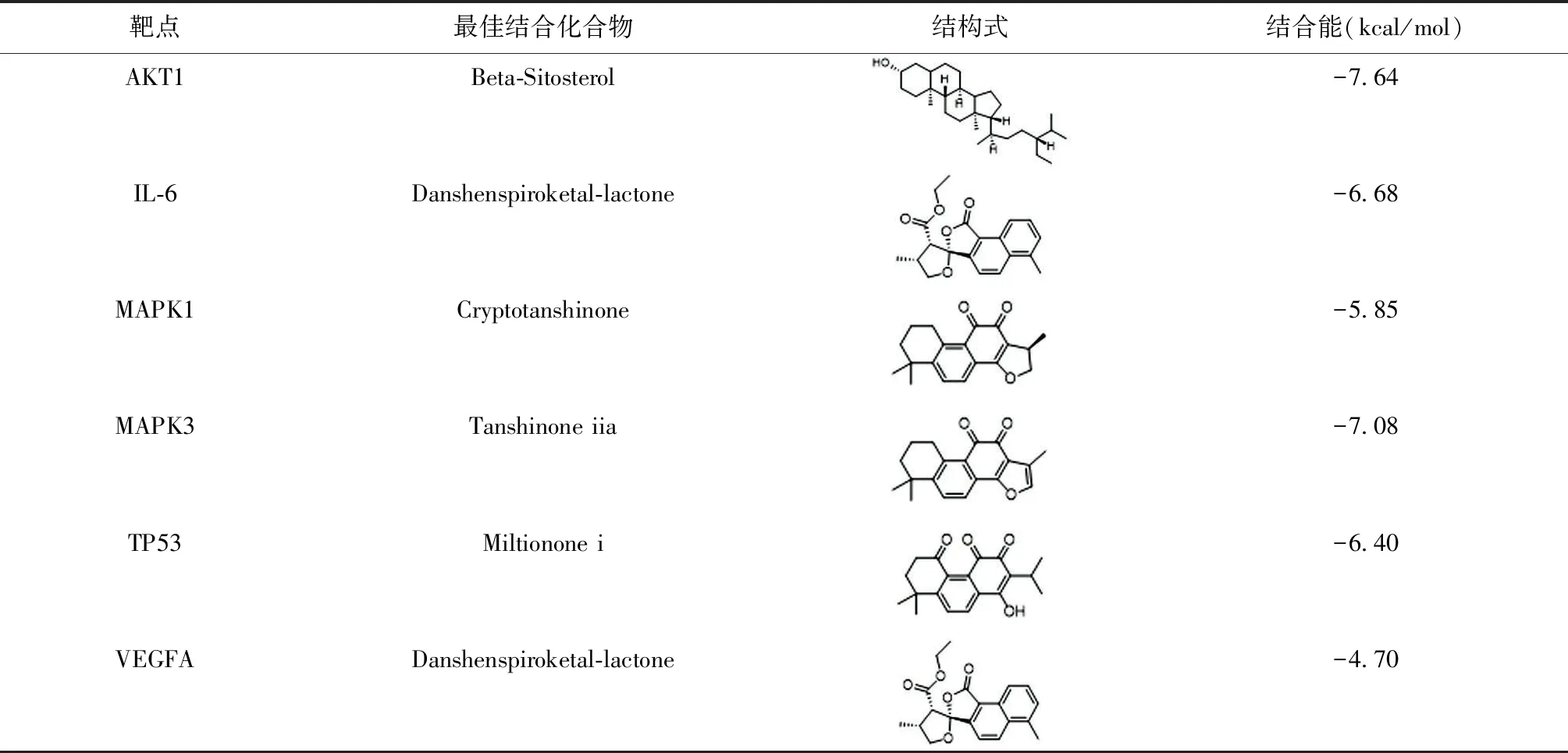
表3 丹参-郁金核心作用靶点蛋白与其亲和力最强的化合物的分子对接
通结合性最强的是丹参螺旋缩酮内酯与IL-6。二者结合能为-6.68 kcal/mol,潜在的结合位点包括PRO-115,SER-110,TYR-127,GLN-105等氨基酸残基。丹参螺旋缩酮内酯的羰基以及五元环上的氧均可以与氨基酸形成氢键,如羰基与TYR-127的酚羟基形成的氢键,距离为2.3 Å,五元环上的氧与SER-110形成氢键,距离均为2.7 Å。进一步分析发现,部分氨基酸与化合物可形成弱氢键,如五元环上的氧与TYR-127残基苯环上的质子形成弱氢键,氢键距离为2.2 Å,残基GLN-105的羰基与化合物苯环上面的质子形成弱氢键,氢键距离为2.4 Å。见图6。
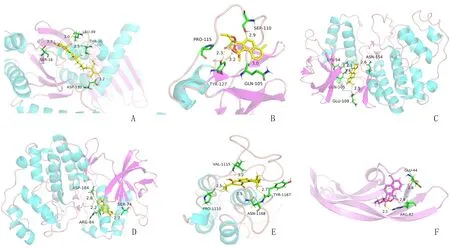
图6 核心作用靶蛋白与其亲和力最强的化合物的分子结合模式
3 讨论
3.1 核心成分 丹参-郁金药对中含有的核心化合物主要为二萜类化合物、黄酮类化合物、内酯类化合物、甾醇类化合物等。其中二萜类化合物以丹参酮类二萜为主,丹参酮Ⅰ及隐丹参酮对卵巢器官的生殖内分泌有调节作用[5],能够抑制人类肝脏中细胞色素P450酶系的活性[6],而PCOS患者常表现出P450芳香化酶功能异常;黄酮类化合物主要包括木犀草素及柚皮素,木犀草素可以通过抑制促炎性信号通路及依靠AMPK-SIRT1信号通路调节脂肪细胞对葡萄糖的利用改善胰岛素抵抗[7-8],柚皮素可显著提高PCOS大鼠体内活性氧清除酶过氧化氢酶、超氧化物歧化酶和谷胱甘肽过氧化物酶水平,并可防止体质量增加。柚皮素治疗PCOS大鼠能显著降低其血糖水平,使雌二醇和睾酮水平恢复正常,并维持卵巢的正常解剖结构[9]。
3.2 核心靶点及信号通路 通过构建PPI网络发现,AKT1、TP53、IL-6、VEGFA、MAPK3、MAPK1是丹参-郁金治疗PCOS的核心蛋白。IL-6基因编码一种细胞因子,在炎症反应和B细胞成熟过程中发挥作用。研究显示IL-6基因启动子区174G/C多态性、-124位启动子区碱基多态性与IR有关[10]。在PCOS患者中,PCOS合并IR者血清白细胞介素-6水平明显高于单纯PCOS患者[11]。以上发现均提示白细胞介素-6与PCOS及胰岛素抵抗发病机制密切相关。白细胞介素-6通路以抗炎/促炎为主要特征,由白细胞介素-6与白细胞介素-6R结合2个gp130分子启动,启动PI3K或MAPK信号通路[12]。隶属于丝/苏氨酸蛋白激酶家族的促分裂原活化的蛋白激酶(Mitogenactivated Protein Kinase,MAPK)3、MAPK1参与调控炎症反应、凋亡、生长因子等诸多生理活动,而MAPK通路对PI3K通路负反馈调节也会导致导致PCOS患者胰岛素抵抗的形成,从而加重PCOS患者病情[13]。
PI3K/AKT信号通路主要为被PI3K激活的AKT通过磷酸化作用于下游蛋白,调节细胞生长、增殖活动[14]。其磷酸化异常可能是造成PCOS患者胰岛素抵抗、高雄激素血症的重要原因。有研究显示,敲除AKT1基因的小鼠会出现高胰岛素血症[15];PI3K的P85α亚单位的met326多态性被认为可以调节PCOS患者血清17-OHP或游离睾酮的浓度[16]。除此之外,PCOS患者子宫内膜增生被认为与细胞增殖失调与凋亡减少有关,而雌激素介导的PI3K/AKT信号通路可能在调节组织稳态中起重要作用[17]。PCOS患者子宫内膜中观察到生存蛋白蛋白激酶B和Ras蛋白以及细胞周期调节因子P27和周期蛋白依赖激酶2的表达增加[18]。叉头框O(Forkhead Box O,FOXO)转录因子是PI3K/AKT信号通路的下游因子之一,PI3K/AKT/FOXO信号通路是调节细胞凋亡的重要途径。哺乳动物中的FOXO家族有4位成员:FOXO1、F0XO3a、F0XO4和F0XO6。F0XO3a是PI3K/AKT信号通路对生长因子等细胞内刺激信号反应的下游靶点,在卵泡颗粒细胞的增殖和分化中起到重要作用。有研究证实,在猪卵巢早期闭锁的卵泡颗粒细胞表面,F0XO3a蛋白呈强阳性表达,与细胞凋亡相一致,推测可能由于F0XO3a的过表达,导致了某些凋亡因子上调,最终导致卵泡闭锁[19]。
缺氧诱导因子(Hypoxia-inducible Factor,HIF-1)是缺氧条件下广泛存在于哺乳动物的一种转录因子,其α亚基决定了生理学功能。研究表明,血管内皮生长因子是HIF-1α主要的下游靶基因,一些研究评估了不同人群中PCOS患者的血管内皮生长因子基因多态性发现,血管内皮生长因子基因+405G/C多态性、-583T>C和-634G/C多态性都与PCOS发病及疾病进展密切相关[20-21]。HIF-1α被激活能够引起血管内皮生长因子转录、表达增强,促进血管生成[22]。卵巢内异常血管生成会改变卵巢血流,并进一步影响卵泡发育,而PCOS患者卵巢中存在血管生成异常[23],可能是造成稀发排卵的原因之一。血管内皮生长因子作为PCOS患者卵巢中最能描述血管生成改变的因子,其表达增强所致的异常血管生成很可能是由于HIF-1通路异常引起的。
由此可见,HIF-1信号通路、FoxO信号通路、PI3K/AKT信号通路等在PCOS的发病、发展中发挥重要作用,同时有证据证实丹参-郁金药对中有效成分可以通过以上通路干预病情进展、起到治疗作用。在PCOS小鼠模型的卵巢组织中发现,隐丹参酮可以调节受损的PI3K/AKT信号通路功能,从而达到改善糖代谢的作用[24]。有研究证实丹酚酸B对HIF-1α具有抑制作用,故丹酚酸B可能通过抑制HIF-1α以及血管内皮生长因子拮抗异常血管生成,从而减缓PCOS的病情发展[25]。
综上所述,丹参-郁金可通过“多成分-多靶点-多途径”治疗PCOS,从改善糖代谢、拮抗异常血管生成、调节生殖内分泌轴等方面发挥作用。后续可根据预测所得主要活性成分、作用靶点、信号通路进行实验验证,为中药治疗PCOS提供依据。

