富勒醇修饰氮掺杂二氧化钛复合材料及其光催化性能研究
陈一凡,唐国钦,赵春霞,陈业凯
(武汉理工大学材料科学与工程学院,武汉 430070)
0 引 言
TiO2具有制备工艺简单、价廉、无毒、高催化活性、高化学稳定性等一系列优点,已成为光催化研究领域的首选半导体材料[1-2]。然而TiO2带隙较宽,使其只能吸收不到太阳光5%的紫外光[3-4]。同时,它较高的电子空穴复合率也使其光催化性能受到极大限制[5-6]。因此如何拓展 TiO2光催化剂光响应范围至可见光区域,使其更高效地产生电子-空穴对,同时促进光生电子和空穴对有效分离,是改良TiO2光催化性能最核心的问题。
Sato等[7]首次发现在TiO2中引入N可使其产生可见光催化活性,引发了用非金属改性TiO2的研究热潮。非金属离子(如N、C)掺杂在提高TiO2可见光响应能力方面效果较好,掺杂离子通过形成杂质能级而减小TiO2的禁带宽度,有助于光生电子跃迁至活性位点[8],从而拓宽TiO2的光响应范围,但不能解决TiO2光生电子空穴对复合率高的问题。富勒烯(C60)自1985年被首次发现以来,就以其特殊的物理和化学性质[9-10],被广泛应用于光学材料、医用材料等领域的研究[11-12]。C60在室温下具有较高的电子迁移率,且几乎不受温度等条件的影响。因此利用C60优异的电子传递特性及稳定性,将其与二氧化钛复合,可以高效转移 TiO2中的光生电子[13]。然而,C60是非极性分子,难溶于水,仅能溶于非极性的有机溶剂,限制了其应用。
本文采用四丁基氢氧化铵(tetrabutylammonium hydroxide, TBAH)催化碱法制备多羟基富勒烯衍生物——富勒醇(PHF),在改善C60水溶性的同时保留了母体的π键共轭体系。在此基础上,以尿素为氮源,钛酸丁酯为钛的前驱体,采用溶胶凝胶法制备富勒醇修饰氮掺杂二氧化钛催化材料。采用X射线衍射(XRD)、拉曼光谱(Raman)、红外光谱(FT-IR)、X射线光电子能谱(XPS)和紫外-可见光漫反射吸收光谱(UV-Vis DRS)等技术方法对材料的结构及光吸收特性进行了表征,研究PHF修饰和N掺杂对TiO2可见光活性的影响。并将该复合催化剂用于室温CO2的光催化还原研究,探讨了PHF修饰与N掺杂对提高TiO2可见光催化还原CO2的影响。
1 实 验
1.1 试剂与仪器
1.1.1 试验试剂与药品
富勒烯(AR,≥99.0%,质量分数)、钛酸丁酯(AR)、间二甲苯(AR,≥99.0%,质量分数)、过氧化氢(AR,≥30.0%,质量分数)、四丁基氢氧化铵(AR,≥30.0%,质量分数)、甲醇(AR)、无水乙醇(AR)、冰醋酸(AR)、氢氧化钠(AR)、尿素(AR)。
1.1.2 试验仪器
PS-100A超声波清洗机、TG16WS高速离心机、HJ-6A数显恒温磁力搅拌器、DZF-6020真空干燥箱、DHG-9070A电热恒温鼓风干燥箱、GL124-1SCN分析天平、OTF-1200X双温区管式炉等。
1.2 富勒醇的制备
用电子天平称取80 mg的C60固体粉末,将其溶解在25 mL的间二甲苯溶液中,用超声清洗仪使其充分溶解,得到紫色透明溶液①。将溶液①置于磁力搅拌器上搅拌,并在搅拌条件下滴加2 mL氢氧化钠溶液(1 g/mL NaOH),2 mL四丁基氢氧化铵溶液(10%TBAH,质量分数)和4 mL双氧水(30%H2O2,质量分数),继续搅拌3 h,得到混合液②。
将上述混合液②进行分液,保留下层的棕褐色水相部分,并向其中加入适量甲醇,待析出棕黄色沉淀后,用离心机离心(8 000 r/min,5 min)除去水和甲醇。再加入适量的去离子水使棕黄色沉淀完全溶解,继续加入甲醇使沉淀再次析出,离心除去水和甲醇。重复3~4次直至未反应的NaOH和TBAH被完全洗净,此时用pH试纸测得离心后的甲醇溶液pH值小于8。最后将得到的棕褐色沉淀物置于60 ℃干燥箱中干燥12 h,得到固体PHF。
1.3 富勒醇修饰二氧化钛的制备
量取30 mL无水乙醇至烧杯中,逐滴加入10 mL钛酸丁酯,并在超声条件下处理10 min,得到透明溶液,记为溶液③;将10 mL无水乙醇、1 mL去离子水和1 mL冰醋酸依次加入到烧杯中,超声处理10 min,记为溶液④。在磁力搅拌条件下,将溶液④逐滴加入到溶液③中,强力搅拌30 min,记为溶液⑤。量取4 mL去离子水,在磁力搅拌条件下逐滴加入到溶液⑤中。滴加结束后,继续搅拌一段时间,得到白色溶胶⑥,避光静置12 h。
称取一定量上述制备的PHF,溶解于少量去离子水中。在强力搅拌条件下,向静置后的白色溶胶⑥中滴加PHF溶液,继续搅拌2 h至溶胶变为棕黄色,避光静置12 h,再在60 ℃水浴干燥6 h,变成棕黄色固体块状物。将其研磨成粉末状,将粉末置于管式炉中,氩气保护下5 ℃/min加热至400 ℃,保温3 h,得到棕灰色粉末状的富勒醇修饰二氧化钛,记为PHF-TiO2,测试其中C含量为2.0%(质量分数)。
1.4 氮掺杂二氧化钛的制备
配制溶液⑤方法同1.3节。量取一定量1 g/mL的尿素溶液,逐滴加入到溶液⑤中。滴加结束后,继续搅拌2 h,得到白色溶胶⑦,将其避光静置12 h。水浴干燥和热处理的方法及条件同1.3节。最终得到灰黑色粉末状的氮掺杂二氧化钛,记为N-TiO2,测试其中N含量为0.17%(质量分数)。
1.5 富勒醇修饰氮掺杂二氧化钛的制备
制备氮掺杂二氧化钛白色溶胶⑦方法同1.4节。向静置后的氮掺杂二氧化钛白色溶胶⑦中加入与1.3节制备过程中等量的PHF,随后处理方法和条件同1.3节。最终得到棕灰色粉末状的富勒醇修饰氮掺杂二氧化钛,记为PHF-N-TiO2,测试其中C含量为2.0%(质量分数),N含量为0.17%(质量分数)。
1.6 样品表征
采用MiniFlex 600 X射线衍射仪对催化剂进行晶型结构分析,测试条件为:扫描速率5 (°)/min,扫描范围5°~80°。采用法国Horiba Jobin Yvon生产的激光共聚焦显微拉曼光谱仪对样品进行拉曼光谱测试,测试条件为:激光波长为532 nm,波数范围为200~2 000 cm-1。采用美国Therno Nicolet公司生产的Nexus智能型傅里叶变换红外光谱仪对样品进行红外光谱定性分析,波数范围为4 000~400 cm-1。采用美国Thermo Fisher公司生产的ESCALAB 250Xi X射线光电子能谱仪对物质的元素种类和对应电子的结合能进行分析。采用美国 PerkinElmer公司生产的Lambda 750 S紫外可见近红外分光光度计测量样品在350~800 nm波长范围内的漫反射吸收光谱。
1.7 光催化剂性能测试
称量30 mg催化剂,置于可密封的玻璃反应器皿中,向其中注入1.2 mL去离子水,使催化剂均匀分散于玻璃反应器皿底部。将CO2通入反应器皿中,控制CO2流速,通入12 min,使瓶中杂质气体排净且充满CO2,将处理好的反应器皿静置于暗处2 h,使催化剂充分吸附CO2。将处理好的玻璃器皿密封,置于500 W的氙灯照射下,且用滤光片滤去氙灯波长小于420 nm的光段,每隔1 h用针管吸取反应器皿中100 μL气体,注射到气相色谱仪(GC-4000A型气相色谱仪,FID检测器)内分析CO和CH4等产物及其含量。
2 结果与讨论
2.1 物相分析
图1为所制备样品的XRD谱。分析可知,样品PHF在18.13°和31.17°处有两个衍射峰,是富勒醇的特征衍射峰[14]。商品TiO2粉末(P25)在25.4°、38.0°和48.1°等位置的衍射峰对应锐钛矿相TiO2的(101)、(004)和(200)等晶面(卡片编号为73-1764)。样品N-TiO2也在相应位置出现了清晰的衍射峰,说明N-TiO2主要为锐钛矿相TiO2。与之相比,PHF-TiO2和PHF-N-TiO2的衍射峰位置和强度没有显著改变,说明复合材料为锐钛矿相。此外,复合材料在31.17°处也观察到了微弱的衍射峰,说明PHF-TiO2和PHF-N-TiO2中存在PHF。

图1 PHF样品、P25和所制备催化剂样品的XRD谱及局部放大图Fig.1 XRD patterns of PHF, P25 and as-prepared catalysts
2.2 Raman分析
图2是制备样品的Raman谱。在395 cm-1、510 cm-1和634 cm-1处的拉曼峰归属于锐钛矿型TiO2的B1g、A1g+B2g和Eg模式[15]。插图中PHF在1 380 cm-1处和1 585 cm-1处有两个拉曼峰,分别对应碳的D-峰和G-峰[16]。PHF-TiO2和PHF-N-TiO2两个样品在相应位置也有拉曼峰,说明复合材料中PHF的存在。此外,复合材料中对应TiO2的Eg模式的拉曼峰出现展宽,分析认为是由于PHF复合抑制了TiO2晶粒的生长,晶粒尺寸变小,表面原子处于相对松弛状态,相应振动的散射信号频率范围加宽[17-18]。N-TiO2与PHF-N-TiO2均在327 cm-1处出现拉曼峰,其归属于非化学计量TiN的一级散射[19],说明N取代部分O进入晶格中。

图2 制备催化剂样品的Raman谱Fig.2 Raman spectra of as-prepared catalysts
2.3 FT-IR分析
所制备样品的FT-IR谱如图3所示。样品在1 630 cm-1附近都有吸收峰,对应颗粒表面的吸附水分子或羟基[20-21],400~800 cm-1的振动峰归属于TiO2的Ti—O—Ti键。与P25相比,本文所制备的N-TiO2和PHF-N-TiO2在1 410 cm-1处均出现新的吸收峰,对应颗粒表面含氮基团[22],结合本文氮源为尿素,分析认为是—NH2基团。图3(b)为PHF的FT-IR谱,在1 593 cm-1、1 378 cm-1和1 080 cm-1处表现出较强的特征吸收峰[23],分别对应碳碳双键、碳上羟基和碳氧单键。然而在PHF-TiO2和PHF-N-TiO2样品中这些吸收峰并不明显,仅在1 080 cm-1处有微弱吸收峰。分析认为,这是PHF在复合材料中分散较好,含量较低,且PHF本身偶极矩变化较小所致。

图3 P25、所制备催化剂样品和PHF样品的FT-IR谱Fig.3 FT-IR spectra of P25, as-prepared catalysts and PHF
2.4 XPS分析
对N-TiO2和PHF-N-TiO2进行XPS分析,并对N元素半谱(见图4)进行分峰处理和拟合。N-TiO2的N 1s谱中N有两种存在形式,在397.38 eV附近的特征峰对应β-N 1s,源于O—Ti—N键[24],证明掺杂N取代部分O进入TiO2晶格中的O位点;398.88 eV附近的特征峰对应γ-N 1s,源于含N基团,其可能渗入晶格间隙或吸附于材料表面[25-26]。而PHF-N-TiO2的N 1s谱中N有三种存在形式,β-N 1s出现两处吸收峰,分析认为可能由于PHF与部分O—Ti—N间存在化学键连接,从而改变部分β-N 1s的化学状态。

图4 N-TiO2和PHF-N-TiO2表面N 1s的XPS能谱Fig.4 XPS spectra of N 1s taken on the surface of N-TiO2 and PHF-N-TiO2
对样品中的O和Ti进行半谱扫描并拟合。商品P25的O 1s对应的结合能分别是528.67 eV和530.24 eV(见图5(a)),而N-TiO2和PHF-N-TiO2中O 1s对应结合能均向结合能低的方向移动。同时,商品P25的Ti 2p自旋分裂峰对应的结合能分别是457.49 eV和463.17 eV(见图5(b))。与之相比,N-TiO2和PHF-N-TiO2中Ti 2p对应结合能均向结合能低的方向移动。分析认为,N元素取代TiO2晶格中的O后形成了O—Ti—N键,使得局部原子电负性改变,进而改变了晶格中O的化学状态,也说明N成功掺入TiO2晶格内。

图5 商品P25、N-TiO2和PHF-N-TiO2表面O 1s和Ti 2p的XPS能谱Fig.5 XPS spectra of O 1s and Ti 2p taken on the surface of P25, N-TiO2 and PHF-N-TiO2
2.5 UV-Vis分析
图6(a)为所制备样品的UV-Vis漫反射吸收光谱。由图可知,P25在可见光区基本没有吸收,而本文所制备的PHF-TiO2有微弱的吸收。通过N掺杂后,对应样品在350~800 nm的光吸收能力有了明显提高,直观反映出通过PHF修饰或N掺杂均可以提高TiO2在可见光区的吸收,样品PHF-N-TiO2的可见光吸收最佳,说明二者协同可进一步改善可见光吸收性能。
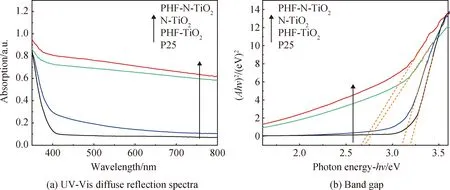
图6 P25和所制备催化剂样品的紫外可见光漫反射吸收光谱图及带隙宽度Fig.6 UV-Vis diffuse reflection spectra and the band gap of P25 and as-prepared catalysts
基于UV-Vis测试数据并利用Tauc plot法((Ahν)1/n=B(hν-Eg),其中A为吸光度,h为普朗克常数,ν为频率,B为材料相关物理量,Eg为半导体光学带隙,n=1/2)作图,将图中直线部分延伸至横坐标,可得出催化剂样品的光学带隙宽度,见图6(b)。分析可知,P25的带隙宽度约3.20 eV,与之相比,PHF-TiO2的带隙宽度约为3.08 eV,N-TiO2的带隙宽度约为2.70 eV。
分析认为,PHF本身具有一定的光吸收能力和优良的电子传输性能,这就使得在光照下TiO2产生的电子可以及时地通过PHF输运出去,抑制了电子空穴对复合,进而使得PHF-TiO2对光的吸收和利用能力提高。同时,N掺杂可以有效降低TiO2的带隙宽度,二者共同对TiO2改性,使得PHF-N-TiO2的带隙宽度最小,约为2.65 eV,进而提高了材料的可见光吸收性能。
3 光催化性能测试
将复合材料用于室温下可见光催化还原CO2试验研究,检测到还原产物是CO和少量的CH4,结果如图7和图8所示。其中,商品P25的CO平均生成速率为0.413 μmol·g-1·h-1,CH4平均生成速率为0.137 μmol·g-1·h-1,CO选择性只有75%。与之相比,PHF-TiO2的CO平均生成速率提升至3.345 μmol·g-1·h-1,是P25的8.1倍;CH4平均生成速率为0.253 μmol·g-1·h-1,是P25的1.8倍,CO选择性达92%,说明PHF修饰显著提升了催化剂的CO2还原转化能力和产物选择性。此外,N-TiO2的可见光催化还原CO2能力也比P25有明显提高。N-TiO2的CO平均生成速率为4.370 μmol·g-1·h-1,是P25的10.6倍;CH4平均生成速率为0.680 μmol·g-1·h-1,是P25的5.0倍,CO选择性达86%,说明N掺杂显著提升了催化剂的CO2还原转化能力,但在提升产物选择性上效果不如PHF。
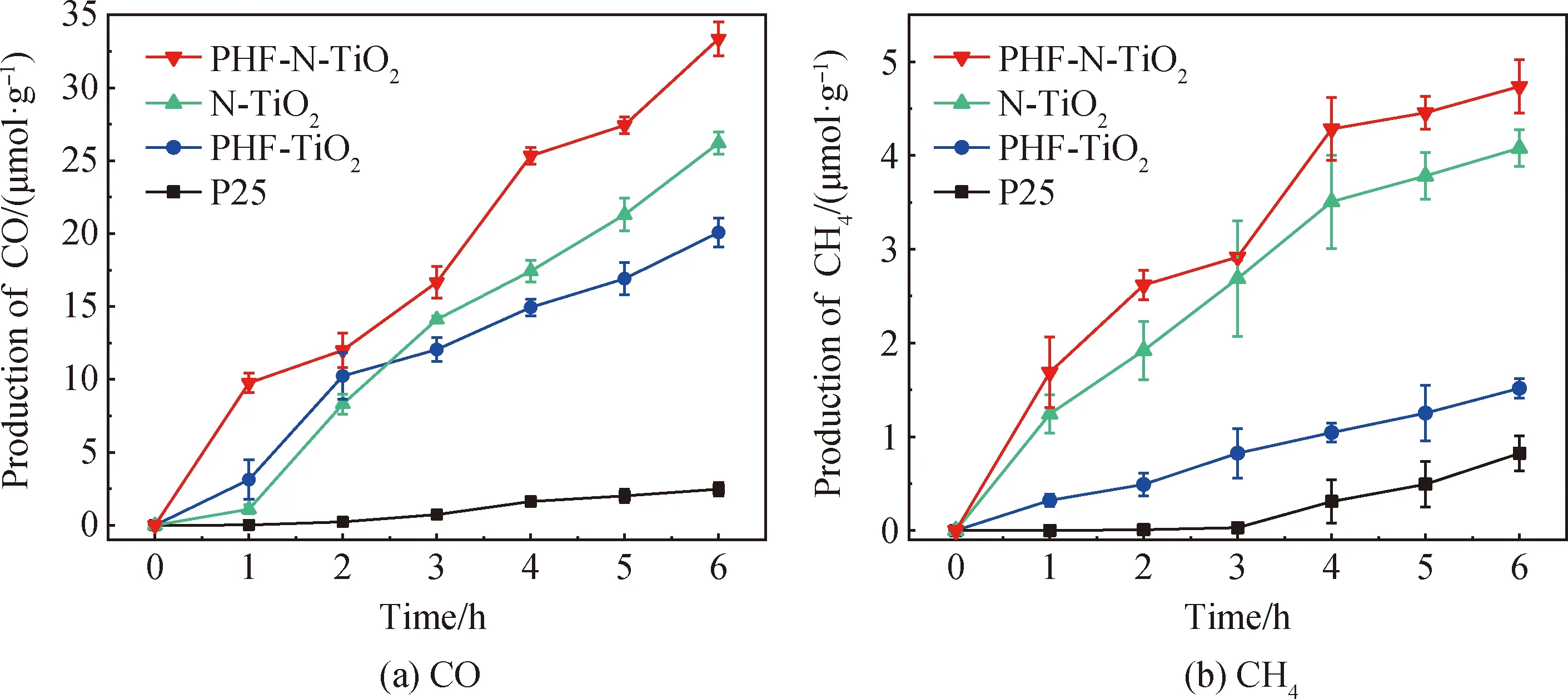
图7 P25和所制备催化剂可见光催化还原CO2的CO和CH4的生成量Fig.7 Production of CO and CH4 in photocatalytic reduction of CO2 by visible light with P25 and as-prepared catalysts

图8 P25和所制备催化剂可见光催化还原CO2的CO和CH4的生成速率Fig.8 Production rate of CO and CH4 in photocatalytic reduction of CO2 by visible light with P25 and as-prepared catalysts
采用PHF修饰N掺杂TiO2后,PHF-N-TiO2的CO平均生成速率进一步提升至5.560 μmol·g-1·h-1, CH4平均生成速率提升至0.789 μmol·g-1·h-1,明显高优于PHF-TiO2和N-TiO2,CO选择性达88%。结果表明,PHF修饰和N掺杂同时改性TiO2,可以进一步改善材料在可见光下的光催化性能。
此外,所有样品的CO产量均远高于CH4,这是由于CH4相较于CO的还原程度更高,反应所需的能量更多,同时反应路径更繁杂[27]。且在提高CH4产量方面,N掺杂效果明显优于PHF修饰。PHF修饰N掺杂TiO2复合材料的催化机理见图9。

图9 富勒醇修饰氮掺杂二氧化钛材料光催化基本原理Fig.9 Principles of photocatalysis of PHF-N-TiO2
在相同试验条件下,用Ar气替代CO2,没有检测到任何CO和CH4的生成,说明还原产物的碳源来自充入的CO2。
4 结 论
本文采用溶胶凝胶法成功制备了PHF修饰N掺杂TiO2复合光催化剂,对可见光的吸收显著高于P25,这是由于N取代部分O进入TiO2晶格中,引起TiO2禁带宽度的改变,改善了TiO2对可见光的响应;而富勒烯结构优异的电子传输特性和稳定性又进一步提高了TiO2在可见光下的催化活性。所制备的PHF-N-TiO2催化剂在室温下就可以实现可见光催化还原CO2,其中CO平均生成速率达5.560 μmol·g-1·h-1,CH4平均生成速率为0.789 μmol·g-1·h-1,是具有潜力的新型催化剂,对实现“双碳”目标具有科学意义和应用价值。

