水泥基材料氯离子结合机理及影响因素研究综述
耿圆洁,孙丛涛,孙 明,张余果,5,段继周
(1.内蒙古科技大学土木工程学院,包头 014010;2.青岛海洋科学与技术试点国家实验室海洋腐蚀与防护开放工作室,青岛 266237;3.中国科学院海洋研究所海洋环境腐蚀与生物污损重点实验室,青岛 266071;4.南通中科海洋科学与技术研究发展中心,南通 226004;5.青岛理工大学土木工程学院,青岛 266033)
0 引 言
氯离子引发的钢筋锈蚀易导致处于海洋环境和除冰盐环境下的钢筋混凝土结构破坏[1],严重影响钢筋混凝土结构的耐久性[2-4]。混凝土中的氯离子统分为两大类:一类是能够在孔隙中自由移动,对钢筋造成威胁的自由氯离子[5];一类是主要与铝相反应或直接被水化产物吸附(主要为水化硅酸钙(C-S-H)凝胶)的结合氯离子。混凝土的氯离子结合作用可以延缓自由氯离子到达钢筋表面时间,降低临界氯离子浓度,能有效延长混凝土结构中钢筋起始锈蚀时间[6-7]。因此,为更精准地预测钢筋混凝土结构的使用寿命[8-9],需考虑混凝土的氯离子结合能力[6,10]。
混凝土氯离子结合能力主要取决于混凝土中C-S-H凝胶和Friedel’s盐(3CaO·Al2O3·CaCl2·10H2O)的共同作用。C-S-H凝胶通过物理吸附作用结合氯离子,在吸附过程中存在吸附和解吸过程[11],而Friedel’s盐主要是氯离子与铝酸三钙(C3A)、铁铝酸四钙(C4AF)(化学作用)或水化硫铝酸钙(AFm)(离子置换)相互作用的产物。两者在混凝土内部的氯离子结合能力均与孔隙液pH值以及氯离子浓度相关[12],此外,C-S-H凝胶的氯离子结合能力还与自身Zeta电位息息相关[13]。尤其是处于氯盐、硫酸盐、碳化等单一或耦合作用下的混凝土结构,随着侵蚀进行,其内部pH值、离子浓度不断改变,微观结构也反复重构,易影响混凝土中C-S-H凝胶和Friedel’s盐的稳定性[14-16],促使混凝土内氯离子重新结合或释放,进而影响混凝土的氯离子结合能力。
本文基于水泥基材料,考虑了水泥种类、矿物掺合料种类、温度、氯离子浓度、阳离子类型、硫酸盐侵蚀和碳化等多种因素,对C-S-H凝胶和Friedel’s盐的氯离子结合机理、自身稳定性,以及在各因素作用下两者的氯离子结合能力等研究状况进行了综述与分析,并给出了氯离子结合能力的研究建议,可为混凝土中氯离子结合能力及氯离子传输规律研究提供参考。
1 C-S-H凝胶和Friedel’s盐的氯离子结合机理
1.1 C-S-H凝胶对氯离子的物理吸附
C-S-H凝胶是对氯离子起吸附作用(静电或范德华力[11])的水泥水化产物,约占硅酸盐水泥质量的75%[17],由水泥矿物成分硅酸三钙(C3S)、硅酸二钙(C2S)水化而成。人工合成的C-S-H凝胶具有像鱼鳞一样的片层状结构[18],而水泥中的C-S-H凝胶随着水化的进行存在由纤丝状向片状过渡的阶段[19]。C-S-H凝胶自身具有的凝胶孔和毛细孔能够为氯离子的传输和吸附提供场所[20],Hirao等[21]研究表明C-S-H凝胶对氯离子的吸附量大约为0.6 mmol/g。C-S-H凝胶通过两种方式吸附Cl-,如式(1)、式(2)所示[22]。由于SiOCa+吸附Cl-后呈电中性,SiOH吸附Cl-后呈电负性,因此相较于前者,后者稳定性较低,一般认为SiOCa+是Cl-的主要吸附位点[23]。被C-S-H凝胶吸附后的Cl-存在三种状态[24]:(1)吸附在C-S-H凝胶表面的化学吸附层;(2)进入C-S-H凝胶层间;(3)紧密结合在C-S-H凝胶晶格中。
≡SiOCa++Cl-←→≡SiOCaCl
(1)
≡SiOH+Cl-←→≡SiOHCl-
(2)
1.2 Friedel’s盐的形成
Friedel’s盐是Cl-化学结合的主要产物,由Cl-与C3A、C4AF或AFm相互作用得到,呈片状晶体结构[25]。Cl-与C3A、C4AF作用:Cl-以内掺方式进入混凝土,Cl-主要通过直接与铝相反应生成Friedel’s盐[26],如式(3)所示[27]。Cl-与AFm作用:Cl-以外渗方式进入混凝土,Cl-与AFm(SO2-4-AFm[28]、OH--AFm[29])发生离子置换反应生成Friedel’s盐,如式(4)、式(5)所示。Suryavanshi等[30]认为AFm也可以通过吸附机理形成Friedel’s盐,这是由于AFm主层结构[Ca2Al(OH-)6]+呈正电荷性,为保持电荷平衡会吸附Cl-、OH-、CO2-3和SO2-4等阴离子,当外界条件改变时,阴离子之间可以相互转换[31-33]。与AFm具有相似吸附机理的还有层状双金属氢氧化物水滑石,其化学通式为[M2+1-xM3+x(OH)2]x+(An-)x/n·yH2O,由于部分二价金属离子被三价金属离子取代,带正电的主层板结构也会吸附Cl-以保持电荷平衡[34]。
C3A+Ca2++2Cl-+10H2O3CaO·Al2O3·CaCl2·10H2O
(3)
SO2-4-AFm+2Cl-3CaO·Al2O3·CaCl2·10H2O+SO2-4+2H2O
(4)
OH--AFm+2Cl-3CaO·Al2O3·CaCl2·10H2O+2OH-+2H2O
(5)
2 氯离子结合及其稳定性影响因素
2.1 阳离子对氯离子结合及其稳定性的影响
研究[35-36]表明,阳离子对氯离子结合能力的影响排序为Ca2+>Mg2+>Na+≈K+。Arya等[37]研究混凝土氯离子结合能力影响因素时发现,CaCl2、MgCl2作用下混凝土的氯离子结合能力远大于NaCl作用下混凝土的氯离子结合能力。
Weerdt等[38]认为对氯离子结合起主要作用的是C-S-H凝胶。Hirao等[21]和Chu等[39]研究也表明C-S-H凝胶对氯离子结合的贡献至关重要,Chu等[39]对不同氯盐侵蚀的砂浆进行微商热重(DTG)测试(见图1)后发现,与NaCl和KCl侵蚀相比,MgCl2和CaCl2侵蚀后的砂浆具有更明显的C-S-H凝胶和钙矾石(AFt)分解吸热峰,而Friedel’s盐的分解吸热峰变化并不明显。这表明在上述四种阳离子中,Ca2+、Mg2+对氯离子结合影响显著,且主要体现在对C-S-H凝胶的影响上。这是由于CaCl2能促进C-S-H凝胶的形成,甚至会减弱碳化对氯离子结合的负面影响[40],而MgCl2在生成腐蚀产物水镁石(Mg(OH)2)和水化硅酸镁(M-S-H)[41-42]的同时也会促进水泥水化生成C-S-H凝胶。综上所述,CaCl2、MgCl2在一定程度上均会提高氯离子结合能力,且CaCl2提高效果更加明显[43]。
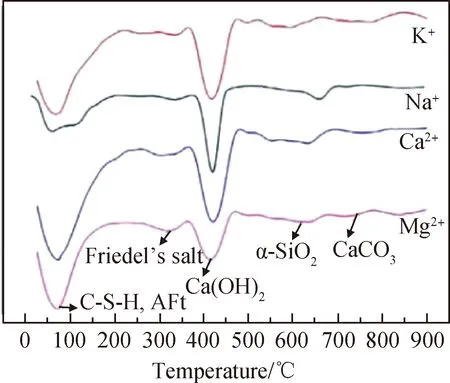
图1 不同阳离子侵蚀下水泥砂浆的DTG曲线[39]Fig.1 DTG curves of cement mortar erodedby different cation[39]
C-S-H凝胶的氯离子吸附能力主要取决于阳离子和双电层之间的Zeta电位。Zeta电位会随着C-S-H凝胶表面吸附离子种类和数量的变化而发生改变[44-45],从而影响C-S-H凝胶的氯离子结合能力[46]。Viallis等[47]利用核磁共振(NMR)研究了C-S-H凝胶的硅酸盐四面体对Na+的吸附能力,结果表明,在低Ca/Si摩尔比(C/S)条件下,Na+会补偿C-S-H凝胶表面的负电荷,使C-S-H凝胶表面趋于带正电荷,有利于其对氯离子的结合。Yoon等[48]的研究也表明,当C/S为0.66时,C-S-H凝胶与Na+相互作用,而当C/S为1.66时,C-S-H凝胶与Cl-相互作用。这是由带正电荷的Ca2+和带负电荷的硅酸盐四面体链在C-S-H凝胶层间的电荷不平衡所导致,不同C/S的C-S-H凝胶所带电荷不同,会影响其与阴离子或阳离子的相互作用。随着C/S增高,C-S-H凝胶中硅酸盐长链断裂为有缺陷的短链,可提供更多的非桥接氧位聚集水分子和钙离子[49]。钙离子被硅酸链中的氧原子吸附,促使C-S-H凝胶呈正电荷性,有利于氯离子的吸附[18]。因此,一定条件下高C/S的C-S-H凝胶更有利于其对氯离子的结合[46]。
Tang等[50]制备了不同Mg/Si摩尔比(M/S)的C-S-H凝胶,DTG结果如图2所示,随着Mg2+浓度的增加,C-S-H凝胶分解吸热峰降低,出现了较为明显的Mg(OH)2分解吸热峰。此外,当Mg2+浓度较高时,松软无黏结能力的M-S-H[51]较C-S-H凝胶更加稳定[52],如图3所示,随着Mg2+含量的增加,C-S-H凝胶峰强逐渐降低,而M-S-H峰逐渐显现。这表明,在一定条件下Mg2+会降低C-S-H凝胶含量,从而降低C-S-H凝胶对氯离子的吸附能力。

Note: M0.05, sample with Mg/Si molar ratio of 0.05.图2 Mg2+侵蚀下C-S-H凝胶的DTG曲线[50]Fig.2 DTG curves of C-S-H gel with Mg2+ attack[50]
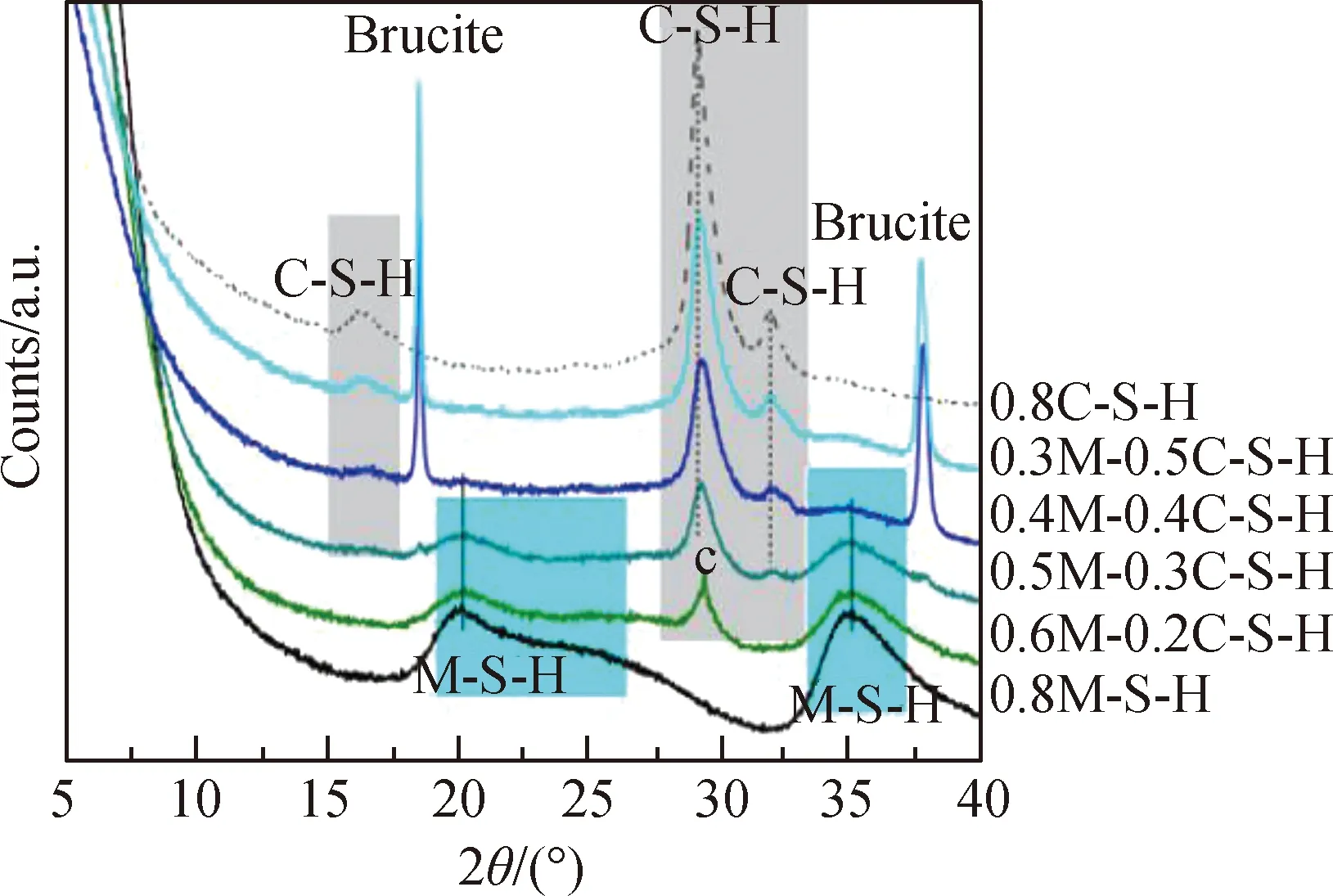
Note: 0.3M-0.5C-S-H, sample with Mg/Si molar ratio of0.3 and Ca/Si molar ratio of 0.5.图3 20 ℃反应1年后C(M)-S-H的XRD谱(摩尔比:(Mg+Ca)/Si为0.8)[52]Fig.3 XRD patterns of C(M)-S-H reacted for 1 a at 20 ℃(molar ratio: (Mg+Ca)/Si is 0.8)[52]
C-S-H凝胶的稳定性依赖于孔隙液pH值[53]。Na+、K+由于生成强碱性物质(NaOH、KOH),会提高孔隙液pH值;Ca2+、Mg2+则相反,Ca2+在一定程度上会抑制Ca(OH)2的电离[54],而Mg2+会消耗OH-生成Mg(OH)2,两者均会使孔隙液pH值降低,进而影响C-S-H凝胶的稳定性。Revertegat等[55]研究了pH值对C-S-H凝胶稳定性的影响,结果如图4所示,在pH值(pH=13)较高时,样品中C-S-H凝胶含量几乎没有变化,但随着pH值的降低以及反应时间的增加,C-S-H凝胶含量逐渐减少。实验进行36个月后,在pH值为11.5和4.6时,普通硅酸盐水泥中CaO含量(C-S-H凝胶和铝酸盐)分别降低了21%和53%,掺矿渣和粉煤灰的水泥中CaO含量分别降低了4%和56%。这一现象说明pH值对C-S-H凝胶的稳定性影响显著,低pH值环境中C-S-H凝胶不易稳定存在,且易发生钙的浸出[56]。
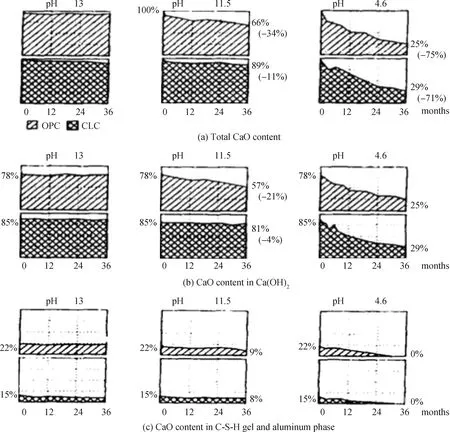
Note: OPC, ordinary Portland cemrnt; CLC, the mass ratio of mineral admixture is 50%,and that of blast furnace slag and fly ash is 1 ∶1.图4 水泥的CaO含量分布(质量比)[55]Fig.4 CaO content distribution of cement (mass ratio)[55]
与上述认为阳离子只显著影响C-S-H凝胶生成量及稳定性观点不同,Jiang等[40]认为CaCl2提高氯离子结合能力的原因为Friedel’s盐含量的增加以及C-S-H凝胶氯离子结合能力的增强。肖佳等[57]也认为阳离子不同会引起Friedel’s盐生成量的差异,且Friedel’s盐对氯离子的固化主要在水泥水化早期,而C-S-H凝胶对氯离子的固化集中在水化后期,且固化量较小,这一研究结果可能与阳离子改变孔隙液pH值有关。相关研究[58-59]表明,Friedel’s盐的稳定性具有pH值依赖性,在pH值降到11之前,几乎所有的氯离子都被释放。Glass等[60]研究也表明,当孔隙液pH值从12.5开始下降时,结合的氯离子便会被迅速释放,pH值为11.5时,氯离子结合率不到2%。这是因为当孔隙液pH值降低时,Friedel’s盐溶解式(如式(6)所示[26])向右移动,Friedel’s盐会分解释放出氯离子。此外,过高的pH值同样不利于氯离子的结合,当孔隙溶液中OH-浓度很高时,OH-会占据Friedel’s盐结构中氯离子的结合位点,生成OH--AFm,同样会使Friedel’s盐稳定性降低。
3CaO·Al2O3·CaCl2·10H2O4Ca2++2Cl-+4OH-+2Al(OH)-4+4H2O
(6)
上述学者的研究结果表明,阳离子尤其是Ca2+、Mg2+对氯离子结合能力影响显著,这是因为正二价离子相较于正一价离子对C-S-H凝胶表面电荷性影响更大,能显著改变C-S-H凝胶对氯离子的吸附能力。此外,阳离子对孔隙液pH值的改变也会影响Friedel’s盐和C-S-H凝胶的稳定性,从而改变混凝土的氯离子结合能力。
2.2 硫酸盐对氯离子结合及其稳定性的影响
硫酸盐环境下,SO2-4会与Ca(OH)2、C-S-H凝胶、SO2-4-AFm反应生成具有膨胀性的腐蚀产物[61]:钙矾石、石膏,反应过程见式(7)~式(9),SEM照片如图5所示。SO2-4对Ca(OH)2的消耗改变了孔隙液pH值,这将会影响Friedel’s盐和C-S-H凝胶的稳定性。此外,SO2-4与C-S-H凝胶反应导致的脱钙现象也将影响C-S-H凝胶对氯离子的吸附能力[62-63]。因此,硫酸盐与氯盐共存时,SO2-4将改变混凝土对Cl-的固化能力[55-64]。
C3A+3SO2-4+3Ca(OH)2+32H2O3CaO·Al2O3·3CaSO4·32H2O+6OH-
(7)
SO2-4-AFm+2SO2-4+2Ca(OH)23CaO·Al2O3·3CaSO4·32H2O+4OH-
(8)
SO2-4+Ca(OH)2+2H2OCaSO4·2H2O+2OH-
(9)

图5 硫酸盐侵蚀下钙矾石和石膏的SEM照片[65]Fig.5 SEM images of ettringite and gypsum under sulfate solution[65]
Geng等[66-67]的研究表明固化后的氯离子易受硫酸盐影响,即SO2-4会替代Friedel’s盐中的Cl-,使Friedel’s盐分解形成AFt。Xu等[68-69]将不同浓度的硫酸钠和硫酸钙分别引入水泥浆中发现,随着硫酸盐含量的增加,水泥对氯离子的结合能力迅速下降,且在硫酸盐含量相同时,引入硫酸钙的水泥浆相较于引入硫酸钠的水泥浆具有更高的氯离子结合能力,这可能与硫酸盐碱度有关。Luo等[70]也认为SO2-4和碱度均会影响氯离子的结合,并将其归因于SO2-4、OH-、Cl-之间的竞争。一般情况下,AFm的稳定性排序为SO2-4-AFm>Cl--AFm>OH--AFm[71],但当孔隙液中Cl-浓度达到一定值时,Cl-会置换出AFm中的其他阴离子并使AFm转化成Friedel’s盐。Jain等[13]采用人工合成的孔隙液与AFm,研究了不同pH值与Cl-浓度下Friedel’s盐的生成量。对比图6(a)、(b)可知,随着模拟孔隙液中Cl-浓度的增加,Friedel’s盐含量整体呈增加趋势,这表明当Cl-浓度足够高时,Cl-可以取代SO2-4-AFm和OH--AFm中的阴离子,使AFm相转换成Friedel’s盐,但Friedel’s盐含量的增加仍受pH值限制,如图6(b)所示,Cl-浓度在1 000~5 000 mmol/L范围内时,低pH值(pH=11.6)下Friedel’s盐含量更高。这是由于阴离子与AFm主层[Ca2Al(OH-)6]+通过电荷吸引相结合,两者之间的黏结力较弱,当孔隙液碱度较高时,OH-占据主导地位,会与其他阴离子(SO2-4、Cl-)进行离子交换[72]。
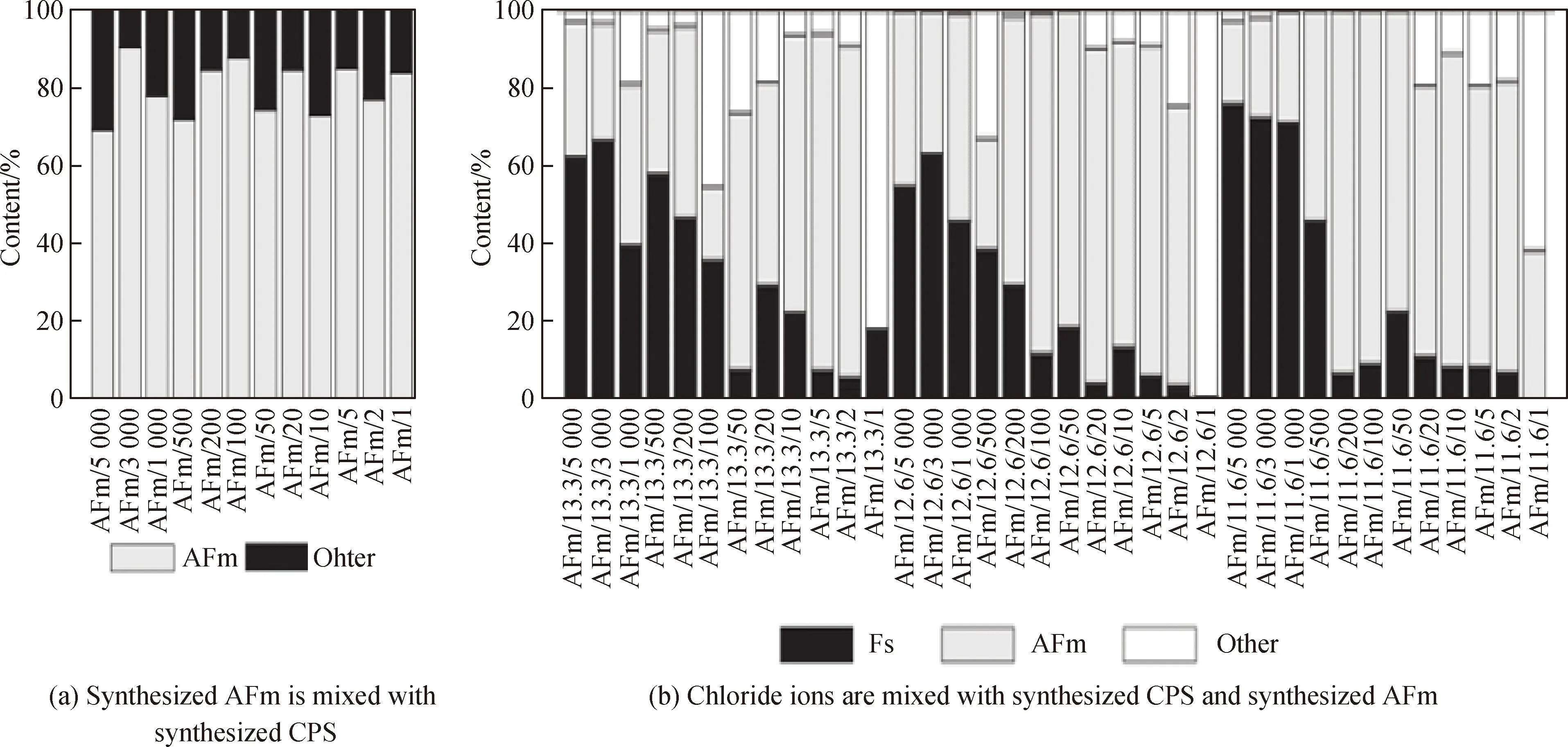
Note: AFm, synthesized using C3A, gypsum and water; Fs, Friedel’s salt; AFm/13.3/5 000, 13.3 is pH, 5 000 is theconcentration of Cl-(mmol/L); CPS (concrete pore solution), synthesized using NaOH, KOH, Ca(OH)2 and gypsum.图6 模拟液中各成分含量[13]Fig.6 Content of each component in simulated solution[13]
除使Friedel’s盐分解外,SO2-4也会改变C-S-H凝胶的C/S,甚至降低C-S-H凝胶含量。Gollop等[73]研究表明,在距硬化水泥浆体0.6 mm处,与SO2-4反应的Ca2+来自Ca(OH)2和C-S-H凝胶,且相较于遭受Na2SO4侵蚀的硬化水泥浆体,遭受MgSO4侵蚀的硬化水泥浆体中C-S-H凝胶的脱钙现象更加明显,这是由于Mg2+会加速C-S-H凝胶的分解,生成无黏结能力的M-S-H[74-75]。Liu等[76]通过XRD分析也得出,硫酸盐侵蚀下,C-S-H凝胶衍射峰强度减小甚至消失。对于C-S-H凝胶的脱钙,研究表明C-S-H凝胶夹层中的Ca2+比主层中的Ca2+更易被去除[77],这可能是由于C-S-H凝胶主层结晶度较高。此外,在不同pH值环境中SO2-4会影响C-S-H凝胶的层间距,改变其对氯离子的吸附能力。Liu等[77]通过XRD观察到了不同pH值下硫酸盐侵蚀前后C-S-H凝胶的层间距(d)变化,如图7所示,结果表明,硫酸盐侵蚀后C-S-H凝胶层间距减小,但随着pH值降低C-S-H凝胶层间距逐渐增加。Matsuyama等[78]和Bach等[79]认为C-S-H凝胶层间距的增加可归因于C-S-H凝胶桥氧四面体的增加和Na/Si的增加,两者均会导致C-S-H凝胶C/S降低,从而降低C-S-H凝胶对氯离子的吸附能力。
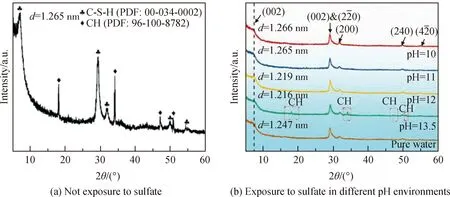
Note: CH, Ca(OH)2.图7 C-S-H凝胶的XRD谱[77]Fig.7 XRD patterns of C-S-H gel[77]
上述研究结果表明,SO2-4主要通过影响Friedel’s盐稳定性和C-S-H凝胶C/S改变氯离子结合能力,但Cl-和SO2-4之间存在相互影响,Cl-的存在对SO2-4也有一定的抑制作用[69]。混凝土中Cl-的传输速度优于SO2-4,能较早形成Friedel’s盐填充孔隙,抑制SO2-4进入混凝土[64]。此外,Cl-和SO2-4均会与C3A、Ca(OH)2反应,Cl-的结合能延缓膨胀性产物的生成。总体上,硫酸盐的侵蚀作用更强,两者共存时,SO2-4使固化Cl-分解占据主导地位。
2.3 碳化对氯离子结合及其稳定性的影响
碳化会降低混凝土的氯离子结合能力[80-81],这主要与水泥基材料中Ca(OH)2的消耗有关(如式(10)所示)。Ca(OH)2大量减少,孔隙液pH值降低,易导致Friedel’s盐和C-S-H凝胶稳定性降低。此外,CO2还会直接与Friedel’s盐(如式(11)所示)和C-S-H凝胶反应[82],进一步降低混凝土的氯离子结合能力。碳化作用下,固化氯离子重新被释放,将促使氯离子重分布[83-84],且CaCO3的生成也使混凝土内部微观结构改变[85],如图8所示,碳化和氯盐耦合作用下的裂缝相较于氯盐单一作用下减少。
Ca(OH)2+CO2CaCO3+H2O
(10)
3CaO·Al2O3·CaCl2·10H2O+3CO23CaCO3+Al2O3+Ca2++2Cl-+10H2O
(11)

图8 碳化前后混凝土的SEM照片[83]Fig.8 SEM images of concrete before and after carbonation[83]
龚傲龙等[86]以拌合水的形式向水泥浆中引入不同浓度氯离子后将其碳化,研究发现碳化后的水泥石中Friedel’s盐发生分解,这说明固化后的氯离子并不稳定,在碳化作用下易失稳释放。Chang[87]研究了三种不同碳化条件下氯离子结合能力的变化,结果均表明完全碳化后,氯离子结合能力完全丧失。Sun等[88]也认为结合态氯离子在严重碳化作用下几乎完全分解,如图9所示,碳化3 d后Friedel’s盐的衍射峰几乎消失,其研究也表明随着碳化程度的降低,碳化引起的分解现象随之减弱。Suryavanshi等[26]将经受数十次氯盐侵蚀-干燥循环作用后的混凝土结构板放置在实验室环境下进行暴露试验,暴露时间约为两年半,热重分析(DTA)结果表明,遭受碳化作用的混凝土表层Friedel’s盐分解吸热峰降低,如图10所示。碳化作用下Friedel’s盐含量的减少可归因于孔隙液pH值的降低以及CO2与AFm的直接反应,后者表现在CO2会消耗与Cl-发生置换反应的OH--AFm或CO2直接与Friedel’s盐反应,从而使Friedel’s盐生成量减少[14]。
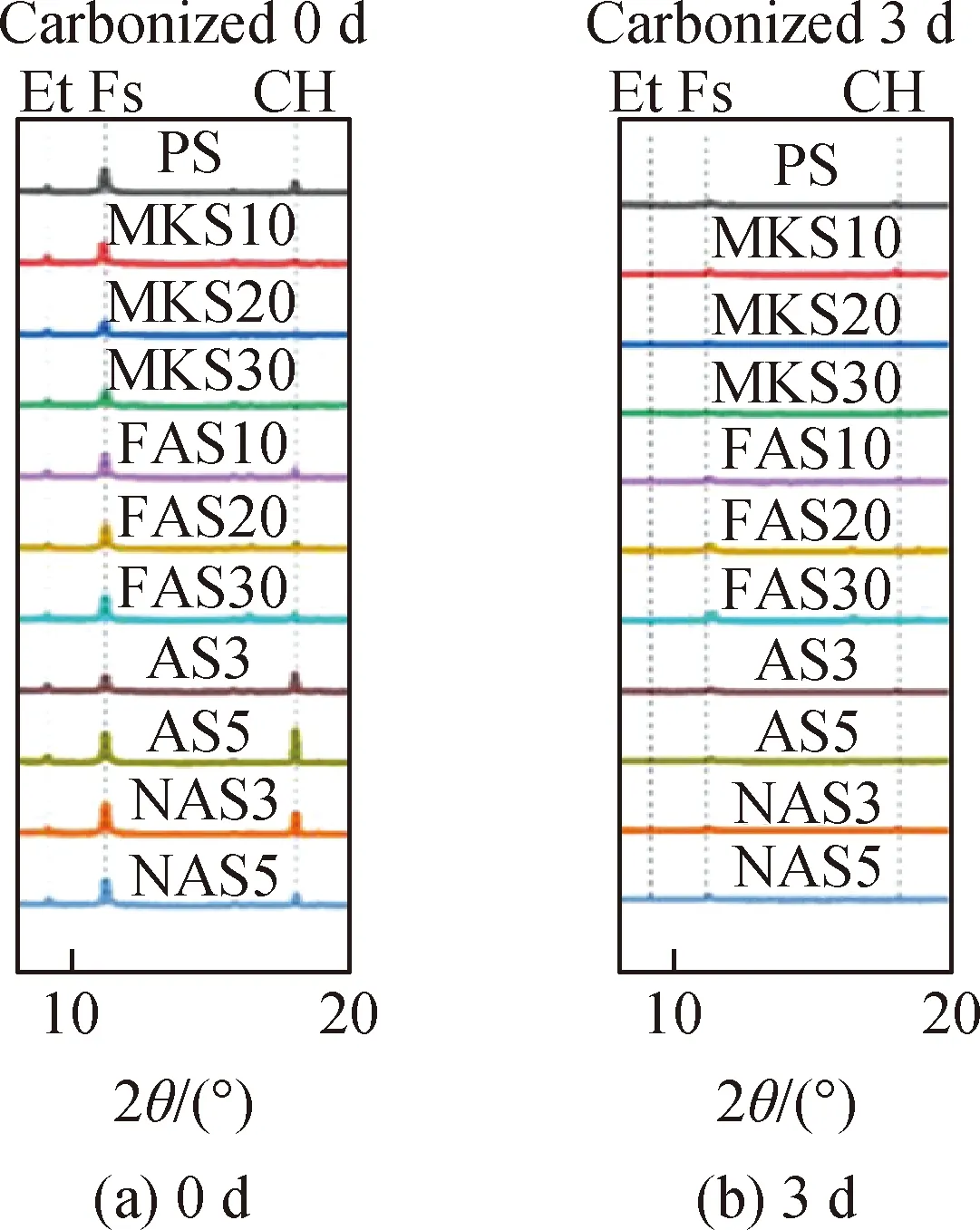
Note: Et, ettringite; Fs, Friedel’s salt; CH, Ca(OH)2;PS, ordinary Portland cement mortar; MK, metakaolin;FA, fly ash; A, aluminum; NA, nano-Al2O3;MKS10, MK accounts for 10% (mass ratio) of thecementitious materials in cement mortar.图9 不同碳化时间下砂浆的XRD谱[88]Fig.9 XRD patterns of mortars under differentcarbonation time[88]

Note: Et, ettringite; Fs, Friedel’s salt; CH, Ca(OH)2;QT: α-quartz.图10 自然暴露混凝土的DTA曲线[26]Fig.10 DTA curves of naturally exposed concrete[26]
氯离子结合能力的丧失除与Friedel’s盐分解释放氯离子相关外,还与C-S-H凝胶的分解密不可分[82]。Saillio等[33]将碳化作用下氯离子结合能力的降低归因于C-S-H凝胶表面的电荷改变,其研究表明,碳化过程中AFm的脱钙作用促使Al与C-S-H凝胶相互作用,这将改变C-S-H凝胶表面电荷,使其携带更多负电荷,降低C-S-H凝胶对氯离子的物理吸附能力。而Kobayashi等[89]将碳化作用下氯离子结合能力的降低归因于C-S-H凝胶含量的降低,其采用特定比例的三溴甲烷和乙醇将混凝土粉末中的C-S-H凝胶、SO2-4-AFm与CaCO3等其他沉淀物分离,结果表明,被分离在悬浮液中的C-S-H凝胶会被碳化,且C/S越小则表明C-S-H凝胶碳化越严重。Goni等[90]也认为Friedel’s盐的碳化并不能使自由氯离子显著增加,这说明氯离子被困在另一种固相里,但在文献中并未做出具体说明,这一固相极有可能是C-S-H凝胶。
综上所述,碳化一方面会影响孔隙液pH值,另一方面会消耗固化氯离子的Friedel’s盐和C-S-H凝胶,促使水泥基材料的氯离子结合能力降低,但碳化同硫酸盐侵蚀一样,其与氯离子的影响也存在相互作用。由于CaCO3与Friedel’s盐均会填充孔隙,CO2与氯离子在混凝土中的传输会相互牵制。
2.4 其他因素对氯离子结合及其稳定性的影响
水泥基材料的氯离子结合受多种因素影响,除阳离子种类、硫酸盐和碳化外,水泥种类、矿物掺合料种类、氯离子浓度和温度等也会改变水泥基材料的氯离子结合能力。
氯离子浓度对氯离子的结合特性影响显著。研究[6,29,91]表明,孔隙液氯离子浓度在0~20 kg/m3范围内时,孔隙液中的氯离子含量越多,结合氯离子含量也越多,见图11,其中α、β为常数,结合特点符合Langmuir或Freundlich等温线。当氯离子浓度很低时,结合氯离子以Kuzel’s盐(3CaO·Al2O3·0.5CaCl2·0.5CaSO4·10H2O)的形式存在[92],随着氯离子浓度不断增加,结合氯离子由Kuzel’s盐向Friedel’s盐转变[31,93]。
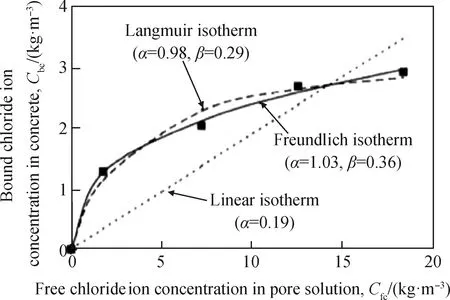
图11 Langmuir和Freundlich 等温线[6]Fig.11 Langmuir and Freundlich isotherms[6]
水泥品种不一样时,水泥中C3A、C4FA、C2S和C3S等组分的含量不同,其氯离子结合能力也存在差异[94]。耿健等[95]研究了三种不同水泥类型即普通硅酸盐水泥(OPC)、硫铝酸盐水泥(SAC)和高铝水泥(AC)对氯离子结合能力的影响,结果表明28 d时氯离子结合能力强弱依次为OPC(23.90%)>AC(19.97%)>SAC(7.95%)。刘俊龙等[94]的研究也表明,对于硅酸盐水泥、普通硅酸盐水泥和抗硫酸盐硅酸盐水泥而言,后两者的氯离子结合能力分别比前者高出10%和60%。上述氯离子结合能力的差异与水泥中有效铝酸盐含量以及硅酸盐含量有关,此外,水泥中硫酸盐的含量也是影响氯离子结合能力的一个不容忽视的因素[96],其与水泥基材料中氯离子结合能力的相关性也值得深入探究。
温度也会改变水泥基材料的氯离子结合能力。Panesar等[97]研究了不同温度下矿渣水泥的氯离子结合能力,结果表明,氯离子结合能力顺序为22 ℃>-3 ℃>13 ℃>5 ℃,即在0~22 ℃范围内随着温度的升高,氯离子结合能力增强。Ogirigbo等[98]也认同此观点,并认为即使在38 ℃时矿渣水泥的氯离子结合能力与温度仍成正比,但随着温度的升高,Friedel’s盐溶解度和吸附物振动能会增加,高温会降低氯离子结合能力。Guerrero等[99]的研究表明,当温度为40 ℃且有硫酸盐存在时,高温会加剧硫酸根离子与铝酸盐之间的反应,从而抑制Friedel’s盐的形成,降低氯离子结合能力。
为提高水泥基材料的氯离子结合能力,学者们考虑添加矿物掺合料。粉煤灰、矿渣、硅灰和偏高岭土能细化孔结构,改变水泥基材料中铝相含量,是目前应用较为广泛的矿物掺合料。随着粉煤灰掺量的增加,粉煤灰水泥的氯离子结合能力先上升后下降,其对氯离子结合能力的提高可归因于粉煤灰中较高的铝相,有利于生成更多的Friedel’s盐[100]。与粉煤灰类似,随着矿渣掺量的增加,矿渣水泥的氯离子结合能力也表现出先上升后下降的趋势。大量研究[37,101-103]表明,硅灰会降低水泥的氯离子结合能力,这可能与孔隙液pH值降低、C3A含量减少有关。虽然硅灰整体上对氯离子结合不利,但会增加水泥基材料中C-S-H凝胶含量[15],对物理吸附氯离子有积极效应。相较于上述三种矿物掺合料,偏高岭土由于具有更高的氧化铝含量,在提高氯离子结合能力方面效果更为显著(见图12)[104]。此外,新型矿物掺合料水滑石也能提高氯离子结合能力,如图13所示,当水滑石掺量为9%(质量分数)时,水滑石水泥结合氯离子含量相较于纯水泥明显提高,但其氯离子结合效果不如掺30%(质量分数)矿渣的水泥[105]。这是由于矿渣中的氧化铝能够增加水泥基材料中的铝相含量,有利于提高水泥基材料的化学结合能力[106],水滑石的加入主要提高水泥基材料的物理吸附能力,而水泥基材料的化学结合作用相较于物理吸附作用更强,因此矿渣相较于水滑石氯离子结合效果更加显著。翁智财等[91]研究表明,当总结合氯离子浓度达到5 mg/g时,化学结合氯离子浓度约是物理吸附氯离子的3倍,Hirao等[21]研究也表明AFm的氯离子结合能力是C-S-H凝胶的5倍,这说明提高水泥基材料对氯离子的化学结合能力是增强其氯离子结合能力更为有效的方法。
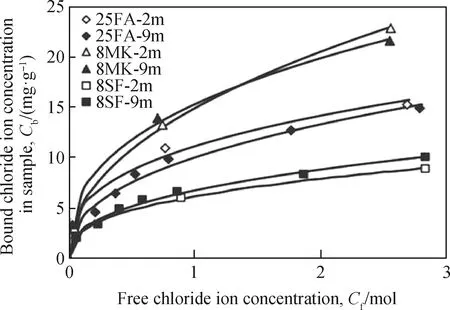
Note: SF, silica fume; MK, metakaolin; FA, fly ash;25FA-2m, fly ash content accounts for 25%of cement weight, curing age is 2 month.图12 含有不同矿物掺合料水泥的氯离子结合等温线[104]Fig.12 Chloride ion binding isotherms of cement withdifferent mineral admixtures[104]
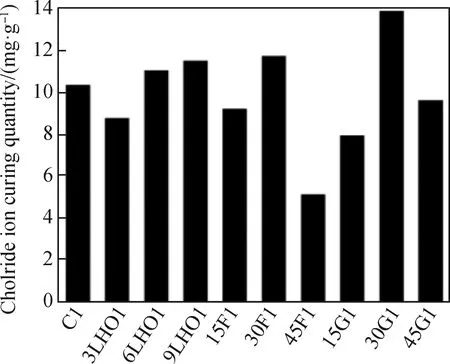
Note: C1, pure cement; LHO1, magnesium-aluminum carbonatedhydrotalcite; F1, fly ash; G1, slag; 45G1, the content ofslag accounts for 45% of cement weight.图13 含有不同矿物掺合料水泥的结合氯离子含量[105]Fig.13 Binding chloride ion content of cement withdifferent mineral admixtures[105]
3 结语与展望
(1)水泥基材料的氯离子结合能力主要取决于其物理吸附能力(以C-S-H凝胶为主)和化学结合能力(以Friedel’s盐为主)。水泥基材料的化学结合能力约为物理吸附能力的3~5倍,提高水泥基材料的化学结合能力对改善其氯离子结合能力更为显著。
(2)C-S-H凝胶和Friedel’s盐的稳定性均受孔隙液pH值影响。对于Friedel’s盐,在一定pH值范围内时其才会稳定存在;对于C-S-H凝胶,过低的pH值易使其脱钙,降低自身C/S,影响其氯离子结合能力。
(3)不同类型的阳离子会改变孔隙液pH值以及C-S-H凝胶的C/S。CaCl2侵蚀作用下C-S-H凝胶的C/S将会增加,而MgCl2侵蚀下,C-S-H凝胶的C/S不但会降低,其还会转变成无黏结能力的M-S-H。
(4)硫酸盐侵蚀或碳化作用下,两种相关阴离子均会消耗Ca(OH)2,使pH值降低,并与C-S-H凝胶反应使其脱钙。此外,当SO2-4或CO2-3达到一定浓度时,会置换Friedel’s盐中的Cl-,从而增加孔隙中自由氯离子含量。
(5)目前多采用热重法和X射线衍射方法分析Friedel’s盐和C-S-H凝胶的氯离子结合能力,但Friedel’s盐及C-S-H凝胶的含量及各自结合氯离子的量很难精确测定,更多定量分析的测试方法有待进一步研究。
(6)C-S-H凝胶对氯离子的物理吸附能力是由于其表面携带正电荷,正好与携带负电荷的阴离子(Cl-)相互吸引,而SO2-4、CO2-3同样也为阴离子,且均为负二价离子,相较于负一价离子更易吸附在C-S-H凝胶表面。目前这三种阴离子在C-S-H凝胶上的竞争力大小并未准确给出,且两种负二价离子使C-S-H凝胶脱钙的具体过程也并未深入研究。

