谈酸碱盐竞争性反应的“优先原则”
西安市新东方培训中心(710000)张邵文
我们在平日做题的过程中,会遇到很多经典的题目,如果在解题之后,能够对这些题目深入反思,就可以抽象出其中隐含的化学模型。当我们灵活运用所提炼的这些模型解决类似的化学问题时,便可以有效缩减思考的时间,大大提升解题的效率。本文对酸碱盐的竞争性反应问题进行深入剖析,提炼出其内在规律,进而提高解题的效率。
一、酸碱盐竞争反应中的“碱先反应”探索

图1
在碱溶液和盐溶液的混合溶液中不断加入酸溶液,相关反应问题属于酸碱盐竞争反应中常见的一种类型,谁与酸溶液先反应则是解决此类问题的关键。
【例1】向NaOH 和Na2CO3的混合溶液中不断加入稀盐酸,图1 横坐标表示加入的稀盐酸质量,纵坐标表示产生的气体质量。下列分析中不正确的是( )。
A.滴至a 克时,溶液中的反应为HCl+NaOH=NaCl+H2O
B.滴至b克时,溶液中含有HCl、NaCl两种溶质
C.滴至c 克时,溶液中溶质质量比原混合溶液中溶质质量大
D.滴至d克时,溶液的pH<7
解析:向NaOH 和Na2CO3的混合溶液中不断加入稀盐酸,盐酸先和NaOH 反应,当NaOH 反应完全后,盐酸和Na2CO3反应产生CO2气体,故Oa 段发生的化学反应为HCl+NaOH=NaCl+H2O,ac段发生的化学反应为2HCl+Na2CO3=2NaCl+H2O+CO2↑。因此,a点时溶液中的溶质为NaCl和Na2CO3,b点时溶液中的溶质为NaCl 和Na2CO3,c 点时溶液中的溶质为NaCl,d 点时溶液中的溶质为NaCl 和HCl,故答案为B选项。
反思:盐酸之所以先与NaOH 反应,是因为盐酸与Na2CO3反应产生的CO2气体会与原溶液中的NaOH 反应生成Na2CO3,导致反应相当于没有发生。故此类酸碱盐竞争性反应问题可简单地判断为“碱先反应”。
【变式1】将一定量的氢氧化钙溶液与碳酸钠溶液混合,充分反应后过滤,向滤液中滴加稀盐酸,产生气体的体积与加入稀盐酸的体积关系如图2所示。下列说法不正确的是( )。
A.O点溶液中溶质的成分为碳酸钠、氢氧化钠
B.M点表示碳酸钠和稀盐酸恰好完全反应
C.M 点和N 点对应溶液蒸发结晶后得到的固体成分不同
D.OP 段发生的化学反应为NaOH+HCl=NaCl+H2O
解析:将Ca(OH)2与Na2CO3溶液混合,发生的化学反应是Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,根据图像显示,OP 段是HCl与NaOH 的反应,PM 段是HCl和Na2CO3的反应,由此表明加入的Na2CO3过量。因此O 点时溶液中的溶质为NaOH、Na2CO3,P点时溶液中的溶质为NaCl、Na2CO3,M 点时溶液中的溶质为NaCl,N 点时溶液中的溶质为NaCl、HCl,故答案为C选项。
反思:本题看似是在考查Ca(OH)2与Na2CO3的相关反应,但通过分析不难发现,核心问题仍是“在NaOH 和Na2CO3的混合溶液中加入稀盐酸”的相关问题,实则还是NaOH、Na2CO3与HCl的竞争性反应问题,属于“碱先反应”的变式图像问题。
【变式2】化学兴趣小组的同学利用下列实验探究碱的相关化学性质,做了如图3 甲所示的两个实验。某同学发现B 烧杯中出现白色浑浊,过滤后在滤液中倒入A 烧杯中的溶液,结果混合溶液显红色。请你分析并完成下列问题。

图2

图3
(1)判断A 烧杯恰好完全反应的现象是_________________________;
(2)B烧杯中的白色浑浊物是______________;
(3)混合后的溶液呈碱性,可能存在的碱性物质有_______________。
[做出猜想]猜想一:可能是NaOH;
猜想二:可能是NaOH、Ca(OH)2;
猜想三:可能是NaOH和Na2CO3;
猜想四:可能是Ca(OH)2和Na2CO3。
同学们经过讨论一致认为猜想四是错误的,理由是_______________。
[实验验证]同学们对可能含有的碱性物质进行验证:取一定量的混合溶液,向其中逐滴加入稀盐酸,根据反应现象得到如图3乙所示的图像。
[结论]依据图像分析,得出猜想____________正确。
解析:在滴有酚酞的NaOH 溶液中加入盐酸,恰好反应时的现象是溶液由红色变为无色;在澄清石灰水中加入碳酸钠,发生的化学反应是Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,故会产生白色沉淀。混合后的溶液呈碱性,而生成物NaOH、反应物Ca(OH)2与Na2CO3呈碱性,故猜想一、二、三均有可能,但猜想四不可能,原因是二者会发生反应不能共存。乙图像说明溶液中一定含有能与HCl 反应产生气体的物质,这便只有猜想三中的Na2CO3符合要求,而起初没有气体产生,原因则是HCl 先与NaOH 发生反应,当NaOH消耗完后,HCl才与Na2CO3发生反应;同时也说明实验B 中的Na2CO3过量。
反思:本题看似考查HCl与NaOH反应、Ca(OH)2与Na2CO3反应后相互混合倒入的实验探究问题,但借助图像分析不难发现,核心问题再一次转化为“在NaOH 和Na2CO3的混合溶液中加入稀盐酸”的相关问题,实则还是NaOH、Na2CO3与HCl的竞争性反应问题,属于“碱先反应”的变式实验问题。
归纳与总结:当在碱溶液和盐溶液中逐渐加入酸溶液时,如何判断反应的“谁先谁后”?具体依据是:若不生成难溶于酸的沉淀(BaSO4、AgCl),有碱参与的反应优先发生。其原因是碱溶液中不可能存在酸性气体,如CO2、HCl等。
二、酸碱盐竞争反应中的“酸先反应”探索
在酸溶液和盐溶液的混合溶液中不断加入碱溶液,相关反应问题也属于酸碱盐竞争反应中常见的一种类型,谁与碱溶液先反应则是解决此类问题的关键。
【例2】向盐酸和MgCl2的混合溶液中不断加入的NaOH 溶液,图4 横坐标表示加入的NaOH 溶液的质量,纵坐标表示反应的其他相关量,其中正确的是( )。
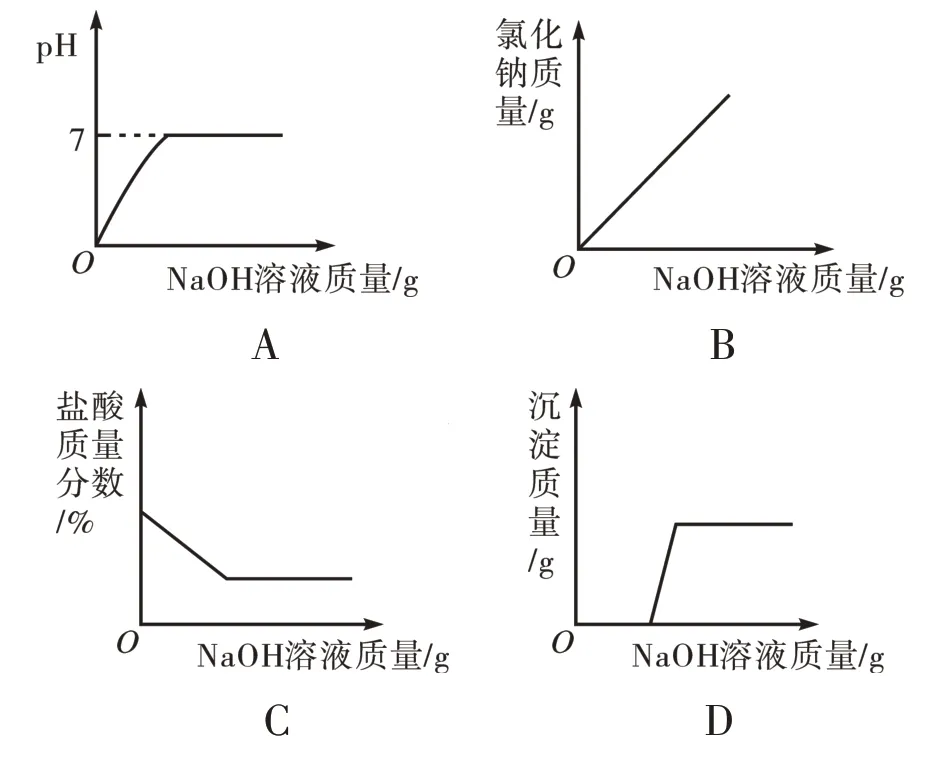
图4
解析:向盐酸和MgCl2的混合溶液中不断加入NaOH 溶液,反应分为三个过程:(1)NaOH 先和盐酸反应,直至将盐酸消耗完全,此时溶液中的溶质为NaCl、MgCl2;(2)继续加入NaOH溶液,再与MgCl2反应产生Mg(OH)2沉淀,直至将MgCl2消耗完全,此时溶液中的溶质为NaCl;(3)继续加入NaOH 溶液,此时溶液中的溶质为NaCl、NaOH。故答案为D选项。
反思:NaOH 之所以与盐酸先反应,是因为NaOH 与MgCl2反应产生的Mg(OH)2沉淀会与原溶液中的HCl 反应生成MgCl2,使得反应相当于没有发生。故此类酸碱盐竞争性反应问题可简单地判断为“酸先反应”。这与前述的“在NaOH 和Na2CO3的混合溶液中加入盐酸”的情况同属一脉,即酸碱中和反应优先,二者原理分析的实质是相同的。
【例3】向一定量盐酸和CaCl2的混合溶液中,逐滴加入一定质量分数的Na2CO3溶液,直至过量。生成沉淀质量与滴入Na2CO3溶液质量的变化关系如图5所示,下列说法正确的是( )。
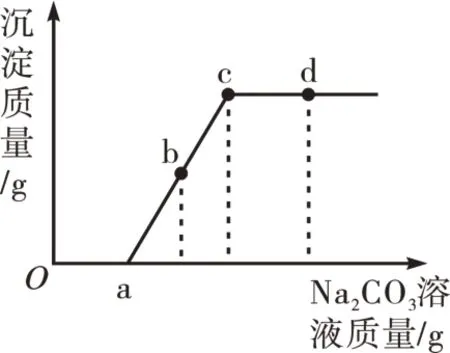
图5
A.滴至a 点时,溶液中的反应为CaCl2+Na2CO3=2NaCl+CaCO3↓
B.滴至b点时,溶液中含有HCl、NaCl两种溶质
C.滴至c 点时,溶液中的溶质质量比原混合溶液中的溶质质量大
D.滴至d点时,溶液呈中性
解析:Oa段发生的化学反应为2HCl+Na2CO3=2NaCl+H2O+CO2↑,ac 段发生的化学反应为CaCl2+Na2CO3=2NaCl+CaCO3↓。因此,a点时溶液中的溶质为NaCl 和CaCl2,b 点时溶液中的溶质为NaCl 和CaCl2,c点时溶液中的溶质为NaCl,d点时溶液中的溶质为NaCl和Na2CO3,故答案为C选项。
反思:Na2CO3之所以先与盐酸反应,是因为Na2CO3与CaCl2反应产生的CaCO3沉淀会与原溶液中的HCl 反应生成CaCl2,使得反应相当于没有发生。故遇到此类酸碱盐竞争性反应问题,可认为“有酸参与的反应优先”。此例较上述“酸先反应”类型,延伸与扩大了酸碱盐竞争反应的覆盖面。
归纳与总结:当在酸溶液和盐溶液中逐渐加入碱溶液或碱性盐溶液时,如何判断反应的“谁先谁后”具体依据是:若不生成难溶于酸的沉淀(BaSO4、AgCl),有酸参与的反应优先发生。其原因是酸溶液中不可能存在难溶性碱,如Mg(OH)2、Cu(OH)2等;也不可能存在难溶性碳酸盐,如CaCO3、BaCO3等。
三、酸碱盐竞争反应中的“同时反应”探索
在酸碱盐竞争反应中,除上述两种常见的类型外,还存在较少出现的“同时反应”类型。
【例4】向盐酸、CuSO4混合溶液中加Ba(OH)2溶液,产生沉淀的质量与滴加的Ba(OH)2溶液质量的关系如图6 所示。请回答下列问题:
(1)分析A、B、C 各点沉淀中的成分;
(2)分析A、B、C各点溶液中溶质的成分。

图6
解析:在盐酸和CuSO4溶液中加Ba(OH)2溶液,存在如下化学反应:2HCl+Ba(OH)2=BaCl2+2H2O,CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓,且二者同时发生(原因是BaSO4沉淀难溶于酸)。AB段沉淀的质量不变,BC 段沉淀的质量增长,说明OA 段、AB 段溶液中的盐酸是过量的。因此,OA 段发生的反应除了上述反应,还有2HCl+Cu(OH)2=CuCl2+2H2O,AB 段发生的反应是2HCl+Ba(OH)2=BaCl2+2H2O,BC 段发生的反应是CuCl2+Ba(OH)2=Cu(OH)2↓+BaCl2。A 点溶液中的溶质有BaCl(2生成的)、CuCl(2生成的)、HCl(剩余的),沉淀只有BaSO4;B 点溶液中的溶质有BaCl2、CuCl2,沉淀只有BaSO4;C点溶液中的溶质有BaCl2,沉淀有Cu(OH)2、BaSO4。
反思:本题看似在考查HCl、CuSO4与Ba(OH)2的相关反应,但通过分析不难发现,核心问题由两部分组成,一部分是OA 段“HCl 和CuSO4的混合溶液中加入Ba(OH)2”的问题,实则是HCl、CuSO4与Ba(OH)2的竞争性反应问题;另一部分是AB 段“BaCl2、HCl、CuCl2与Ba(OH)2的混合溶液中加入Ba(OH)2”的问题,实则是HCl、CuCl2与Ba(OH)2的竞争性反应问题。此例较上述“酸先反应”类型,再一次延伸与扩大了酸碱盐竞争反应的覆盖面,使得酸碱盐竞争反应的优先问题得到全面的覆盖。
归纳与总结:根据上述三大类型的酸碱盐竞争性反应来看,酸碱盐竞争性反应不能简单地理解为“中和反应优先发生”,原因在于部分反应并没有中和反应出现;同时也不能认为“有酸参与的反应就一定优先发生”,原因在于部分反应没有出现难溶于酸的沉淀(此类沉淀可以与原溶液中的酸共存)。因此,酸碱盐竞争性反应中“优先发生反应”的关键取决于是否会出现难溶于酸的沉淀,若没有此类沉淀出现,则“有酸参与的反应优先发生”;若有此类沉淀出现,则反应没有先后,而是同时发生。
综上所述,酸碱盐竞争性反应问题的考查是多元化的,有时还结合图像和实验的相关内容进行,将化学反应原理、实验现象、物质检验等考点综合于一体。学生应结合题目给出的信息,运用提炼的反应规律,展开有效的解题分析,以有效掌握相关的解题技巧。

