固脾消积饮诱导人肝癌Hep G2细胞凋亡的分子机制*
柳 卓,田雪飞,郜文辉,谭小宁,翦慧颖,李可心,张 振,曾普华1,△
(1.湖南省中医研究院,长沙 412000;2.湖南中医药大学,长沙 412006;3.湖南省中医药研究院附属医院,长沙 412000)
肝癌是我国常见恶性肿瘤之一,发病率占所有恶性肿瘤的第6位,死亡率占恶性肿瘤第4位[1]。其高致死率对我国人民健康造成极大的威胁。目前肝癌的治疗主要以手术和放化疗为主,具有生物复杂性和治疗手段的局限性,同时还面临费用高,起效慢,易复发毒副作用大等特点。因此,肝癌治疗亟待安全、经济、有效的药物。
能量代谢正成为当前肿瘤研究热点,细胞能量代谢重编程(有氧糖酵解、线粒体能量代谢异常)是肿瘤细胞代谢的重要特征,其产生的能量主要用于肿瘤的快速扩增与迁移[2]。线粒体是机体能量代谢的细胞器,是肿瘤细胞快速增殖的重要介质。基于肿瘤细胞能量代谢为靶点,抑制肿瘤细胞增殖,有望成为恶性肿瘤临床治疗的新靶点。“固脾消积饮”原名益气化瘀解毒方是我院国医大师潘敏求教授团队治疗肝癌的经验方,以四君子汤为基础方加减,由白参、白术、半枝莲、莪术、茯苓、黄芪、石见穿组成。具有益气化瘀、散结解毒之功效。前期研究表明该方具有带瘤生存,改善患者生存状况的疗效[3]。动物研究表明其具有抑制移植瘤生长,诱导肝癌细胞自噬和凋亡的作用[4],但其凋亡作用的机制尚未明确。
本实验体外培养HepG2研究固脾消积饮含药血清对肝癌细胞凋亡的作用机制,为其临床疗效提供理论依据。
1 材料与方法
1.1 细胞及动物
HepG2细胞为湖南省中医药研究院附属医院中心实验室惠赠。所有实验动物遵循国家科学技术委员会颁布的《实验动物质量管理办法》,SPF级SD大鼠10只,雄性,体质量180~220 g,动物购于湖南斯莱克景达实验动物有限公司,动物合格证号SCXK(湘)2019-0004。本动物实验经湖南省中医药研究院动物伦理委员会批准,批准号2019-0072。
1.2 药物及试剂
固脾消积饮白参10 g、黄芪30 g、半枝莲30 g、重楼15 g、醋莪术15 g、甘草5 g购于湖南省中医药研究院附属医院。DMEM高糖培养基(Procell公司,批号:WH0021K261),小牛血清(CELL-BOX公司,批号:20201118),CCK8试剂盒(APExBIO公司,批号:K1018),SDS-PAGE凝胶配制试剂盒(Elabscience公司,批号:E-IR-R305),增强型线粒体膜电位检测试剂盒(JC-1,上海碧云天生物技术有限公司,批号:C2003S),周期与凋亡检测试剂盒(上海碧云天生物技术有限公司,批号:C1052),Bax抗体(Elabscience公司,批号:E-AB-10049),Bcl-2抗体(Elabscience公司,批号:E-AB-22004),Caspase-3抗体(Elabscience公司,批号:E-AB-22115);Seahorse XF RPMI培养基(美国Agilent公司,批号:00620006);丙酮酸、葡萄糖ELISA试剂盒(南京建成生物工程公司,批号A081、F006);丙二醛(MDA)检测试剂盒(英国Abcam公司,批号GR33333591);糖酵解速率测定试剂盒(美国Agilent公司,批号26817104);三酰甘油(TG)、胆固醇(TC)ELISA检测试剂盒(中生北控生物科技股份有限公司,批号201651、206021)。
1.3 仪器
DxFLEX型流式细胞仪(美国Beckman Coulter有限公司);Multifuge XIR型超低温低速离心机(德国ThermoFisher);EIX808U型酶标仪(美国BioTek公司);Mini Protean 3 Cell型电泳仪(美国Bio-Rad);GBox XRQ型凝胶成像仪(中国Gene公司);Seahorse XFe96型能量代谢分析仪(美国Agilent公司)。
1.4 固脾消积饮含药血清的制备
饮片冷水浸泡30 min,煎煮2次,将药液混合后过滤,浓缩至成人3倍剂量,再将药物浓缩至100 ml含生药1.8 g/ml,取10只SD大鼠,中药组5只,按相当于成人120 g/d等效量换算,每日灌胃量21.6 g/kg;空白组5只,用等体积蒸馏水灌胃;连续5 d,灌胃后第6日腹主动脉取血,收集两组大鼠的血清,-80℃保存、备用。
1.5 细胞培养及分组
HepG2用10%胎牛血清的完全培养基培养,置于37℃,5%CO2培养箱培养,取对数生长期细胞进行实验。细胞共设4组:对照组(Control)、空白血清组(Blank)、固脾消积饮血清组(GPXJY)和顺铂组(Positive),每组设置6~10个复孔。空白血清组加入10%空白血清,中药组分别加入10%固脾消积饮含药血清培养基,顺铂组培养基中加入20μg/ml顺铂,于5%CO2,37℃常规培养24 h。
1.6 细胞活力检测试剂盒(CCK8)检测细胞活性
HepG2细胞按照1.5分组干预后,弃掉上清,每孔加入CCK8,37℃培养2 h,于450 nm波长处,用酶标仪测定各孔吸光值(OD值)。
1.7 4',6-二脒基-2-苯基吲哚(DAPI)染色法检测凋亡情况
在12孔板上,按照1.5共培养分组和干预后,弃掉上清,每孔加入相应DAPI,染10 min后,PBS洗后显微镜下观察。
1.8 Tunel检测HepG2细胞凋亡情况
每组细胞用4%多聚甲醛固定30 min,充分固定后,PBS清洗2×3 min次,Triton X-100封闭5 min,用PBS清洗2×3 min,配检测液后每孔加入50 μl,37℃避光60 min孵育,PBS洗2×3 min后,在荧光显微镜下拍照。
1.9 流式细胞仪检测人肝癌Hep G2细胞周期
各组加入等体积药物干预24 h后,收集细胞,1 000 r/min左右离心3 min,沉淀细胞。用PBS清洗2次。向400μl细胞悬液中加入400μl结合缓冲液和10μl AnnexinV-FITC(20μg/ml),混匀,4℃避光孵育15 min后,在向细胞悬液中加入5μl碘化丙啶(PI)(20μg/ml),混匀。4℃避光孵育5 min,室温放置10 min。采用流式细胞仪检测细胞周期。
1.10 JC-1线粒体检测试剂盒检测人肝癌HepG2细胞线粒体膜电位
取各组细胞悬液1 ml(含1×106细胞),以冷PBS洗涤细胞,100μl PBS液悬浮细胞,加入JC-1染色工作液,37℃孵育20 min,600 r/min 4℃离心3 min,沉淀细胞,重复三次,用JC-1重悬后,用流式细胞仪检测细胞线粒体膜电位,结果以平均荧光强度表示。
1.11 细胞上清液胆固醇(TC)和三酰甘油(TG)含量检测
取各组上清液按照说明书检测细胞上清液TG和TC含量。
1.12 脂质过氧化物(MDA)的检测
使用蛋白酶消化细胞,收集每组细胞。按照脂质过氧化MDA检测试剂盒说明书,95℃下60 min孵育,冰浴10 min,酶标仪检测。
1.13 细胞糖酵解速率测定
药物干预后细胞,每孔加入XF RPMI培养基,再将细胞放入无CO2的细胞培养箱中1 h等待上机检测,按照糖酵解速率试剂盒步骤进行检测。
1.14 葡萄糖代谢检测
取各组细胞上清液按照ELISA试剂盒说明书检测丙酮酸和葡萄糖含量
1.15 蛋白免疫印记法(Western blot)检测
BCL2-Associated X的蛋白质(BCL2-Associated X,Bax)、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)、含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase-3)蛋白按照1.5共培养分组和干预后,提取蛋白,取含有100μg总蛋白的细胞裂解产物进行电泳,5%脱脂奶粉进行封闭1 h,一抗4℃孵育过夜,清洗后二抗摇床孵育2 h,清洗后用凝胶成像。
1.16 统计学处理
2 结果
2.1 固脾消积饮对HepG2细胞增殖的影响
细胞处理24 h后,光密度OD(optical density)检测的结果显示,与空白对照组比较,顺铂组和固脾消积饮组细胞明显被抑制(P<0.05,表1)。同时,DAPI染色结果显示,固脾消积方含药血清对HepG2细胞的抑制作用较明显,细胞数变少(图1)。各组给予相应浓度药物,分别作用于HepG2细胞24 h后,检测其光密度OD(optical density)。结果显示,与空白对照组比较,顺铂组和固脾消积饮组细胞明显被抑制(P<0.05)。
DAPI染色结果如图1显示,固脾消积方含药血清对HepG2细胞的抑制作用较明显,细胞数变少。
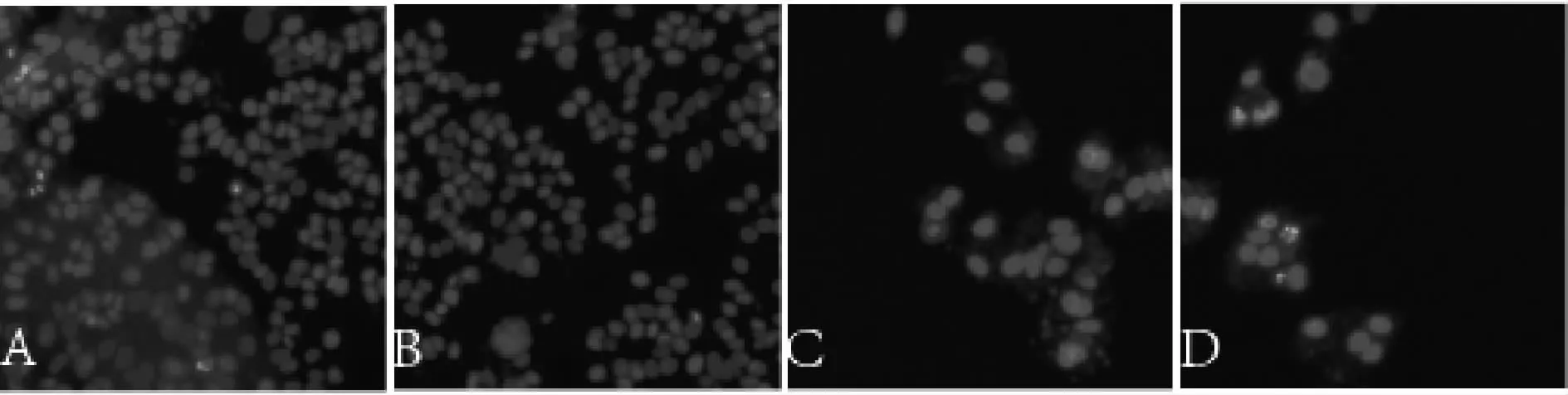
Fig.1 DAPI staining of HepG2 cells treated with medicated serum in each group(×200)
2.2 固脾消积饮对HepG2形态的影响
凋亡细胞的原位末断转移酶标记法(TUNEL)实验表明,固脾消积饮血清和顺铂血清组凋亡阳性细胞数明显多于对照组和无含药血清(P<0.01,表1,表2)。
Tab.1 Positive expression rate of OD and TUNEL cells in each group(±s,n=8)
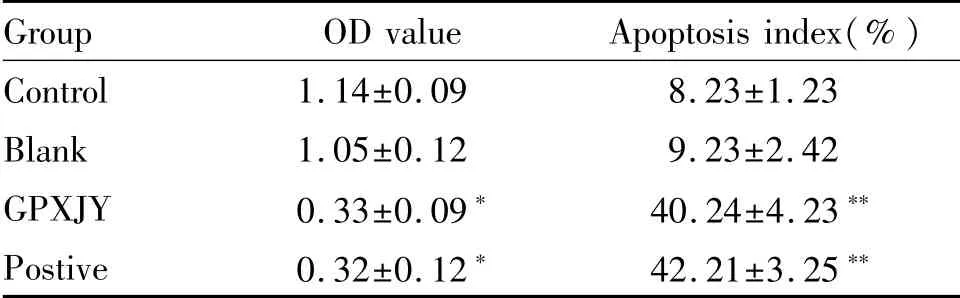
Tab.1 Positive expression rate of OD and TUNEL cells in each group(±s,n=8)
*P<0.05,**P<0.01 vs the control group
Group OD value Apoptosis index(%)Control 1.14±0.09 8.23±1.23 Blank 1.05±0.12 9.23±2.42 GPXJY 0.33±0.09* 40.24±4.23**Postive 0.32±0.12* 42.21±3.25**
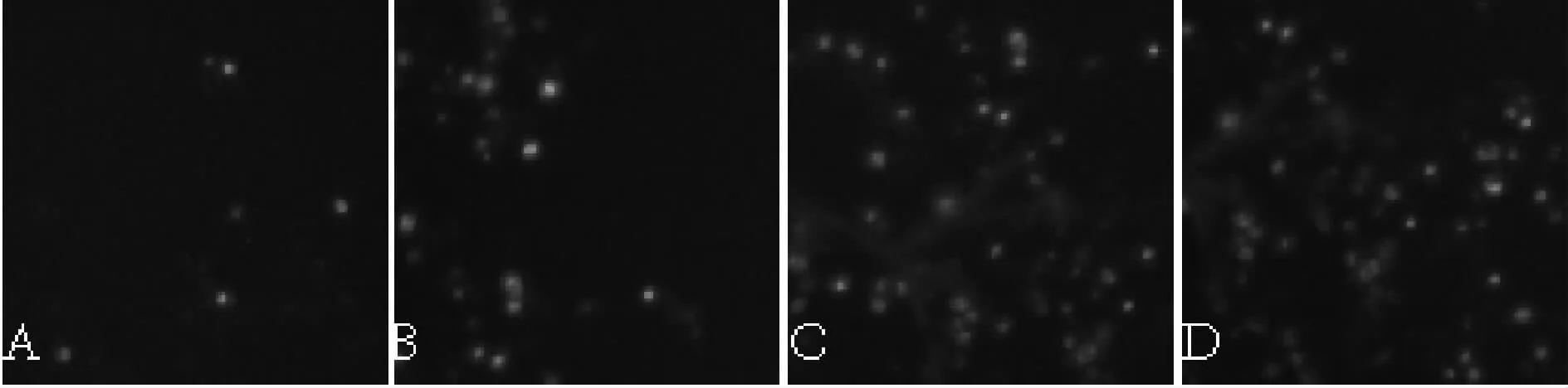
Fig.2 TUNEL apoptosis of cells in each group
2.3 固脾消积饮对HepG2周期的影响
细胞周期表明,固脾消积饮血清组和顺铂血清组HepG2细胞G0-G1期的百分率比对照组大,差异具有统计学意义(P<0.05),固脾消积饮血清组和顺铂血清组HepG2细胞S期的百分率降低,无统计学意义。固脾消积饮血清组和顺铂血清组HepG2细胞G2-M期降低,无统计学意义(表2,图3)。
Tab.2 Cell cycle and apoptosis in each group(%,±s,n=8)
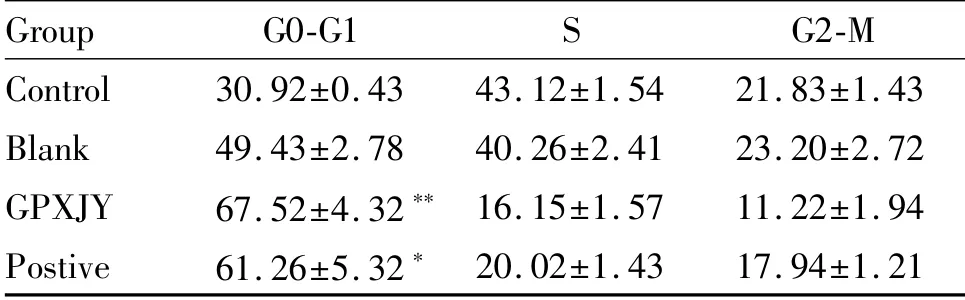
Tab.2 Cell cycle and apoptosis in each group(%,±s,n=8)
*P<0.05,**P<0.01 vs the control group
Group G0-G1 S G2-M Control 30.92±0.43 43.12±1.54 21.83±1.43 Blank 49.43±2.78 40.26±2.41 23.20±2.72 GPXJY 67.52±4.32**16.15±1.57 11.22±1.94 Postive 61.26±5.32*20.02±1.43 17.94±1.21
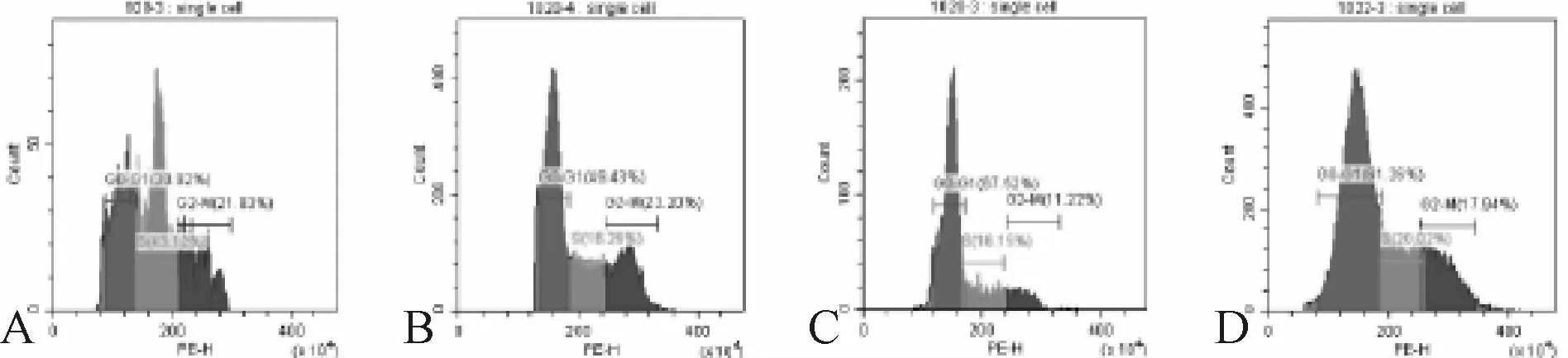
Fig.3 Results of cell cycle and apoptosis in each group
2.4 固脾消积饮对Hep G2细胞线粒体膜电位的作用
线粒体膜电位显示,与对照组比较,固脾消积饮和顺铂血清组线粒体膜电位依次下降(P<0.01,表3,图4)。
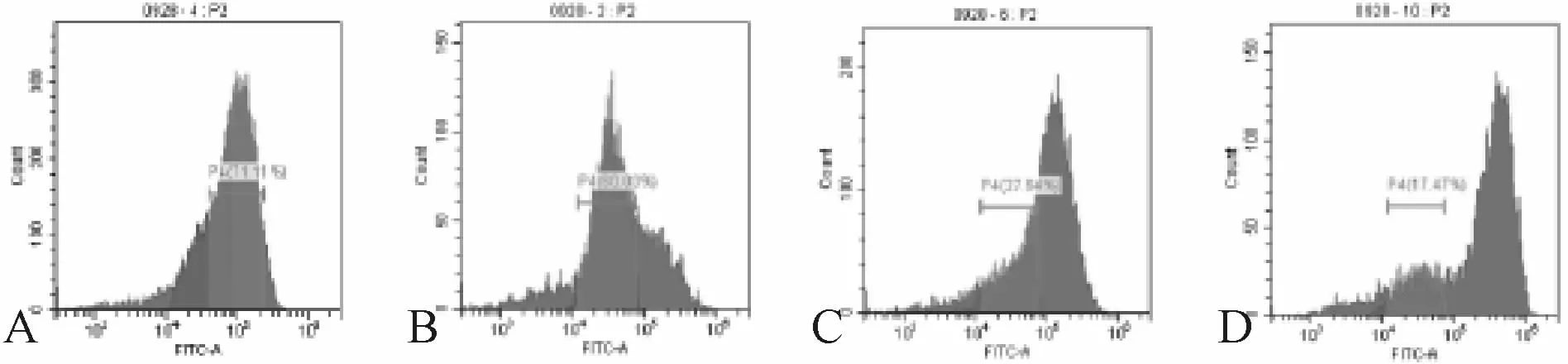
Fig.4 Mitochondrial membrane potential of cells in each group
2.5 固脾消积饮对HepG2能量代谢的影响
2.5.1 固脾消积饮对HepG2脂质代谢的影响 与对照组相比,空白组TG和TC无变化,中药组和顺铂组TG和TC含量显著减少(P<0.05,P<0.01,表3)。
2.5.2 固脾消积饮对HepG2的糖酵解功能和MDA水平的影响 与对照组相比,空白组糖酵解和MDA含量无明显变化,中药组和顺铂组糖酵解功能明显降低,MDA含量明显增加(P<0.05,P<0.01,表4)。
2.5.3 固脾消积饮对HepG2的丙酮酸和葡萄糖的影响 与对照组相比,空白组丙酮酸含量和葡萄糖含量无变化,中药组和顺铂组上清液丙酮酸含量明显增加,葡萄糖含量明显减少(P<0.05,P<0.01,表5)。
2.6 固脾消积饮对Bax、Bcl-2、Caspase-3蛋白的影响
与对照组相比较,固脾消积饮和顺铂组的Bax、Caspase-3表达显著增高,固脾消积饮和顺铂组中Bcl-2蛋白表达量显著降低(P<0.05,P<0.01,表6,图5)。
Tab.3 Mitochondrial membrane potential and comparison of TG and TC contents in cells of each group(±s,n=8)
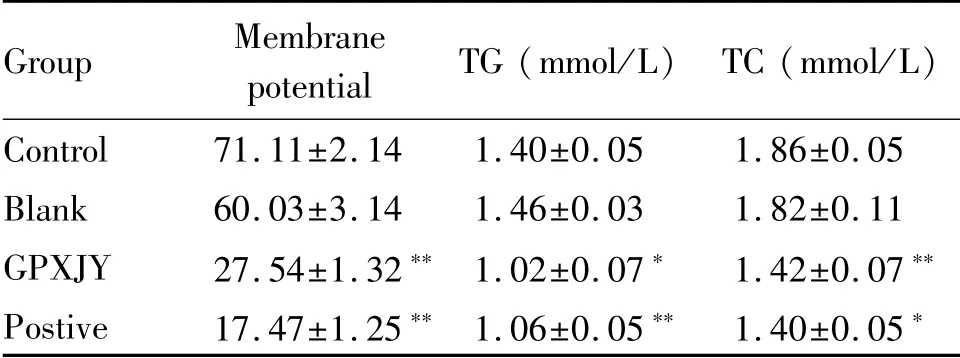
Tab.3 Mitochondrial membrane potential and comparison of TG and TC contents in cells of each group(±s,n=8)
*P<0.05,**P<0.01 vs the control group
Group Membrane potential TG(mmol/L)TC(mmol/L)Control 71.11±2.14 1.40±0.05 1.86±0.05 Blank 60.03±3.14 1.46±0.03 1.82±0.11 GPXJY 27.54±1.32**1.02±0.07*1.42±0.07**Postive 17.47±1.25**1.06±0.05**1.40±0.05*
Tab.4 Comparison of glycolytic function and MDA level of cells in each group(±s,n=8)

Tab.4 Comparison of glycolytic function and MDA level of cells in each group(±s,n=8)
*P<0.05,**P<0.01 vs the control group
Group PER(mpH/min) MDA(mmol/L)Control 809.7±13.9 0.62±0.05 Blank 798.3±18.7 0.75±0.01 GPXJY 472.2±26.7** 1.03±0.01*Positive 463.1±26.5* 1.08±0.05**
Tab.5 Comparison of pyruvate and glucose contents in cells of each group(±s,n=8)
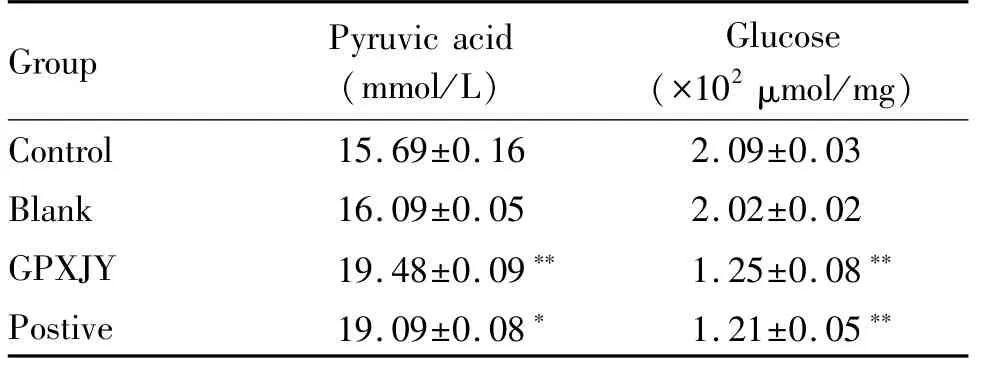
Tab.5 Comparison of pyruvate and glucose contents in cells of each group(±s,n=8)
*P<0.05,**P<0.01 vs the control group
Group Pyruvic acid(mmol/L)Glucose(×102μmol/mg)Control 15.69±0.16 2.09±0.03 Blank 16.09±0.05 2.02±0.02 GPXJY 19.48±0.09** 1.25±0.08**Postive 19.09±0.08* 1.21±0.05**
Tab.6 Expression of Bax,Bcl-2 and caspase-3 proteins in each group(±s,n=10)
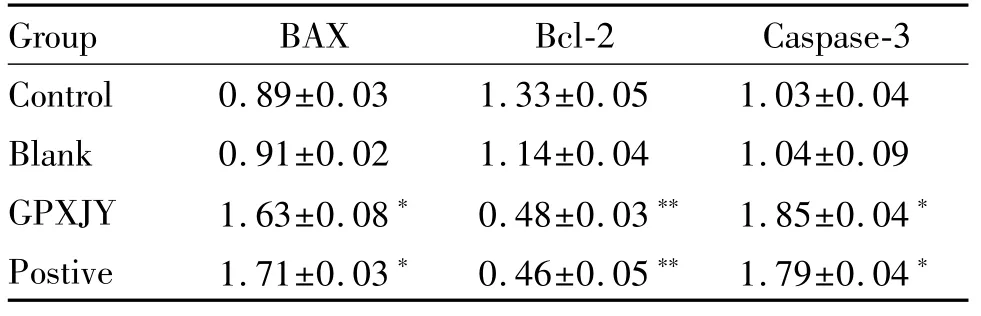
Tab.6 Expression of Bax,Bcl-2 and caspase-3 proteins in each group(±s,n=10)
*P<0.05,**P<0.01 vs the control group
Group BAX Bcl-2 Caspase-3 Control 0.89±0.03 1.33±0.05 1.03±0.04 Blank 0.91±0.02 1.14±0.04 1.04±0.09 GPXJY 1.63±0.08*0.48±0.03**1.85±0.04*Postive 1.71±0.03*0.46±0.05**1.79±0.04*
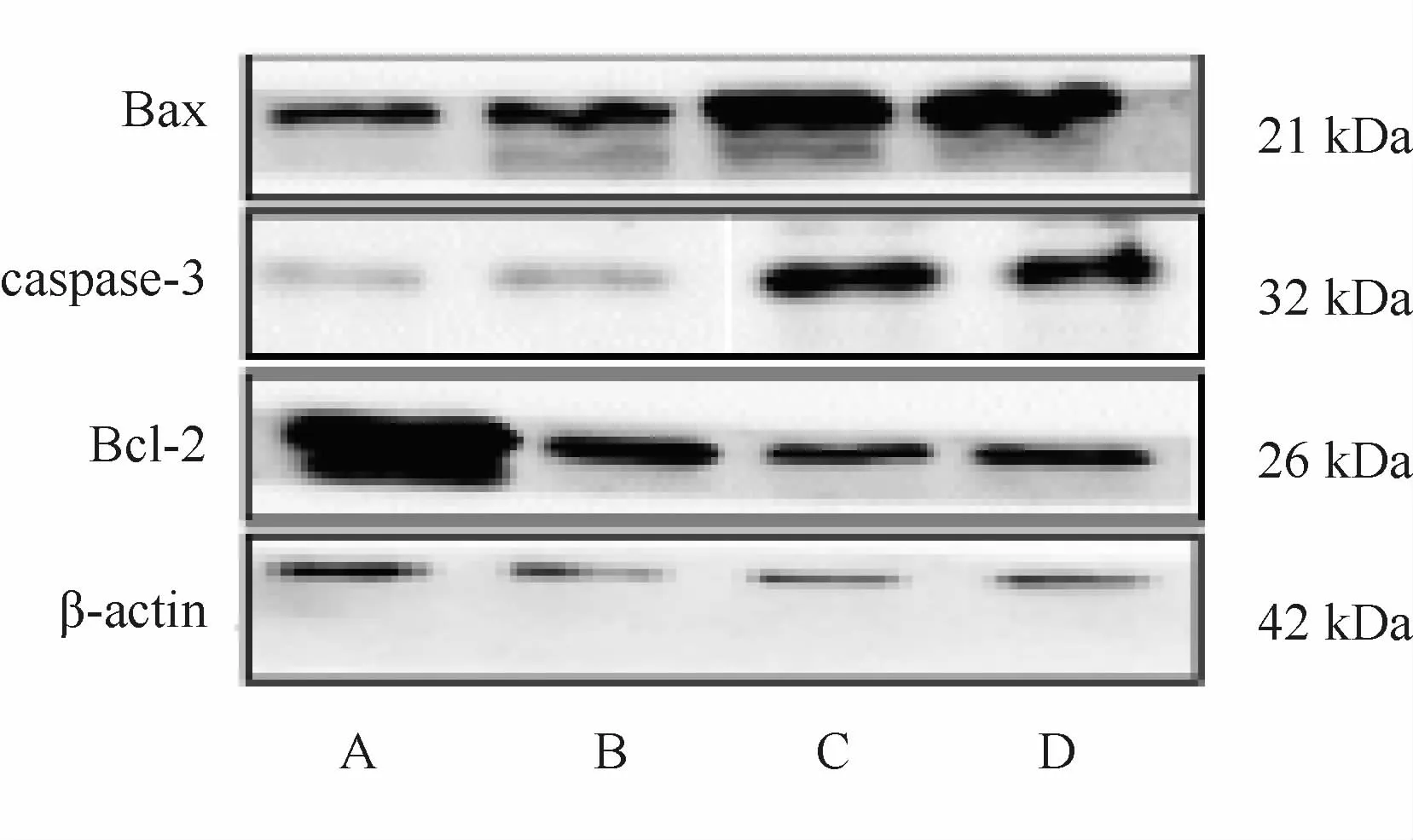
Fig.5 Protein expressions of Bax,Bcl-2 and Caspase-3 in each group
3 讨论
细胞凋亡可以有效抑制肿瘤细胞生长和繁殖,从而抑制肿瘤发生发展。诱导肿瘤细胞凋亡可以在杀灭癌细胞的同时有效的避免对正常细胞的损害。因此,其是一种能有效的抑制癌细胞增殖的重要手段。凋亡常表现为细胞体积缩小,细胞器发生变化以及凋亡小体出现等[5]。线粒体、死亡受体和内质网是凋亡发生的三种机制,通过凋亡信号诱导程序性死亡路径,从而使得肿瘤疾病得以有效治疗[6]。本研究结果显示,固脾消积饮对肝癌细胞有抑制作用,TUNEL实验显示固脾消积饮干预细胞组凋亡阳性细胞明显增多。流式结果显示固脾消积饮血清组G1期的百分率比对照组大。表明固脾消积饮可能是通过阻滞HepG2细胞G1期而抑制癌细胞的增殖作用。
线粒体跨膜电位与细胞凋亡间关系密切,是由线粒体内膜两侧电子的不对称分布造成。线粒体是能维持电化学质子梯度、进行氧化磷酸化的结构基础[7]。正常生理情况下线粒体内膜通透性很低,仅允许不带电荷的小分子物质通过。在细胞凋亡早期线粒体外膜蛋白质的通透性增高,线粒体膜电位降低,最终导致细胞凋亡[8]。细胞凋亡中线粒体起着重要作用,而这一过程是通过Bax、Bcl-2家族平衡来调控[9]。Bcl-2基因可抑制细胞凋亡,延长细胞生存期。Bax则是具有对抗Bcl-2蛋白作用,促进细胞凋亡产生。Caspase-3是凋亡途径的效应分子,在线粒体介导细胞凋亡途径中受凋亡信号的刺激下,其上游信号分子作用于线粒体膜,线粒体膜通透性发生反应,引起凋亡[10]。本实验结果表明,固脾消积饮含药血清处理人肝癌细胞后,线粒体膜电位下降,凋亡率增加,并对线粒体凋亡相关的通路蛋白Bcl-2表达降低,Bax、Caspase-3表达增高。由此可推测,固脾消积饮可能通过线粒体途径诱导肝癌细胞凋亡的发生。
与正常细胞不同,肿瘤细胞主要通过糖酵解产生ATP获得大量能量,有氧糖酵解是肿瘤细胞最具特征的代谢表型,为肿瘤细胞的增殖提供能量[11]。实验表明,抑制癌细胞的糖酵解和脂质代谢等能量代谢,可以促进肿瘤细胞的凋亡[12-14]。本实验表明,固脾消积饮血清干预TG和TC含量显著减少,糖酵解功能明显降低,MDA含量明显增加,丙酮酸含量明显增加,葡萄糖含量明显减少。由此可推测,固脾消积饮可能对肝癌细胞能量代谢有调节作用。
综上所述,我们通过体外实验证实固脾消积饮能促进肝癌细胞凋亡,其作用可能跟线粒体途径和调节能量代谢有关。下一步将进一步对体内实验进行验证,并联合放化疗药物进一步探讨。

