臭氧亚慢性暴露对大鼠心脏lncRNA表达谱的影响*
赵 越,田 蕾,闫 峻,李 康,林本成,袭著革,刘晓华
(军事科学院军事医学研究院环境医学与作业医学研究所,天津 300050)
近年来空气污染问题已成为全球亟待解决的重要环境问题之一,臭氧(ozone,O3)作为环境重要污染物之一,已成为我国夏季大气首要污染物[1]。中国环境监测总站数据显示,2019年就有154个城市出现O3高值,且以O3为首要污染物的天数共153 d;2020年,京津冀地区、长江三角地区和汾渭平原O3超标天数占总超标天数的一半[1]。流行病学研究表明O3暴露与人类呼吸系统和心血管系统疾病的发病率和死亡率呈正相关关系[2]。O3暴露可引起黏膜和呼吸道刺激性反应,产生多种细胞因子,这些因子随血液循环到达其他组织器官,引起全身性反应[3]。
长链非编码RAN(long noncoding RNA,lncRNA)是真核生物DNA转录中产生的一类非编码RNA,其核苷酸数量大于200个碱基,lncRNA功能与其在细胞中的定位相关,在细胞核中的lncRNA主要通过干预染色体来发挥调控功能,在细胞质中的lncRNA通过转录调控参与机体生理病理学过程[4]。Janika等人研究表明lncRNA Chat可促进心室重塑[5],Maria-Teresa Piccoli团队研究表明Meg3升高可在慢性心肌肥大的基础上导致心脏纤维化,特异性干扰该基因的表达可显著改善心脏功能[6]。
目前O3亚慢性暴露对心脏影响的研究较少,深入机制研究更为匮乏。本文首次针对O3亚慢性暴露后大鼠心脏中lncRNA的表达谱变化情况,和差异性lncRNA潜在的生物学功能进行阐述,为预防O3亚慢性暴露对人体的损伤提供科学依据。
1 材料与方法
1.1 动物模型构建及样本采集
从北京维通利华有限公司购入18只6周龄雄性Wistar大鼠,于清洁级动物房中适应性饲养一周后,将其随机分为清洁空气组和臭氧暴露组,每组9只。建模期间,将大鼠置于气体染毒柜(Beijing huironghe,HRH-CSED-K)中,清洁空气组暴露于过滤空气中,臭氧暴露组暴露于O3浓度为0.5 ppm(0.980 mg/m3)的混合气体中,每天6 h,共90 d。暴露结束后大鼠禁食不禁水,次日以3%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,经腹主动脉取血后立即摘取心脏,随后每组取3只大鼠心尖组织置于10%甲醛固定液中用于石蜡切片制备,其余心肌组织于4℃生理盐水中清洗去除血液后置于液氮中保存。本实验针对大鼠的所有操作都经过军事科学院军事医学研究院环境医学与作业医学研究所动物伦理委员会的审查和批准。
1.2 总RNA提取及质量控制
根据TRIzol试 剂(Invitrogen,Carlsbad,CA,USA)说明书从前述实验中冻存的6只大鼠心脏中提取总RNA,利用RNasey Mini Kit对RNA样本进行纯化,最后采用标准琼脂糖凝胶电泳对总RNA完整性进行评估,通过Nanodrop ND-1000(Nanodrop,Wilmington,de,USA)对每个样本中的总RNA进行定量和质量验证。
1.3 芯片杂交分析
由Arraystar Technologies(Maryland,USA Rockville)设计并生产大鼠lncRNA芯片2.0 V(4×44k),根据Quick Amp Labeling Kit和One-Color试剂盒(Agilent,USA)说明书将1.2中提取的总RNA样本进行标记并反转为荧光cRNA,随后纯化并检测cDNA的质量和浓度。根据Agilent Gene Expression Hybridization试剂盒(Agilent,USA)说明书进行杂交实验,通过Agilent Scanner G2505C对实验结果进行扫描,通过R(3.1.2版)对原始数据进行处理。
1.4 实时荧光定量PCR(qRT-PCR)实验
从芯片结果中选取6个差异性显著的lncRNA(3个显著上调,3个显著下调)进行验证,以GAPDH为内参,利用Primer 5.0设计引物。用TRIzol试剂提取前述实验中冻存的心肌组织中总RNA,去除基因组DNA,根据RevertAid First Strand cDNA Synthesis试剂盒(Thermo,US)进行反转录实验(30℃10 min;42℃50 min)。qRT-PCR实验主要仪器为Bio-Rad iq5(Bio-Rad,US);主要试剂为Fast-Start Essential DNA Green Maste(Roche)qRT-PCR,条件为85℃10 min,每组六次平行实验。
1.5 GO和KEGG分析
基因本体论(Gene Ontology,GO)(http://www.geneontology.org)分析包括生物过程(biological process,BP)、细胞成分(cellular component,CC)和分子功能(molecular function,MF)三个部分,使用Fisher检验进行统计学检验,P(P<0.05)值越小,GO项越显著;京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)(https://www.genome.jp/kegg/)用于描述差异性lncRNA可能参与的信号通路,P(P<0.05)值越小,KEGG项越显著。
1.6 统计学处理
2 结果
2.1 O3亚慢性暴露对大鼠心脏中lncRNA表达谱的影响
我们采用芯片杂交技术对O3亚慢性暴露后大鼠心脏中lncRNA表达变化情况进行分析。箱式图描述了臭氧暴露组与清洁空气组数据分布情况,结果显示六组数据分散情况基本一致(图1A)。热图结果表明,与对照组相比,臭氧暴露组中大量lncRNA表达量发生改变(红色为表达上调,绿色为表达下调,图1B)。火山图结果显示差异性lncRNA中显著上调的有167个(红色),显著下调的有64个(绿色,图1C)。
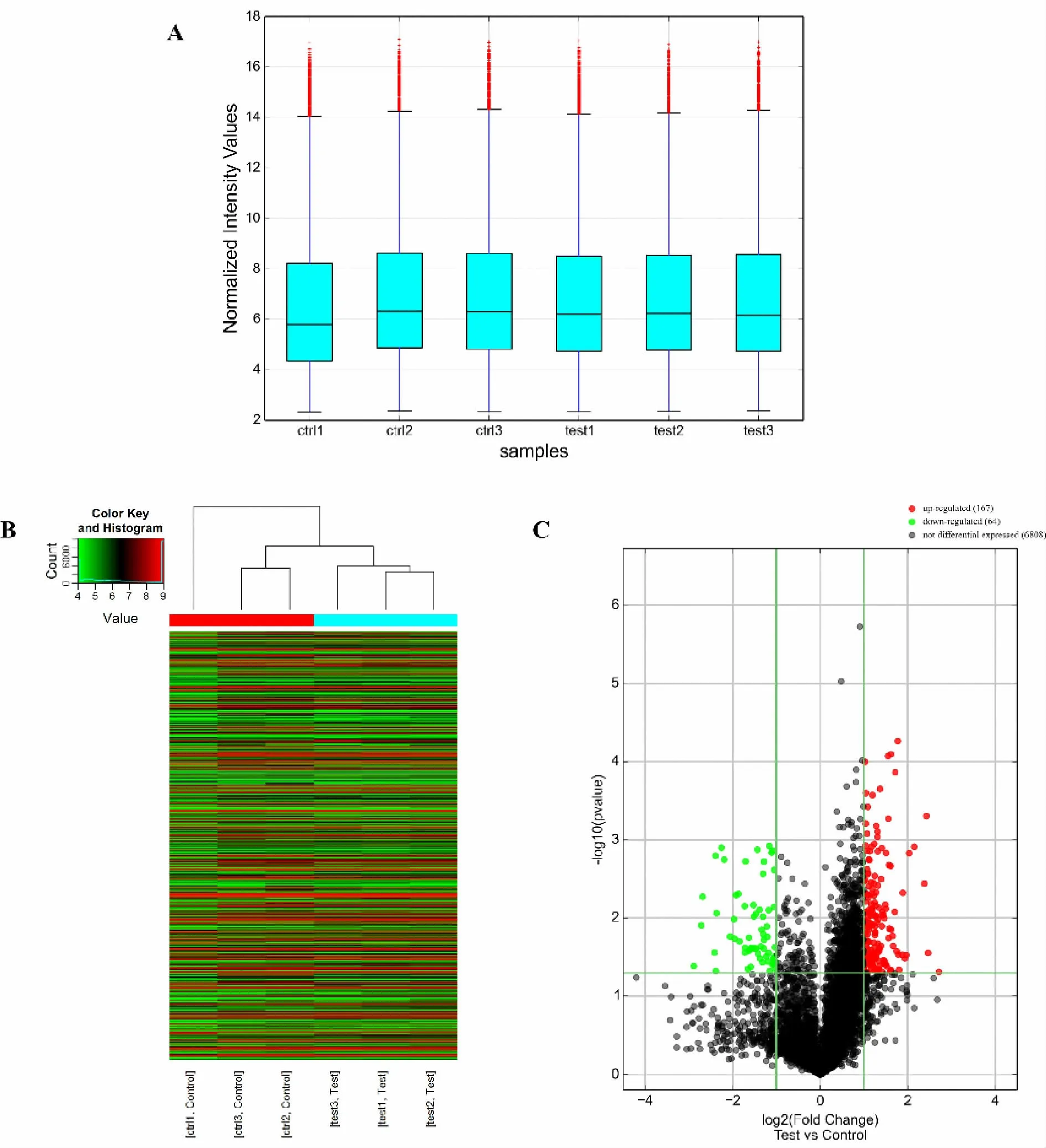
Fig.1 Overview of differentially expressed lncRNA
2.2 O3亚慢性暴露大鼠心脏中差异表达lncRNA分类
通过对差异表达lncRNA进行分类分析,结果显示差异性上调的lncRNA中含量最多的是基因间lncRNA(灰色,34%)、外显子有义重叠型lncRNA(橙色,32%)和内含子有义重叠型lncRNA(黄色,21%);差异性下调的lncRNA中含量最多的是基因间lncRNA(灰色,46%)、双向型lncRNA(深蓝色,22%)和外显子有义重叠型lncRNA(橙色,20%)。在全部lncRNA中占比最多的是基因间lncRNA(灰色),最少的是天然反义型lncRNA(绿色,图2)。
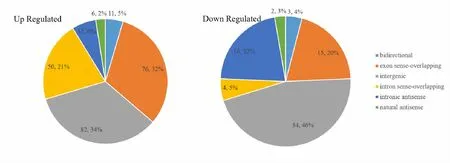
Fig.2 Classification of the differentially expressed lncRNA
2.3 差异表达lncRNA表达量验证
根据芯片杂交分析结果,我们利用qRT-PCR方法对表达变化最显著的6个lncRNA(LOC102554403、LOC103693964、LOC108349594、LOC102554241、LOC102547903、LOC102552250)的表达趋势进行验证。qRT-PCR结果显示,LOC102554403、LOC103693964和LOC108349594表达 上 调,LOC102554241、LOC102547903和LOC102552250表达下调,且变化倍数>2,这一结果与芯片分析结果一致,即芯片结果可信(图3)。
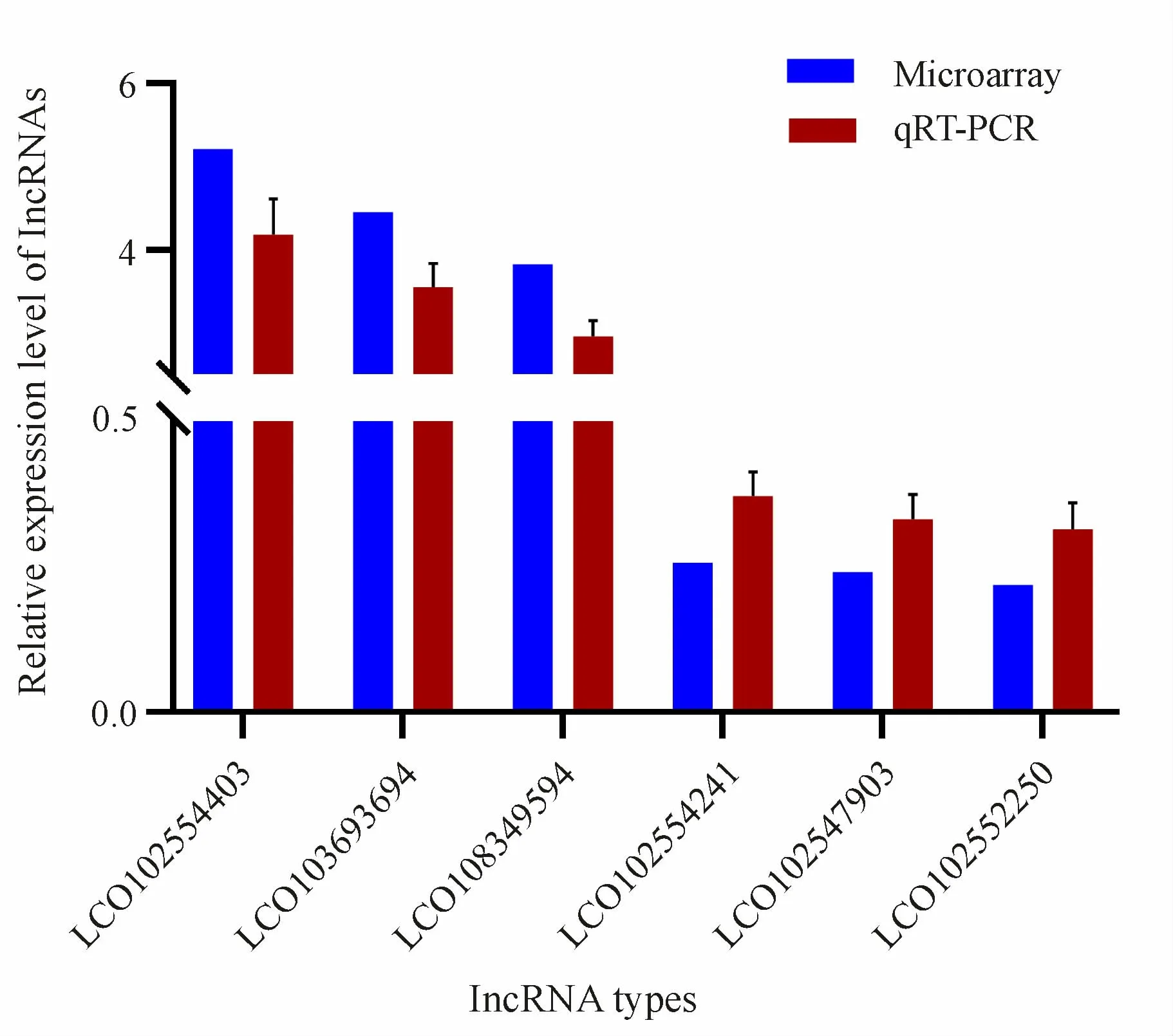
Fig.3 LncRNA expression level validated by microarray and qRT-PCR(±s,n=6)
2.4 O3亚慢性暴露大鼠心脏中差异表达lncRNA的GO分析
GO分析结果表明,显著上调的lncRNA主要参于生长发育过程和细胞对外界刺激性的反应;在细胞中主要存在于细胞质中;可能具有黏着功能(GO:0005488)和与其他物质相结合的功能(表1)。
显著下调的lncRNA主要参与细胞器定位(GO:0051640)和物质分解代谢的过程;在细胞中主要定位于纤毛纤维过渡、浓缩的染色体外着丝粒和微管中;可能通过调节氧化还原酶活性发挥调控功能(表2)。
2.5 O3亚慢性暴露大鼠心脏中差异表达lncRNA的KEGG分析
KEGG分析结果表明显著上调的lncRNA主要参与PI3K-Akt信号通路、脂肪酸降解、甲状腺激素等信号通路;显著下调的lncRNA主要参与各种维生素和主要供能物质的代谢过程,并可能调控药物代谢细胞色素P450等过程(表3)。
3 讨论
O3是目前大气污染中重点防治对象之一,O3对哺乳动物和人的影响主要集中于呼吸系统,研究表明O3急性暴露导致肺部发生广泛性、持续性的炎症,使机体免疫功能降低、肺上皮细胞增生和肺纤维化[3]。在本研究中我们采用芯片技术研究证实O3亚慢性暴露可导致大鼠心脏中lncRNA表达谱发生变化,显著上调的lncRNA有167个,显著下调的lncRNA有64个(FC≥1.5和P<0.05),其中数量最多的是基因间lncRNA。

Tab.1 GO analysis for up-regulated lncRNA after ozone subchronic exposure
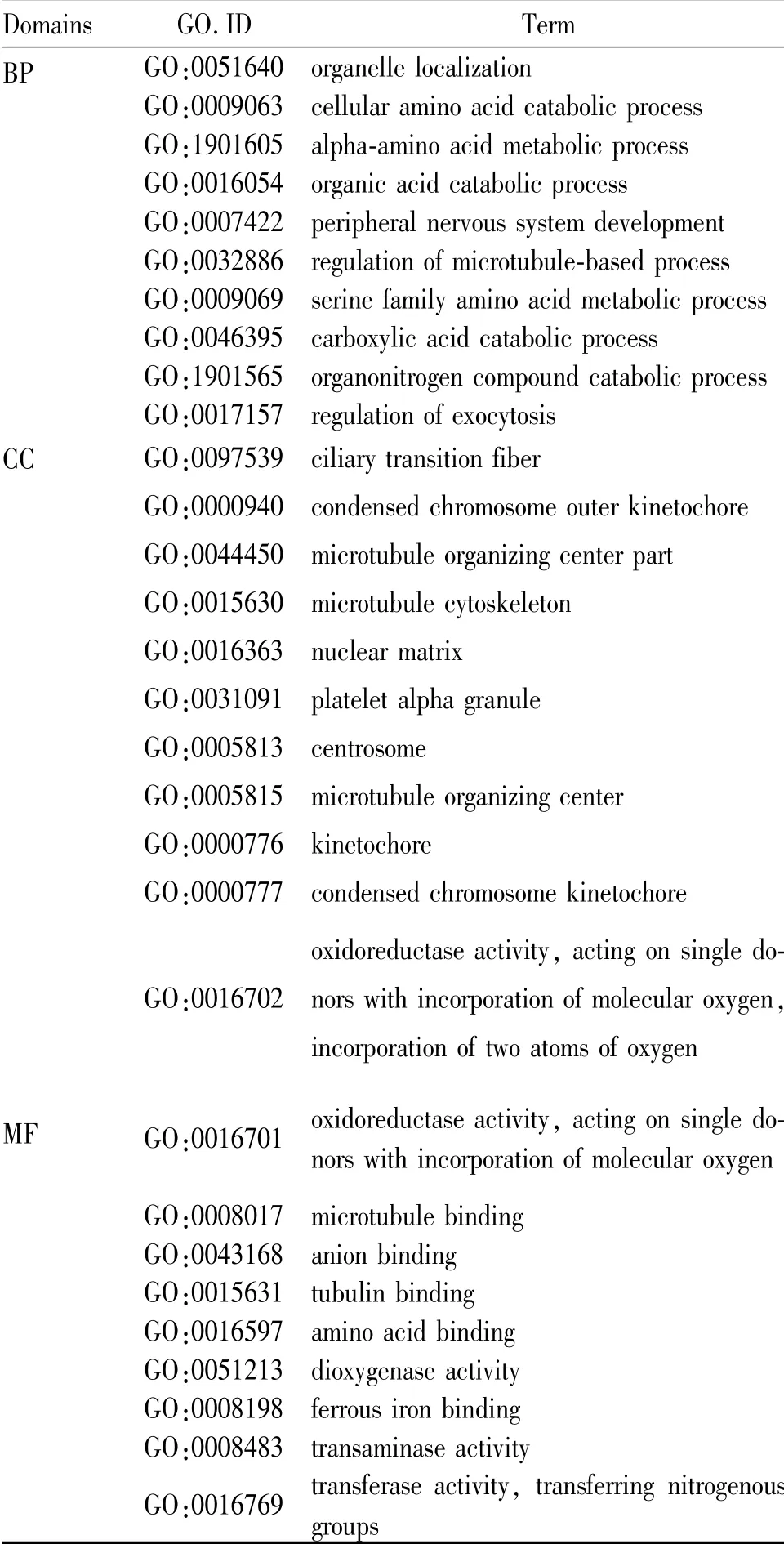
Tab.2 GO analysis for down-regulated lncRNA after ozone sub-chronic exposure
GO分析结果表明差异性上调的lncRNA可能主要参与生长发育过程,大量研究表明发育过程较为复杂的生物体内的lncRNA可能通过RNA修饰参与调节生长发挥过程,与心脏发育密切相关的基因有Bvht、Fendrr等,其中lncRNA SRA1和Linc-MD可通过海绵作用调控细胞分化[7],本研究也发现大量与发育相关的lncRNA,GO分析提示这些差异表达的lncRNA可能参与调控细胞发育、器官生长发生或系统发育过程;此外还可能参与细胞对化学刺激和有机物刺激的应激过程,有研究表明O3急性暴露可使神经体液因子失调,这些神经体液因子随循环系统到达全身各处,造成机体代谢紊乱,Miller DB等人的研究表明O3大多在呼吸道发生反应并产生大量应激因子和脂质代谢物,如IL-6、内皮素、纤维蛋白原等,同时检测结果表明循环系统中上述物质表达量显著升高[8],而这些物质在循环中的升高可导致内皮功能障碍,造成血栓和动脉粥样硬化[2]。

Tab.3 KEGG analysis for differentially expressed lncRNA after ozone sub-chronic exposure
KEGG分析结果表明差异性上调的lncRNA可能主要参与PI3K-Akt信号通路,有大量研究揭示PI3K-Akt信号通路在多种心脏疾病和功能损伤等病理进程中发挥重要调节作用,该通路的激活可调节细胞生长与增殖,氧化应激激活该通路使心肌细胞凋亡加快[9],败血症诱导的心脏功能障碍中PI3K和Akt去磷酸化导致细胞炎症与凋亡,在心肌肥大的研究中发现PI3K/Akt/mRNA信号通路活化后,可通过Bcl-2诱导细胞自噬[9,10]。其次,差异性上调的lncRNA也可能参与调节脂肪酸代谢,脂肪酸氧化分解可产生ATP,在成年心脏中脂肪酸是主要能量代谢物质[11],脂肪酸代谢超过一定的限度可抑制心脏糖酵解过程,从而导致能量供给不足,使心脏功能降低,在临床治疗中通常通过直接增加糖酵解或抑制脂肪酸代谢来改善心脏功能[12],实验证明棕榈酸酯可诱导心肌细胞肥大和心肌细胞死亡相关基因、蛋白质表达升高[13],结合我们实验室前期实验结果,我们可以假设O3暴露可能通过线粒体氧化应激途径对心脏造成损伤;近年来有体外实验证明lncRNA参与调控脂肪酸代谢过程,LINC00473在脂肪细胞中特异性表达,该基因的表达量与线粒体氧化代谢能力相关,在调节脂肪酸解代谢也有重要作用,核lncRNA Blinc1参与调控生热脂肪细胞的发育,lncBATE10通过抑制Ppargc1a mRNA基因的表达使细胞产热[14]。
差异表达下调的lncRNA可能主要参与氨基酸代谢过程,心脏可以分泌大量谷氨酸和丙氨酸,有研究表明支链氨基酸分解代谢受损使心脏更容易发生缺血/再灌注损伤,这主要是通过抑制小鼠体内葡萄糖代谢和O-GlcNAc的蛋白修饰来实现的[15];γ-氨基丁酸主要参与调节心血管生理病理进程,在慢性心力衰竭患者血中总氨基酸和多种分类氨基酸含量均降低,其中天冬氨酸、蛋氨酸和牛黄酸含量与心脏功能衰减程度有正相关关系[16]。谷氨酰胺是癌症细胞中重要的能量代谢物质,lncRNA可调节癌症中谷氨酰胺代谢,如肝内胆管癌中lncRNA TUG1表达升高与该疾病愈后差密切相关,抑制lncRNA TUG1表达后谷氨酰胺消耗和能量产生显著减少,lncRNA EPB41L4A-AS1表达量降低可使HeLa和HepG2细胞对谷氨酰胺的依赖性增强,同时加快谷氨酰胺的代谢,在膀胱癌细胞中抑制lincRNA-p21的表达也可以使谷氨酰胺代谢加速,而过表达lincRNA-p21可抑制癌细胞增殖[17]。
KEGG分析结果表明差异性下调的lncRNA主要参与维生素的调节,流行病学研究和大量实验研究证明维生素D在心肌细胞、内皮细胞和血管平滑肌细胞中有重要作用[18],25-OH D水平降低可激活肾素-血管紧张素系统和左心室心肌肥厚,体内维生素D不足与心血管疾病发病机制密切相关,Zhou等人研究发现缺乏维生素D可增加人群心血管疾病发病风险,维生素D水平过低的患者发生心脏病的风险更高,而且该人群血压更高[19]。维生素E是一种重要的脂溶性抗氧化剂,流行病学研究、体外实验和动物实验研究结果表明维生素E升高可抑制低密度脂蛋白氧化所诱导的动脉粥样硬化斑块的进一步发展[20],这为维生素E治疗与脂质氧化相关心血管疾病提供重要数据支撑。
我们实验中发现的大量lncRNA可能参与调节心脏中能量和营养物质代谢,目前对营养物质在心血管疾病中的研究仅是冰山一角,需要深入研究,并且营养素补充对疾病的治疗在用量和方法上都难以从动物试验中推广到人群实验中。lncRNA在心脏中的研究在功能和调控机制尚未阐述完全,由于ln-cRNA保守性差,因此动物实验研究结果向临床试验外推十分困难,lncRNA在临床治疗方面尚处空白阶段,因此对心脏中lncRNA功能和调控机制研究十分必要,而我们的研究对治疗心脏疾病的可能有重大推进作用。

