有氧运动对非酒精性脂肪肝小鼠肝脏CNPY2-PERK通路的影响*
李军汉,熊 伟,王佳倩,李亚龙,蒋昌君
(1.成都体育学院运动医学与健康学院,四川 成都 610041;2.四川省人民医院肝外科,成都 610041)
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)以弥漫性肝细胞脂肪性变为主要特征,包括单纯性脂肪肝、脂肪性肝炎和肝硬化等,是由酒精和其他明确的肝损伤以外因素所致的临床病理综合征[1],其患病率在世界范围内呈上升趋势[2],严重危害人类健康。目前,NAFLD在临床治疗上尚无特效药物[3]。研究[4]报道,生活方式改变可有效改善NAFLD。有研究表明,运动可有效抑制NAFLD的病理进展,减少肝脏脂肪沉积。近年来,运动治疗NAFLD受到国内外学者的广泛关注。然而,运动改善NAFLD的作用机制尚有待进一步研究。
冠层成纤维细胞生长因子信号调节器2(canopy fibroblast growth factor signaling regulator 2,CNPY2)在机体各组织器官广泛表达,属于Canopy家族成员(CNPY1,2,3和4)之一,由182个氨基酸组成,分子量约21 KDa,是胞浆分泌型蛋白,以心、肝、胰腺表达较高。Hong[5]报道,CNPY2是内质网应激(endoplasmic reticulum stress,ERS)的重要分子组成,CNPY2正向调控PKR样内质网激酶(PKR-like endoplasmic reticulum kinase,PERK)-C/EBP同源蛋白(C/EBP homologous protein,CHOP)信号通路,是一种新的ERS起始因子。CNPY2的研究仍处于起步阶段,有关CNPY2-PERK通路的文献见于人脐静脉内皮细胞缺血/再灌注[6]的研究报道。最新研究[7]发现,有氧运动可有效改善NAFLD,其机制与有氧运动调控肝脏PERK-CHOP信号通路有关。然而,CNPY2-PERK信号通路在有氧运动改善NAFLD中是否发挥作用,尚未见文献报道。本研究通过高脂膳食喂养诱导NAFLD小鼠模型,采用有氧运动干预,探讨有氧运动对NAFLD小鼠肝脏CNPY2-PERK通路的影响,以期为运动防治NAFLD的作用机制提供理论依据。
1 材料与方法
1.1 实验动物与模型制备
8周龄雄性C57/BL6J小鼠,SPF/VAF级,体重为(20.1±1.2)g,许可证编号:JSNJ(苏)2020-0003,由江苏集萃药康生物科技有限公司提供。所有小鼠在成都体育学院实验中心小动物房内分笼饲养,相对湿度45%~55%,室温18~22℃,自由饮食饮水,12 h阴暗交替。所有小鼠适应性喂养1周后,按随机数字表法分为对照组(C)、对照+运动组(CE),NAFLD模型组(M)和NAFLD模型+运动组(ME),每组10只。C组和CE组给予普通饲料喂养18周,M组和ME组给予高脂饲料喂养18周,高脂饲料配方如下:猪油28%、全脂奶粉10.8%、蔗糖5.6%、微晶纤维素1.6%、酪蛋白11.5%、磷酸氢钙1.8%、实验动物预混料2%、石粉0.4%、基础饲料38%,此配方中能量占比约60%来源于脂肪,21%来源于糖,19%来源于蛋白质[8]。普通饲料和高脂饲料均由江苏协同医药生物工程有限责任公司提供[编号:苏饲证(2020)01008]。在实验第9周,从各组中分别随机抽取2只小鼠,禁食12 h,10%水合氯醛腹腔注射麻醉取肝脏左叶做油红O病理形态检测,结合血脂变化,以确认模型制备成功[9]。第10周开始,CE组和ME组进行有氧跑台训练。
1.2 跑台训练方案
跑台训练方案参考现有文献[10]。运动组小鼠先进行1周适应性跑台训练,初始速度为8 m/min×10 min,20 min/d,每天以0.5 m/min的速度 和10 min/d的时间递增,直至运动时间达到60 min/d,运动速度达到12 m/min,正式运动持续8周,每周运动5 d,直至实验结束。
1.3 样本采集与处理
为避免运动应激反应,实验结束后48 h取材。以4 ml/kg腹腔内注射2%戊巴比妥钠溶液麻醉,摘取小鼠眼球取血。以腹部正中切口打开腹腔,迅速取出肝脏,称肝湿重。肝脏一部分用4%多聚甲醛固定,用于HE染色和免疫组化检测;一部分固定包埋,用于冰冻切片和油红O染色;另一部分放置于液氮中速冻,转入-80℃冰箱储存,用于Western blot和qRT-PCR检测。
1.4 肝脏病理形态
用4%多聚甲醛将肝组织固定,常规石蜡包埋,切片后苏木精-伊红(HE)染色,光镜下观察肝组织病理学改变。采用NAS评分[11]标准对肝组织脂肪性变进行病理学评分。肝组织常规油红O染色,脂滴为红色,脂滴光密度采用IPP 6.0图像分析系统进行分析。
1.5 血液生化指标
全自动生化仪检测小鼠血清总胆固醇(total cholesterol,TC)、总甘油三酯(total triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-c)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-c)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天冬氨酸转氨酶(aspartate aminotransferase,AST)水平,检测方法严格按照试剂盒说明书进行。
1.6 Western blot
取肝组织加入RIPA裂解液裂解后提取肝组织中总蛋白。50μg蛋白样品经12.5%SDS聚丙烯酞胺凝胶电泳分离后,电转移至硝酸纤维素膜上,经5%脱脂奶粉室温下封闭1 h。5%BSA-TBST稀释一抗CNPY2(1:400),PERK(1∶500),p-eIF2a(1∶1 000)、CHOP(1∶1 000),β-actin(1∶10 0000),5%BSA-TBST稀释HRP结合的羊抗兔IgG(1∶5 000),ECL发光法曝光,显影,定影。β-actin作为内参,用Gel-pro32图像分析软件进行分析,蛋白表达量用“目的蛋白/β-actin”计算。
1.7 qRT-PCR
按照Trizol试剂盒说明书提取肝组织总RNA,逆转录获得eDNA,采用SYBR Green I实时荧光定量PCR方法检测各组肝组织CNPY2,PERK基因的表达水平。反应条件:95℃×30 s,95℃×3 s,55℃×30 s,72℃×30 s,45个循环。每个样本重复检测3次,以β-actin作为内参,计算相对量,采用2-ΔΔCT法分析。引物设计见表1,由上海生工公司设计合成。

Tab.1 Oligonucleotide primers used for qRT-PCR
1.8 免疫组化
免疫组化严格按照SABC免疫组化染色试剂盒说明书操作步骤进行。DAB显色,常规脱水、透明,中性树胶封片。光学显微镜下观察,棕黄色或棕褐色颗粒为阳性,用IPP 6.0免疫组化分析软件进行定量分析。
1.9 统计学处理
2 结果
2.1 各组肝脏病理形态变化
肝脏病理结果显示:C组和CE组肝细胞内可见少量脂肪性变和脂滴,肝小叶结构清晰;M组肝细胞内充满大量脂肪空泡,肝细胞脂肪性变显著,肝细胞内可见大量脂滴;ME组肝细胞脂肪性变程度和脂滴数量位于C组和M组之间(图1)。肝细胞脂肪性变积分结果显示:M组肝细胞脂肪性变积分和脂滴密度较C组显著升高(P<0.05),ME组肝细胞脂肪性变积分和脂滴密度较M组显著降低(P<0.05),CE组肝细胞脂性变积分和脂滴密度与C组比较,没有显著性差异(P>0.05,表2)
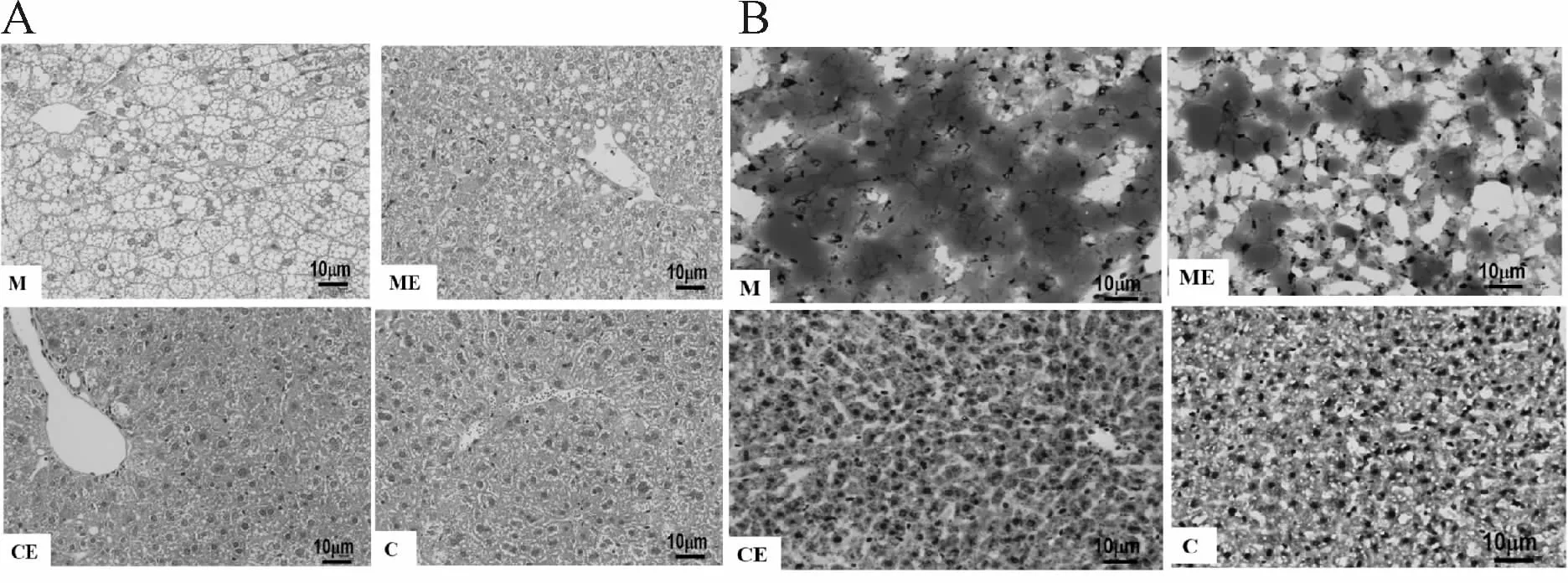
Fig.1 The hepatic pathological changes in mice of each group(Bar=10μm,×400)
Tab.2 Comparisons of the quantification of histological pathology in mice of each group(±s,n=8)
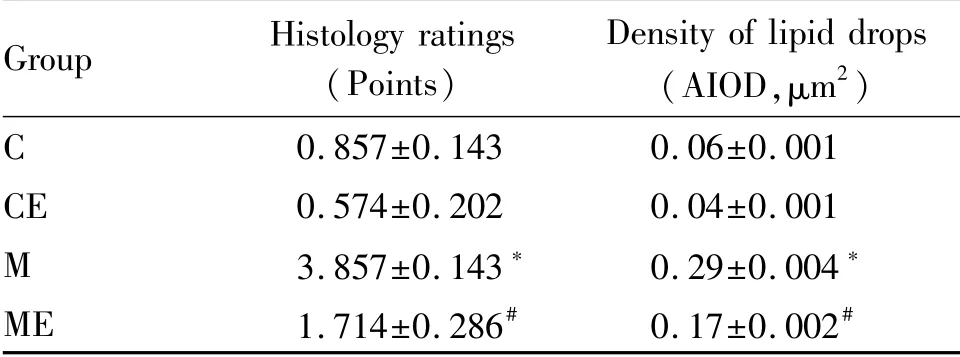
Tab.2 Comparisons of the quantification of histological pathology in mice of each group(±s,n=8)
C:Control;CE:Control+Exercise;M:Model;ME:Model+Exercise;AIOD:Average integrated optical density area*P<0.05 vs C group;#P<0.05 vs M group
Group Histology ratings(Points)Density of lipid drops(AIOD,μm2)C 0.857±0.143 0.06±0.001 CE 0.574±0.202 0.04±0.001 M 3.857±0.143* 0.29±0.004*ME 1.714±0.286# 0.17±0.002#
2.2 各组体重和肝指数变化
各组小鼠体重结果显示(表3),实验开始时,各组小鼠体重无显著性差异(P>0.05);数周后,M组和ME组小鼠体重增长快速,至第9周末,M组小鼠体重显著高于C组(P<0.05),ME组体重较M组没有显著性差异(P>0.05);实验结束时,M组体重较C组显著升高(P<0.05);ME组体重较M组显著降低(P<0.05),CE组体重较C组没有显著性差异(P>0.05)。肝湿重和肝指数(肝指数=肝湿重/体重)结果显示,M组肝湿重和肝指数较C组显著升高(P<0.05),ME组肝湿重和肝指数较M组显著降低(P<0.05),CE组肝湿重和肝指数与C组比较,没有显著性差异(P>0.05)
Tab.3 Comparisons of the body weight and liver index in mice of each group(±s,n=8)
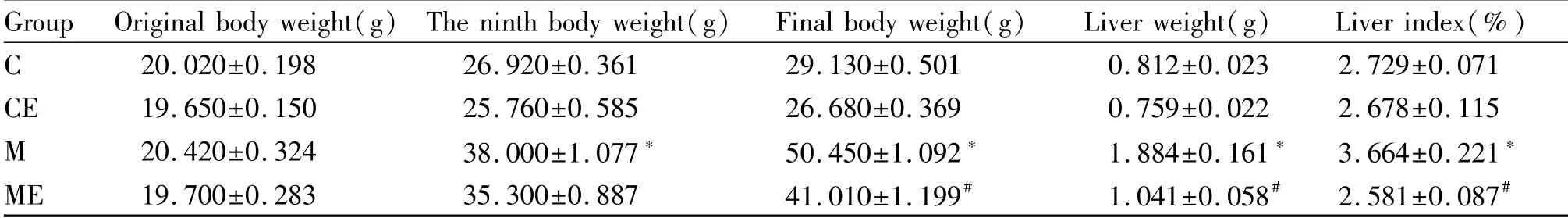
Tab.3 Comparisons of the body weight and liver index in mice of each group(±s,n=8)
C:Control;CE:Control+Exercise;M:Model;ME:Model+Exercise*P<0.05 vs C group;#P<0.05 vs M group
Group Original body weight(g)The ninth body weight(g)Final body weight(g)Liver weight(g) Liver index(%)C 20.020±0.198 26.920±0.361 29.130±0.501 0.812±0.023 2.729±0.071 CE 19.650±0.150 25.760±0.585 26.680±0.369 0.759±0.022 2.678±0.115 M 20.420±0.324 38.000±1.077* 50.450±1.092* 1.884±0.161*3.664±0.221*ME 19.700±0.283 35.300±0.887 41.010±1.199# 1.041±0.058#2.581±0.087#
2.3 各组血液生化指标变化
小鼠血液生化指标结果显示(表4):M组血清ALT、AST、TC、TG和LDL-c含量较C组显著升高(P<0.05),ME组以上指标较M组显著降低(P<0.05);M组血清HDL-c含量较C组显著降低(P<0.05),ME组血清HDL-c含量较M组没有显著性差异(P>0.05);CE组以上血液生化指标与C组比较,没有显著性差异(P>0.05)。
Tab.4 Comparisons of the serum lipid and liver function enzymes in mice of each group(±s,n=8)
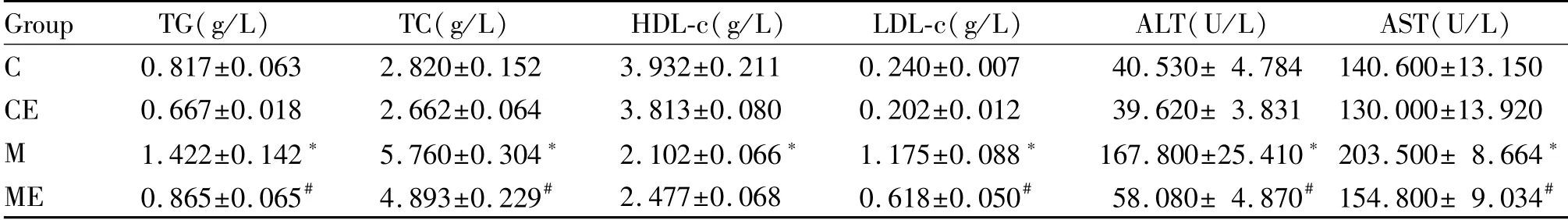
Tab.4 Comparisons of the serum lipid and liver function enzymes in mice of each group(±s,n=8)
C:Control;CE:Control+Exercise;M:Model;ME:Model+Exercise*P<0.05 vs C group;#P<0.05 vs M group
Group TG(g/L) TC(g/L) HDL-c(g/L) LDL-c(g/L) ALT(U/L) AST(U/L)C 0.817±0.063 2.820±0.152 3.932±0.211 0.240±0.007 40.530±4.784 140.600±13.150 CE 0.667±0.018 2.662±0.064 3.813±0.080 0.202±0.012 39.620±3.831 130.000±13.920 M 1.422±0.142* 5.760±0.304* 2.102±0.066* 1.175±0.088* 167.800±25.410*203.500±8.664*ME 0.865±0.065# 4.893±0.229# 2.477±0.068 0.618±0.050# 58.080±4.870#154.800±9.034#
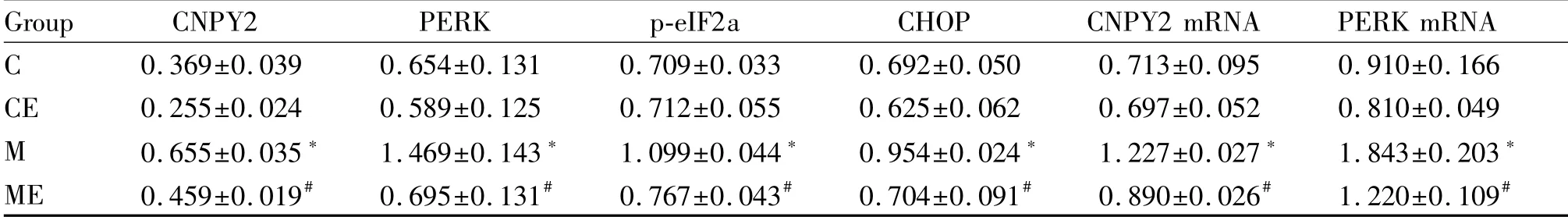
2.4 各组肝组织CNPY2-PERK通路蛋白表达变化
Western blot结果显示(表5,图2):M组CNPY2、PERK、p-eIF2a、CHOP蛋白表达较C组显著升高(P<0.05);ME组以上指标较M组显著降低(P<0.05);CE组以上指标与C组比较,没有显著性差异(P<0.05)。
Tab.5 The relative expressions of CNPY2-PERK pathway in mice of each group(±s,n=6)
Tab.5 The relative expressions of CNPY2-PERK pathway in mice of each group(±s,n=6)
C:Control;CE:Control+Exercise;M:Model;ME:Model+Exercise*P<0.05 vs C group;#P<0.05 vs M group
Group CNPY2 PERK p-eIF2a CHOP CNPY2 mRNA PERK mRNA C 0.369±0.039 0.654±0.131 0.709±0.033 0.692±0.050 0.713±0.095 0.910±0.166 CE 0.255±0.024 0.589±0.125 0.712±0.055 0.625±0.062 0.697±0.052 0.810±0.049 M 0.655±0.035* 1.469±0.143* 1.099±0.044* 0.954±0.024* 1.227±0.027* 1.843±0.203*ME 0.459±0.019# 0.695±0.131# 0.767±0.043# 0.704±0.091# 0.890±0.026# 1.220±0.109#
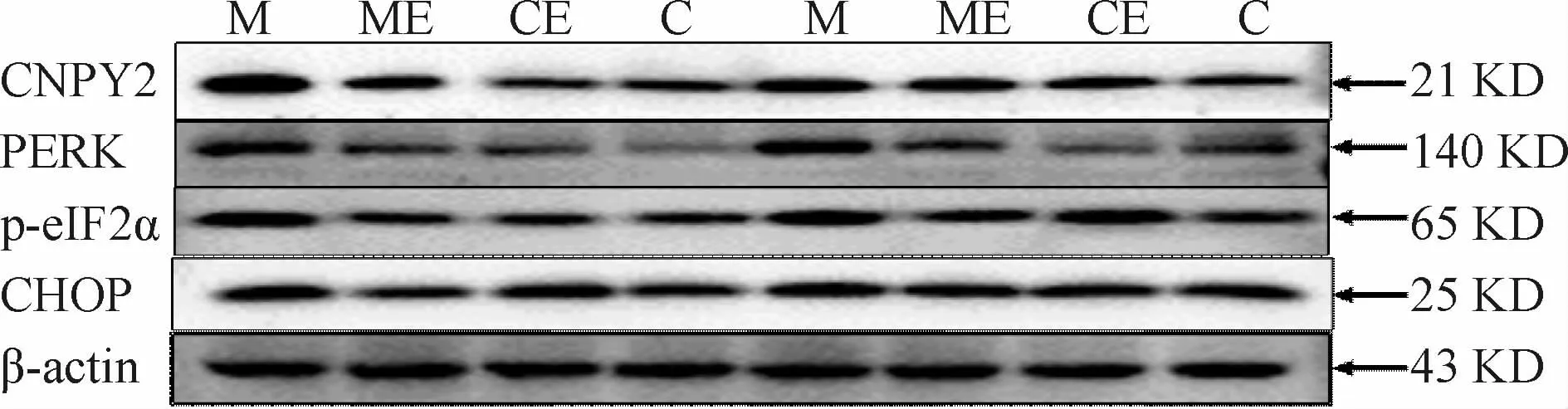
Fig.2 The relative expressions of proteins in CNPY2-PERK pathway
2.5 各组肝组织CNPY2/PERK通路mRNA表达变化
qRT-PCR结果显示(表5):M组CNPY2 mRNA和PERK mRNA表达较C组显著升高(P<0.05);ME组以上指标较M组显著降低(P<0.05);CE组以上指标与C组比较,没有显著性差异(P>0.05)。
2.6 各组肝组织CNPY2、PERK阳性表达变化
免疫组化结果显示:CNPY2和PERK阳性产物主要分布在细胞质及细胞间质,M组各蛋白表达较C组范围广,着色深;ME组各蛋白表达较M组范围少,着色浅;C组和CE组各蛋白表达最少,着色最浅(图3);CNPY2、PERK蛋白阳性表达结果显示,M组CNPY2、PERK蛋白阳性表达较C组显著升高(P<0.05),ME组上述指标较M组显著降低(P<0.05),CE组上述指标与C组比较,没有显著性差异(P>0.05,表6)。
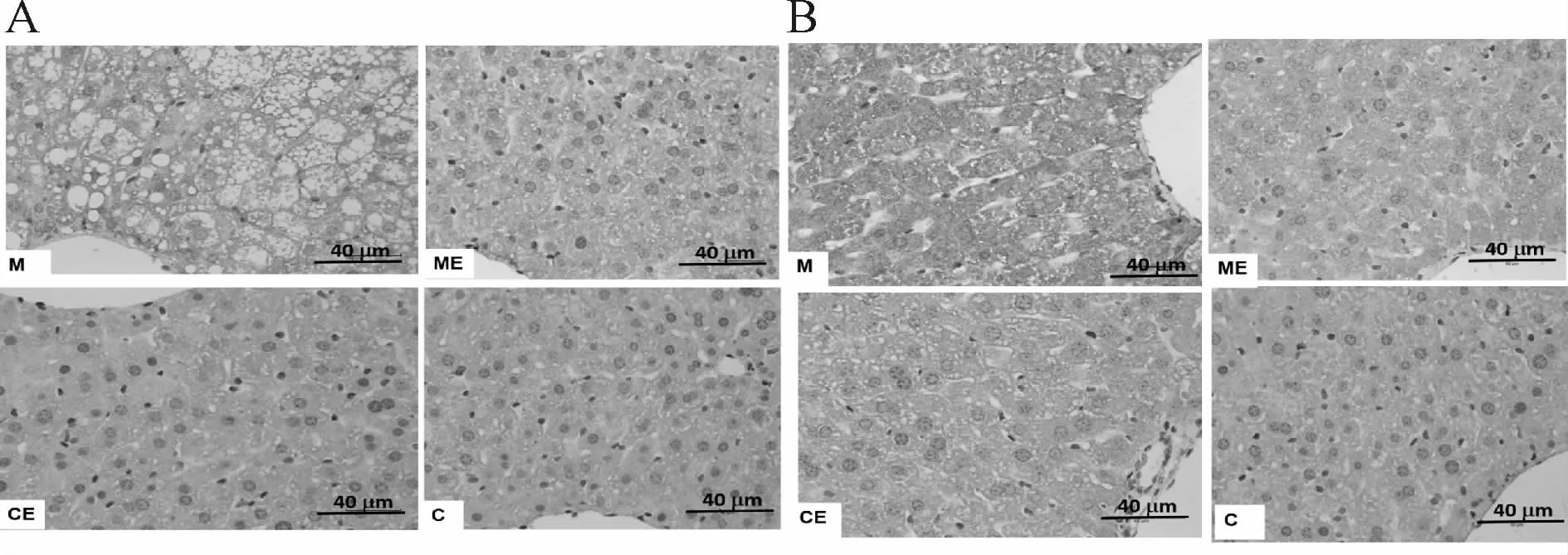
Fig.3 The positive staining of CNPY2 and PERK in mice of each group(Immunohistochemistry,Bar=40μm,×400)
Tab.6 Comparisons of the percentage of positive staining of CNPY2 and PERK in mice of each group(%,±s,n=6)

Tab.6 Comparisons of the percentage of positive staining of CNPY2 and PERK in mice of each group(%,±s,n=6)
C:Control;CE:Control+Exercise;M:Model;ME:Model+Exercise*P<0.05 vs C group;#P<0.05 vs M group
Group The positive staining of CNPY2 The positive staining of PERK C 0.180±0.001 0.240±0.003 CE 0.110±0.001 0.110±0.001 M 0.590±0.005* 2.530±0.007*ME 0.250±0.003# 0.380±0.003*#
3 讨论
NAFLD多发生于40~60岁人群,其主要病理学特征为肝细胞内脂质沉积,早期病理仅为单纯性肝细胞脂肪样变,而中晚期会继发炎性细胞浸润、肝细胞凋亡和坏死。NAFLD最初被认为是一种良性肝病,但现在被认为是代谢综合征在肝脏的表现[12]。临床上NAFLD除了依靠病史、症状、体症进行诊断外,其主要的实验室手段包括血脂和肝功能酶水平检测、肝脏B超、CT、MRI和活检,其中,病理组织学是诊断NAFLD的金标准[13]。本研究采用高脂饮食诱导NAFLD小鼠模型,肝脏病理形态结果显示M组肝细胞脂肪性变和脂滴数量较C组显著增加,提示本研究NAFLD动物模型复制成功。
减少体重被广泛认为是治疗NAFLD最有效的手段之一,而运动常常作为重要的减体重手段[14]。本研究结果显示,有氧运动可有效减缓高脂膳食诱导的体重增加。脂质代谢紊乱是诱发NAFLD的主要因素之一,TC、TG、LDL-c、HDL-c为反映肝脏脂代谢的重要指标[15]。本研究结果显示,高脂膳食诱导血清TC、TG、LDL-c显著升高,HDL-c显著降低,而有氧运动显著降低血清TC、TG、LDL-c水平。研究[7]报道,中低强度有氧运动和递增强度有氧运动均可有效降低血清TC、TG、LDL-c水平,提示运动改善NAFLD脂代谢,不受运动强度或训练方案的影响。研究发现,运动改善脂代谢是影响肝脏脂质沉积的独立因素,与体重变化无关[16]。ALT、AST作为肝损伤的标志性转氨酶,常被作为评价肝损伤的指标。在生理状态下,ALT、AST主要存在于肝细胞胞浆内,当NAFLD产生时,肝细胞膜的结构与功能严重受损,细胞膜通透性增加,ALT、AST进入血液,导致血清ALT、AST水平升高。研究[7]报道,中高强度体育活动和中低强度体育活动可显著降低NAFLD患者血清ALT、AST水平,提示不同强度的运动锻炼均可有效缓解NAFLD肝损伤。
PERK/eIF2a/CHOP信号通路是ERS介导细胞凋亡的主要途径之一,研究[17]发现,PERK/eIF2α通路具有调节脂肪生成和脂肪变性的功能。研究[5]报道,CNPY2敲除可以阻断PERK/eIF2a/CHOP通路,对衣霉素诱导的急性NAFLD和高脂诱导的NAFLD均有较强的保护作用。本研究结果显示,高脂膳食诱导小鼠肝脏CNPY2-PERK信号通路相关分子表达升高,有氧运动显著降低CNPY2-PERK信号通路相关分子表达,提示CNPY2-PERK信号通路参与NAFLD形成,有氧运动有效改善NAFLD,其机制可能与其显著降低CNPY2-PERK信号通路相关分子表达有关。
运动对NAFLD的影响,与运动方式、运动强度和运动量有关。研究[7]报道,有氧运动与抗阻运动改善NAFLD的效果相似,中等强度有氧运动或高强度间歇训练均有效减少肝脏TG,而80%最大摄氧量的大强度运动反而加重NAFLD。本研究结果显示,较长时间的中等强度有氧运动可有效抑制高脂膳食诱导的NAFLD。有趣的是,与C组比较,CE组小鼠肝组织结构、体重、肝指数、血脂和肝功能酶水平、以及肝脏CNPY2-PERK信号通路相关分子表达均未见显著性差异,提示有氧运动可有效减轻NAFLD小鼠病理结构变化,改善NAFLD小鼠血脂紊乱和肝功能酶水平,下调NAFLD小鼠肝脏CNPY2-PERK信号通路相关分子表达,但对于健康小鼠,有氧运动不具上述特点和作用。研究[18]报道,持续6周的跑台训练,无论是低强度,中等强度,递增强度还是大强度,正常大鼠肝脏中PERK的表达均未见显著变化,而长期训练后肝脏中的PERK有明显下降[19]。我们推测,本研究中有氧运动对正常肝脏未有显著性影响,可能与运动时间较短有关。
综上所述,CNPY2-PERK信号通路参与高脂膳食诱导NAFLD的形成。有氧运动可有效改善NAFLD,其机制可能与有氧运动降低CNPY2-PERK通路相关分子表达有关

