时钟基因BMAL1在运动性骨骼肌损伤恢复中的作用*
傅泽铤,夏 雨,丁海丽
(成都体育学院,四川 成都 610041)
生物节律通过时钟基因的表达调控人体各组织器官的机能,时钟基因的表达随着昼夜时间(circadian time,CT)改变而变化,对人体多种生理活动有重要影响。骨骼肌作为外周组织也受时钟基因调控,大脑/肌肉芳香经受体核转位因子样蛋白1(brain and muscle ARNT-like1,BMAL1)作为核心时钟基因,参与肌生成的过程[1];细胞骨架有维持细胞内部结构的功能,可将它分为三种类型的蛋白质纤维,即微丝(microfilament)、微管(microtubule)和中间丝(intermediate-filament)。其中,中间丝在细胞质内形成一个完整的支撑网架系统,在细胞内和细胞间都起着多方面的结构作用。骨骼肌细胞骨架按位置可分为肌小节内骨架、肌小节外骨架和肌细胞膜骨架,肌小节外细胞骨架主要由中间丝构成[2],结蛋白(DESMIN)作为主要的肌肉特异性中间丝,贯穿Z线使肌原纤维连接起来,同时DESMIN也是新肌生成的重要标志[3]。
运动性骨骼肌损伤(exercise-induced muscle damage,EIMD)是骨骼肌在长时间及大负荷运动下,产生的一种骨骼肌纤维损伤。已证实一次性90 min下坡跑步可造成运动性骨骼肌损伤[4]。运动作为一种条件刺激可引起骨骼肌时钟基因相位的改变。研究表明[5,6],小鼠在一天中非活动时间运动可以引起BMAL1的mRNA表达发生变化,计划性运动可影响骨骼肌自身节律表达,使时钟基因相位前移2~3 h,但不影响中枢节律变化;而人类的急性运动也会引起骨骼肌核心时钟基因表达改变[7]。尽管这些研究证明骨骼肌核心时钟基因在运动中表达会发生改变,并且参与新肌生成,但运动诱发的骨骼肌损伤修复过程中的关系尚不明确。基于此,本研究采用一次下坡跑建立大负荷运动大鼠模型,通过分析时钟基因BMAL1的周期性节律表达变化趋势及mRNA表达;观察大负荷运动后骨骼肌肌纤维超微结构;检测BMAL1、DESMIN的蛋白表达;观测二者共定位情况,以此探讨时钟基因BMAL1在运动性骨骼肌损伤恢复中与骨架蛋白DESMIN之间的关系,为肌肉运动能力的恢复以及治疗肌肉相关疾病提供新的思路与实验依据。
1 材料与方法
1.1 实验动物
健康雄性8周龄SPF级SD大鼠共208只,(283.17±4.06)g,购于成都达硕实验动物有限公司。于成都体育学院实验动物房每笼4只分笼饲养,定时训练,室温20~26℃,相对湿度40%~70%,自由饮水饮食。实验室光照与黑暗时间12 h交替,CT0(即光照起始时间)为早8:00开灯;CT12(即光照结束时间)为晚20:00熄灯。实验中动物处置符合国家科学技术部2006年颁布的《关于善待实验动物的指导性意见》相关规定,获得成都体育学院伦理委员会批准。
1.2 实验动物分组与干预方案
将208只实验大鼠随机分为两组,对照组(Control,C,n=104)和运动组(Exercise,E,n=104)。依据时间点进一步分为13亚组(n=8):即刻组(CT0),运动后6 h组(CT6),运动后12 h组(CT12),运动后18 h组(CT18),运动后24 h组(CT24),运动后30 h组(CT30),运动后36 h组(CT36),运动后42 h组(CT42),运动后48 h组(CT48),运动后54 h组(CT54),运动后60 h组(CT60),运动后66 h组(CT66),运动后72 h组(CT72)。
大负荷离心运动方案:参考Armstong离心运动方案[8],使用小动物电动跑台对大鼠进行训练。E组在正式实验前进行适应性跑台训练3 d,第1日坡度0°,速度16 m/min,运动时间5 min;第2日坡度0°,速度16 m/min,运动时间10 min;第3日休息,第4日进行一次持续性下坡跑,坡度-16°,速度16 m/min,运动时间90 min。
1.3 实验标本取样
实验大鼠分别在安静和运动后即刻0 h、6 h、12 h、18 h、24 h、30 h、36 h、42 h、48 h、54 h、60 h、66 h、72 h时分批处死并取材。所有大鼠取材前称量空腹体重,10%的水合氯醛腹腔注射麻醉后开腹分离并剪取腓肠肌,放入冰台上的锡纸,小心去除肌腱和结缔组织。取材过程中,避免肌肉牵拉。把处理后的腓肠肌肌腹分为三段,其中一段大小为1 mm×1 mm×3 mm,然后放入4℃预冷的3%戊二醛固定液,用于透射电镜观察;剩余部分平均分成两段,一段放入4%多聚甲醛溶液中,保存于4℃,用于免疫荧光共定位观测;另一段用锡纸包裹后放入液氮迅速降温,然后保存于-80℃,用于Western blot法及实时荧光定量PCR检测。
1.4 透射电子显微镜观察骨骼肌纤维超微结构变化
将腓肠肌1)戊二醛固定;2)四氧化锇再固定;3)丙酮脱水;4)树脂包埋;5)制备切片;6)JEM-1400透射电镜观察。采用透射电镜(型号JEM-1400PLUS,日本电子(JEOL)生产)观察腓肠肌的肌原纤维特征,包括肌小节排列顺序、肌节明/暗带分布情况、线粒体改变情况。先将骨骼肌切段后样品预固定(3%戊二醛)后再固定(1%四氧化锇),经丙酮逐级脱水,按比例设置脱水剂的浓度(在100%浓度中更换3次),处理后的骨骼肌样品使用脱水剂,后经过环氧树脂包埋,制备约50 nm切片后,漂浮于刀槽液面上,再捞至铜网,分别通过醋酸铀和枸橼酸铅双染色10~15 min和1~2 min,透射电镜观察采图。
1.5 实时荧光定量PCR检测核心时钟基因mRNA表达
将100 mg组织在液氮中磨碎加入1 ml已预冷的Trizol,依次采用氯仿、异丙醇、75℅乙醇经反复离心分离提纯样本总RNA,经超微量紫外分光光度计和琼脂糖凝胶电泳检测浓度和纯度后,将RNA逆转录合成cDNA。
采用PIKORed 96(美国ThermoFisher生产)实时荧光定量PCR检测BMAL1的mRNA表达水平,所有引物均交由上海生工生物工程技术服务有限公司设计合成,并以ULTRAPAGE纯化。BMAL1的上游引物序列为5′-TGCCACCAATCCATACAC-3′,下游引物 序 列 为5′-TTCCCTCGGTCACATCCTAC-3′;βactin的上游引物序列为5′-GAAGATCAAGATCATTGCTCC-3′,下游引物序列为5′-TACTCCTGCTTGCTGATCCA-3′。使用Thermo Scientific PikoReal软件分析PCR过程各检测样本的CT(Threshold cycle)值。通过2-△△CT计算X相对mRNA表达水平。
1.6 免疫印迹法检测骨骼肌细胞BMAL1、DESMIN的蛋白含量
取适量每周期始末肌肉样本,经过裂解、低温离心收集上清液,用Bradford法蛋白检测试剂盒测定蛋白浓度,并进行蛋白变性处理。使用PAGE凝胶快速制备试剂盒(7.5%)制胶,上样:40μg(10 g/L)蛋白;电泳:稳定电压100 V,15 min;转膜:200 mA转膜1~2 h;封闭PVDF膜2 h。孵育Ⅰ抗的浓度分别为:BMAL1和DESMIN,1∶1 000;GAPDH,1∶10 000。Ⅱ抗孵育稀释浓度为1∶10 000。将PVDF膜平铺到曝光板上,利用ECL发光液显影、定影,最后用天能GIS机箱控制软件2.0对条带进行曝光扫描,结果以目的蛋白相对表达量表示。
1.7 免疫荧光染色标记骨骼肌细胞BMAL1与DESMIN共定位情况(双染)
1)固定好的大鼠腓肠肌组织通过全自动脱水机进行脱水、包埋、切片。2)石蜡切片脱蜡至水:依次将切片放入二甲苯Ⅰ15 min,二甲苯Ⅱ15 min,二甲苯Ⅲ15 min,无水乙醇Ⅰ5 min;无水乙醇Ⅱ5 min,85%酒精5 min,75%酒精5 min,蒸馏水洗;3)抗原修复:将切片浸入柠檬酸盐缓冲液(pH 6.0),微波炉高火加热10 min,停火8 min,中高火再加热10 min;冷却后,PBS洗3次,每次5 min;4)血清封闭:滴加山羊血清封闭液,室温静置20 min;5)滴加一抗,4℃条件静置过夜;6)PBS洗3次,每次5 min;7)滴加二抗,37℃30 min;8)PBS洗3次,每次5 min;9)滴加DAPI,室温孵育10 min;PBS洗3次,每次5 min;10)使用抗荧光衰减封片剂封片。
1.8 统计学处理
应用余弦分析软件circacompare(R package)获取拟合余弦曲线参数,其拟合的余弦函数方程为Y=Mesor+Amplitude×cos(time_Radians-φ),其中Mesor为基线/中值;Amplitude为节律震荡的振幅;φ为峰值相位;time Radians为时间所对应的弧度值。
2 结果
2.1 一次大负荷离心运动对骨骼肌时钟基因节律震荡的影响
结果显示:C组BMAL1基因呈现节律性表达,72 h内共呈现3个完整节律周期。C组拟合余弦函数曲线显示,BMAL1 mRNA于CT 0.25(早上8:25)处于峰值,随后下降到CT 12.25(晚上8:25)为谷值,然后回升至CT 24(24 h,1 d)完成一个周期节律振荡;E组BMAL1基因表达在72 h中节律性丧失,0~24 h节律出现紊乱,24~48 h节律有所恢复,48~72 h与C组相似(图1,表1)。
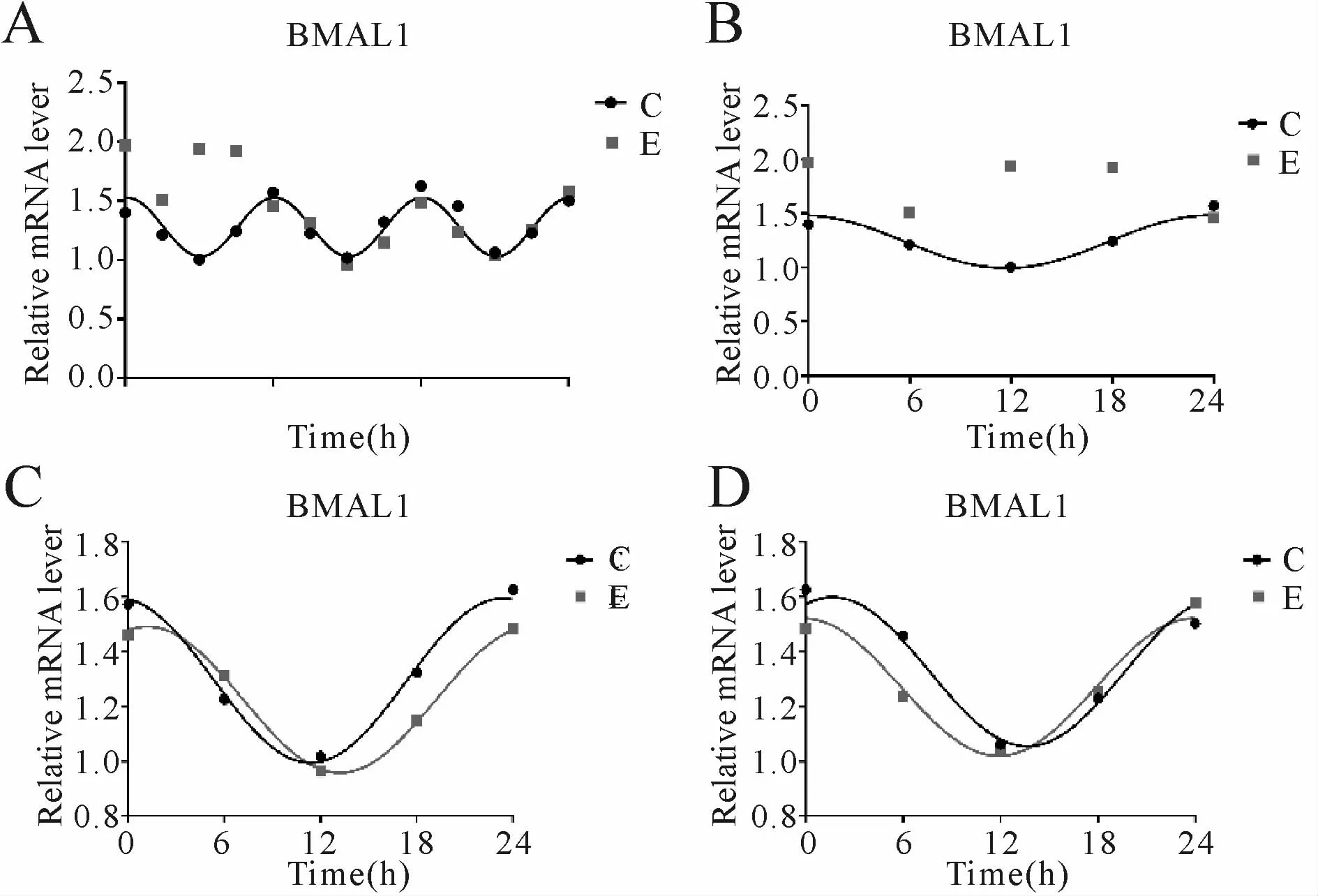
Fig.1 Bmal1 mRNA expression and the rhythmic changes of the fitted cosine function
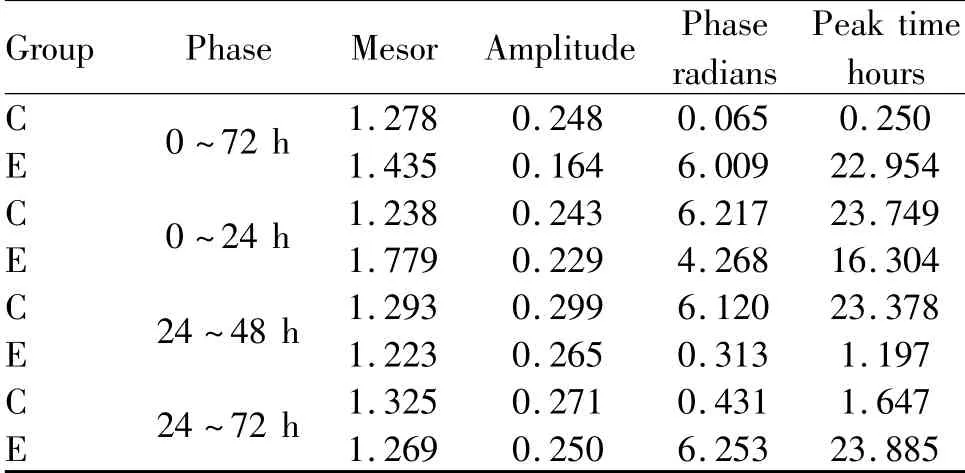
Tab.1 Parameters of BMAL1 mRNA expression in fitting cosine function
2.2 各组对应时相骨骼肌核心时钟基因表达的比较分析
统计结果显示:E组BMAL1 mRNA含量呈现先升高,后趋于正常的状态,在0 h、6 h、12 h和18 h显著高于C组对应时相(P<0.05,表2)。
2.3 一次大负荷离心运动对骨骼肌纤维超微结构变化的影响
C组肌纤维超微结构整齐,肌节均匀,z线清晰,肌原纤维排列整齐,线粒体分布均匀,形态正常。E组运动后0 h,肌节变宽,z线模糊不清呈水波状,肌原纤维断裂、扭曲,间隙增大;12 h组,肌纤维大面积溶解,整个视野内无法看清整齐的肌原纤维和肌节,z线消失;24 h组,肌原纤维弯曲,排列不规则,间隙依然比较大;48 h组,骨骼肌超微结构扭曲的形态开始恢复;72 h组,骨骼肌超微结构扭曲的形态基本恢复(图2)。
Tab.2 The relative expressions of BMAL1 mRNA at different phases after a high-load exercise(±s,n=8)
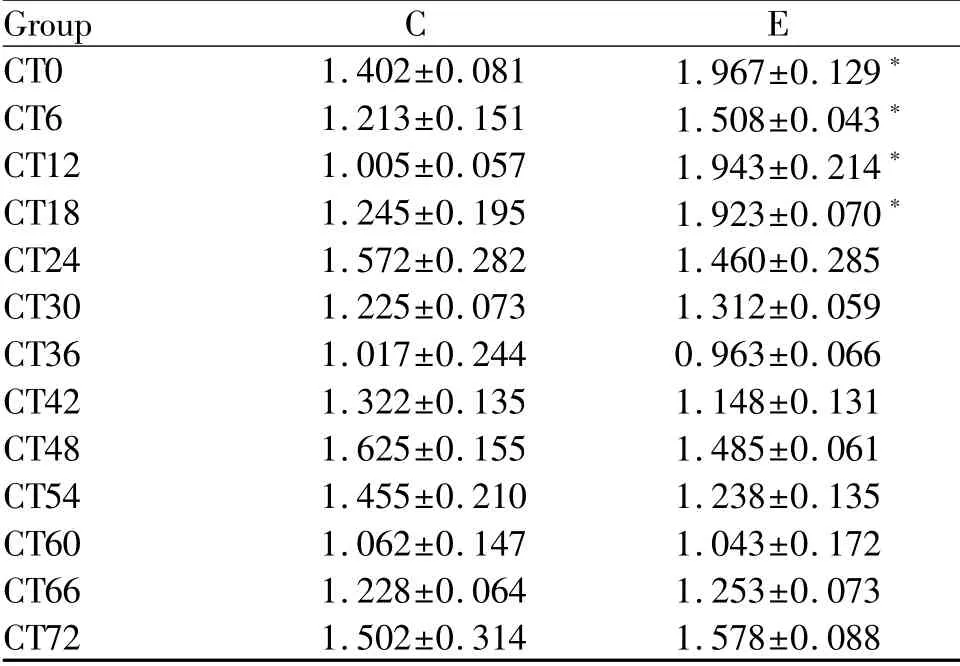
Tab.2 The relative expressions of BMAL1 mRNA at different phases after a high-load exercise(±s,n=8)
*P<0.05,**P<0.01 vs control group at the same phase
Group C E CT0 1.402±0.081 1.967±0.129*CT6 1.213±0.151 1.508±0.043*CT12 1.005±0.057 1.943±0.214*CT18 1.245±0.195 1.923±0.070*CT24 1.572±0.282 1.460±0.285 CT30 1.225±0.073 1.312±0.059 CT36 1.017±0.244 0.963±0.066 CT42 1.322±0.135 1.148±0.131 CT48 1.625±0.155 1.485±0.061 CT54 1.455±0.210 1.238±0.135 CT60 1.062±0.147 1.043±0.172 CT66 1.228±0.064 1.253±0.073 CT72 1.502±0.314 1.578±0.088
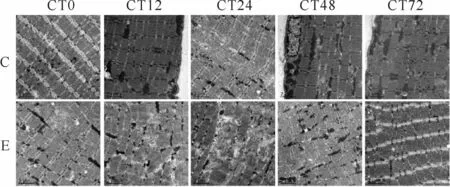
Fig.2 Skeletal muscle myofibrils of rats under high power electron microscopy
2.4 一次大负荷离心运动对骨骼肌BMAL1、DESMIN蛋白表达的影响
BMAL1蛋白表达统计结果显示,与C组相比,E组BMAL1蛋白表达在运动后0 h、12 h显著上升(P<0.05),24 h至72 h恢复至与C组无明显差异(图3,表3)。DESMIN蛋白表达统计结果显示:与C组相比,E组DESMIN蛋白表达在运动后0 h、12 h显著下降(P<0.05);24 h开始逐渐升高,48 h表达达到最高,与C组存在显著性差异,至72 h与C组相比无显著性差异(P>0.05,图3,表4)。
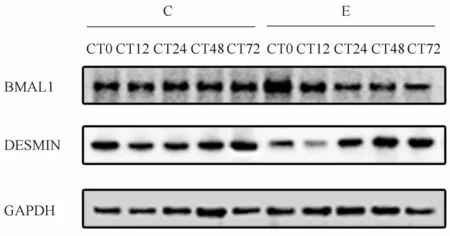
Fig.3 The protein expressions of BMAL1 and DESMIN after a high-load exercise
2.5 一次大负荷离心运动后骨骼肌细胞BMAL11与DESMIN共定位变化
免疫荧光共定位结果显示:C组五个时相Pear-son系数小于0.5,Overlap系数小于0.6,均不存在共定位现象(图4,表5);与C组相比,E组在运动后0h的Pearson系数为0.822022、Overlap系数为0.819980,12h的Pearson系数为0.888031、Overlap系数为0.889843,24 h的Pearson系数为0.831670、Overlap系数为0.832746,说明存在共定位现象;48 h的Pearson系数大于0.5,但Overlap系数小于0.6,72 h的Pearson系数小于0.5,Overlap系数小于0.6,说明不存在共定位现象。0~24 h共定位呈现先降低后升高的趋势,24 h的荧光强度达到最高值(图5,表5,6)。
Tab.3 The relative expressions of BMAL1 protein at different phases after ahigh-load exercise(±s,n=8)
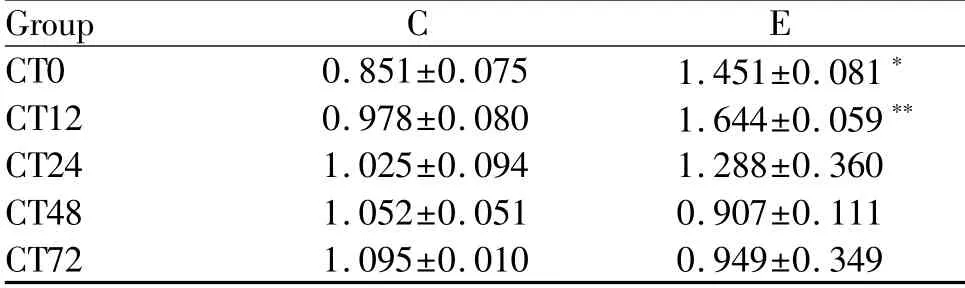
Tab.3 The relative expressions of BMAL1 protein at different phases after ahigh-load exercise(±s,n=8)
*P<0.05,**P<0.01 vs control group at the same phase
Group C E CT0 0.851±0.075 1.451±0.081*CT12 0.978±0.080 1.644±0.059**CT24 1.025±0.094 1.288±0.360 CT48 1.052±0.051 0.907±0.111 CT72 1.095±0.010 0.949±0.349
Tab.4 The relative expressions of DESMIN protein at different phases after ahigh-load exercise(±s,n=8)

Tab.4 The relative expressions of DESMIN protein at different phases after ahigh-load exercise(±s,n=8)
*P<0.05,**P<0.01 vs control group at the same phase
Group C E CT0 1.036±0.062 0.687±0.012*CT12 0.784±0.010 0.426±0.054**CT24 0.958±0.088 1.009±0.030 CT48 1.032±0.005 1.339±0.038**CT72 1.255±0.118 1.308±0.074
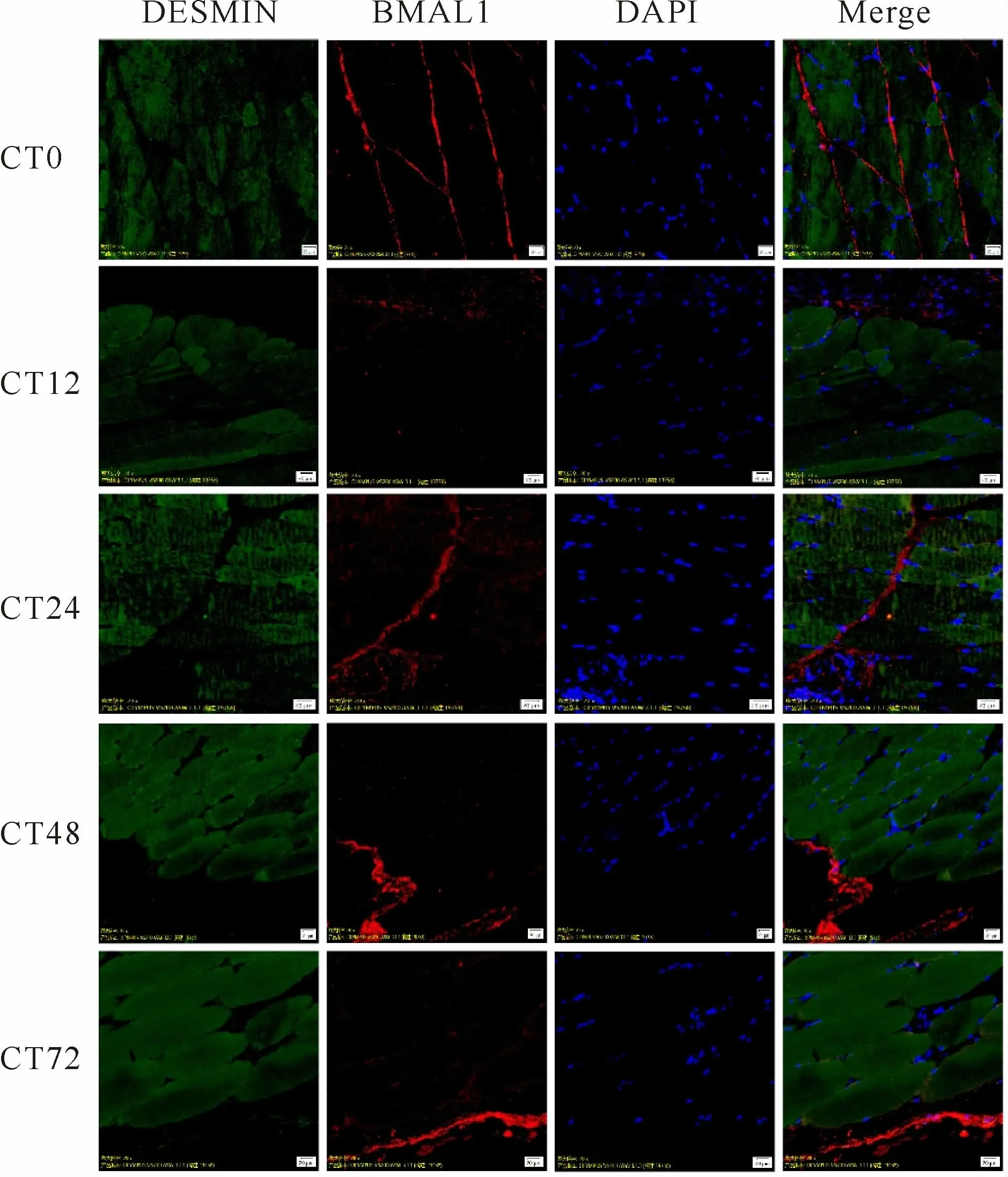
Fig.4 Co-localization of BMAL1 and DESMIN aggregates at different phases at Group C after a high-load exercise
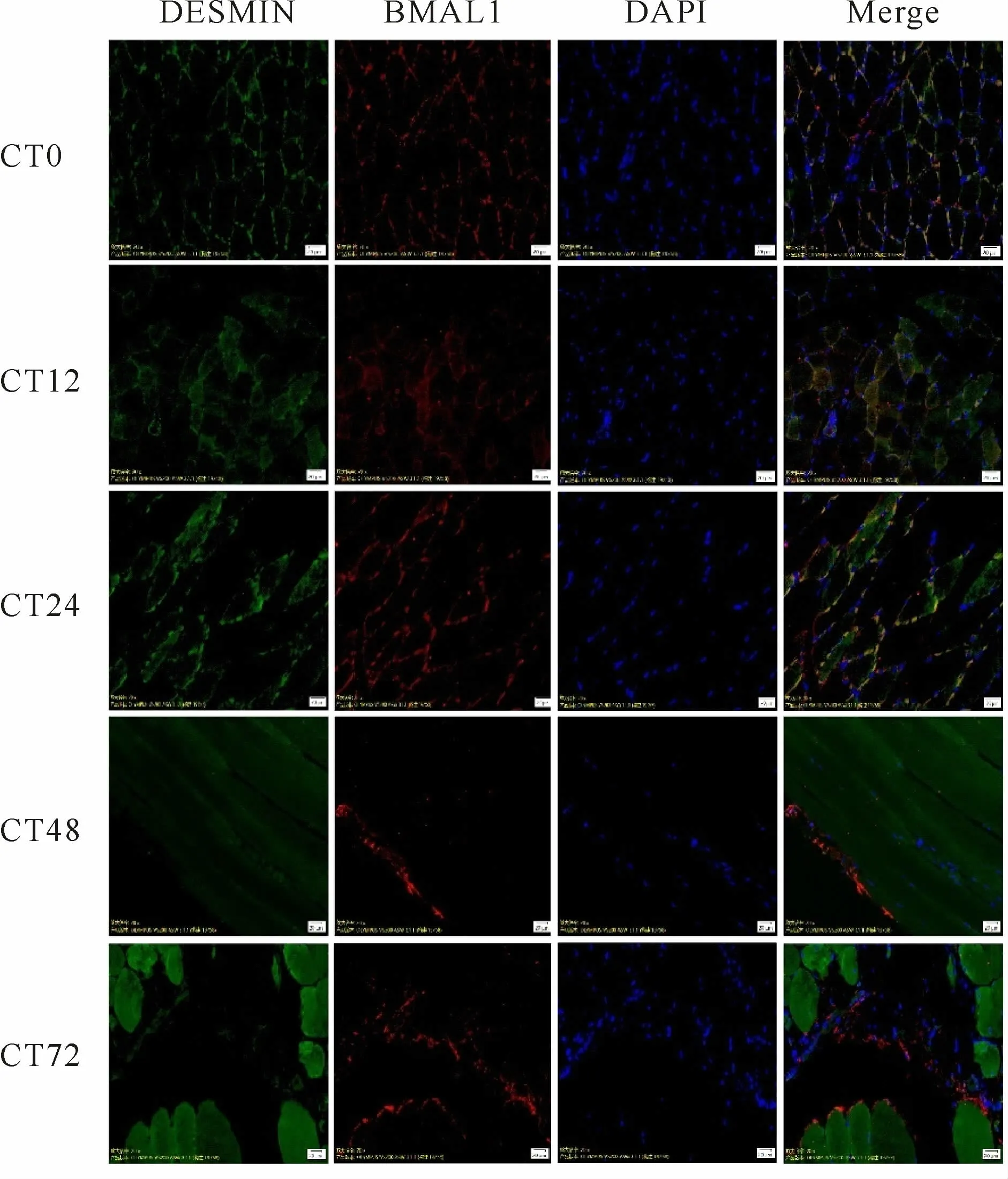
Fig.5 Co-localization of BMAL1 and DESMIN aggregates at different phases at Group E after a high-load exercise
Tab.5 The Pearson's correlation and overlap coefficient of colocalization of BMAL1 and DESMIN(±s,n=8)

Tab.5 The Pearson's correlation and overlap coefficient of colocalization of BMAL1 and DESMIN(±s,n=8)
Group Phase Pearson's correlation(Rr)Overlap coefficient(R)C E CT0 0.375368 0.402997 0.822022 0.819980 C E CT12 0.216996 0.239659 0.888031 0.889843 C E CT24 0.462627 0.496067 0.831670 0.832746 C E CT48 0.302091 0.319237 0.528399 0.411978 C E CT72 0.425345 0.430837 0.347045 0.383269
Tab.6 Immunofluorescence intensity of light BMAL1 and DESMIN after a high-load exercise(±s,n=8)
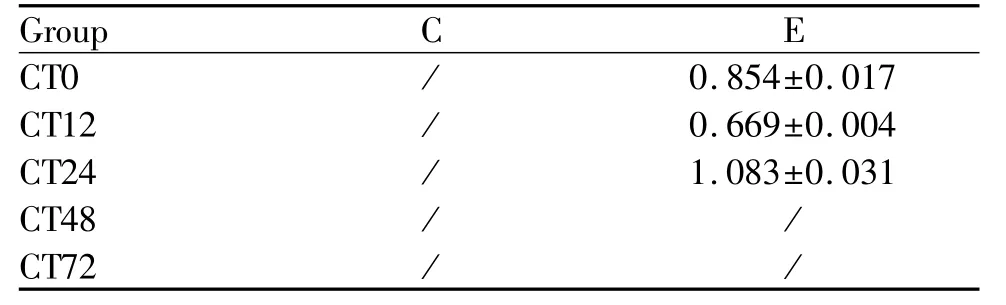
Tab.6 Immunofluorescence intensity of light BMAL1 and DESMIN after a high-load exercise(±s,n=8)
Group C E CT0 / 0.854±0.017 CT12 / 0.669±0.004 CT24 / 1.083±0.031 CT48 / /CT72 / /
3 讨论
骨骼肌具有内在固有的周期性昼夜节律,该节律由时钟基因驱动产生。啮齿动物的日常作息为昼伏夜出,活跃时期一般在夜间,研究发现小鼠夜间晚期运动优于夜间早期[9];对人体骨骼肌活检发现,时钟基因BMAL1在CT12到CT24期间,mRNA表达上升达到峰值[10],形成约24 h周期循环。运动作为一种授时因子可影响骨骼肌节律变化,同时受到骨骼肌固有时钟的调控。研究表明,昼夜节律紊乱模型小鼠的运动能力比正常小鼠显著降低,而运动可通过改变骨骼肌节律来恢复肌肉正常的代谢功能[11,12]。本研究对未施加干预的C组SD大鼠骨骼肌BMAL1 mRNA进行检测,并获取拟合余弦曲线参数分析其变化趋势,发现72 h内上述基因均呈现3个完整近日节律周期,即昼夜节律振荡。进一步分析其振荡曲线的峰值与谷值,发现C组BMAL1 mRNA在CT0到CT12期间由波峰降至波谷,在CT12到CT24期间回升至波峰,而E组BMAL1 mRNA在运动后第1日(0 h~24 h)出现近日节律消失,第2日(24 h~48 h)和第3日(48 h~72 h)基本恢复,表明一次大负荷运动可诱发骨骼肌核心时钟基因节律振荡紊乱。
下坡跑步作为一种全身性运动,因可使肌肉产生离心运动而广泛用于研究肌肉损伤的生理变化。一次大负荷运动可诱发运动性骨骼肌损伤[4],导致骨骼肌纤维超微结构发生改变,骨架蛋白发生降解,肌小节结构破坏,DESMIN纤维丝断裂;Z线模糊、破坏或消失是在离心收缩后肌纤维观察到的典型特征[13]。DESMIN在运动后12 h降解最为显著,大约在运动后48 h表达开始升高,此时重新生成新的肌原纤维[14,15]。在本研究中,骨骼肌在运动性骨骼肌损伤的修复过程中,BMAL1的昼夜节律遭到破坏,其mRNA含量在运动后0 h、6 h、12 h、18 h显著性上升,蛋白表达在运动后0 h、12 h显著性升高,24 h即与C组无明显差异,这与先前的研究结果相符合[16]。DESMIN的蛋白表达在运动后0 h、12 h发生显著性下降,24 h表达逐渐恢复,升高至48 h与C组存在显著性差异,先前的证据也显示骨骼肌细胞在离心运动后的增殖表现出时序性[17]。我们在每个昼夜节律周期始末观察肌纤维超微结构,同时分析比较E组与C组对应时相基因及蛋白表达情况,结果显示E组相比于C组在昼夜节律表达均受到破坏的0 h、12 h、24 h存在显著性差异,同时肌纤维超微结构改变在0 h、12 h、24 h也较为明显;24 h~48 h时BMAL1节律发生偏移,而48 h时刻点的肌纤维超微结构仍有损伤现象,48 h~72 h随着BMAL1昼夜节律的恢复,肌纤维超微结构损伤也明显减轻。提示时钟基因对维持骨骼肌质量及结构具有重要作用,当昼夜节律紊乱时,骨骼肌会发生细胞水平的结构和功能改变,包括最大肌力的降低、肌丝结构紊乱以及线粒体形态的异常[18]。有报道证明[1],骨骼肌损伤后,BMAL1的表达发生上调并且促进卫星细胞的生长,而在BMAL1-/-小鼠模型观察到卫星细胞的再生缺陷,这说明BMAL1是肌肉修复所需的促生肌反应的组成部分。此外,John等学者用转录组确定骨架蛋白同样具有昼夜节律[19]。已有证据显示BMAL1调控MyoD促进肌生成[18],并且MyoD可激活DESMIN的表达[20],这提示大负荷运动后核心时钟基因BMAL1可能通过调控DESMIN蛋白表达从而影响骨骼肌修复过程。
为进一步探究BMAL1与DESMIN的关系,本研究进行免疫荧光共定位,结果显示运动后BMAL1和DESMIN在0 h、12 h、24 h出现共定位,在12 h合光强度达到最低,在24 h达到最高值。我们推测,BMAL1受到运动刺激,自身表达发生上升,虽然它能调控骨骼肌修复和再生,但由于骨骼肌损伤的修复和再生阶段是一个比较复杂的过程,在骨骼肌发生损伤后,其蛋白质合成受抑制而分解加强,出现蛋白质的净降解[15],因此DESMIN在蛋白表达结果上显示为运动后0 h、12 h表达下降,在共定位结果上显示为运动后12 h合光强度最弱;在24 h蛋白质合成率逐渐增加后蛋白表达才显示为上升,在共定位结果上显示为运动后24 h合光强度最强。
综上所述,大负荷离心运动可诱导骨骼肌时钟基因BMAL1节律紊乱,我们初步探讨了时钟基因BMAL1与骨架蛋白DESMIN在大负荷运动后骨骼肌损伤修复过程中存在一定相关性,为恢复肌肉运动能力以及运动员如何缓解高强度训练后时钟基因对身体机能的影响提供了实验依据及参考。但关于BMAL1基因是通过何种途径来调控DESMIN的,其分子机制仍有待进一步的研究验证。

