基于网络药理学分析芪贞元丹治疗动脉粥样硬化的作用机制*
李林芳,吕鑫钰,邱玉玲,孔德新△
(1.天津市天津医院药学部,天津 300200;2.天津医科大学药学院临床药学系,天津 300070;3.天津天狮学院医学院,天津 301700)
动脉粥样硬化(atherosclerosis,AS)所导致的心脑血管疾病是全球范围内位居前列的死亡原因之一[1]。近年来,AS发生率呈逐年增加态势,发病群体也越来越年轻化。
AS的病理过程相当复杂,大量泡沫细胞死亡而裂解成纤维帽,不稳定的斑块碎裂,进而阻塞管腔[2],导致动脉瘤、冠心病、脑梗死等并发症,危害人类健康[3]。
针对动脉粥样硬化临床表现和特点,中医理论体系将之归为“胸痹”、“眩晕”、“中风”、“脉痹”等证,近年来有关于“毒邪致病”的理论报道[4]。中医药界在此基础上辩证论治,把防治AS的常见中药总结为如下几种:清热解毒类、补益类、活血化瘀类。芪贞元丹是一个用于治疗高血脂和动脉粥样硬化的临床验方,含黄芪、女贞子、延胡索与丹参,其中黄芪与女贞子为补益组分,补益正气,增强体质,抵御外邪;延胡索和丹参为活血组分,通利血脉、促进血行、消散瘀血。补益组分中黄芪为补气要药,适用于补气升阳,固表止汗,行滞通痹,托毒排脓等;女贞子为补阴药,用于滋补肝肾,明目乌发。活血组分中的延胡索为活血镇痛药,用于活血,行气,镇痛;丹参是活血凉血药,用于活血祛瘀,通经止痛,清心除烦,凉血消痈。
经过文献挖掘研究表明,黄芪可以提高人外周血管内皮祖细胞(endothelial progenitor cells,EPCs)的增殖、增强其迁移能力、黏附能力[5];女贞子能降低实验动物血清中的胆固醇和甘油三酯水平,从而消减AS斑块,并降低AS发生率[6];延胡索则对实验动物动-静脉旁路诱发的血栓有抑制作用[7];丹参能减少动脉粥样硬化的实验动物主动脉血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)的表达[8]等。大量实验研究为芪贞元丹治疗AS提供佐证,但中药复方化学成分复杂,芪贞元丹是如何协同多成分、多靶点、多途径对抗AS的,仍需进一步探讨。
本研究利用网络药理学研究手段具有整体性、系统性的这一特征,并结合传统中医学的辨证论治理论,进一步发掘芪贞元丹组方治疗AS的作用机制。
1 材料与方法
1.1 实验材料
中药系统药理学数据库TCMSP(https://tcmspw.com/tcmsp.php)、UniProt数 据 库(https://www.uniprot.org/)、OMIM(https://omim.org/)、GeneCards(www.genecards.org/)、TTD(http://db.idrblab.net/ttd/)、STRING数据库(https://stringdb.org/)、Cytoscape3.8.0软件、Metascape(http://metascape.org/gp/index.html)。
1.2 芪贞元丹初选化学成分和靶点的筛选
运用数据库TCMSP(https://tcmspw.com/tcmsp.php)获取芪贞元丹复方中四味中药全部化学成分,以OB≥30%和DL≥0.18为标准进行筛选,得到的化学成分可能具有对抗AS的作用,作为芪贞元丹复方的初选化学成分,并查询初选化学成分所对应的靶点蛋白名。
1.3 药物靶点的标准化
在UniProt数 据 平 台(https://www.uniprot.org/)上检索芪贞元丹靶点蛋白名,校正物种来源为Human,将蛋白名进行基因名标准化。
1.4 AS疾病靶点的预测
运用OMIM(https://omim.org/)数据库系统、和TTD(http://db.idrblab.net/ttd/)数据库系统,以疾病名称“atherosclerosis”搜索,分别删除重复项,以Excel形式存档备用;运用GeneCards(www.genecards.org/)数据库系统,以疾病名称“atherosclerosis”搜索,根据数据库中“relevance score”得分排序,选取与AS相关性较大的前1 000个靶点进行研究,以Excel形式存档备用,三个数据库所得数据截止时间为2020年7月,将三个数据库的搜索结果合并后再次删除重复项,获取与AS相关的疾病靶点。
1.5 芪贞元丹治疗AS的作用靶点预测
利用Venny2.1(http://bioinfogp.cnb.csic.es/tools/venny)对1.3和1.4所得数据求交集,获得芪贞元丹-AS共同靶点,作为作用靶点。
1.6 “药物-活性成分-作用靶点”网络的构建
1.5中作用靶点所对应的初选化学成分,为最终对抗AS的活性成分,将活性成分、作用靶点分别以Excel形式存档,整理好对应关系,导入Cytoscape 3.8.0软件,构建“药物-活性成分-作用靶点”网络图。
1.7 芪贞元丹治疗AS的作用靶点PPI网络的构建
利用STRING数据平台对芪贞元丹治疗AS的作用靶点进行PPI网络作用分析,物种限定为“Homo sapiens”,置信度分值为0.4,用Cytoscape 3.8.0进行可视化分析。
1.8 GO功能分析与KEGG通路富集分析
将作用靶点上传至Metascape(http://metascape.org/gp/index.html)数据库,筛选要求是Log10(P)<0.1,并把GO生物过程和KEGG信号通路按P-Value[-Log10(P)]值大小排序,选取数值较大的前20位。
1.9 “活性成分-作用靶点-KEGG信号通路”网络构建
建立“活性成分-作用靶点-KEGG通路”网络。以电子表格的形式上传至Cytoscape3.8.0进行网络可视化。
2 结果
2.1 芪贞元丹活性成分的筛选
检索得到:黄芪的初选化学成分20个、女贞子的初选化学成分13个、延胡索的初选化学成分49个、丹参的初选化学成分65个,合并重复成分后共获得143个初选化学成分,再输入TCMSP数据库后,共获得271个药物靶点,其中,有255个靶点通过UniProt数据平台成功转换为基因名。
2.2 疾病靶点的筛选
利用OMIM(https://omim.org/)数据库系统、GeneCards(www.genecards.org/)数据库系统和TTD(http://db.idrblab.net/ttd/)数据库系统,以疾病名称“atherosclerosis”为关键词进行检索,OMIM检索到AS疾病靶点484个,GeneCards筛选得到AS疾病靶点1 000个,TTD检索到AS疾病靶点22个,合并后去掉重复项后共获得1364个疾病靶点。
2.3 药物治疗AS作用靶点的预测
利用Venny 2.1绘制韦恩图,得到芪贞元丹与AS共有靶点蛋白共118个,作为芪贞元丹组方治疗AS的作用靶点(图1)。
2.4 “药物-活性成分-作用靶点”网络的构建
在“药物-活性成分-作用靶点”网络中,共包含245个节点,1 501条边,其中,代表药物的节点4个,代表活性成分的节点123个,代表作用靶点的节点118个。药物、活性成分、作用靶点之间通过“边”相关联,黄芪中的14个活性成分与103个作用靶点相关联,女贞子中的8个活性成分与97个作用靶点相关联,延胡索中49个活性成分与103个作用靶点相关联,丹参中56个活性成分与64个作用靶点相关联,复方中每个活性成分平均作用于11.20个作用靶点,每个作用靶点关联的活性成分为5.04个,表明药物的活性成分与作用靶点之间存在着一对多的对应关系,而作用靶点也同时存在于多个活性成分中。活性成分中木犀草素为丹参、女贞子所共有,槲皮素为黄芪、女贞子、延胡索所共有,山奈酚为黄芪、女贞子所共有,并且通过计算Degree值,可知这三种活性成分相关联的作用靶点最多,见表1(Degree值前十位),表明这三种活性成分具有关键作用。
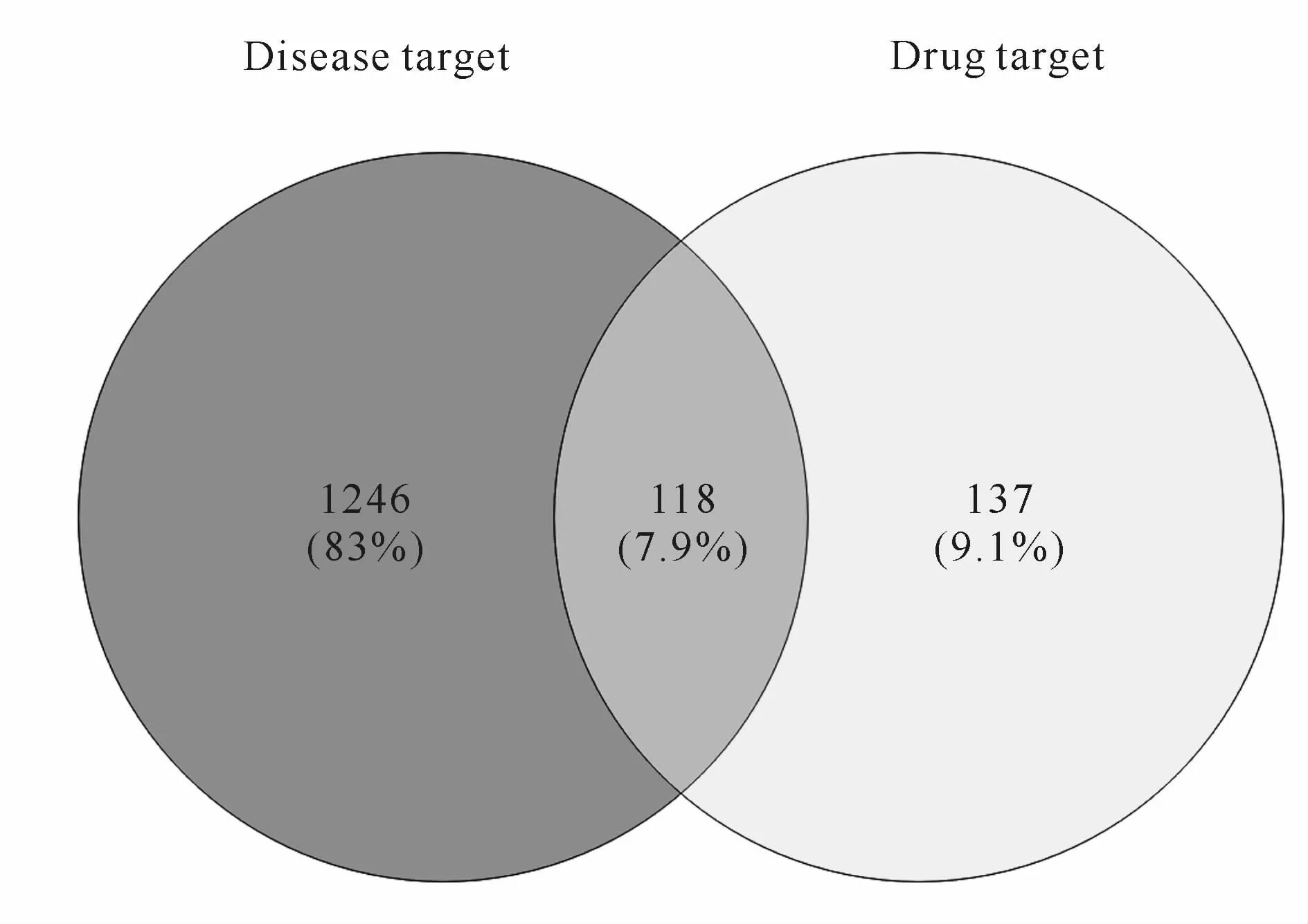
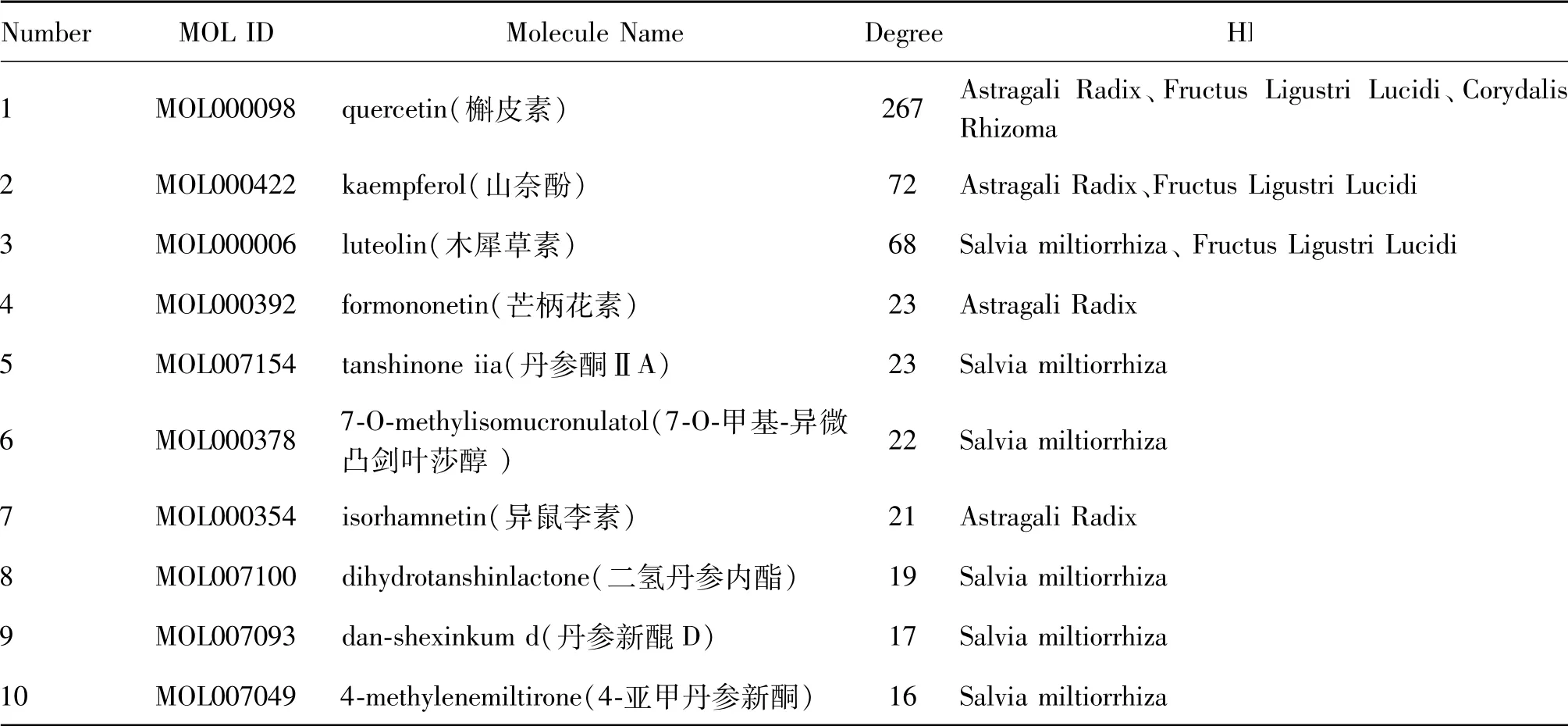
Fig.1 Venn diagram of targets of herbs and diseaseTab.1 The key active ingredients in QiZhenYuanDan and their Degree values
2.5 药物治疗AS作用靶点PPI网络的构建
将118个作用靶点上传至STRING数据库平台,以收集蛋白互作关系相关数据,然后通过Cytoscape 3.8.0软件绘制PPI网络图,并通过Degree值调节节点大小(图2)。节点图形越大,表示与之产生互作关系的的靶点越多,边越粗,表示靶点蛋白之间的相互作用越强。

Fig.2 PPI network of active targets
根据度值排序,选取排在前十位的靶点,见表2,再次运用Cytoscape 3.8.0构建PPI网络,这十个靶点可能为芪贞元丹组方治疗AS的关键靶点(图3)。
2.6 GO生物过程和KEGG通路富集分析
利 用Metascape(http://metascape.org/gp/index.html)数据平台,分析芪贞元丹-AS作用靶点的GO生物过程和KEGG信号通路富集过程。

Tab.2 Top 10 targets of degree in PPI network
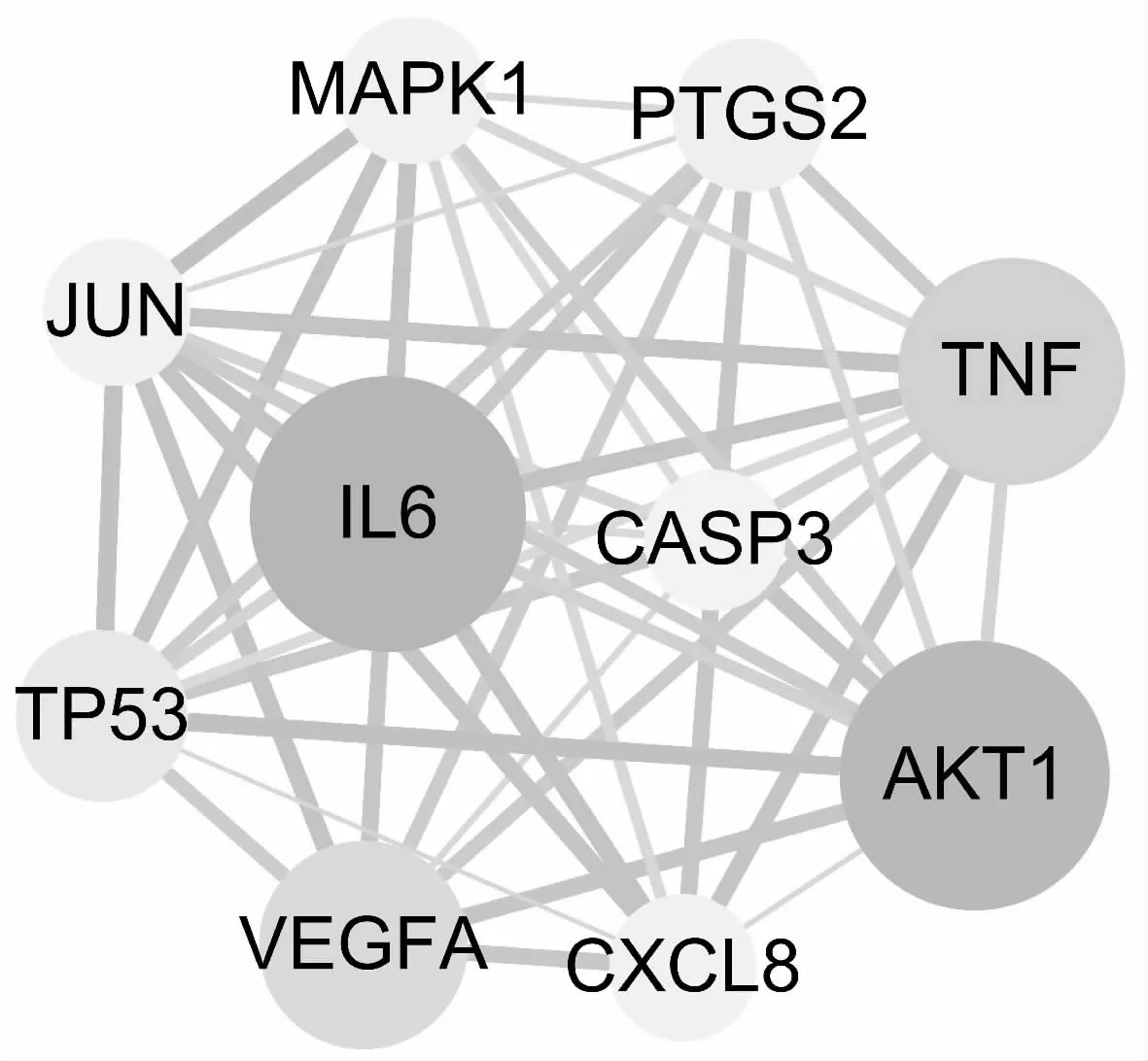
Fig.3 PPI network of key targets
将118个作用靶点上传至Metascape数据库,然后依次进行GO Biological Processes(生物过程)、GO Cellular Components(细胞组成)、GO Molecular Functions(分子功能)分析,根据P-Value[-Log10(P)]值由大至小的排序,最后选取前20个GO生物过程分析条目,并将其上传至易汉博生物信息平台(http://www.ehbio.com/ImageGP/index.php/Home/Index/GOenrichmentplot.html)进行数据可视化处理(图4)。GO分析结果提示芪贞元丹治疗AS的作用靶点显著富集在对无机化合物的反应、对脂多糖的反应、对有毒物质的反应、细胞对脂质的反应等生物过程中(图4A);分子功能主要在细胞因子受体结合、转录因子结合、蛋白酶结合、蛋白质结构域特异性结合等过程中有所体现(图4B);在细胞组成中膜筏、囊泡、RNA聚合酶Ⅱ转录因子复合物、受体复合物、细胞外基质等占比最大(图4C)。
同样,共获得155条KEGG信号通路,根据PValue[-Log10(P)]值从大到小的顺序,选取前20个KEGG信号通路上传至易汉博生物信息平台,得到KEGG的气泡图(图5)。分析气泡图显示,KEGG显著富集在细胞流体切应力与动脉粥样硬化等疾病相关信号通路以及磷脂酰肌醇3激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)-蛋白激酶B(protein kinase B,AKT)、缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)、核转录因子κB(nuclear factorκB,NF-κB)等信号通路上。富集结果表明,芪贞元丹可能通过上述信号通路发挥治疗作用。
2.7 “活性成分-作用靶点-KEGG信号通路”网络构建
经整理,将“药物活性成分-作用靶点-KEGG信号通路”互作关系对应匹配,上传至Cytoscape 3.8.0软件可视化,网络图表明,芪贞元丹组方中各活性成分通过“多靶点、多信号通路”协同互作发挥治疗AS的作用。
3 讨论
中医药由于具有整体调节、多靶优效和毒副作用小等优势被广泛应用于AS相关科研与临床实践工作中。网络药理学的分析结果表明,芪贞元丹治疗AS的活性成分主要有10个,分别为槲皮素、山奈酚、木犀草素、芒柄花素、丹参酮ⅡA、7-O-甲基-异微凸剑叶莎醇、异鼠李素、二氢丹参内酯、丹参新醌D、4-亚甲丹参新酮。槲皮素可通过调节PI3K-Akt、NF-κB p65等信号通路抑制细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)和白细胞介素-6(interleukin-6,IL-6)的表达,改善血管内皮细胞功能,降低AS中的炎症反应,延缓AS过程[9]。山奈酚可减少巨噬细胞衍生趋化因子(macrophage derived chemokine,MDC)、干扰素诱导蛋白-10(interferon induced protein-10,IP-10)、白细胞介素-8(interleukin-8,IL-8)等炎症因子形成,抑制炎症的发生[10];降低动脉血中ICAM-1、VCAM-1、整合蛋白、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)等黏附分子的基因水平和蛋白水平,抑制MAPK信号通路,降低血管炎症反应,具有防止AS发生的潜在功能[11]。木犀草素可以降低臭氧和活性氮类成分的合成,从而影响花生四烯酸的代谢和炎性相关通路的表达[12],同时可以降低的白细胞介素-17(interleukin-17,IL-17)、IL-6等炎症因子的形成,降低丙二醛(malondialdehyde,MDA)的水平[13],发挥抗炎、抗氧化的作用。这几种活性成分在芪贞元丹复方抗AS过程中发挥重要作用。由此可知,芪贞元丹可能是通过其活性成分与靶点、信号通路交互作用,降低AS中的炎症反应,延缓AS发病进程的。
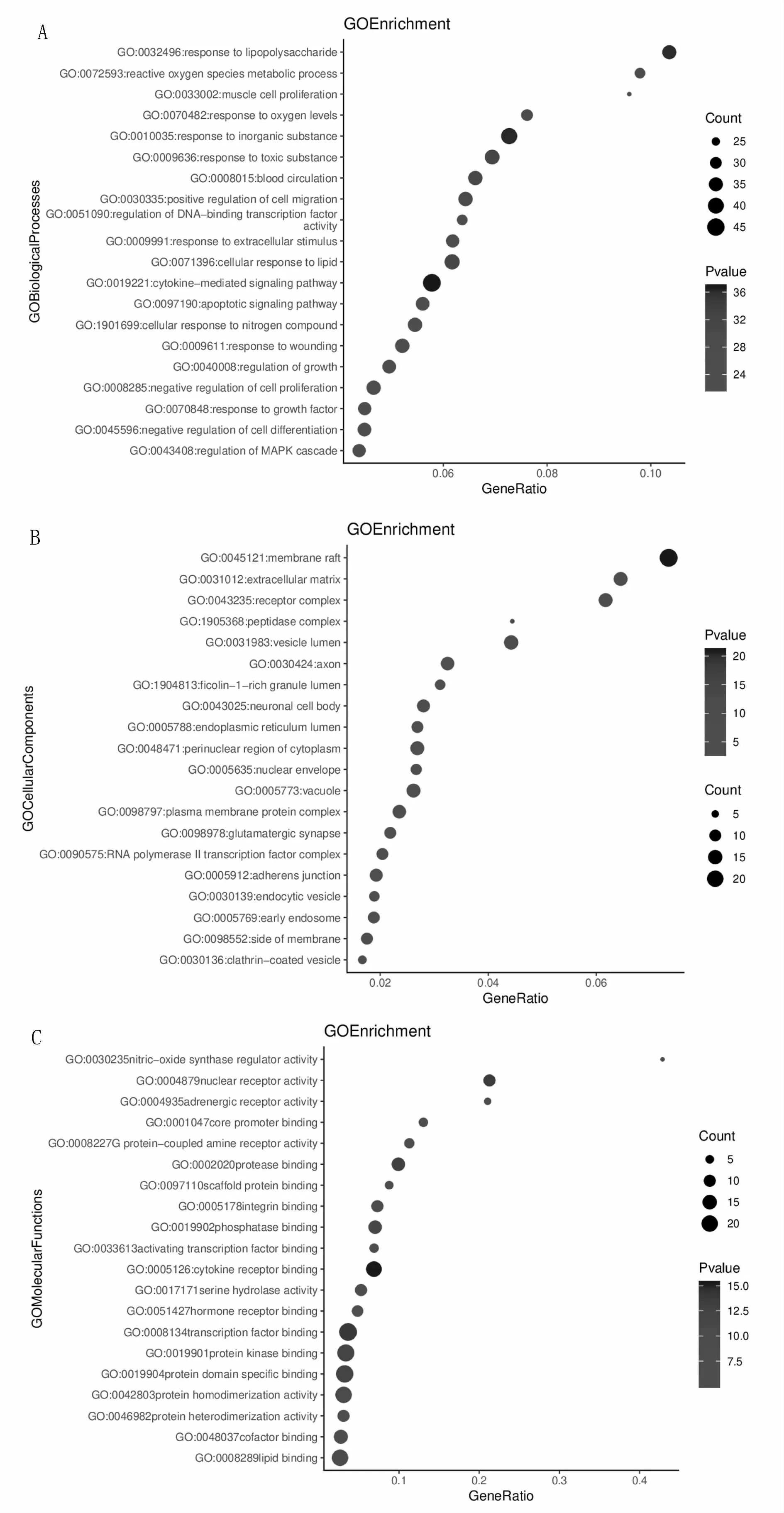
Fig.4 Visualization results of GO pathway enrichment

Fig.5 Visualization results of KEGG signaling pathway
蛋白质相互作用网络研究结果表明,芪贞元丹可能是通过IL-6、蛋白激酶(RAC-alpha serine/threonine-protein kinase,AKT1)、肿瘤坏死因子(tumor necrosis factor,TNF)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)等药物-疾病共有靶点发挥治疗AS作用。白细胞介素-6基因名为IL-6,T细胞、上皮细胞、B细胞及血管内皮细胞等都能分泌IL-6,在AS的发病过程中,IL-6主要参与机体的各种炎症反应[14]。VEGFA可通过作用于炎性细胞和内皮细胞间接参与瘢痕的生成,也可作用于人皮肤成纤维细胞(human skin fibroblast,HSF)直接参与到瘢痕的生成[15]。此外,靶点蛋白互作过程还可能与多种脂蛋白及血管内皮炎性因子等相关,如AKT1、TNF、丝裂原活化蛋白激酶(mitogen-activated protein kinase 1,MAPK1)等,而AS发病过程又与脂质代谢紊乱、炎症反应等相关,证明芪贞元丹作为中药复方,其成分复杂性的特点,使其能通过多分子、多靶点、多途径相互作用发挥抗AS的效果。
结合GO生物过程分析和KEGG富集分析的结果提示,芪贞元丹治疗AS,是多种复杂的生物过程富集在不同信号通路上,各通路共同作用产生的结果。结果显示有PI3K-Akt、NF-κB、HIF-1等信号通路和炎症性肠病(inflammatory bowel disease,IBD)通路等,这些通路都能影响脂代谢、炎症反应、调节细胞凋亡等过程。PI3K-Akt信号通路在细胞中广泛存在,磷酸化活化后,诱发第二信促使AKT磷酸化,磷酸化AKT可以促增殖、抗凋亡,并且能够抑制氧化应激[16]。NF-κB信号通路与机体免疫及炎症反应的关系密切。NF-κB作为一种蛋白复合物,是一种重要的核转录因子,其主要亚型是P50和P65,即NF-κB1和Rel A,通过TNF-α、IL-1、脂多糖(Lipopo-lysaccharide,LPS)等刺激因子的活化,诱导多种相关基因的表达,产生多种细胞因子参与炎症反应[17,18]。HIF-1信号通路是一条重要的信号通路,在集体对低氧代偿的众多调节机制中,HIF-1作为重要的转录因子,在生理和病理条件下,能够调整多种基因的表达,在机体低氧和缺血的状态下发挥保护作用,从而降低心肌酶活性,改善心肌组织形态,抑制心肌细胞死亡,降低心梗面积,改善心肌缺陷再灌损伤效果[19]。此外,KEGG富集结果中Pathways in cancer、Proteoglycans in cancer、Transcriptional misregulation in cancer等癌症相关通路富集较高。有研究表明,内皮损伤反应可能是肿瘤与AS发生的共同诱因,肿瘤细胞浸润血管内皮,损伤血管内皮细胞,当血管内皮受损后,释放组织因子(tissue factor,TF),促进局部血栓形成。同时,肿瘤细胞还能激活凝血系统,致凝血和纤溶功能的异常,凝血活性亢进,外周血中D-二聚体升高,如肺癌、直肠癌、肝癌、卵巢癌等,使患者发生深静脉血栓的风险增加[20]。同时结果显示,与Malaria、Inflammatory bowel disease等信号通路的相关性,提示疟疾、炎性肠病可能与AS的某些信号通路可能是共通的,有共同的致病诱因,也提示我们在研究其抗AS作用的同时应留意可能产生的副作用。
综上所述,本研究从网络药理学角度,分析芪贞元丹治疗AS是多成分—多靶点—多途径协同作用的过程。结果表明,该复方中的槲皮素、山奈酚、木犀草素等活性成分作用于IL-6、PI3K-Akt、VEGFA等靶点,通过抗细胞凋亡、抑制氧化应激、抑制炎症反应等发挥抗AS作用。
利益冲突 所有作者均声明不存在利益冲突

