抹茶对高脂饮食诱导的小鼠肝脏脂质积累和炎症反应的保护作用及机制
周继红,余月儿,丁乐佳,徐平,毛立民,2,王岳飞*
(1.浙江大学农业与生物技术学院茶叶研究所,杭州 310058;2.浙江省茶叶集团股份有限公司,杭州 310058)
肥胖是全球公共性健康问题之一,过多摄入高热量食物已成为肥胖及相关非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)的关键诱因[1]。NAFLD 以肝细胞内过量的脂肪积累为主要临床特征,其发病轨迹可从单纯的脂肪变性蔓延至非酒精性脂肪性肝炎、肝硬化乃至肝癌,成为人类健康的重要威胁[2]。关于肥胖及相关NAFLD 等并发症的明确作用机制和有效诊疗手段是亟待解决的重要科学问题。
绿茶作为一种广泛流行的健康饮品,已被证明具有显著的降脂减肥、降血糖、缓解胰岛素抵抗、改善肝脂肪变性等作用[3-4],绿茶及其提取物也成为防治肥胖相关代谢综合征和NAFLD的有效干预手段,相关作用机制的研究已成为近年来的热点。与传统饮茶方式只能摄入水溶性成分相比,抹茶“吃茶”的食用方法大大提高了茶叶活性成分的摄入率,是一种兼顾滋味和营养的健康食品[5-6]。为明确抹茶在降脂减肥和保肝护肝方面的作用,本研究基于高脂饮食诱导的C57BL/6J肥胖小鼠模型,就抹茶改善肥胖及相关NAFLD的作用机制展开研究,为健康饮茶及抹茶保健功能开发提供实验基础和科学支撑。
1 材料与方法
1.1 材料与试剂
抹茶样品(‘迎霜’‘鸠坑’‘中茶108’和‘茂绿’品种)由浙江骆驼九宇有机食品有限公司提供;雄性C57BL/6J 小鼠(4 周龄,清洁级)购于上海斯莱克实验动物有限责任公司;普通小鼠饲料(D12450J)、高脂小鼠饲料(D12492)购于美国Research Diets 公司;苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒、油红O染色试剂盒购于北京索莱宝科技有限公司;谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase, ALT)检测试剂盒购自上海臻科生物科技有限公司;超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde,MDA)检测试剂盒购自上海碧云天生物技术有限公司;总RNA 提取(Trizol)试剂盒、反转录试剂盒、SYBR 荧光定量聚合酶链反应(polymerase chain reaction, PCR)试剂盒购自日本TaKaRa公司。
1.2 仪器与设备
TP-214 电子分析天平(美国丹佛仪器公司);HH-6 数显恒温水浴锅(江苏省常州澳华仪器有限公司);TGL-16M 高速台式冷冻离心机(湖南湘仪动力测试仪器有限公司);5804R 离心机(德国Eppendorf 公司);UV-6100A 紫外可见分光光度计(上海元析仪器有限公司);515 高效液相色谱(high performance liquid chromatography, HPLC)仪(美国Waters 公司);ZRQSV24CN 超纯水仪(美国Thermo Fisher Scientific 公司);血糖仪(美国强生集团);SHZ-IIIA循环水式多用真空泵(上海豫康科教仪器设备有限公司);GZX-9246 MBE 数显鼓风干燥箱(上海博迅实业有限公司医疗设备厂);SpectraMax M5多功能酶标仪(美国加州分子仪器公司);TS100倒置显微镜(日本Nikon 公司);实时荧光定量PCR(real-time quantitative PCR, qRT-PCR)仪(美 国Applied Biosystems公司)。
1.3 实验方法
1.3.1 抹茶主要化学成分测定
抹茶主要化学成分测定根据文献[7]的方法进行,其中含水量测定参考GB 5009.3—2016(《食品安全国家标准 食品中水分的测定》),茶水浸出物含量测定参考GB/T 8305—2013(《茶 水浸出物测定》),茶多酚含量测定参考GB/T 8313—2018(《茶叶中茶多酚和儿茶素类含量的检测方法》),游离氨基酸含量测定参考GB/T 8314—2013(《茶 游离氨基酸总量的测定》),可溶性糖含量测定采用蒽酮硫酸比色法,可溶性蛋白质含量测定采用考马斯亮蓝比色法,儿茶素与咖啡碱含量测定参考GB/T 8313—2018(《茶叶中茶多酚和儿茶素类含量的检测方法》)中HPLC法。
1.3.2 动物实验设计
小鼠于浙江大学实验动物中心SPF级实验室饲养,饲养环境为:温度22~26 ℃,相对湿度40%~70%,12 h/12 h昼夜交替。将25只雄性C57BL/6J小鼠在实验环境条件下适应性饲养7 d后随机均分为5组,每组5只,分别饲喂普通饲料(NCD组)、高脂饲料(HFD组)、含0.1%抹茶(‘茂绿’)的高脂饲料(HML组)、含0.5%抹茶的高脂饲料(HMM组)、含1.0%抹茶的高脂饲料(HMH组)。实验期间小鼠自由摄食饮水,每周记录摄食量和体质量,实验周期为8周。8周后禁食12 h,采集小鼠血液,使用血糖仪检测小鼠血糖值。随后麻醉并处死小鼠,剖取肝脏样本并保存,用于后续实验。以上相关实验设计和实施遵循《实验动物 福利伦理审查指南》(GB/T 35892—2018)。
1.3.3 肝脏组织HE 染色
将肝脏组织置于10%甲醛水溶液中固定24 h,石蜡包埋后用石蜡切片机连续切片(厚度为5 μm),按照HE染色试剂盒说明书进行染色。用中性树胶封片后将切片置于显微镜下拍摄图像。
1.3.4 肝脏组织油红O 染色
将肝脏组织用冰冻切片包埋剂包埋后,于-20 ℃条件下制备冰冻切片(厚度为10 μm),按照油红O 染色试剂盒说明书进行染色。用甘油封片后将切片置于显微镜下拍摄图像。
1.3.5 肝脏功能与氧化应激相关指标检测
用组织研磨器将小鼠肝脏组织研磨成匀浆,按照试剂盒说明书检测ALT、AST、SOD活性以及MDA含量。
1.3.6 实时荧光定量PCR 检测基因表达水平
按照Trizol 试剂盒方法提取各组细胞的RNA,使用NanoDrop 超微量分光光度计(美国Thermo Fisher Scientific 公司)测定RNA 浓度。将样品稀释,并根据反转录试剂盒(日本TOYOBO公司)说明书将其反转录为cDNA。适当稀释cDNA,配制SYBR 反应体系:SYBR Green 7.5 μL,引物混合物0.6 μL,ddH2O 5.1 μL,ROX 0.3 μL,cDNA 1.5 μL。以GAPDH为内参,进行肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6)、白介素-1β(interleukin-1β,IL-1β)炎症因子和Toll样受体4(Toll-like receptor 4,TLR4)、MyD88炎症相关通路关键基因的相对表达量分析(各基因引物序列如表1所示)。实时荧光定量PCR扩增程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,45 个循环;95 ℃变性15 s,60 ℃退火1 min,95 ℃延伸15 s。每个样品重复3次,采用2-ΔΔCT法对基因表达进行定量分析。
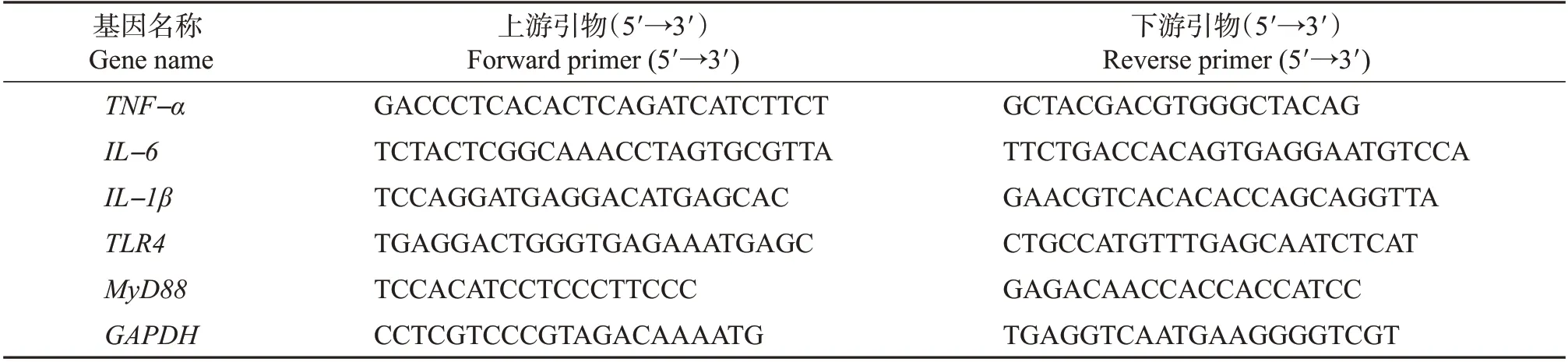
表1 实时荧光定量PCR引物序列Table 1 Primer sequences of qRT-PCR
1.3.7 数据统计与分析
数据采用平均值±标准差的形式表示,通过GraphPad Prism 8.0 进行统计分析和作图。2组间的比较采用t检验,多组间比较采用单因素方差分析和Tukey事后检验,以P<0.05表示差异有统计学意义。
2 结果与分析
2.1 不同品种抹茶主要化学成分含量测定结果
抹茶中主要化学成分含量与抹茶品质和健康功效关系密切。4个茶树品种加工的抹茶成分检测结果如表2所示,从中可知,不同茶树品种加工的抹茶在成分上存在一定的差异。根据GB/T 34778—2017(《抹茶》)[8]中抹茶的含水率≤6%判定,4个品种抹茶均符合要求。水浸出物含量最高的是‘鸠坑’品种,为39.38%;游离氨基酸含量最高的是‘茂绿’品种,为5.14%;可溶性糖含量最高的是‘鸠坑’品种,为5.85%;茶多酚含量最高的是‘茂绿’品种,为12.75%;咖啡碱含量最高的是‘迎霜’品种,为2.47%。
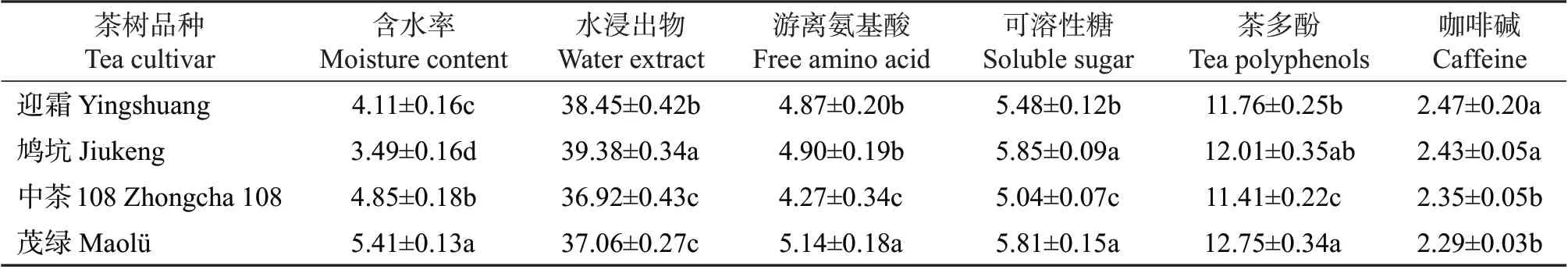
表2 不同品种抹茶主要生化成分含量Table 2 Contents of main biochemical components in matcha made from different tea cultivars %
通过HPLC 法进一步检测儿茶素单体的含量,结果如表3所示。茶叶中儿茶素主要包括非酯型儿茶素和酯型儿茶素。非酯型儿茶素包括没食子儿茶素、表没食子儿茶素、儿茶素、表儿茶素等;酯型儿茶素包括没食子儿茶素没食子酸酯、表没食子儿茶素没食子酸酯[(-)-epigallocatechin gallate,EGCG]、表儿茶素没食子酸酯、没食子酸酯等。4种抹茶样品的儿茶素中EGCG 含量最高,为6.21%~7.48%,其中EGCG含量最高的品种是‘茂绿’,最低的是‘迎霜’。
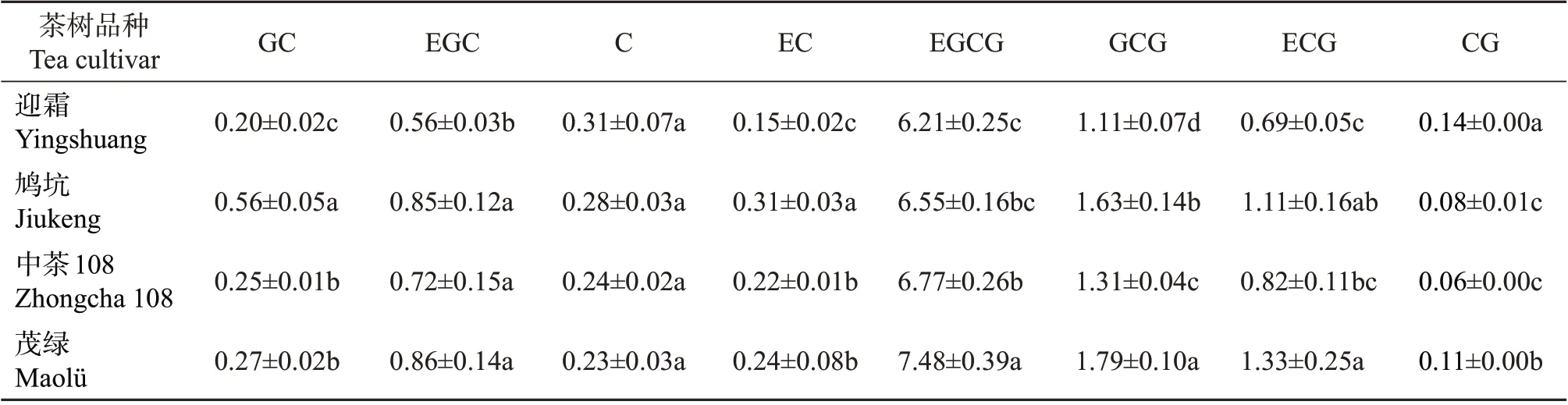
表3 不同品种抹茶儿茶素单体含量Table 3 Catechin monomer contents in matcha made from different tea cultivars %
研究表明,茶多酚和儿茶素(尤其是EGCG)在降脂减肥、改善脂质积累、抑制脂性炎症损伤等方面有突出的功效[9-10]。因此,选择4个品种抹茶中茶多酚和EGCG 含量最高的‘茂绿’用于后续的动物实验和功效探索。
2.2 抹茶对高脂饮食诱导小鼠肥胖的作用
不同饲料喂养8周后,各组小鼠的体质量变化、摄食量、空腹血糖水平如表4 所示。各组小鼠的平均初始体质量没有明显差异,而饲喂8 周后的平均体质量终值与体质量增量在各组间差异显著。其中,以HFD 组的平均体质量终值与体质量增量最大,增量达14.43 g;NCD 组最小,增量仅5.14 g;添加不同含量抹茶的干预组在体质量增量上较HFD组明显减少,说明膳食补充抹茶能够有效缓解高脂饮食诱导的小鼠体质量增加,而且没有造成小鼠平均摄食量的差异。血液生化检测结果也说明,HFD组较NCD 组出现了明显的血糖水平升高,而膳食补充抹茶后能够浓度依赖性地改善高脂饮食诱发的血糖升高。
2.3 抹茶对高脂饮食诱导小鼠肝脏脂质积累的作用
剖取小鼠肝脏进行形态学观察,结果如图1 所示。在HE染色中,肝脏细胞核被染成蓝色,细胞质被染成红色,脂肪不着色,在显微镜图中呈现白色空泡。图1显示,在HFD组小鼠肝脏中观察到更多的白色空泡,整体的脂肪浸润最为突出。而膳食补充抹茶后,肝脏的脂肪浸润程度得到明显改善。进一步对小鼠肝脏进行油红O染色,其中肝脏细胞核被染成蓝色,脂肪被染成红色。结果表明,与NCD组小鼠相比,HFD 小鼠肝脏中脂滴数量明显增加,同时呈现炎性浸润。而饮食添加抹茶能够显著改善脂滴积累,且效果随抹茶含量的增加而增强,说明抹茶在改善肥胖相关肝脏脂质积累和炎性病变方面具有良好的潜力。因此,选择抹茶干预组中效果最为显著的1.0%抹茶膳食添加组小鼠(HMH组)用于后续研究。
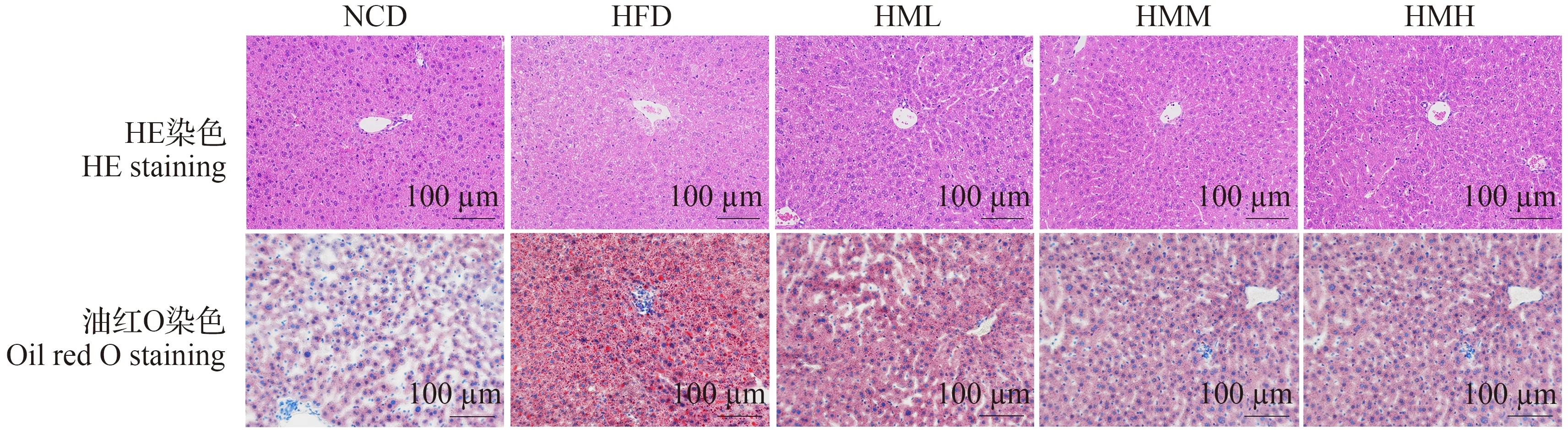
图1 抹茶对不同组小鼠肝脏脂质积累的影响Fig.1 Effects of matcha on liver lipid accumulation in different groups of mice
2.4 抹茶对高脂饮食诱导小鼠肝脏功能与氧化应激水平的影响
AST和ALT是反映肝脏功能和损害程度的重要指标。如图2 所示,高脂饮食情况下小鼠肝脏中的AST、ALT活性均显著高于NCD组小鼠。膳食补充1.0%抹茶后,小鼠AST和ALT活性较HFD组都明显下降。在氧化应激水平方面,HFD组小鼠肝脏中的抗氧化酶SOD活性较NCD组小鼠显著降低,脂质过氧化产物MDA 含量显著升高。与HFD 组相比,抹茶干预能够有效提升SOD 的活性(P<0.05),MDA含量也有所降低,但差异不显著(P>0.05)。
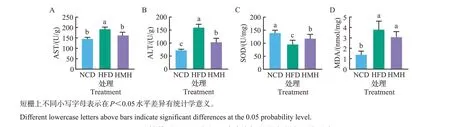
图2 抹茶对不同组小鼠肝脏功能与氧化应激水平的影响Fig.2 Effects of matcha on liver function and oxidative stress level in different groups of mice
2.5 抹茶对高脂饮食诱导小鼠肝脏炎症反应的作用与机制
采用实时荧光定量PCR 法对不同组小鼠肝脏组织中炎症因子和TLR4/MyD88通路关键基因的表达水平进行检测。如图3 所示,与NCD 组相比,高脂饮食显著增加了肝脏组织中TNF-α、IL-6、IL-1βmRNA 表达水平。抹茶干预能够有效抑制相关炎症因子的表达,其中TNF-α和IL-1β的表达水平较HFD 组显著降低(P<0.05),而对IL-6的抑制效果不显著(P>0.05)。在作用通路方面,抹茶干预能够有效降低高脂饮食诱导的TLR4高表达,并表现出对其下游基因MyD88的明显抑制,说明膳食补充抹茶能够通过抑制TLR4/MyD88 通路的激活,改善高脂饮食诱导的小鼠肝脏炎症反应。
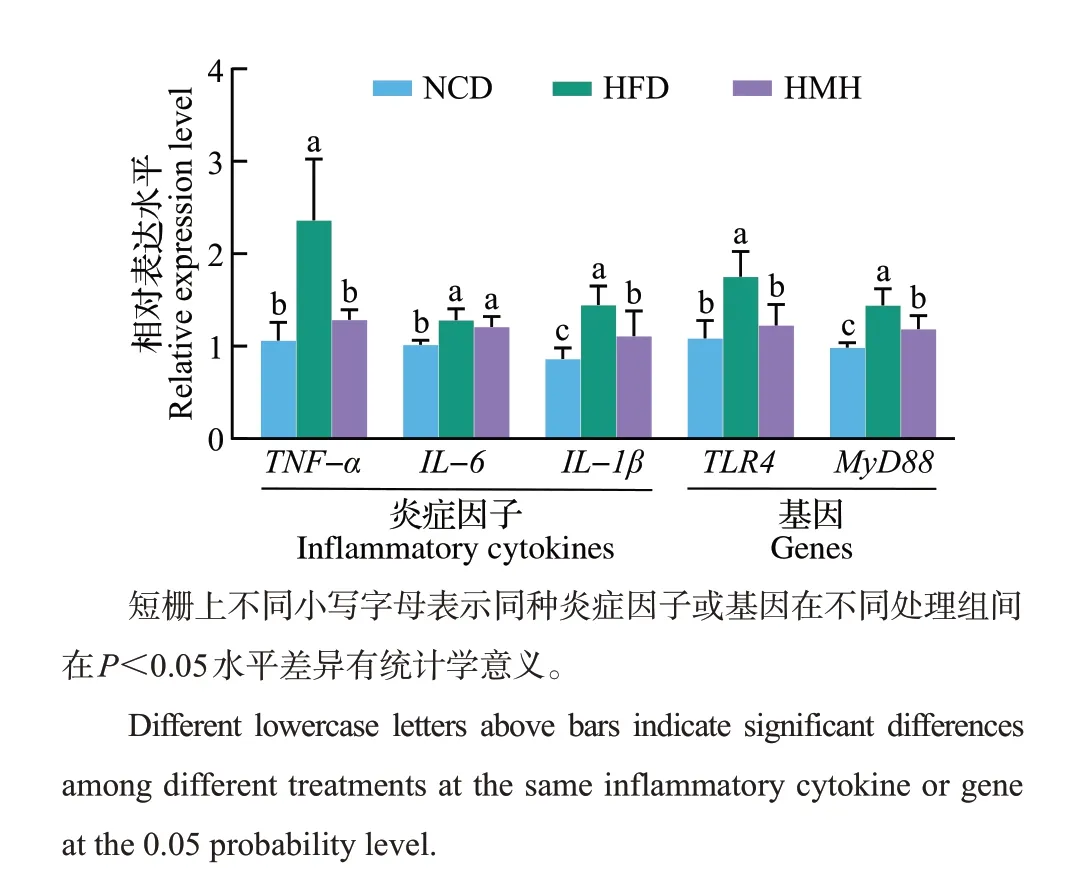
图3 抹茶对不同组小鼠肝脏炎症因子和TLR4/MyD88 通路基因表达的影响Fig.3 Effects of matcha on relative expression levels of inflammatory cytokine and TLR4/MyD88 signaling pathway gene in different groups of mice
3 讨论
肥胖一般由能量摄入与消耗之间的不平衡导致,其是2 型糖尿病、高血压、高脂血症、NAFLD 等多种代谢综合征的关键诱因[11]。NAFLD 全球患病率约为25%,威胁着全球公共健康[12]。NAFLD初期临床表现为肝脏脂肪大量积累并诱发脂肪性肝脏炎症,中后期发展出肝脏组织纤维化、硬化等情况,最终甚至可能造成肝脏癌变[13]。寻找安全、有效的NAFLD干预手段成为亟待解决的科学问题。
抹茶是一种在特定栽培方式和加工方法下生产出的可食用粉状绿茶,其“吃茶”的食用方法意味着全部有效成分都能被人体摄入。研究显示,抹茶中的氨基酸、多酚和EGCG 等成分具有较好的抗氧化、抗炎等活性[14]。本研究选择‘迎霜’‘鸠坑’‘中茶108’和‘茂绿’4 个茶树品种加工的抹茶样品,对其生化成分进行检测。结果表明,不同品种的抹茶在生化成分含量方面有所区别,其中‘茂绿’品种的茶多酚和儿茶素含量(尤其是最具活性的EGCG 的含量)在4个品种中最高,为其具有较高的相关生物活性功能奠定了物质基础。基于高脂饮食诱导的肥胖小鼠模型研究结果表明,抹茶可以有效改善高脂饮食诱导的肥胖和相关肝功能异常。经过8周的高脂饮食后,HFD 组小鼠出现了一系列的症状,包括体质量显著增加、血糖异常升高、肝脏脂质沉积明显等。而膳食补充抹茶显著抑制了小鼠的体质量增加,并表现出降低高血糖、改善肝脏脂质积累的作用。以上结果表明,抹茶作为一种安全、流行的新式健康饮品,在预防食源性肥胖和缓解相关的肝脏脂质过度积累方面具有良好的潜力。
研究表明,肥胖的发生及相关代谢综合征的发展与慢性低度的炎症反应密切相关[15]。当机体处于过量摄入营养的状态下,脂肪组织、肝脏组织等代谢组织会响应这一状态,诱发炎症因子的释放,进而表现为慢性低度的炎症反应[16]。由此造成的胰岛素抵抗和代谢功能障碍被认为是诸多代谢疾病产生的重要诱因[17]。近年来,关于食源性肥胖导致的代谢组织炎症反应和相关机制已成为很多科学家关注的热点。通过降低炎症反应的干预手段来防治肥胖及相关代谢性疾病也成了新的治疗策略[18]。
TLR4 相关通路已被报道与肥胖相关的肝脏炎症密切相关[19]。TLR4 是细胞表面模式识别受体TLRs 家族的重要成员,广泛存在于多种免疫细胞的表面,在机体免疫应答方面发挥着重要作用[20]。TLR4介导的信号转导包括MyD88依赖性和MyD88非依赖性2种途径,其中MyD88依赖性途径已被证明为多种植物活性成分治疗NAFLD的有效靶点[21]。当过量摄入营养和能量时,循环系统和组织中的游离脂肪酸水平升高,促进了TLR4的激活,并启动募集下游信号配体MyD88的信号转导。MyD88与白介素1受体相关激酶结合后激活泛素连接酶肿瘤坏死因子受体相关因子6(tumor necrosis factor receptorassociated factor 6,TRAF6)。活化的TRAF6 通过一系列信号转导,最终导致核因子-κB(nuclear factorκB,NF-κB)的激活和细胞核转移,诱发炎性细胞因子的释放和细胞损伤[22]。本研究结果表明,抹茶能够显著抑制高脂饮食诱导的肝脏TLR4和下游信号配体MyD88的激活,有效降低TNF-α、IL-6、IL-1β等炎症因子的表达水平,说明TLR4 的MyD88 依赖性途径是抹茶改善高脂诱导的肝脏炎症反应的有效作用靶点。
综上所述,抹茶作为一种富含茶多酚等活性成分的健康饮品,可以减轻高脂饮食诱导的肥胖及相关肝脏脂肪变性和脂肪性肝炎的病理过程,其机制可能与调控TLR4及其下游MyD88基因信号转导通路有关,揭示了抹茶作为降脂减肥和改善非酒精性脂肪性肝病(NAFLD)有效手段的潜力,为茶叶资源综合利用和保健功能开发奠定了实验基础。

