浙江省桑园土壤病原菌及其微生态调查
金杏丽,何金涛,蔡永良,李坤峰,陈乐阳,鲁兴萌,邵勇奇*
(1.德清县农业技术推广中心,浙江 湖州 313200;2.浙江大学动物科学学院蚕蜂研究所,杭州 310058;3.德清县莫干天竺蚕种有限
责任公司,浙江 湖州 313204;4.浙江大学农业试验站,杭州 310058;5.金华市农业农村局,浙江 金华 321017)
桑椹菌核病是果桑生产中的重要病害,已发现的菌核病病原均为真菌,包括桑实杯盘菌(Ciboria shiraiana)[1-4]、肉阜状杯盘菌(Ciboria carunculoides)[5-6]、桑椹核地杖菌(Scleromitrula shiraiana)[7-8]和核盘菌(Sclerotinia sclerotiorum)[9]等。已有大量的研究表明,地理区域[9]、气候条件[2]、桑树品种[10-11]、栽培和管理模式[12-13]等因素对桑椹菌核病的发生都有影响。可见,桑椹菌核病的发生和流行是一个复杂的系统过程。目前,植物病害发生与土壤微生态(细菌和真菌)的关系以及通过改善土壤微生态来减少植物病害发生并提高农产品品质正被学者所关注[14-15],但是迄今鲜有桑椹生产桑园土壤病原菌及其微生态调查的报道。
浙江省湖州市德清县于2009 年开始较大规模地种植果桑,至2016年果桑面积达到32 hm2。2017年,因春季低温阴雨以及桑园用药和防控措施单一等因素而引发大规模病害,部分桑园颗粒无收。本实验以浙江栽培果桑相对较多的地域(德清、长兴、金华)的桑园为研究对象(其中长兴为大棚栽培,其他为露地栽培),同时,以四川地域的桑园(极少或未发生桑椹菌核病)作为参照,开展了桑园土壤微生态的相关调查,试图通过对土壤样本中真菌和细菌微生态的描述及定性研究,为基于土壤的桑椹菌核病的防控技术研发提供参考。
1 材料与方法
取样调查桑椹生产桑园,包括采用常规露地栽培方式的浙江省湖州市德清县(DQ)和金华市多湖街道(JD)、江东镇(JJ)地域的3 个桑园,以及浙江大学农业科学试验站长兴分站的采用“地布覆盖-塑料大棚-根域限制-棚架”栽培方式的桑园(长兴,CX),并以历年极少或未发生桑椹菌核病的四川1 个地域的桑园为对照(CK)。除因地域不同而产生的土壤、气候和栽培管理方式等差异外,四川桑园的栽培品种为‘嘉陵30’,浙江桑园均为‘大10’。
1.1 果桑栽培方式和桑椹生产基本情况
采集样本的桑园的果桑栽培时间分别为德清2009 年、金华1999 年、长兴2014 年、四川2006 年。德清(DQ)和金华(JD、JJ)桑园为中低干栽培,株行距均为0.8 m,栽植密度为330~400 株/667 m2。当年果实收获后及时修剪,留6~7 根结果枝,于秋冬季对超过1.5 m 的枝条剪梢,并在冬季用45%晶体石硫合剂50~80倍液封园。根据历年开花期记载和本年度的果桑生长情况,于春季用药,每隔7 d以70%甲基硫菌灵700~800 倍稀释液和42.8%氟菌·肟菌酯1 500倍稀释液交替使用,连续用药3次。长兴(CX)桑园采用棚架立体栽培[16],株行距均为4.0 m,栽植密度为40 株/667 m2。冬季修剪以疏剪和短截相结合,随着主枝的延伸和侧枝的配置,形成4主枝和多侧枝的树形,剪去枝条顶端的枯梢、病虫枝及长度为20~30 cm的细小倒侧枝。病虫害防治从覆膜时开始,用45%晶体石硫合剂80~100 倍液喷洒地面清园1 次,在花蕾初现时用70%甲基托布津可湿性粉剂1 000倍液或50%多菌灵粉剂800倍液交替喷雾,每次间隔7~10 d,一般防治4次左右。四川(CK)桑园采用乔化砧木,株行距均为1.0 m,栽植密度为350株/667 m2。冬季修剪时将夏季萌发的弱小枝、病虫枝等全部从基部剪除,并将保留的结果母枝适当截短,一般剪去枝梢顶端15~20 cm 生长不充实、不饱满的部分。桑椹菌核病的防治分始花期、盛花期、末花期3 次进行,每隔7~10 d 用70%甲基托布津可湿性粉剂1 000 倍液或50%多菌灵粉剂1 000倍液喷洒防治1次。
2019 年度各取样地域桑园的桑椹菌核病调查结果为:德清(DQ)桑园可见少量菌果;金华多湖(JD)及江东(JJ)桑园菌果较多,感官不佳,但对产量的影响不大;长兴(CX)和四川(CK)桑园未见菌果。
1.2 土壤样本来源和采样时间
在桑园边界的2 行(或2 株)内,用梅花法选择5株桑树,在距桑树根部约20 cm、地表约5 cm处采集5个土样,土壤量约50 g,分别置于含干冰的密封袋中,24~48 h 内送至浙江大学家蚕病理学与病害控制实验室。实验室收到样本后,即刻于-80 ℃低温条件下保存,备用。
土壤采样时间为最后一次用药后1周左右。德清(DQ)的具体采样时间为2019年4月2日,金华多湖(JD)和江东(JJ)均为2019 年3 月27 日,长兴(CX)为2019 年3 月24 日,四川(CK)为2019 年4月3日。
1.3 土壤样本的DNA 提取及16S rRNA 和内转录间隔区(internal transcribed spacer, ITS)基因的高通量测序
分别称取低温保存的土壤样品250 mg,装入破碎管,利用Precellys©24 组织研磨仪(法国Bertin公司)以5 500 r/min研磨45 s。利用DNeasy©PowerSoil试剂盒(德国Qiagen公司)提取各土壤样品的DNA。经NanoDrop 2000 紫外-可见分光光度计对样品的DNA 浓度进行测定,并经1%琼脂糖凝胶电泳确定DNA 提取质量后,送至上海美吉生物医药科技有限公司进行MiSeq 高通量测序,共计25 个测序样品(5个地域,每个地域5个土样)。靶基因的扩增引物及序列[17-18]为:细菌(16S rRNA-V4 区域),515FGTGCCAGCMGCCGCGGTAA和806R-GGACTAC HVGGGTWTCTAAT;真菌,ITS1-CTTGGTCATTTA GAGGAAGTAA和ITS2-GCTGCGTTCTTCATCGA TGC。
1.4 土壤样本主要理化指标测定
将土壤样本送至有检测资质的公司(浙江国正检测技术有限公司)进行主要理化指标分析。其中:全氮(total nitrogen,TN)参照LY/T 1228—2015进行测定;全磷(total phosphorus, TP)参照LY/T 1232—2015 进行测定;全钾(total potassium,TK)参照LY/T 1234—2015 进行测定;有机质(organic matter, OM)参照NY/T 1121.6—2006 进行测定;pH参照NY/T 1121.2—2006进行测定。
1.5 数据分析
16S rRNA 和ITS 基因的高通量测序数据分析参考本实验室前期的研究[19-20],使用Trimmomatic v0.33 软件对原始测序序列进行质控,使用FLASH v1.2.11 软件进行拼接:1)过滤测序序列(reads)尾部质量值低于20 的碱基,设置50 bp 的窗口,如果窗口内的平均质量值低于20,则从窗口开始截去后端碱基,过滤质控后50 bp以下的测序序列,去除含N 碱基的测序序列;2)根据双端测序(pairedend, PE)序列之间重叠部分(overlap)的关系,将成对测序序列拼接成1 条序列,最小重叠部分长度为10 bp;3)拼接序列的重叠部分允许的最大错配比率为0.2,筛选不符合序列;4)根据序列首尾两端的条形码(barcode)和引物区分样品,调整序列方向,其中,条形码允许的错配数为0,最大引物错配数为2。
使用UPARSE v7.1 在线软件(http://drive5.com/uparse/),根据97%的相似度对序列进行可操作分类单元(operational taxonomic unit, OTU)聚类并剔除嵌合体。利用RDP分类器(classifier)v2.10.2(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,在Silva v128(16S rRNA)和Unite v7.0(ITS)数据库中进行比对,设定比对阈值为70%,获得OTU表。实验数据的统计分析使用R v3.6.3软件。
2 结果与分析
2.1 土壤样本真菌和细菌多样性分析
观察从不同地域5个桑园中采集的土壤样本的真菌和细菌多样性发现,真菌和细菌相对丰度(relative abundance,RA)>1.0%(优势菌)的OTU数目分别为7.0~12.6 和21.0~24.6,0.1%≤RA≤1.0%(稀有菌)的OTU 数目分别为18.8~40.8 和104.6~134.4,可鉴定OTU 的总数分别为70.6~141.4 和441.8~558.6(表1)。从可鉴定的优势菌的分布及其微生态结构看,细菌的多样性大于真菌。但从各样本的可鉴定序列占总测定序列的比例看,真菌类微生物为92.79%~95.81%,细菌类微生物为53.97%~64.46%,由此可进一步判断桑园土壤中细菌类微生物的多样性较真菌类更为丰富,且在属、科、目、纲和门的分类学鉴定中,不能明确的细菌(其他)更多(图1~2)。
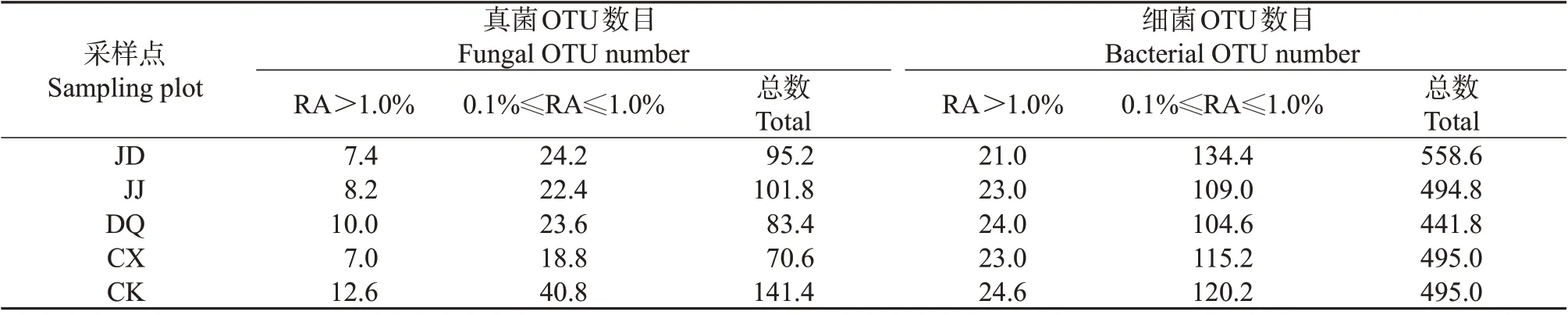
表1 不同桑园土壤样本中可鉴定的真菌和细菌种类(OTU数目)Table 1 OTU numbers of identified fungi and bacteria in the soil samples from different mulberry fields
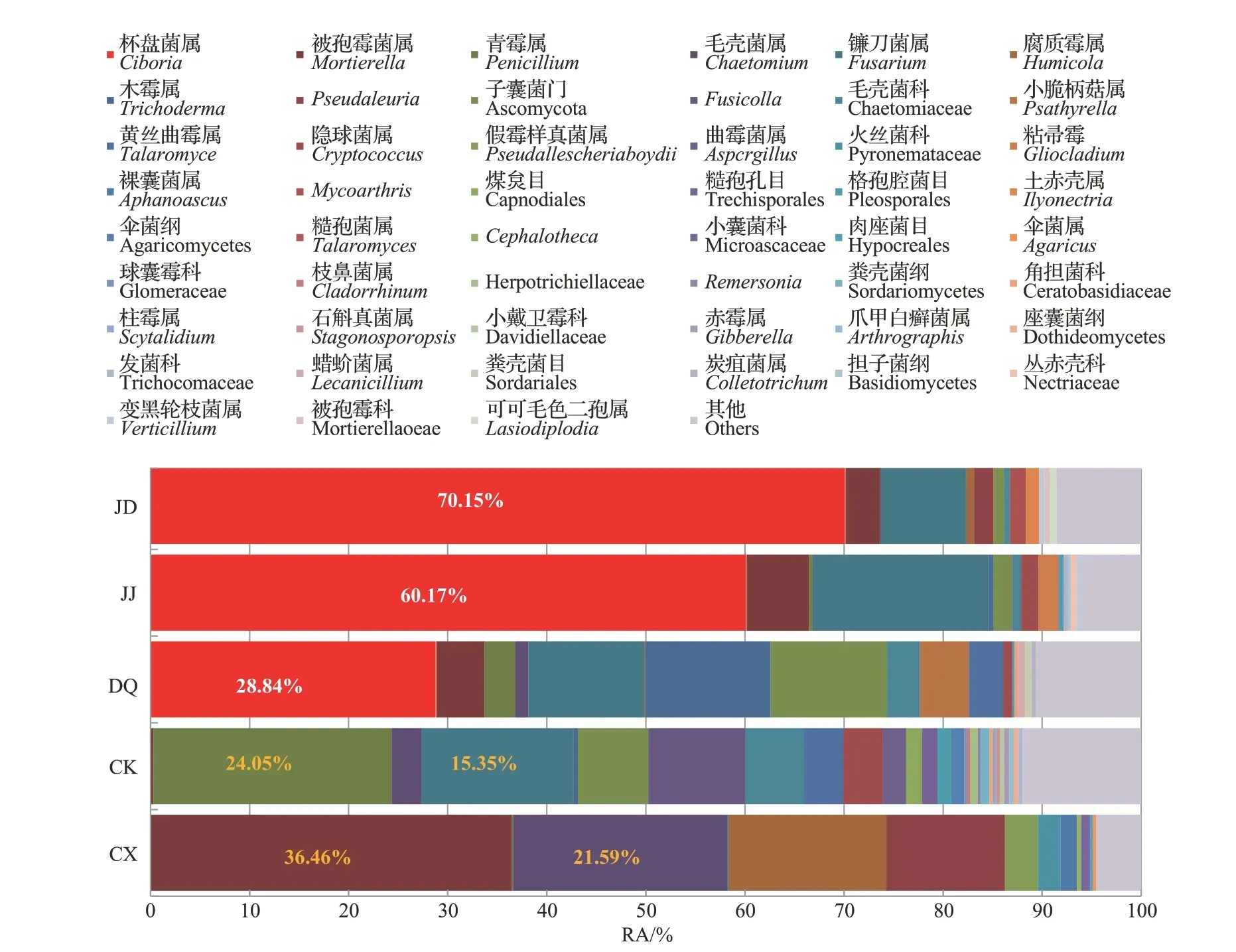
图1 不同桑园土壤样本的真菌微生态结构(RA)Fig.1 Fungal microecological structures of the soil samples from different mulberry fields(RA)
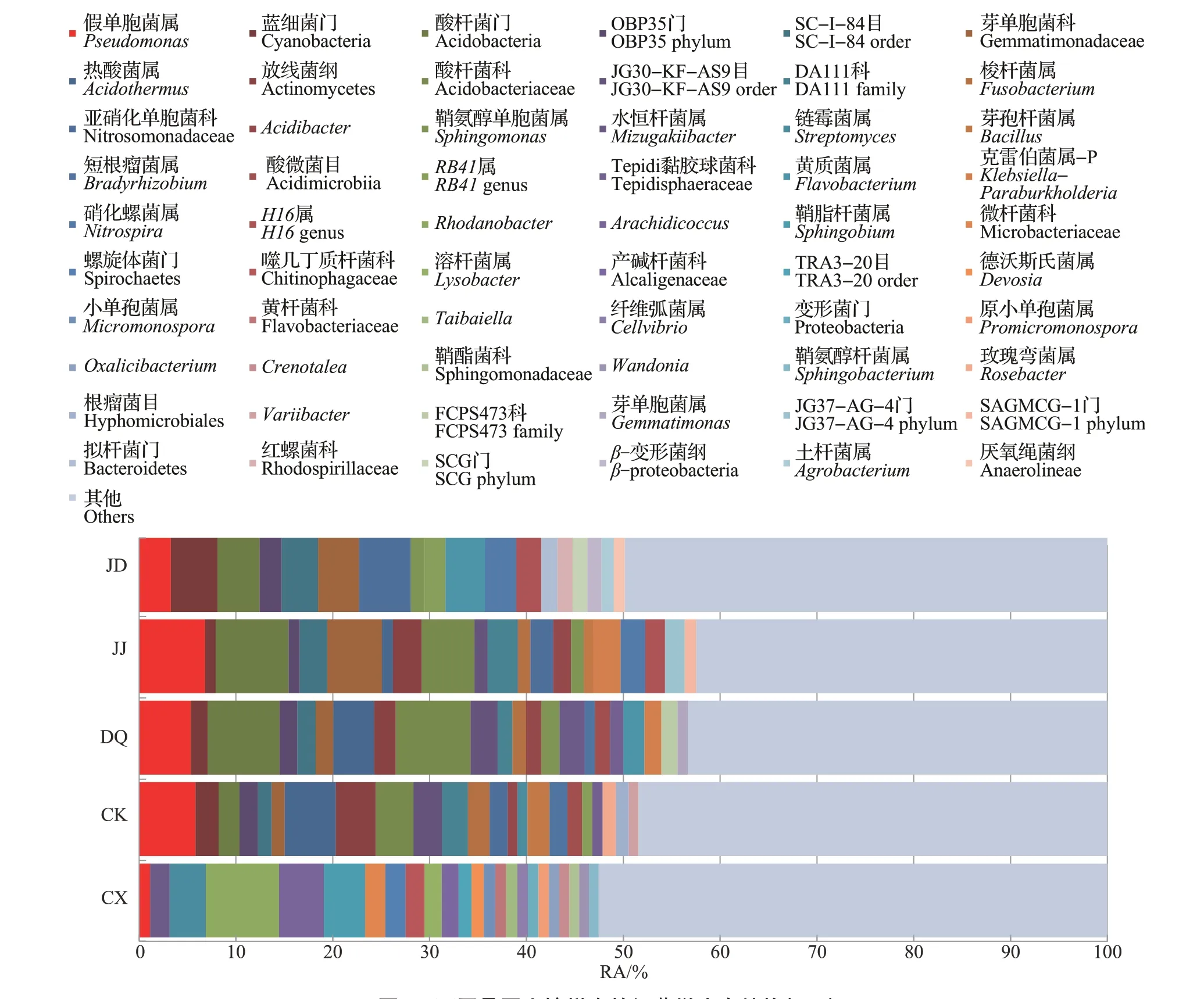
图2 不同桑园土壤样本的细菌微生态结构(RA)Fig.2 Bacterial microecological structures of the soil samples from different mulberry fields(RA)
在真菌的可鉴定序列中,不同桑园土壤中优势真菌(RA>1.0%)的OTU 数目以四川(CK)样本组最高,极显著高于长兴(CX)、多湖(JD)和江东(JJ)样本组(图3A);对于稀有真菌(0.1%≤RA≤1.0%)的OTU数目,四川(CK)样本组极显著高于其他4个样本组(图3B);在可鉴定的OTU总数上,四川(CK)样本组也极显著高于其他4个样本组(图3C)。

图3 不同桑园土壤样本中的真菌在不同RA范围可鉴定的OTU数目比较Fig.3 Comparisons of identified OUT numbers at different RA ranges of fungi in the soil samples from different mulberry fields
在细菌的可鉴定序列中,不同桑园土壤中优势细菌(RA>1.0%)的OTU数目未见显著性差异(图4A);稀有细菌(0.1%≤RA≤1.0%)的OTU 数目以多湖(JD)样本组最高,分别极显著和显著高于德清(DQ)和江东(JJ)样本组,其他样本组间未见显著性差异(图4B);在可鉴定的OTU总数上,多湖(JD)样本组最高,极显著高于德清(DQ)样本组,其他样本组间未见显著性差异(图4C)。
2.2 菌核病病原真菌及其他真菌的微生态结构分析
对比不同桑园土壤中杯盘菌属(Ciboria)真菌的RA(图5)发现:多湖(JD)和江东(JJ)样本组的RA 都极显著高于德清(DQ)、长兴(CX)和四川(CK)样本组;德清(DQ)样本组的RA 极显著高于四川(CK)和长兴(CX)样本组;江东(JJ)和多湖(JD)以及长兴(CX)和四川(CK)样本组的RA 未见显著性差异。
在桑椹菌核病低发生地域的四川(CK)样本组中,主要为青霉属(Penicillium)、镰刀菌属(Fusarium)和Fusicolla真菌,其RA 分别为24.05%、15.35%、9.75%。青霉属(Penicillium)在德清(DQ)样本组中有一定丰度(RA 为3.07%),但在其余样本组中的RA都很低,均极显著低于四川(CK)样本组(图6A);镰刀菌属(Fusarium)在德清(DQ)样本组中的RA 也较高(11.70%),与四川(CK)样本组无显著差异,且均极显著高于长兴(CX)、江东(JJ)和多湖(JD)样本组(图6B);Fusicolla在长兴(CX)和多湖(JD)样本组中未检出,在德清(DQ)和江东(JJ)样本组中的RA也极低。

图6 不同桑园土壤样本中青霉属(Penicillium)(A)和镰刀菌属(Fusarium)(B)真菌的RAFig.6 RA of Penicillium(A)and Fusarium(B)fungi in the soil samples from different mulberry fields
在桑椹菌核病低发生地域长兴(CX)样本组中,主要为被孢霉菌属(Mortierella)、毛壳菌属(Chaetomium)和腐质霉属(Humicola)真菌,其RA分别为36.46%、21.59%、15.93%,与同为桑椹菌核病低发生地域的四川(CK)以及德清(DQ)、江东(JJ)和多湖(JD)样本组有较大不同,长兴(CX)样本组中这3 个菌属的RA 均极显著高于其他样本组(图7)。

图7 不同桑园土壤样本中被孢霉菌属(Mortierella)(A)、毛壳菌属(Chaetomium)(B)和腐质霉属(Humicola)(C)真菌的RAFig.7 RA of Mortierella(A),Chaetomium(B),and Humicola(C)fungi in the soil samples from different mulberry fields
此外,在长兴(CX)样本组中,Pseudaleuria的RA较高(11.94%),极显著高于其他样本组(图8A);在德清(DQ)样本组中,木霉属(Trichoderma)的RA较高(3.97%),且其在5 个样本组内的差异较大(0.27%~53.30%)(图8B);在四川(CK)样本组中,隐球菌属(Cryptococcus)的RA 较高(3.97%),显著高于长兴(CX)样本组,极显著高于德清(DQ)及多湖(JD)样本组,与江东(JJ)样本组未见显著性差异(图8C)。
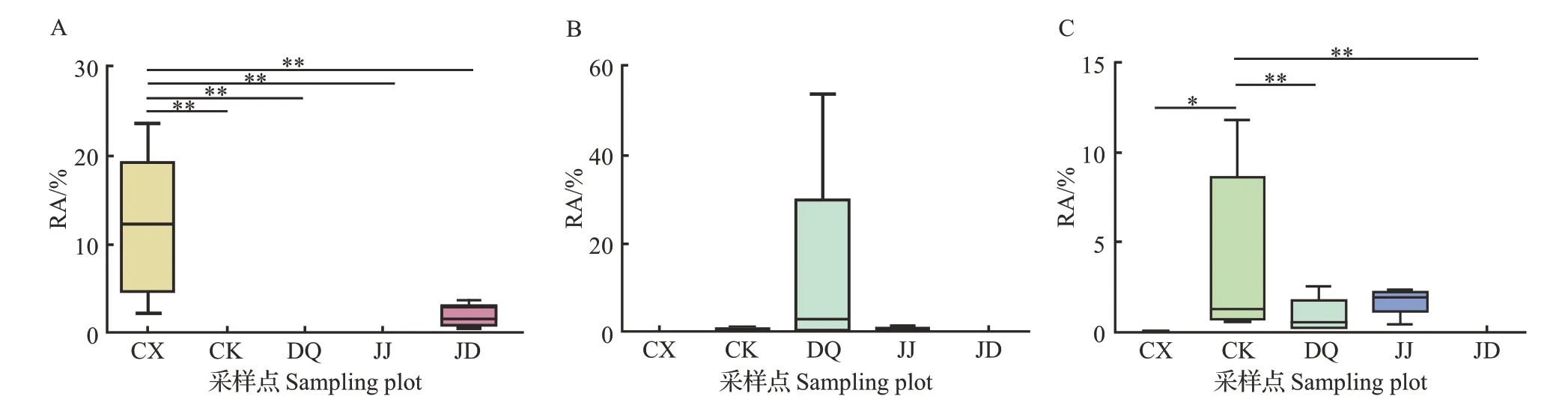
图8 不同桑园土壤样本中Pseudaleuria(A)、木霉属(Trichoderma)(B)和隐球菌属(Cryptococcus)(C)真菌的RAFig.8 RA of Pseudaleuria(A),Trichoderma(B),and Cryptococcus(C)fungi in the soil samples from different mulberry fields
2.3 细菌的微生态结构分析
假单胞菌属(Pseudomonas)是唯一在5 个样本组中均有可鉴定序列的细菌:在长兴(CX)和多湖(JD)样本组中其RA 较低,其中,长兴(CX)样本组极显著低于江东(JJ)、德清(DQ)和四川(CK)样本组,多湖(JD)样本组显著低于江东(JJ)样本组;江东(JJ)样本组的RA 最高(6.81%),德清(DQ)和四川(CK)样本组的RA 也较高,但两者组内差异较大(图9A)。蓝细菌门(Cyanobacteria)、酸杆菌门(Acidobacteria)和SC-I-84 目未确定的芽单胞菌科(Gemmatimonadaceae)的可鉴定序列在长兴(CX)样本组中的RA 很低,其平均值分别为0.06%、0.10%、0.09%,在其他样本组中的平均值为1.10%~7.41%(图9,部分数据未列出)。蓝细菌门(Cyanobacteria)可鉴定序列在多湖(JD)样本组中的RA 具有较高的平均值(4.81%),分别显著和极显著高于江东(JJ)和长兴(CX)样本组;其在多湖(JD)和四川(CK)样本组内差异较大,分别为0.11%~9.83%和0.05%~9.81%(图9B)。酸杆菌门(Acidobacteria)可鉴定序列的RA 在德清(DQ)和江东(JJ)样本组中较高,分别为7.41%和7.54%,且两者间无显著差异,但德清(DQ)和江东(JJ)样本组分别极显著和显著高于四川(CK)和多湖(JD)样本组,长兴(CX)样本组则极显著低于德清(DQ)、江东(JJ)和多湖(JD)样 本组(图9C)。
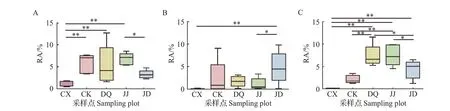
图9 不同桑园土壤样本中假单胞菌属(Pseudomonas)(A)、蓝细菌门(Cyanobacteria)(B)和酸杆菌门(Acidobacteria)(C)可鉴定序列细菌的RA比较Fig.9 Comparisons of RA of identified sequences of Pseudomonas (A), Cyanobacteria (B), and Acidobacteria (C) bacteria in the soil samples from different mulberry fields
链霉菌属(Streptomyces)、黄质菌属(Flavobacte‐rium)、克雷伯菌属-P(Klebsiella-Paraburkholderia)、热酸菌属(Acidothermus)、硝化螺菌属(Nitrospira)和H16是在5 个地域的样本组中较为高频出现的细菌,但它们在不同样本组之间存在较大的差异(图10)。
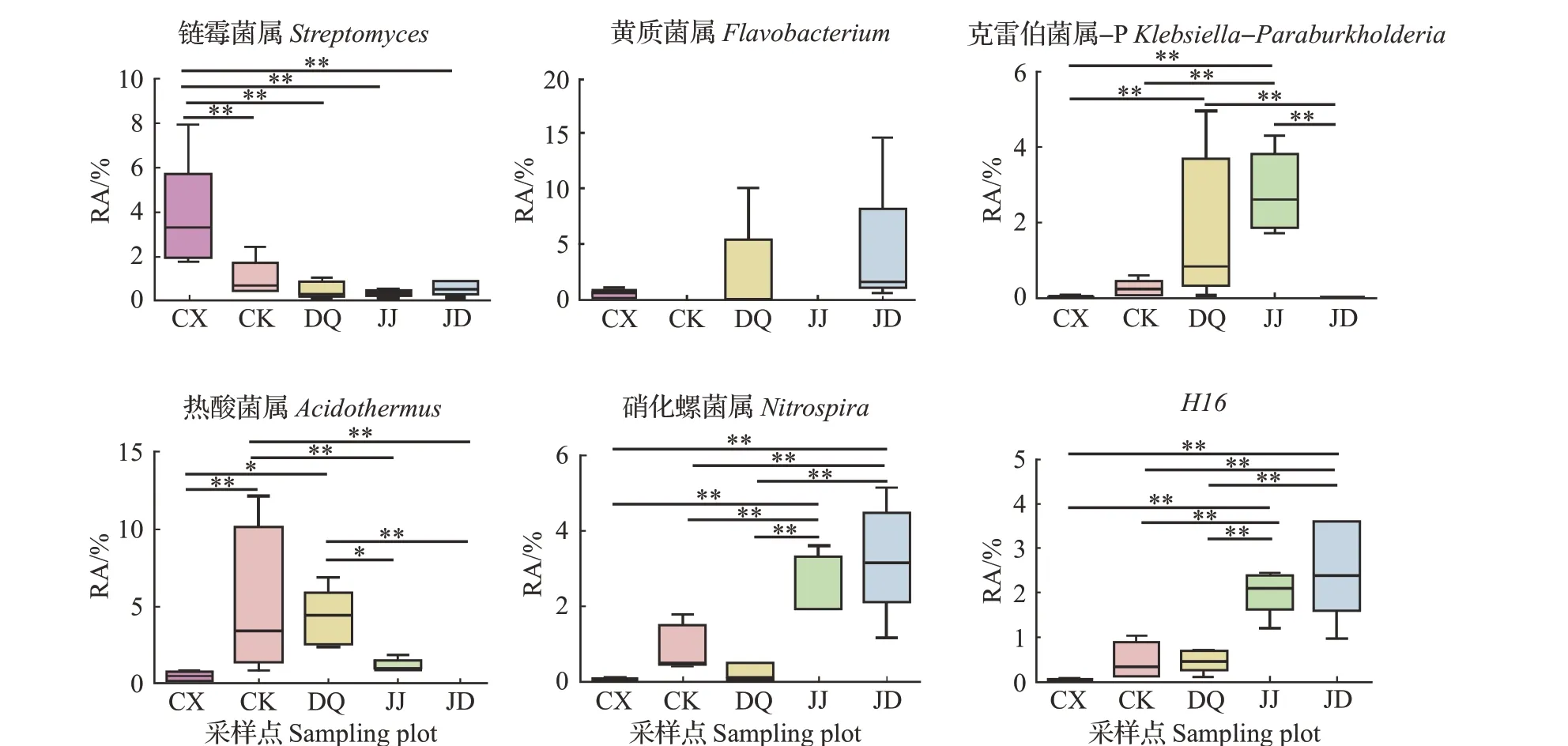
图10 不同桑园土壤样本中6个高频出现的细菌属的RA比较Fig.10 Comparisons of RA of the six high frequency bacterium genera in the soil samples from different mulberry fields
2.4 土壤样本主要理化指标分析
对浙江桑园土壤样本的主要理化指标(有机质、全氮、全磷、全钾含量和pH)分析发现,不同采样地域的土壤pH 差异不显著(pH 7~8),并且同一地域发病与不发病土壤间主要理化指标的差异也不大。进一步分析发现,长兴(CX)桑园土壤有机质(155.7 g/kg)、全氮(9.6 g/kg)、全磷(6.3 g/kg)含量高于其他地域(有机质9.6~50.0 g/kg、全氮0.5~3.1 g/kg、全磷0.6~0.9 g/kg),但其全钾含量偏低(13.5 g/kg),而其他地域为18.7~34.2 g/kg。
3 讨论与结论
土壤是微生物的大本营,土壤真菌和细菌的多样性是其微生态的基本特征。作物栽培(种类、耕作和培肥管理等)和土壤微生态间存在着复杂的相互作用关系,其作用结果对作物的生物产量和病害发生有着不同的影响[14-15,21-22]。本研究以历年极少或未发生桑椹菌核病(四川)和发生桑椹菌核病(浙江)的桑园土壤样本为对象,发现浙江4 个地域(德清、长兴、金华多湖及江东)和四川对照地域桑园土壤样本的真菌和细菌都具有丰富的多样性,但其在微生态结构上存在明显的不同。
菌核病病原杯盘菌属(Ciboria)真菌在多湖、江东和德清露地栽培样本组中为主要菌群(RA分别为70.15%、60.17%、28.84%),在长兴大棚栽培和四川对照样本组中的RA很低(分别为0.02%和0.06‱),与桑园桑椹菌核病的实际发生情况吻合,即证实桑椹菌核病发生与桑园土壤杯盘菌属(Ciboria)病原菌的存在和数量有关。四川桑园不仅果桑品种与其他4个桑园不同(四川为‘嘉陵30’,浙江为‘大10’),在地理上也相距较远,气候和土壤条件等存在较大差异,该地域未见桑椹菌核病病果可能与其独特的地理、气候、土壤条件以及人为防控措施有关。浙江长兴地域也未见桑椹菌核病病果,可能与其采用地布覆盖和大棚栽培方式有关。地布覆盖具有良好的土壤隔离作用,且有利于消毒;大棚则有利于隔离大范围存在或漂移的子囊孢子。此外,在长兴地域采用根域限制栽培时对土壤进行了严格配比,其土壤有机质、全氮、全磷含量高于其他地域,这些土壤的主要理化特性与其微生态的关系值得深入研究。隋跃宇等[23]研究了有机质含量不同的农田黑土与土壤微生物量、碳、氮及土壤酶活性的关系,发现土壤微生物量、碳、氮随土壤有机质含量的增加而增加。何金祥等[24]对烟草栽培地研究表明,土壤速效磷含量和pH 对植株发病率的影响较大,而其他土壤化学性状(如钾、水分含量等)与植株发病率的相关性不显著。桑椹菌核病发现地域中真菌多样性的下降,以及四川和浙江长兴地域中主要菌群[如被孢霉菌属(Mortierella)、毛壳菌属(Chaetomium)、腐 质 霉 属(Humicola)、青 霉 属(Penicillium)、镰刀菌属(Fusarium)和Fusicolla]的功能也是值得关注的问题。比如,土壤微生物多样性的变化可能会影响植物土传病害。有研究表明,土壤微生物多样性与植物健康呈正相关[25]:健康烟草土壤与枯萎病株土壤相比,前者具有更高的细菌多样性;健康三七根际土壤中细菌和真菌的多样性指数亦高于根腐病株根际土壤。健康植物根际土壤优势菌属有助于对土传病害的抑制[25]。
在本研究中,不论是属水平的可鉴定的OTU数目还是可鉴定序列的RA 都显示了细菌丰富的多样性,虽未见明显优势菌群,但假单胞菌属(Pseudomonas)在不同地域的5 个桑园中均被检出;链霉菌属(Streptomyces)、黄质菌属(Flavobacterium)和克雷伯菌属-P(Klebsiella-Paraburkholderia)等虽有较高的出现频率,但其RA都较低。本研究结果为后续进一步寻找不同地域、不同栽培条件下相同品种、相同树龄以及发病程度相似的试验材料进行定量研究提供了良好的视角和基础。
桑椹菌核病的发生主要由病原真菌感染引起。已发现的可引起桑椹菌核病的真菌有杯盘菌属(Ciboria)和核地杖菌属(Scleromitrula),它们的子囊孢子黏附在桑花柱头后感染桑椹,导致桑椹变成灰白色并膨大或缩小,甚至落果。病原真菌的主要来源可能是病果跌落后在土壤中越冬,并在来年春季其菌核生长,子囊盘钻出土表,发育成熟后从子囊顶端喷出子囊孢子并随风飘散,到达桑花柱头发生感染[1-3]。因此,为防止桑椹菌核病的发生,主要在果桑开花期进行数次化学药物喷施,或者进行果桑品种选育、调整果桑开花期,以及尝试其他农业防治措施等[26-28]。桑椹菌核病的病原被认为主要来源于土壤,利用土壤微生态结构提高作物产量和防止病害发生,以及利用微生态制剂改变土壤微生态的研究和应用已有尝试[29-30]。虽然ITS和16S rRNA基因的高通量测序局限于属水平的鉴定,对杯盘菌属(Ciboria)具体种的地位未能确定,但不同桑园土壤的微生态结构和主要菌群特征暗示了诸多进一步解析病害发生机制的途径,以及利用或研发病原菌微生态防控技术的可能性。本研究对不同地域桑园土壤病原菌及其微生态的调查为桑椹菌核病的绿色防控提供了新思路。

