P53、Ⅱ型拓扑异构酶、P-糖蛋白在食管癌组织中的表达及临床意义
张喜凤,梁宪斌,向 梅,张维真 (郑州市第三人民医院肿瘤内科,河南 郑州 450000)
食管癌为临床多发消化道恶性肿瘤,发病率和病死率均较高[1-2]。外科手术为临床治疗食管癌的重要措施,可有效切除病变组织,但针对临床分期较晚、发生肌层浸润及淋巴结转移的患者,经手术治疗后难以取得满意效果,且复发风险较高[3-4]。因此,如何对食管癌予以早期明确诊断成为研究热点。随分子生物技术不断发展,肿瘤相关基因于恶性肿瘤中的研究已成临床焦点,检测相关癌基因及抑癌基因表达和其表达情况对食管癌患者的影响,对早期诊断食管癌、评估预后极为重要[5-6]。p53属抑癌基因类型,临床多项研究均已证实其在恶性肿瘤疾病发生、进展中具有重要作用,且可对其生物学行为直接产生影响[7-8]。Ⅱ型拓扑异构酶(topoisomerase type Ⅱ,TOPOⅡ)为调节DNA构象动态改变的重要核酶,为肿瘤细胞增殖的特异性标志物;P-糖蛋白(P-glycoprotein,PGP)是多药耐药基因所编码的跨膜糖蛋白类型,其表达水平增高通常表明病灶对相应化疗药物存在耐药性,同时提示预后效果不佳[9-10]。本研究选取郑州市第三人民医院收治的213例食管癌患者,探讨其p53、TOPOⅡ、PGP表达情况。
1 资料与方法
1.1 一般资料选取郑州市第三人民医院2018年12月至2020年9月收治的213例食管癌患者设为研究组、21例食管良性肿瘤患者设为对照组。研究组:男143例,女70例;年龄39~76(57.13±5.65)岁;临床分期:Ⅰ+Ⅱ期114例,Ⅲ+Ⅳ期99例;肌层浸润情况:<1/2肌层浸润85例,≥1/2肌层浸润128例;低分化106例,中分化64例,高分化43例;淋巴结转移116例,淋巴结无转移97例。对照组:男13例,女8例;年龄36~73(56.87±5.08)岁;疾病类型:息肉瘤3例,食管血管瘤2例,乳头状瘤6例,食管平滑肌瘤10例。2组基本临床资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 选取标准食管癌纳入标准:1)经病理检查确诊;2)Ⅰ~Ⅳ期;3)知情同意本研究;4)采取手术治疗。排除标准:1)合并肾肝功能重度障碍;2)合并血液系统病变;3)合并全身性重度感染性疾病;4)合并其他肿瘤;5)存在认知功能障碍或神经系统病变,无法顺利配合完成本研究。
1.3 方法2组均采取手术治疗,术中取病变组织制成石蜡切片,然后常规进行免疫组化染色。依据p53、TOPOⅡ、PGP阳性数目占比评估,占比≤10%、11%~50%、51%~75%、>75%分别计1~4分;依据染色强度,无色、淡黄、棕黄、黑色、褐色分别计0~3分,两项相乘不足3分为阴性(-),3~5分呈弱阳性(+),6~9分呈中阳性(++),9分以上呈强阳性(+++)。
1.4 观察指标比较观察2组p53、TOPOⅡ、PGP阳性表达情况。统计分析研究组不同淋巴结转移情况、不同临床分期、不同肌层浸润情况、不同分化程度患者p53、TOPOⅡ、PGP阳性表达情况。
1.5 统计学处理采用SPSS 25.0对数据进行分析,计数资料用百分数表示,比较用χ2检验,检验水准α=0.05。
2 结果
2.1 2组p53、TOPOⅡ、PGP阳性表达情况比较研究组p53(57.28%)、TOPOⅡ(78.40%)、PGP(60.56%)阳性表达率高于对照组(4.76%、9.52%、4.76%),差异均有统计学意义(χ2=21.142,P<0.001;χ2=45.206,P<0.001;χ2=24.106,P<0.001)。见表1。
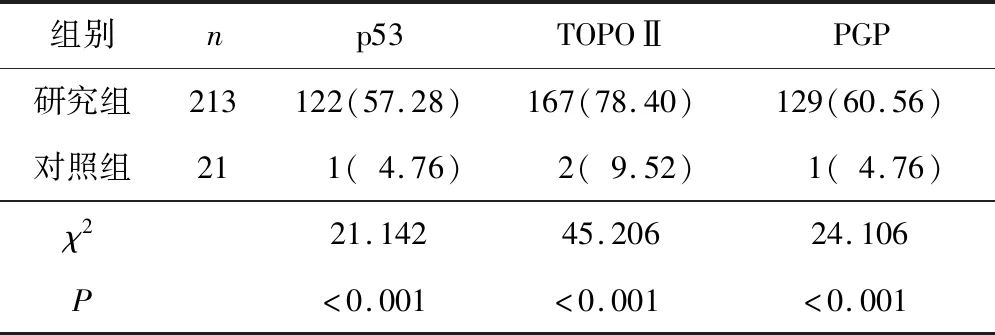
表1 2组p53、TOPOⅡ、PGP阳性表达情况比较 n(%)
2.2 有无淋巴结转移患者p53、TOPOⅡ、PGP阳性表达情况比较有淋巴结转移者p53(75.00%)、TOPOⅡ(89.66%)、PGP(80.17%)阳性表达率高于无淋巴结转移者(36.08%、64.95%、37.11%),差异均有统计学意义(χ2=32.696,P<0.001;χ2=19.044,P<0.001;χ2=41.008,P<0.001)。见表2。

表2 有无淋巴结转移患者p53、TOPOⅡ、PGP阳性表达情况比较 n(%)
2.3 不同临床分期患者p53、TOPOⅡ、PGP阳性表达情况比较Ⅲ+Ⅳ期食管癌患者p53(80.81%)、TOPOⅡ(95.96%)、PGP(84.85%)阳性表达率均高于Ⅰ+Ⅱ期患者(36.84%、63.16%、39.47%),差异均有统计学意义(χ2=41.855,P<0.001;χ2=33.670,P<0.001;χ2=45.675,P<0.001)。见表3。

表3 不同临床分期患者p53、TOPOⅡ、PGP阳性表达情况比较 n(%)
2.4 不同肌层浸润情况患者p53、TOPOⅡ、PGP阳性表达情况比较≥1/2肌层浸润者p53(72.66%)、TOPOⅡ(95.31%)、PGP(75.00%)阳性表达率高于<1/2肌层浸润患者(34.12%、52.94%、38.82%),差异均有统计学意义(χ2=31.003,P<0.001;χ2=54.160,P<0.001;χ2=27.989,P<0.001)。见表4。
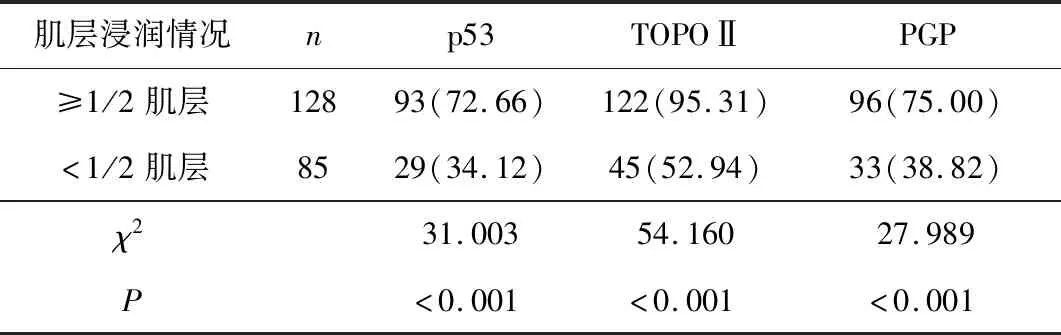
表4 不同肌层浸润情况患者p53、TOPOⅡ、PGP阳性表达情况比较 n(%)
2.5 不同分化程度患者p53、TOPOⅡ、PGP阳性表达情况比较不同分化程度食管癌患者p53、TOPOⅡ、PGP阳性表达情况比较差异均无统计学意义(χ2=1.452,P=0.484;χ2=3.659,P=0.161;χ2=3.877,P=0.144)。见表5。
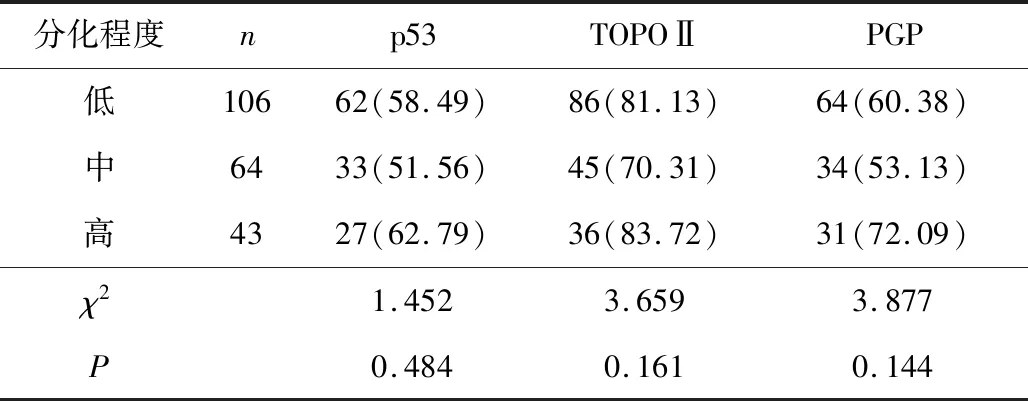
表5 不同分化程度患者p53、TOPOⅡ、PGP阳性表达情况比较 n(%)
3 讨论
恶性肿瘤发病、进展及演变为多步骤、多因素参与的一个复杂生物学过程,且与原癌基因活化和抑癌基因丧失活性具有密切相关性[11-13]。研究[14-15]指出,p53抑癌基因的突变或丢失致使其表达产物p53蛋白功能发生异常,促使食管癌发生、进展,故明确其机制极为重要。本研究结果显示,研究组p53阳性表达率高于对照组,且在不同淋巴结转移、肌层浸润及临床分期患者中存在显著差异。野生型p53通过调节细胞周期、促使细胞分化及细胞凋亡,维持细胞遗传稳定性,但突变型p53则会丧失上述生物学功能,并造成细胞突变,增加肿瘤形成风险。同时,相关研究[16-17]表明,野生型p53半衰期较短,而突变型p53半衰期较长,且具有较高稳定性,因此临床可通过免疫组化等方式检测出突变型p53,并准确判断p53基因异常。另有研究[18]发现,食管癌组织内p53呈异常高表达状态,但正常食管组织内p53则无表达或呈低表达,提示p53基因突变后编码出不具备功能的p53,其丧失促使细胞分化及凋亡、调控细胞周期的功能,无法抑制癌变细胞转化,致使癌变细胞较早发生转移、浸润程度较高等。
近年来,临床对肿瘤多耐药基因研究不断深入,对肿瘤耐药性认知取得进展,其中PGP属多耐药性蛋白产物,其阳性表达情况和细胞耐药程度高度相关[19-20]。PGP属转运蛋白ATP结合家族,其主要分布于具备多耐药细胞膜上,部分表达于细胞质内。研究[21]表明,PGP是一个跨膜药泵蛋白,其分子内不仅存在和药物结合的多个位点,且还有结合于ATP的位点,能结合于多种药物,并通过分解ATP提供能量形式把扩散至细胞的阿霉素、生物碱类及长春新碱等亲脂类药物泵出细胞外,以此降低细胞中药物浓度,造成细胞耐药。同时,肿瘤细胞对化疗药物耐药性,部分是一开始即对其产生耐药,其余则是于化疗后诱导产生,但两者均具备相同生物学基础,即PGP所介导耐药[22-23]。此外,PGP还可间接或直接参与细胞分子代谢及增殖、分化等调控,抵抗caspase依赖性凋亡,于细胞凋亡中发挥重要调节作用。而DNA拓扑异构酶为催化DNA拓扑异构改变的一种酶系,可分为TOPOⅠ及TOPOⅡ,其中TOPOⅡ基因发生点突变后可改变其特异性氨基酸序列,造成TOPOⅡ发生质与量变化,对TOPOⅡ核药物、DNA间结合造成直接影响,并抑制DNA裂解,最终引起耐药[24]。研究[25]指出,以TOPOⅡ作靶点的药物主要包括鬼臼霉素类及蒽环类抗生素,如玫瑰树碱、VP16、多柔比星及新霉素等,TOPOⅡ所介导耐药和细胞中药物靶酶活性变化及DNA修复具有相关性,而化疗是否敏感与TOPOⅡ表达情况相关,若TOPOⅡ表达异常,则会造成肿瘤对抗肿瘤药物发生耐药。
本研究还发现,研究组TOPOⅡ、PGP阳性表达率也高于对照组,并随临床分期、肌层浸润等变化而变化,故结合上述研究认为,食管癌患者p53、TOPOⅡ、PGP阳性表达情况发生异常,且其表达异常与食管癌病灶侵袭、淋巴结转移关系密切,临床可根据p53、TOPOⅡ、PGP阳性表达情况分析食管癌临床分期、肌层浸润等情况,还可参照上述指标表达水平判断疾病耐药性,并依据评估结果调节用药方案,保证治疗有效性、安全性。
综上所述,食管癌患者p53、TOPOⅡ、PGP阳性表达情况异常增高,且随淋巴结转移、肌层浸润及临床分期增高,其阳性表达率越高,临床可通过测定p53、TOPOⅡ、PGP阳性表达情况评估食管癌病情程度、耐药性,为临床制定、调整治疗方案提供一定参考依据。

