卡瑞利珠单抗联合化疗一线治疗晚期食管鳞癌的疗效和安全性分析
许孟丽,孟祥瑞,路 遥,杨媛媛,王 峰 (郑州大学第一附属医院肿瘤科,河南 郑州 450052)
中国食管癌发病率在全球范围内属较高水平,根据WHO统计数据,我国食管癌年新发病例为32.4万人次,大约占到全球的一半[1]。因早期食管癌症状常不明显,导致近75%的患者确诊时已发展为晚期或伴有远处转移。晚期食管癌预后较差,总体5 a生存率不足30%[2]。与欧美国家食管腺癌居多不同,我国食管癌患者90%为食管鳞癌[3]。进展期食管鳞癌的治疗手段包括手术、放疗和化疗,整体疗效已达平台,尤其在以化疗为主的药物治疗和全身治疗方面,多年来疗效一直无显著提高[4]。对于复发或晚期转移性食管鳞癌,一线化疗的客观缓解率(objective response rate,ORR)为30%~50%,中位疾病无进展生存期(progression-free survival,PFS)为4~6个月,中位总生存期(overall survival,OS)为9~12个月[5]。
KEYNOTE-181研究[6]的数据显示,帕博利珠单抗单药二线治疗程序性细胞死亡配体-1(programmed cell death-Ligand 1,PD-L1)阳性晚期或转移性食管癌以及食管胃交界部腺癌患者,可以显著延长患者的OS。在后续的ESCORT研究[7]、ATTRACTION-03研究[8]及美国临床肿瘤学会年会上公布的RATIONALE-302研究[9]中都看到了类似的研究结果。自此,免疫治疗成为食管鳞癌患者标准二线治疗方案。
如何能将免疫治疗带来的治疗优势前移,成为近年来的重要研究方向。2021年KEYNOTE-590[10]、ESCORT-1st[11]等研究重磅数据相继公布,均证明免疫联合化疗相较单纯化疗带来了可喜的生存获益,中位PFS从单纯化疗的5.5~5.8个月增加到5.8~7.2个月,中位OS从单纯化疗的9.8~12.5个月更是增加到12.6~17个月。ESCORT-1st研究中72.1%的ORR同样让人惊喜,此项研究试验组采用了卡瑞利珠单抗联合化疗的方案,结果显示,15.3个月的中位OS、6.9个月的中位PFS以及72.1%的ORR均较单纯化疗组明显受益。卡瑞利珠单抗联合化疗有望成为晚期食管鳞癌一线治疗的新方案。本文通过回顾性分析探讨卡瑞利珠单抗联合化疗一线治疗晚期食管鳞癌的疗效和安全性,现报道如下。
1 资料与方法
1.1 一般资料收集郑州大学第一附属医院2019年6月至2021年6月收治的43例晚期食管鳞癌患者的临床资料。
纳入标准:1)年龄18~75岁;2)胃镜病理学诊断食管鳞癌;3)有不切除的局部晚期或复发性疾病,或有远处转移性疾病;4)既往未接受过针对晚期或转移性食管鳞癌的系统性治疗;5)有符合RECIST 1.1标准的可测量病灶;6)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~1分;7)预计生存期>3个月。排除标准:1)既往接受过程序性死亡因子-1(programmed cell death protein 1,PD-1)/PD-L1抗体、CTLA-4抗体,或其他针对PD-1/PD-L1抑制剂的治疗;2)既往接受过化疗;3)存在严重或不能控制的全身性疾病;4)有活跃的自身免疫性疾病;5)有充血性心力衰竭、心肌梗死病史;6)存在脑转移及活动性周围神经系统转移;7)临床资料缺失。
1.2 治疗方法所有患者均采用卡瑞利珠单抗联合化疗。卡瑞利珠单抗:200 mg/次,联合化疗每3周重复;维持治疗每2周重复。化疗采用紫杉醇(白蛋白结合型)联合奈达铂方案: 紫杉醇(白蛋白结合型)175 mg/m2,静脉滴注30 min,第1天;奈达铂:75 mg/m2,静脉滴注2 h,第1天;每3周重复。化疗药物剂量可根据患者的耐受情况调整。
1.3 疗效评价所有患者每6周行增强计算机断层扫描或磁共振成像评价疗效。根据实体瘤疗效评价标准RECIST 1.1,近期疗效分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable response,SD)、进展(progressive disease,PD),以CR+PR计算ORR,以CR+PR+SD计算疾病控制率(disease control rate,DCR),主要研究终点为ORR,次要研究终点为DCR。PFS、OS自确诊首日开始计算,PFS截至肿瘤复发、进展、死亡或末次随访时间,OS截至死亡或末次随访时间。
1.4 统计学处理采用SPSS 26.0进行统计学分析;计数资料用百分数表示,比较用χ2检验;生存分析用Kaplan-Meier法和log rank检验;用受试者工作特征(receiver operating characteristic,ROC)曲线确定截断值;检验水准α=0.05。
2 结果
2.1 基线数据入组43例晚期食管鳞癌患者的年龄39~70岁,中位年龄59岁,其中<65岁26例(60.4%)、≥65岁17例(39.6%);男34例(77.2%),女9例(20.4%);ECOG评分0分13例(30.2%),1分30例(69.8%);高分化12例(27.9%),中分化15例(34.9%),低分化17例(37.2);局部复发5例(11.6%),远处转移37例(86.0%),局部复发和远处转移1例(2.4%);肺转移6例(14.0%),肝转移4例(9.3%),淋巴结转移31例(72.1%),其他部位转移1例(2.3%);转移器官数量≤1个28例(65.1%),转移器官数量≥2个15例(34.9%);PD-L1阳性联合评分<1分23例(53.5%),≥1分20例(46.5%)。
2.2 近期疗效43例患者中,CR 4例(9.3%),PR 26例(60.4%),SD 9例(20.9%),PD 4例(9.3%),ORR为69.8%(30/43),DCR为90.7%(39/43)。PD-L1阳性联合评分<1分的23例患者中,CR 2例(8.6%)、PR 13例(56.6%)、SD 6例(26.2%)、PD 2例(8.6%),ORR为65.2%,DCR为91.3%;PD-L1阳性联合评分≥1分的20例患者中,CR 2例(10.0%)、PR 13例(65.0%)、SD 3例(15.0%)、PD 2例(10.0%),ORR为75.0%,DCR为90.0%;两者的ORR、DCR比较差异均无统计学意义(χ2=3.164,P=0.757;χ2=2.894,P=0.883)。
2.3 生存分析43例患者中位PFS为6.9个月(95%CI:6.3~7.5),中位OS为14.5个月(95%CI:11.4~17.6)(图1)。PD-L1阳性联合评分<1分和≥1分患者中位PFS和OS比较差异均无统计学意义(6.9、6.7个月,HR=0.775,95%CI:0.350~1.628,P=0.470);15.2、13.0个月,HR=0.684,95%CI:0.320~1.462,P=0.684)。采用ROC曲线确定患者基线、3周、6周的中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)截断值分别为2.35,3.38和3.63,据此分为低NLR组和高NLR组。基线低NLR组中位PFS长于基线高NLR组(10.8、6.7个月,HR=2.539,95%CI:1.004~6.416,P=0.041);2组中位OS比较差异无统计学意义(10.3、14.5个月,HR=1.251,95%CI:0.545~2.870,P=0.597)。3周低NLR组和3周高NLR组中位PFS和OS比较差异均无统计学意义(6.9、6.9个月,HR=1.516,95%CI:0.550~4.179,P=0.415;15.0、11.5个月,HR=1.501,95%CI:0.563~4.002,P=0.413)。6周低NLR组中位PFS长于6周高NLR组(6.9、6.4个月,HR=0.393,95%CI:0.156~0.992,P=0.040);2组中位OS比较差异无统计学意义(12.0、15.2个月,HR=0.436,95%CI:0.183~1.039,P=0.054)。
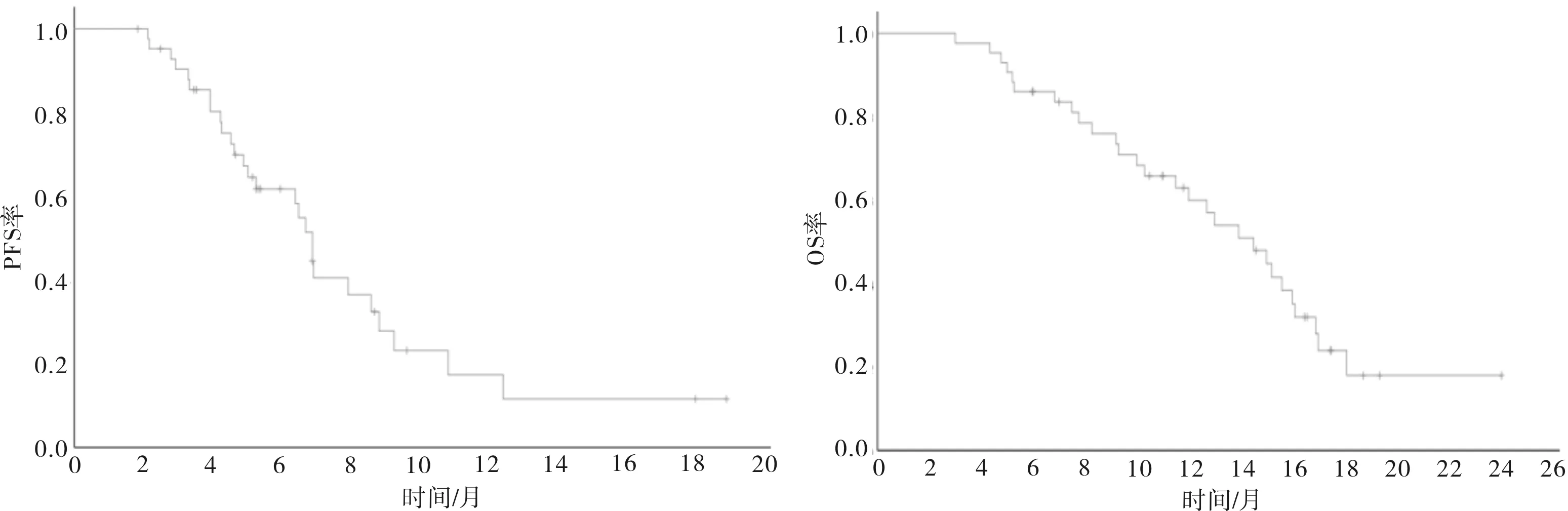
图1 43例患者的PFS、OS生存曲线
2.4 不良反应43例患者中,共有40例(93.0%)患者发生不良反应,其中40例(93.0%)发生治疗相关不良反应、35例(81.4%)发生免疫相关不良反应。最常见的治疗相关不良反应为脱发、贫血、白细胞减少、中性粒细胞减少、外周神经病变、恶心等。最常见的免疫相关不良反应为反应性毛细血管增生症、甲状腺功能减退等。无因不良反应而终止治疗和治疗相关性死亡患者。见表1。
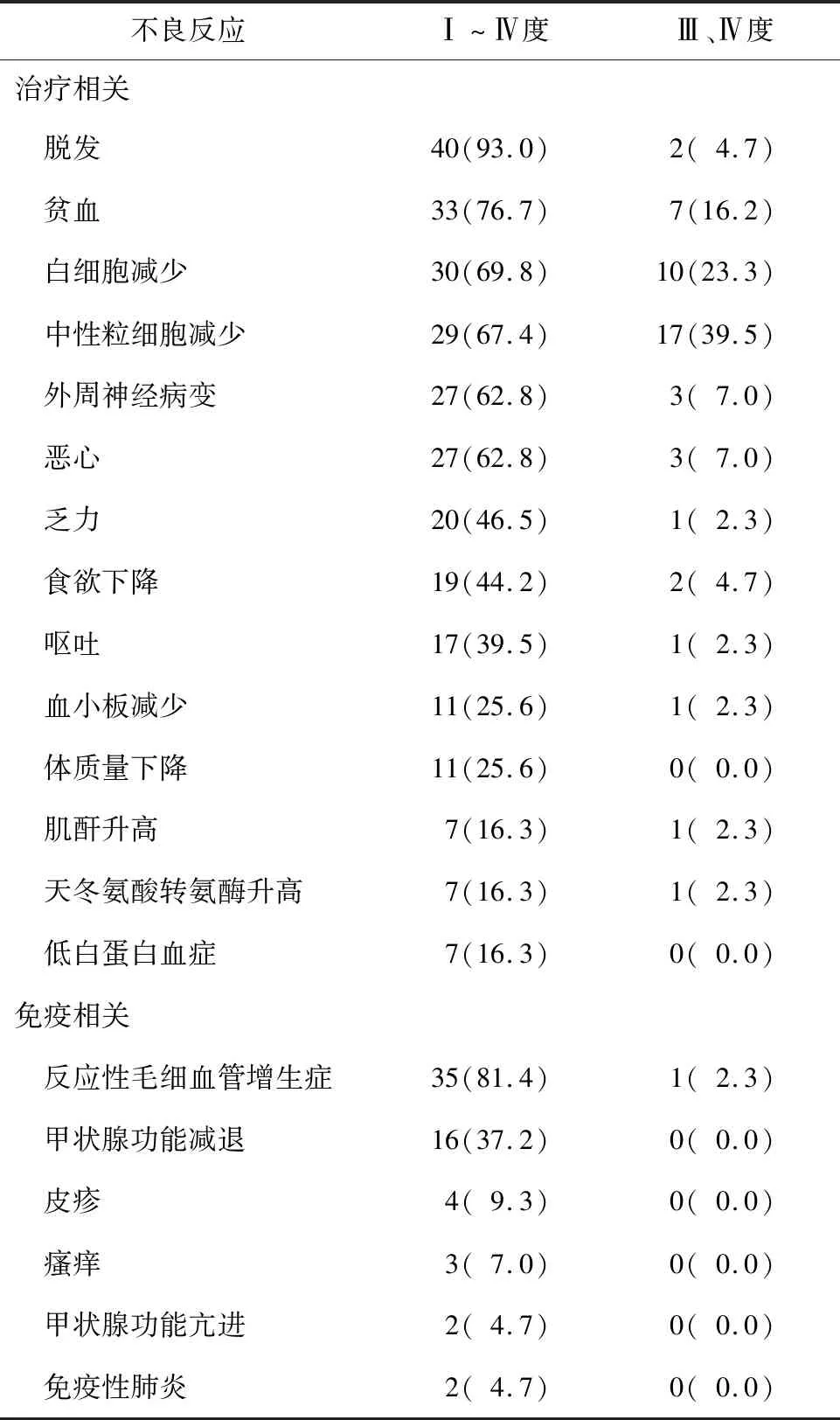
表1 43例患者不良反应发生情况 n(%)
3 讨论
食管鳞癌是一种具有高肿瘤突变负担的免疫原性肿瘤[12],25%~40%的患者过表达PD-L1[13]。其受体PD-1属于CD28超家族成员,是一种必不可少的免疫抑制分子[14]。在肿瘤微环境中,肿瘤细胞和肿瘤相关抗原呈递细胞表达PD-L1[15],与PD-1结合后促进下游的T细胞受体/CD3复合体和Zeta链相关的蛋白激酶70发生去磷酸化,进而抑制磷脂酰肌醇3激酶等的活化,抑制下游通路中间变性淋巴瘤激酶、细胞外调节蛋白激酶等的激活[16],从而进一步诱导CD8+T细胞和CD4+T细胞处于失活状态,抑制相关细胞因子分泌和T细胞增殖,起到免疫负调控作用。阻断PD-1和PD-L1的相互作用可以恢复T细胞的活性,增强免疫应答[17]。因此,通过PD-1或PD-L1抑制剂阻断PD-1途径可能是治疗食管癌的可行方法。
KEYNOTE-028研究[18]和KEYNOTE-180研究[19]均证实帕博利珠单抗单药三线治疗食管鳞癌OS显著获益。鉴于此,开展了一系列PD-1抑制剂单药二线治疗晚期食管鳞癌的研究。KEYNOTE-181研究[6]证实,在PD-L1阳性联合评分≥10分的患者中,帕博利珠单抗组的中位OS对比化疗延长了2.6个月(9.3、6.7个月);在食管鳞癌患者中,帕博利珠单抗组较化疗组中位OS提高了1.1个月(8.2、7.1个月,HR=0.78,P<0.010)。另外,ATTRACTION-3研究[8]表明纳武利尤单抗二线治疗晚期食管鳞癌对比化疗具有更优的中位OS(10.9、8.4个月),而且与PD-L1表达无关。ESCORT研究[7]进一步证实,卡瑞利珠单抗组对比化疗组延长了2.1个月的中位OS(8.3、6.2个月,HR=0.71,P=0.001),12个月OS率提高了11.4%(33.7%、22.3%)。以上研究均证实PD-1抑制剂作为食管鳞癌二线治疗的有效性。
基于在二线及后线取得的突出成果,免疫治疗向晚期食管癌一线推进。KEYNOTE-590研究[20]结果显示,帕博利珠单抗联合化疗组食管鳞癌较单纯化疗组OS显著获益(12.6、9.8个月,P=0.001,HR=0.72,95%CI:0.60~0.88),PD-L1阳性联合评分≥10分的食管鳞癌在帕博利珠单抗联合化疗治疗后OS获益更加显著(13.9、8.8个月,HR=0.57,95%CI:0.43~0.75,P<0.001)。
卡瑞利珠单抗是一种人源化、选择性IgG4-κ单克隆抗PD-1抗体,对多种肿瘤具有抗肿瘤活性[21]。一项卡瑞利珠单抗联合阿帕替尼和化疗一线治疗晚期食管鳞癌Ⅱ期临床研究[22]结果显示,29例患者的CR率16.7%(5/29),PR率63.3%(19/29),ORR为80.0%,DCR为96.7%,中位PFS为6.85个月,中位OS未观察到。在随后进行的ESCORT研究[7]和ESCORT-1st研究[11]中,卡瑞利珠单抗或联合化疗作为二线及一线治疗晚期或转移性ESCC患者的OS率和ORR均显著高于单纯化疗。这说明卡瑞利珠单抗联合细胞毒药物治疗显示出令人鼓舞的抗肿瘤活性。
本文通过回顾性分析探讨了卡瑞利珠单抗联合化疗一线治疗晚期食管鳞癌的有效性和安全性。结果显示,中位PFS为6.9个月,中位OS为14.5个月,ORR为69.8%,中位OS、ORR均未超过ESCORT-1st研究[12]的15.3个月和72.1%,中位PFS与ESCORT-1st研究持平,均为6.9个月。但其69.8%的ORR远超过Keynote-590研究[20]的45.0%,6.9个月的中位PFS也超过Keynote-590研究的6.3个月。最令人惊喜的是其DCR高达90.7%,这在之前的研究中尚未有报道。
在针对生物标志物所做的探索性分析中,KEYNOTE系列研究如KEYNOTE-180[19]、181[6]、061[23]及062[24]研究均证实PD-L1阳性联合评分越高,免疫治疗的OS获益越明显。近几年,NLR在免疫治疗疗效预测方面的价值也逐渐被肯定[25-27]。NLR通过简单的血常规化验获得,避免了组织样本不易获得或妥善保存的局限性。本研究进行了PD-L1及NLR亚组的生存分析。在PD-L1亚组中,PD-L1阳性联合评分≥1分患者的ORR、中位PFS、中位OS均较<1分患者有所提高,但尚未显示出统计学差异,尚不能说明PD-L1表达与疗效有关。这一发现与ESCORT-1st研究结果一致。在NLR亚组中,基线低NLR组中位PFS长于基线高NLR组,6周低NLR组中位PFS长于6周高NLR组,这说明基线及6周NLR可能影响食管癌一线免疫联合化疗的PFS,能作为其良好的疗效预测因子。
在不良反应方面,最常见的治疗相关不良反应中脱发、外周神经病变推测与紫杉醇(白蛋白结合型)相关,贫血、白细胞减少、中性粒细胞减少及其出现的较大比例的重度不良反应提示紫杉醇(白蛋白结合型)联合奈达铂的双药化疗骨髓抑制较明显,临床应关注其血液学毒性。最常见的免疫相关不良反应为反应性毛细血管增生症、甲状腺功能减退,仅有1例重度反应性毛细血管增生症,其发生考虑与卡瑞利珠单抗相关,大多数不需要特殊治疗,停药后可自行消退,有报道称其发生与抗肿瘤反应呈正相关[28]。
综上所述,卡瑞利珠单抗联合化疗治疗晚期食管鳞癌是安全有效的,并可能具有协同作用,且此作用与PD-L1表达无关,NLR可作为其疗效预测因子。
但是,本研究存在一些局限性,首先,此研究是一项单臂的回顾性分析且样本量较少。其次,除PL-L1表达及NLR外,其他与疗效相关的生物标志物的检测仍有待分析。最后,这些患者在疾病进展后大多数接受了跨线的免疫检查点抑制剂治疗,这可能会影响对总生存期的估计。这些尚需前瞻性大样本量的研究进一步研究。

