林下栽培的大球盖菇多酚提取工艺条件优化*
胡德胜,李 健**,张 岩,钟丹苗,方雪飞,廖营忠,苏干光
(1.桐庐县林业技术推广中心,浙江 桐庐 311500;2.桐庐县森林病虫害防治站,浙江 桐庐311500;3.桐庐康源菜竹专业合作社,浙江 桐庐 311512;4.开化县山禾食用菌专业合作社,浙江 开化 324399)
大球盖菇(Stropharia rugosoannulata) 又名皱环球盖菇、皱球盖菇、酒红球盖菇、赤松茸,属于担子菌门(Basidiomycota) 担子菌纲(Basidiomycetes)伞菌目(Agaricales) 球盖菇科 (Strophariaceae) 球盖菇属(Stropharia),是一种草腐食用菌。大球盖菇营养丰富、口味绝佳,被称为“素中之荤”,作为一种特色农业产品,受到联合国粮食及农业组织(FAO) 的青睐[1]。大球盖菇富含蛋白质、多糖、矿质元素、维生素等生物活性物质,还含有17种氨基酸,其中人体必需氨基酸种类齐全[2]。
大球盖菇的菌丝有很强的生理活性和抗逆性,可直接利用稻草、竹屑、茭白叶等农作物秸秆进行生料栽培,具有取材方便、价格低廉和操作简便的优点[3]。栽培过程中不需要菇棚,也无需装袋、灭菌和接种设备。冬季闲置田地、林地、桑果园等都可作为栽培场地[4]。特别是林下套种大球盖菇的栽培模式,可在不占用农田的前提下实现对林间资源的充分利用。该模式可在短期获得较高经济效益的同时,维持农业生态环境的健康、持续发展。
多酚类物质主要包括酚酸、类黄酮、花色苷类等,广泛存在于植物、食用菌中[5]。多酚结构多样,具有抗氧化、抗病毒、抗菌等药理活性[6]。乙醇作为一种常用的绿色溶剂,已广泛应用于天然产物中多酚的提取[7-8]。超声处理常用于食品加工领域,是一种绿色无污染的辅助提取技术,具有耗时短和效率高的优点[9-11]。采用超声处理辅助乙醇提取大球盖菇多酚的方法具有良好的应用潜力。
目前对林下栽培的大球盖菇中多酚提取工艺的研究较少,因此以林下人工栽培的大球盖菇为原料,采用超声处理辅助乙醇提取多酚的方法,设计单因素试验,利用响应面优化法考察不同的乙醇体积分数、超声温度和超声时间对大球盖菇子实体多酚提取量的影响,对提取工艺进行优化,以期为深入开发和利用林下栽培的大球盖菇资源提供依据。
1 材料和方法
1.1 材料与试剂
大球盖菇子实体样品为杭州市桐庐县林下栽培所得。
福林酚(BR),上海源叶生物科技有限公司;没食子酸标准品,北京索莱宝科技有限公司;乙醇、碳酸钠等(国产分析纯),国药集团化学试剂有限公司。
1.2 仪器
KQ-250DE型数控超声波清洗器,昆山超声仪器有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;HH-1数显恒温水浴锅,上海福玛实验设备有限公司;可见分光光度计,上海精密科学仪器有限公司。
1.3 试验方法
1.3.1 标准曲线绘制
用福林酚法[12]测定多酚含量。选择没食子酸为标准品,精确量取没食子酸0.04 g,加入10 mL乙醇,搅拌溶解,加水定容至100 mL,从而配制出400 mg·L-1的没食子酸标准溶液。分别取没食子酸标准溶液 1 mL、2 mL、3 mL、4 mL、5 mL、6 mL定容至 10 mL,即得到 40 mg·L-1、80 mg·L-1、120 mg·L-1、160 mg·L-1、200 mg·L-1、240 mg·L-1的没食子酸稀释液。向各质量浓度没食子酸稀释液中各加入福林酚试剂1 mL,振荡均匀,静置3 min~4 min;分别加入 7.5%碳酸钠溶液 5 mL,加水定容至25 mL;40℃水浴加热30 min;用分光光度计在765 nm处测定吸光度值,纵坐标为吸光度值,横坐标为没食子酸质量浓度,绘制标准曲线。
1.3.2 林下栽培的大球盖菇的多酚提取及测定
将林下栽培的大球盖菇样品进行冷冻干燥、粉碎,称取2.0 g试样于具塞锥形瓶中。加入60 mL的一定浓度的乙醇溶液,按照设定的超声温度和超声时间进行萃取。然后在3 000 r·min-1下离心10 min,上清液定容至100 mL,从中吸取1 mL提取液,按照1.3.1没食子酸标准溶液测定方法测定其多酚含量。
林下栽培的大球盖菇中多酚提取量(Y,mg·g-1)的计算公式为:

式中:C为待测液质量浓度(mg·mL-1);N为稀释倍数;V为提取液体积(mL);M为样品质量(g)。
1.3.3 提取条件的单因素试验
参照1.3.2中的提取方法提取大球盖菇多酚,设计3组单因素试验,每组进行3个平行试验。
1) 固定乙醇体积分数为70%以及超声温度为40℃,在提取时间分别为20 min、30 min、40 min、50 min、60 min、70 min的条件下进行超声提取,分析超声时间对大球盖菇子实体多酚提取量的影响。
2) 固定超声温度为40℃以及液料比为30∶1,分别在乙醇体积分数为30%、40%、50%、60%、70%的条件下,进行30 min的超声提取,分析不同乙醇体积分数对大球盖菇子实体多酚提取量的影响。
3) 固定乙醇体积分数为70%以及液料比为30∶1,分别在超声温度为30℃、40℃、50℃、60℃、70℃的条件下,进行30 min超声提取,分析超声温度对大球盖菇子实体多酚提取量的影响。
1.3.4 响应面优化试验
利用Box-Behnken中心组合试验设计原理,在单因素试验所确定的范围内,采用3因素3水平设计响应面,试验数据用Design Expert 8.05软件进行分析。以-1,0,1依次对自变量的试验水平进行编号,试验因素及水平设计见表1。

表1 响应面分析因子及水平Tab.1 Factors and levels of response surface analysis
2 结果与分析
2.1 大球盖菇多酚提取的单因素试验结果
不同超声时间对林下栽培的大球盖菇子实体多酚提取量的影响见图1。
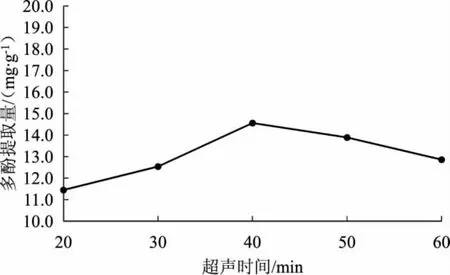
图1 不同超声时间对大球盖菇多酚提取量的影响Fig.1 Effect of different ultrasonic times on polyphenol yeild of Stropharia rugosoannulata
由图1可知,随着超声时间的增加,多酚提取量先迅速上升,后呈逐渐下降的趋势。当超声时间为20 min~40 min时,多酚提取量随超声时间的增加而增加。当超声时间为40 min时大球盖菇子实体多酚提取量达到最大值。当超声时间超过40 min后,多酚提取量开始降低。据此,选择30 min、40 min和50 min作为超声时间响应面分析的3个水平。
不同乙醇体积分数对林下栽培的大球盖菇子实体多酚提取量的影响见图2。

图2 不同乙醇体积分数对大球盖菇多酚提取量的影响Fig.2 Effects of different ethanol volume fractions on polyphenol yield of Stropharia rugosoannulata
由图2可知,当乙醇体积分数为30%~60%时,随着乙醇体积分数的上升,大球盖菇多酚提取量也随之增加,当体积分数为60%时,子实体多酚提取量达到最大值。在乙醇体积分数超过60%时,子实体多酚提取量有所下降。原因可能是多酚的存在形式有结合态、游离态及酯化态等,部分多酚与蛋白质结合在一起形成结合态,乙醇体积分数过高导致蛋白质变性,从而影响结合态多酚的溶出。综合以上因素,乙醇体积分数响应面分析的3个水平选择50%、60%和70%。
不同超声温度对林下栽培的大球盖菇多酚提取量的影响见图3。
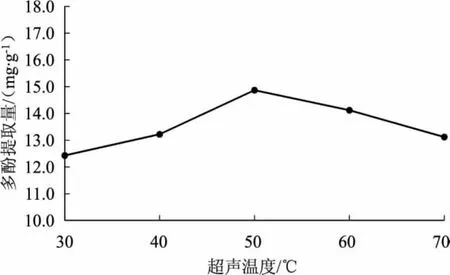
图3 不同超声温度对大球盖菇多酚提取量的影响Fig.3 Effect of different ultrasound temperatures on the polyphenol yeild of Stropharia rugoso annulata
由图3可知,当超声温度为30℃~50℃时,子实体多酚提取量随超声温度的升高而升高;当超声温度为50℃时,子实体多酚提取量达到最大值。原因可能是超声温度越高溶液中分子运动越强,大球盖菇样品充分溶解,多酚溶出量增加。而后随着超声温度继续上升,多酚提取量逐渐下降。原因可能是高温导致部分多酚类物质结构发生变化,或溶液中的杂质增多,使得多酚类物质的提取量下降[13]。由此,超声温度响应面分析的3个水平选择40℃、50℃和60℃。
2.2 响应面优化试验结果及分析
2.2.1 响应面试验结果
根据Box-Behnken中心组合试验设计原理,以林下栽培的大球盖菇子实体多酚提取量作为响应值,设计3因素3水平的响应面分析试验,试验结果见表2。

表2 响应面设计及试验结果Tab.2 Response surface design and experimental results
用Design Expert 8.05软件对表2试验数据进行分析,得出多酚提取量对超声温度、超声时间和乙醇体积分数的多元二次回归方程为:
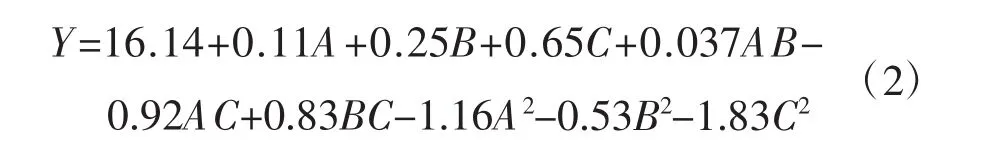
该回归方程的相关系数R2为0.9853。
对上述方程进行方差分析,结果见表3。

表3 方差分析Tab.3 Analysis of variance model
由表3可知,目标函数为多酚提取量的多元二次方程回归效果均达到极显著水平(P<0.01);决定系数R2达到0.985 3,证明模型与实际试验能够较好地拟合;校正决定系数R2adj达到0.966 8,证明该模型能解释96.68%响应值的变化;模型预测值与实际值不拟合的概率表示为模型的失拟项,表3中模型失拟项 P=0.677 2>0.050 0,证明模型失拟项不显著。此外,乙醇体积分数(B)、超声温度(C)对响应值影响显著 (P<0.05),AA、BB、CC 以及 AC 和BC的交互项对多酚提取量的影响极显著(P<0.01)。3个因素对林下栽培的大球盖菇子实体多酚提取量影响大小的顺序依次为:超声温度(C) >乙醇体积分数(B) >超声时间(A)。
2.2.2 响应面图形分析
依据以回归方程制作的响应曲面图与拟合的响应曲面形状,研究不同超声时间、超声温度及乙醇体积分数对林下栽培的大球盖菇子实体多酚提取量的影响。使模型中的超声温度、超声时间及乙醇体积分数皆固定在水平0,进而获得另外2个因素的交互影响结果,二次回归方程的响应面及其等高线图见图4~图6。
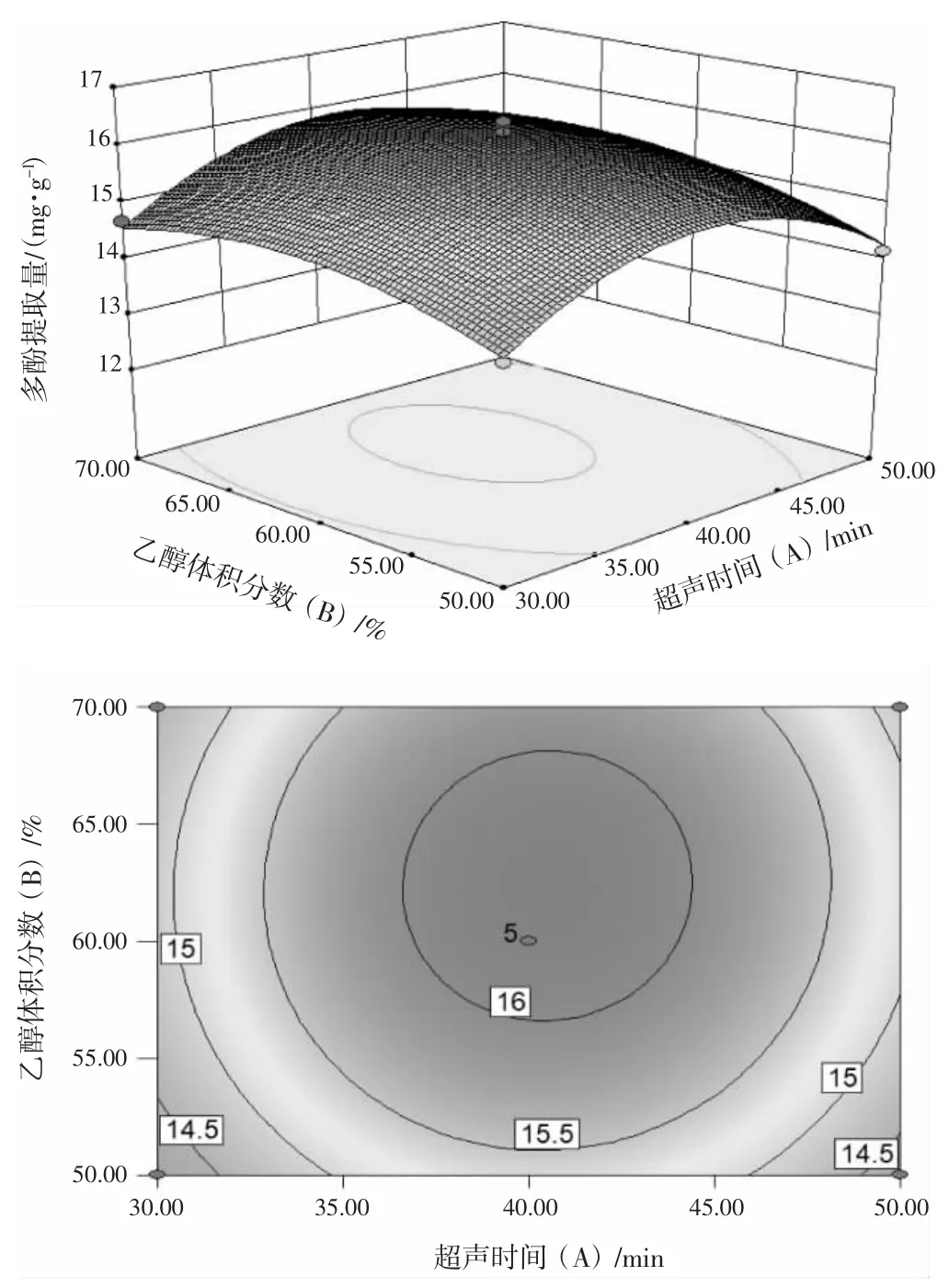
图4 超声时间和乙醇体积分数交互作用对多酚提取量影响的响应面及等高线图Fig.4 Response surface and contour of the interaction between ultrasonic time and ethanol volume fraction on polyphenol yeild

图5 乙醇体积分数和超声温度交互作用对多酚提取量影响的响应面及等高线图Fig.5 Response surface and contour of the interaction between ethanol vdrume fraction and ultrasonic temperature on pdyphenol yeild

图6 超声时间和超声温度交互作用对多酚提取量影响的响应面及等高线图Fig.6 Response surface and contour of the interaction between ultrasonic time and ultrasonic temperature on pdyphenol yeild
由图4~图6可知,超声温度(C) 是影响大球盖菇子实体多酚提取量最显著的因素,在等高线圆心处出现极值条件,响应面弧度出现较大变化;其次是乙醇体积分数(B);超声时间(C) 对响应值影响较小,表现为响应面变化弧度较为平缓。交互效应的强弱可用等高线趋势的变化来表示,两因素交互作用显著用椭圆形展现,相反则呈圆形。因此,超声温度(C) 与乙醇体积分数(B) 的交互作用对多酚提取量有显著影响。
2.3 验证试验
依据Box-Behnken试验得出的结果以及回归方程,使用Design-Expert 8.05对数据进行分析,得到多酚提取优化条件:超声时间为39.3 min,乙醇体积分数为64.68%,超声温度为53.1℃。在此优化条件下计算得到林下栽培的大球盖菇子实体多酚提取量理论值为 16.97 mg·g-1。
为验证模型预测值与实际值的相关性(即对响应面优化模型可靠性进行验证),以及实际生产中大球盖菇子实体中多酚提取量情况,依据软件计算出的最佳提取条件进行3次平行重复试验。得到多酚提取量分别为 16.56 mg·g-1、16.58 mg·g-1、16.63 mg·g-1,多酚实际提取量的平均值为 16.59 mg·g-1,达到了理论预测值的97.76%。试验结果与模型较好拟合,说明该模型可对林下栽培的大球盖菇子实体多酚提取量较好地进行模拟和预测。
3 结论
林下栽培的食用菌具有原生态的特质,与大棚栽培的子实体相比,其生长环境更加接近自然状况,生产的大球盖菇等食用菌营养丰富、品质好。
通过响应面试验设计,利用超声处理辅助乙醇萃取,优化得出林下栽培的大球盖菇子实体多酚的工艺提取条件:超声时间为39.3 min,乙醇体积分数为64.68%,超声温度为53.1℃。在该条件下,林下栽培的大球盖菇子实体多酚提取量达16.59 mg·g-1。同时,依据最佳提取条件进行的3次平行试验,结果证明了该模型可靠,可用于大球盖菇子实体多酚提取量的预测。
此外,林业与食用菌产业的交叉优势,可较大幅度提高竹林地的生产力和经济效益,实现资源的合理循环利用,构成一个良性的原生态食用菌栽培模式,值得推广。

