拟南芥微丝加帽蛋白β亚基参与壳梭孢素诱导的气孔开放过程
王 攀, 李 昭, 赵盖晴, 武玥冉, 豆丽茹, 于 荣*
(1)首都师范大学生命科学学院, 北京 100048;2)中国农业大学生物学院, 北京 100193)
气孔主要位于植物叶表,它是植物体与外界进行水分和气体交换的窗口。气孔可以灵敏地感知激素、光、干旱和低温等外源信号,经过一系列信息传递,使气孔有序开闭,从而调节植物光合、蒸腾以及植物免疫等多种生理活动[1, 2]。壳梭孢素(fusicoccin,FC)是扁桃壳梭孢菌(FusicoccumamygdaleDel.) 产生的一种次生代谢物,可引起绝大多数高等植物气孔开放和种子萌发[3],以及诱导枫叶槭培养细胞产生一系列逆境响应,例如DNA片段化、脂类过氧化反应和细胞凋亡蛋白酶的激活等[4]。在动物细胞中,壳梭孢素甚至可以诱导诸如乳腺癌、神经胶质瘤细胞的凋亡[5]。研究发现,FC能够高亲和地结合质膜上H+-ATPase/14-3-3蛋白复合体,稳定二者之间的相互作用,并强力激活H+-ATPase酶的活性,使大量H+外流,刺激K+内流,促进气孔开放[6]。除了H+-ATPase,FC的其它作用靶物也不断被发现。例如拟南芥保卫细胞液泡膜上的一个NO3-/H+液泡载体蛋白 (vacuolar transporter)—AtCLCa (ArabidopsisthalianaChloride Channel a),也可以响应FC,调节细胞质基质的pH值,修正胞质内稳态 (cytosolic homeostasis) 及气孔运动[7]。枫叶槭培养细胞中,FC可以诱导产生H2O2和一氧化氮NO,以及它们的反应产物过氧硝酸盐 (ONOO-) ,调节线粒体内热激蛋白90 (heat shock protein 90,Hsp90)、内质网结合蛋白 (binding protein,Bip)和胞质14-3-3蛋白的水平变化。此外,在3%蔗糖浸泡下,不论是异位分化形成的聚集成簇保卫细胞(ectopically-differentiated and clustered guard cells),还是分散气孔保卫细胞(spaced stomata),FC诱导下,细胞内微管骨架仍均为辐射状排布,气孔开放,但气孔开度总体小于无蔗糖浸泡的对照[8]。FC作为具有五十多年研究历史的植物毒素 (phytotoxin) ,其在植物上的分子作用机制研究,不仅能够加深人们对它在植物中的功能的理解,而且也有助于拓展FC针对14-3-3靶蛋白在动物及药物研发领域的应用前景[6]。
另一方面,在气孔运动信号转导网络中,保卫细胞微丝骨架 (microfilaments,MF或actin filaments, F-actins)是一个活跃的信息传递者。在脱落酸ABA (abscisic acid) 、光、二氧化碳、干旱、病原体入侵、渗透压等多种因素引起的气孔运动中,均发挥重要作用[9-12]。保卫细胞已经成为研究单一细胞内早期信号传递事件 (early signaling events)与微丝动态之间相互作用特征的强有力实验模式系统[13]。Shimono等[10]利用高分辨率的定量图像分析技术评估发现,不论在日常的光/暗循环,还是致病菌 (flg22和clitin)侵染条件下,反映保卫细胞内微丝精细定位的度量参数 (例如成束程度-bundling、密度-density、方向-orientation)均会随着气孔的开关发生相应变化,微丝骨架这种在时间、空间上高度有序的动态变化,对于维持气孔正常开关和植物免疫激活均有重要意义。其中,微丝结合蛋白家族(actin-binding proteins, ABPs) 是微丝动态组装最直接的调控者和实施者,在气孔运动过程中不断发现微丝结合蛋白的参与[14]。例如,拟南芥微丝结合蛋白SCAB1 (stomatal closure-related actin binding protein1) 功能缺失会阻碍保卫细胞微丝动态重排,导致ABA、H2O2、CaCl2诱导的气孔关闭延迟,对干旱胁迫超敏感[15]。保卫细胞中的另一种微丝结合蛋白ARP2/3 (actin-related proteins, ARPs)复合体突变后,破坏了保卫细胞对ABA、CaCl2及光/暗信号的响应,抑制ABA引起的保卫细胞微丝骨架纤维的快速崩解。ARP2/3在ABA经H2O2信号使气孔关闭的信号通路中是必需的[16]。此外,在ABA和干旱引起的气孔运动中,蛋白激酶CKL2 (casein kinase1-like protein2)直接磷酸化微丝解聚因子ADF4 (actin depolymerizing factor 4),抑制其解聚微丝的活性,调节微丝稳定性以及气孔关闭运动[17]。
拟南芥加帽蛋白 (Arabidopsiscapping protein,AtCP) 是一种异二聚体蛋白质,由α亚基 (CPA) 以及β亚基 (CPB) 构成[18],两个亚基相互协同,完成微丝正极的加帽封端。CPA的C端区域先与微丝末端酸性氨基酸残基通过静电反应而吸引,随后β亚基C端疏水面结合在微丝末端疏水“裂缝”处 (hydrophobic cleft)。加帽蛋白与微丝末端结合后,抑制游离单体肌动蛋白(G-actin)向微丝纤维末端的进一步添加聚合或者微丝解聚,稳定微丝结构[19]。在拟南芥中,CPA和CPB存在于所有组织中,但表达水平明显不同。GUS染色发现,拟南芥幼苗AtCPA主要表达在下胚轴和子叶,AtCPB则出现在整个幼苗[20]。利用拟南芥CP的过表达植株和敲低植株研究发现,提高或降低CP的表达水平,可以改变下胚轴表皮细胞中微丝的密度和成束程度,以及末端具不同伸长速率的微丝比例 (proportion of filament ends with different elongation rate),调节微丝长度和组装周期 (lifetime),与黑暗中下胚轴表皮细胞伸长生长正相关。CP还是一种膜连接蛋白质,也是目前已知唯一可以与磷脂信号分子—磷脂酸 (phosphatidic acid,PA) 结合的微丝结合蛋白质。PA与CP结合会抑制CP与F肌动蛋白(F-actin)末端结合的封端活性,从而刺激微丝持续组装生长,参与花粉管顶端生长[21]。在植物免疫应答过程中,活性氧 (reactive oxygen species,ROS) 可以通过CP将信号传递至微丝骨架,参与植物先天免疫信号转导通路[22]。不论是拟南芥生长发育还是植物先天免疫中,CP都扮演着信号转导器 (transmitter) 的角色。那么在气孔运动庞大而复杂的信号通讯网络中,CP是否也同样发挥作用呢?关于AtCP的可见报道,主要集中于下胚轴及花粉管伸长、微生物入侵植物免疫反应以及植物热激胁迫等方面[18,20,23],其在气孔运动信号通路中的作用尚不明晰。结合Wang等[20]发现,拟南芥热激 (45℃,40~45 min)处理下,与CPA相比,只有AtCPB表现出明显的负调节植物热激耐受性的作用。cpb突变体细胞内微丝的完整性和稳定性远远好于野生型和cpa,显示AtCPB亚基基因表达下调对于提高植物耐热性的独特意义,以及该亚基在植物应答逆境胁迫中的重要作用。因此,本文以CP-β亚基为切入点,以CP-β亚基突变体cpb-3为主要材料,运用药理学实验、激光共聚焦扫描显微镜术、非损伤微测技术等从气孔开度、离子流动以及微丝排布变化等不同的角度,初步探讨CPB在气孔运动中的作用机制,以及其上下游可能的信号因子。
1 材料与方法
1.1 植物材料
拟南芥野生型植株 (Col) 、CP-β亚基T-DNA插入 (SALK_101017) 功能缺失突变体cpb-3、GFP-ABD2转基因植株以及带有GFP-ABD2标记的cpb-3突变体。以上植物材料由中国农业大学毛同林教授和清华大学黄善金教授赠予,突变体均为经三引物法鉴定后的纯合突变体。将成熟饱满种子加入适量蒸馏水置于4 ℃环境下春化3~5 d,播种于1/2 MS培养基,置于光照培养箱中 (16/8,温度22 ℃/18 ℃,光照强度120 μmol/ m2s,相对湿度75%) ,待长出4片叶片时将幼苗移植到灭菌的含有蛭石的培养土中,无任何胁迫条件下继续生长4周左右供实验使用。
1.2 试剂
所用表皮条缓冲液:10 mmol/L MES,50 mmol/L KCl,100 μmol/L CaCl2,pH 6.1;微丝特异性药物Jas (Jasplakinolide) 以及LatB (LatrunculinB) 由DMSO溶解,使用时表皮条缓冲液分别稀释至20 nmol/L和10 nmol/L;壳梭胞素FC (fusicoccin) 使用时表皮条缓冲液稀释至10 μmol/L。
1.3 失水率以及气孔密度统计
突变体失水率分析:分别从生长状态良好4周的cpb-3突变体与野生型的拟南芥植株摘取发育阶段、生长状态相似的莲座叶 (rosette leaves) 9片,放置于同一通风干燥环境中,每30 min称其质量,根据其占初始鲜重的百分比计算叶片失水率。
气孔密度的分析:分别从10株生长状态良好的cpb-3突变体与野生型的拟南芥植株取完全展开的10片莲座叶,在叶的不同位置 (基部、顶部、中部) 测量面积为0.12 mm2远轴下表皮气孔个数,气孔的密度 (气孔数量/0.12 mm2) 为10组图片数据的平均值。
1.4 气孔开度统计
取生长4周的cpb-3 突变体以及野生型植株第二对叶片,置于MES缓冲液中。先将叶片经黑暗处理90 min,使气孔基本关闭后再进行如下处理: (1) 10 μmol/L FC;(2) 10 μmol/L FC+10 nmol/L LatB;(3) 10 μmol/L FC+20 nmol/L Jas处理30~90 min,并在多功能显微镜 (Leica DMRE2) 下记录气孔开度。测量时随机选取8个视野,每个视野内随机选取10个气孔。每个处理至少重复3次,统计平均值,以野生型拟南芥植株为对照,计算相对气孔开度,并经SPSS软件分析差异显著性。
1.5 激光共聚焦显微镜观察
分别取生长4周杂交得到的cpb-3突变体 (GFP-ABD2为背景) 以及普通GFP-ABD2 (对照) 为实验材料。取第二对叶片放置于黑暗环境处理90 min,在10 μmol/L FC处理60 min,用ZEISS7.0激光扫描共聚焦显微镜下观察处理前后保卫细胞微丝骨架排布的变化(物镜63×oil,488 nm激发),采集图片后用Photoshop CS5.0进行图像编辑处理。每种处理采集保卫细胞数目n≥150,分别统计含有3种不同微丝组织排布类型 (TypeⅠ/Ⅱ/Ⅲ) 的保卫细胞所占比例。
1.6 非损伤技术测定保卫细胞离子流动情况
取生长4周的cpb-3突变体以及野生型植株第二对叶片,置于表皮条缓冲液中。先将叶片经黑暗处理90 min,使气孔基本关闭,在10 μmol/L FC中分别处理一定时间进行非损伤Ca2+、K+、H+离子微测[24],具体测量操作在北京旭月公司协助下完成。
1.7 构建ProCPB native:CPB/cpb3功能互补回复系
提取拟南芥总基因组DNA,通过设计相应引物以拟南芥总基因组DNA为模板PCR扩增,对扩增产物回收,PCR扩增产物与pEASY-Blunt Simple Cloning Vector连接。用CaCl2法制备大肠杆菌感受态,随后pEASY-Blunt simple连接体系进行转化,筛选出抗性菌落。通过碱裂解法小提质粒,对菌落的质粒DNA进行酶切验证。用Kpn I/Sal I双酶切的CPB-pEASY-Blunt Simple与植物表达载体pCAMBIA 1300,回收目的片断、连接、转化并筛选抗卡那霉素的阳性克隆,得到最终的包含有目的基因植物表达载体CPB-pCAMBIA1300。对CPB-pCAMBIA1300载体进行菌落PCR鉴定阳性克隆及酶切验证。
制备感受态细胞,经过冻融热激法转化,对转化子的PCR和酶切鉴定,确保得到的是含有目的片段的GV3101转化子。通过根瘤农杆菌介导转化cpb-3拟南芥突变体,转化后收获种子。用潮霉素抗性板筛选,对筛选出的苗进行DNA提取鉴定,最终获得cpb回复系植株,供后续实验使用。
1.8 统计学分析
本文采用独立样本t检验进行统计学分析,用t分布理论来推论差异发生的概率,从而比较两个平均数的差异是否显著。
2 结果
2.1 加帽蛋白β亚基功能缺失后加速植物蒸腾失水
在cpb-3突变体和野生型植株中取相同部位、生长状态相似的叶片放置于相同条件实验台上。失水率统计数据表明,在3 h的失水过程中,突变体的失水率始终高于野生型。叶片离体3 h,突变体蒸腾失水高达63.45%,而野生型仅为48.99%,突变体高出对照14.46%,差异显著。导致叶片蒸腾失水较快的因素主要有2个,一个是由于气孔密度过高,另一个与气孔运动异常有关[25, 26]。统计叶片下表皮气孔密度发现,在0.12 mm2单位面积上,突变体cpb-3的气孔数量可达18个,而野生型只有12个,突变体高出野生型50% (Fig.1B) ,结果差异显著。随后,本文对蒸腾失水的另一个因素气孔开关运动进行了探究。

Fig.1 cpb-3 mutant shows faster transpirational water loss than the wild type (WT) and its stomatal density is also higher than WT (A) Water losses from detached rosette leaves of WT and cpb-3 plants. Data are mean of five independent experiments ±SEM (with nine leaves from two kinds of plants in each experiment). Statistical analysis was performed by paired t test (*P<0.05). (B) Stomatal density in WT and cpb-3 plants. Data are mean of five independent experiments ±SD (with the average stomatal density of ten leaves in each experiment). Statistical analysis was performed by paired t test (*P<0.05)
2.2 加帽蛋白β亚基通过调节微丝骨架动态参与壳梭孢素诱导的气孔开放运动
本文选取FC这种广受关注的真菌次生代谢物为外源信号,进行气孔开度检测。结果发现:在FC处理60 min时,突变体的气孔增大为处理前的1.5倍,高出野生型相对气孔开度约20%,差异显著 (P<0.05)。随着FC处理时间的增加,突变体与野生型相对气孔开度均有所增加,但突变体cpb-3始终高于野生型(Fig.2A)。反观功能互补的cpb-3回复系,cpb突变体气孔开度的生理表型缺陷在所观察的FC处理时间内均可在回复系中基本得到恢复,其气孔开放程度与野生型持平。
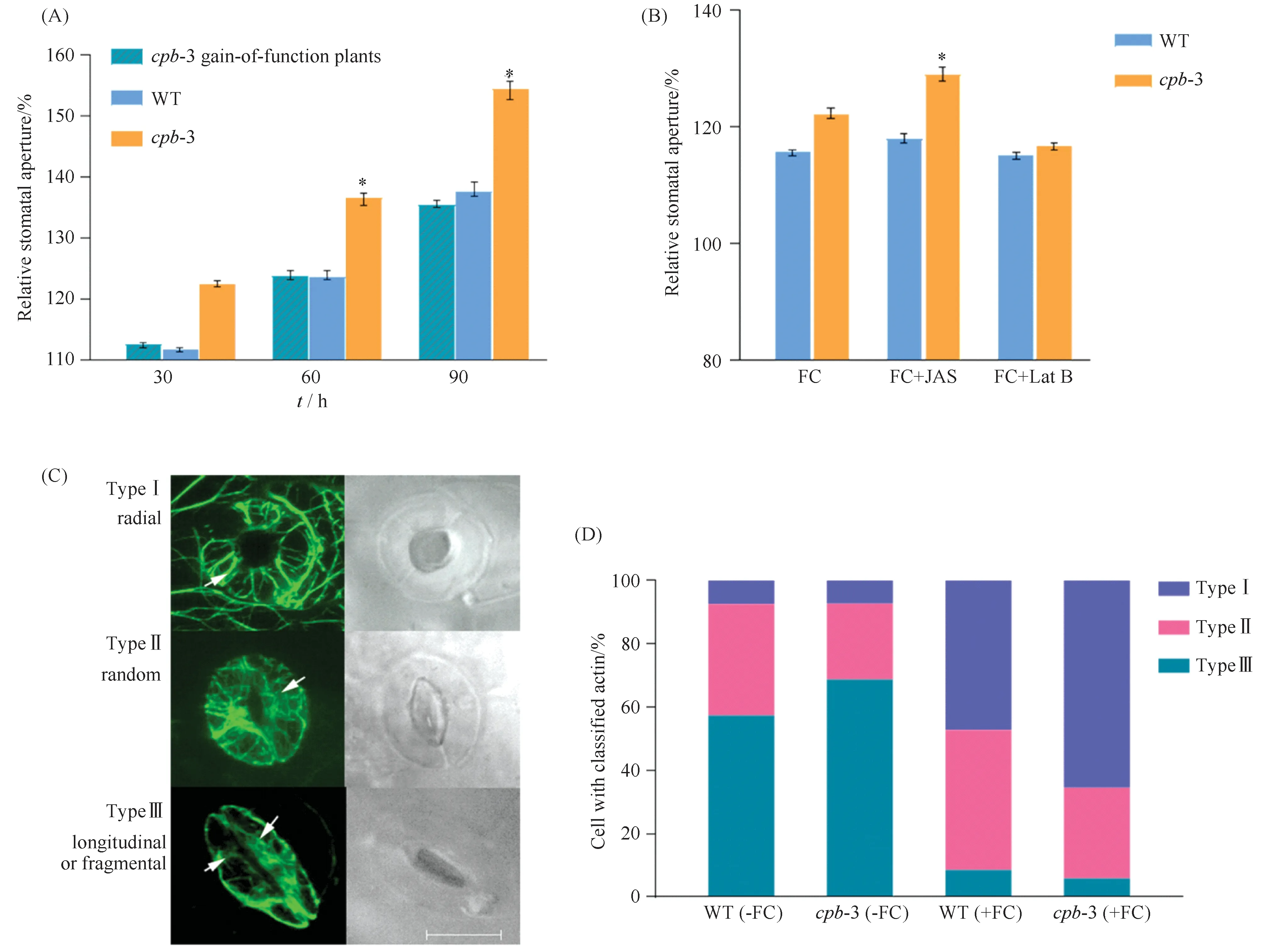
Fig.2 Regulation of CPB on FC-induced microfilament reorganization and stomatal opening (A) Effects of FC treatment for indicated times on stomatal opening of wild type, cpb-3 mutants and cpb-3 gain-of-function plants. Date represent mean ±SEM from five independent experiments with 80 stomata each. Statistical analysis was performed by paired t test (*P<0.05). (B) The effect of actin filament-specific drugs on FC- involved stomatal opening. The detached rosette leaves of seedlings from WT and cpb-3 were treated with FC, JAS, and LatB for 30 minutes. Data presented are the mean± SEM of three independent biological replicates; Totally 80 stomata were analyzed per line. Statistical analysis was performed by paired t test (*P<0.05). (C) Representative images of actin networks during stomatal movement. Actin organization was classified into three groups: radial array, random meshwork, and longitudinal array. Scale bar=10 μm. (D) Percentage of these three groups was calculated for indicated genotypes and treatments. The data were collected from three groups of independent experiments, and 100-120 stomata were analyzed in each group
基于微丝加帽蛋白CP对微丝解聚↔聚合动态转换的调节,本文又施加了微丝特异性药物处理。结果如下(Fig.2B):微丝稳定剂Jasplakinolide (Jas,an actin-stabilizing agent),能够特异性与微丝结合并稳定聚合态微丝纤维,是常用的微丝特异性药物[27,28]。Jas和FC共同作用,进一步增强cpb-3突变体对FC信号的敏感性。30 min时,突变体的相对气孔开度比FC单独处理上升了7%,比同一条件下的野生型对照高了约13%,差异显著 (P<0.05)。LatrunculinB (Lat B) ,是一种微丝特异性抑制剂(an inhibitor of actin polymerization) ,LatB和FC共同作用,cpb-3相对气孔开度比FC单独处理下降了5.4%,在一定程度上减轻了突变体气孔在FC条件下的过度开放,与同期的野生型接近,可以部分恢复突变体对FC的正常反应。显示在FC诱导气孔开放过程中,加帽蛋白CPB对微丝动态不稳定性的负调节发挥着不容忽视的作用。换而言之,微丝稳定剂Jas在一定程度上增强CPB突变对FC诱导气孔开放的促进作用;微丝解聚剂LatB则正好相反,解聚微丝削弱了突变体对FC信号的超敏感。综上表明,相比于野生型,突变体cpb-3对改变微丝解聚聚合动态不稳定的微丝特异性药物更加敏感,微丝骨架动态在FC诱导气孔开放过程中可能在CPB下游发挥作用。
为了对气孔开放过程中保卫细胞中微丝的排布进行直接观察和定量分析,本文依照Li等[14]的研究报道,将保卫细胞中微丝的排布方式主要分为3种类型。例如Fig.2C所示:Ⅰ型 (辐射状列阵) :微丝骨架列阵排列规则,致密有序,大部分由保卫细胞腹壁向背壁呈辐射状排布,多出现在开放气孔保卫细胞中;Ⅱ型 (网状列阵) :微丝骨架排布出现一定的扭曲、相互交错成网状;Ⅲ型 (解聚-纵向列阵) :多数微丝发生解聚,荧光呈弥散状或小片段随机分布于保卫细胞中,甚至有的微丝片段与保卫细胞长轴平行,多出现在关闭气孔保卫细胞中。
随后,本文利用激光共聚焦扫描显微镜,以杂交得到的cpb-3突变体 (GFP-ABD2为背景) 以及GFP-ABD2转基因拟南芥植株 (对照) 为实验材料,对FC诱导气孔开放过程中保卫细胞微丝骨架的组织排布进行了直接观察,以确定CPB对保卫细胞微丝列阵的调节。结果正如Table 1及Fig.2 D所示,FC处理60 min,不论是cpb-3突变体还是野生型,含Ⅰ 型辐射状微丝排布的保卫细胞占比明显升高,而Ⅲ 型解聚、纵向排列微丝的保卫细胞数量下降。与对照组相比,cpb-3突变体保卫细胞含Ⅰ 型辐射状排布微丝的比例由处理前的7.2%剧增为65.5%,增幅为58.3%,远高于对照组39.8%的增量,经独立样本t检验分析,差异显著。表明突变体cpb-3保卫细胞中微丝的动态重排对FC信号更加敏感,该结果与 (Fig.2A) 中气孔开度实验结果一致。
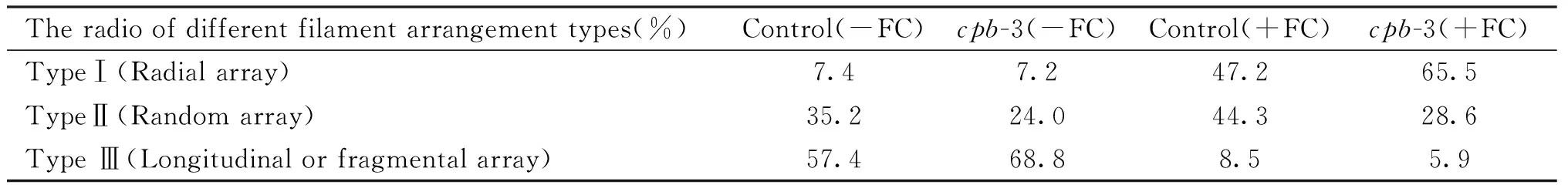
Table 1 Different types of microfilament arrangement in guard cells induced by FC
2.3 加帽蛋白β亚基介导微丝动态响应壳梭孢素诱导气孔开放信号通路中有Ca2+、K+及H+的作用
在气孔运动机制这一庞大而复杂的信号网络中,保卫细胞微丝骨架动态不仅是一个信号的接收者,也是一个积极的调控者。已有研究表明,蚕豆保卫细胞微丝骨架动态会调节保卫细胞质膜上Ca2+渗透通道[29],并且FC对保卫细胞的K+和H+流动有着显著影响。因此,本文通过非损伤测微技术,重点测量了FC诱导气孔开放过程中,突变体和野生型拟南芥植株保卫细胞内外的Ca2+、K+、H+离子流动情况。结果正如Fig.3中A和B所示,FC处理5 min时,突变体cpb-3与野生型均检测到明显的Ca2+外流 (数据为正值),野生型Ca2+平均外流速度为68.76 pmol·cm-2·s-1,而突变体cpb-3为212.86 pmol cm-2s-1,明显比野生型更加强烈,Ca2+的波动幅度更大,经SPSS软件分析,差异显著。同样,依次检测FC处理后的K+和H+流动情况,结果如Fig.3中 C-F所示,FC处理后,突变体保卫细胞中的K+内流 (数据为负值)量为82.50 pmol·cm-2·s-1, 远远大于野生型K+的流速16.33 pmol·cm-2·s-1;相应的H+外流也比野生型高,突变体气孔运动中的几个重要的离子跨膜流动都出现明显异常。

Fig.3 Flux of Ca2+, K+, and H+ in guard cells of wild type (WT) and cpb-3 mutants under FC treatment (A) After FC treatment for 5 minutes, the Ca2+ flux potential of guard cells of WT and cpb-3 mutants was analyzed. Each point represents the mean for Ca2+ flux potential and bars represent the standard error. (B) The mean Ca2+ flux of WT and cpb-3 guard cells before and after exposure to FC for 5 minutes. Each point represents the mean for Ca2+ flux potential and bars represent the standard error. Statistical analysis was performed by paired t test (**P<0.01). (C) After FC treatment for 10 minutes, the K+ flux potential of guard cells of WT and cpb-3mutants was analyzed. The data were the average K+ flux of guard cells in three groups of independent experiments. (D) The mean K+ flux of WT and cpb-3 guard cells before and after exposure to FC for 10 minutes. Each point represents the mean for K+ flux potential and bars represent the standard error. (E) After FC treatment for 10 minutes, the H+ flux potential of guard cells of WT and cpb-3 mutants was analyzed. The data were the average H+ flux of guard cells in seven groups of independent experiments. (F) The mean H+ flux of WT and cpb-3 guard cells before and after exposure to FC for 10 minutes. Each point represents the mean for H+ flux potential and bars represent the standard error
3 讨论
3.1 加帽蛋白β亚基通过调节保卫细胞微丝骨架动态重排参与壳梭孢素诱导的气孔开放运动
微丝骨架 (actin cytoskeleton) 在气孔运动调节机制中的作用已得到越来越多的关注,随着研究的深入,人们发现,保卫细胞中微丝除了具有基本的维持细胞形态、参与植物细胞运动功能之外,还表现出信号受体的激活与信息传递、保卫细胞液泡形态建成及膜泡运输精确定位、叶绿体避光移动、核质衔接等重要作用[30-33]。保卫细胞中微丝骨架活跃的动态重排是其行使功能的基础,该过程在时空上均受到细胞不同层面的严格调控[30]。其中,众多微丝结合蛋白质成员的作用不容忽视。在Li等[34]综述中,将一系列微丝结合蛋白调节微丝动态的方式人为划分为三个水平:(1)微丝骨架纤维起始 (filament initiation) ,例如微丝结合蛋白ARP2/3 (actin-related protein2/3) 和Profilin;(2)单根微丝解聚或生长的随机动力学 (stochastic dynamics) ,例如肌动蛋白相互作用蛋白AIP1 (actin-interacting protein1)、切割蛋白ADFs(actin depolymerizing factors)、加帽蛋白CP等;(3)微丝纤维间的组织排列 (filament organization) ,例如成束蛋白 (fimbrin)、绒毛蛋白 (villin)和肌球蛋白 (myosin)。在参与气孔运动的微丝结合蛋白质中,已陆续发现有促起始成核的Arp2/3、切割蛋白ADF4、成束蛋白ADF5、微丝结合蛋白SCAB1 (stomatal closure related actin binding protein1)等。作为一个异二聚体微丝结合蛋白质,已有研究发现,CP其中任一亚基的表达下调均能引起另一个亚基转录水平和蛋白质水平的降低。免疫印迹表明,拟南芥cpb-3突变体,即使仅β亚基被突变,其CPA和CPB蛋白质水平也均被减弱,化学计量学分析统计,该突变体中不仅CPB:actin的比率由野生型的1∶196下降为1∶996,而且CPA:actin的比率也随之下降,由1∶207下降至1∶2187[35]。结合向云等[20]报道,在拟南芥热激响应中,CP两亚基中唯有CPB亚基比较明显地表现为一个植物热胁迫信号传递中的负调节因子 (a negative regulator) 。因此本研究也选择了cpb-3突变体为主要实验材料。
离体叶片失水率是检测植物叶片蒸腾失水作用的有效指标。单位时间内,离体叶片失水率越高代表植物叶片蒸腾失水作用越强,抗旱能力越差[13]。在相同的条件下,cpb-3突变体的失水率高于野生型。也就是说,CPB缺失会影响植物叶片蒸腾失水。气孔是植物与环境水分交换的通道,气孔密度的多少以及其是否能够进行正常的开闭运动,都是影响植物叶片蒸腾失水的重要指标。通过对野生型以及突变体气孔密度的统计发现,突变体cpb-3气孔密度显著高于野生型,所以较高的气孔密度是导致突变体叶片蒸腾失水异常的一个主要原因。本文发现,在FC诱导气孔开放过程中,cpb-3的气孔开度始终大于野生型,且有差异 (P<0.05) ,气孔开放的速率更快,这充分说明CPB在气孔运动中发挥着积极的作用。而CPB缺失导致的气孔开放异常也是导致突变体失水较快,萎蔫程度高的一个主要原因。壳梭孢素FC是生长在扁桃、桃类植株上的真菌产生的一种植物激素,能引起几乎所有高等植物气孔开放和叶子枯萎。CP蛋白在叶片干旱失水、FC诱导气孔开放中的实验表型,与已有报到中CP在热激、病原菌入侵等逆境胁迫信息传递中的作用相一致。
微丝骨架的动态变化参与气孔运动的调控。CP能够调节微丝动态,那么CP是否可以通过调节微丝动态排布这一方式来参与气孔运动呢?通过药理学实验,当CPB功能缺失以后,突变体对微丝特异性药物更加敏感,共聚焦扫描显微镜观察,在开放的气孔中,正常保卫细胞的微丝骨架多以整齐的辐射状 (TypeⅠ) 排布,而关闭的气孔中保卫细胞的微丝逐步发生解聚或纵向排列 (Type Ⅲ) 。FC处理60 min诱导的开放气孔保卫细胞中,虽然野生型与突变体保卫细胞中微丝的排布均随之发生改变,但cpb-3突变体呈辐射状密集、明亮粗大微丝束的保卫细胞比例远远高于野生型。在2015年Li等[23]研究中已指出,在拟南芥下胚轴表皮细胞中,降低CP含量,会产生更多动态活性的微丝末端,显著增加微丝片段之间的粘合 (filament-filament annealing) ,微丝长度增大,生命周期 (lifetime) 加长,与野生型相比,cpb-1突变体表皮细胞中出现更密集的微丝,表明CP在植物免疫信号信息传递中起负调节作用。同样,在45 ℃/40 min热激条件下,Atcpb突变体与野生型或cpa突变体相比,依然留存更多稳定的微丝网格,显示AtCPB在热激中的负调节作用[20]。本文中观察到突变体保卫细胞微丝组织行为与以上结果相符。我们推测,CPB缺失后,增加了保卫细胞内单体G-肌动蛋白重新聚合生长到微丝末端的机率,增加了动力学,加速微丝重排,使其对外源信号更加敏感,气孔开度更大。
本文推测,CPB可能通过调控微丝解聚和聚合的动态特征,从而调节微丝骨架重排,一方面影响早期气孔保卫细胞的生长发育及形态建成,另一方面影响成熟保卫细胞气孔开关的生理功能,最终调节拟南芥植株叶片蒸腾失水。
3.2 Ca2+、K+等可能参与加帽蛋白对气孔运动调节的信号通路
通常认为,气孔运动的基本过程是:保卫细胞质膜上的受体感受到外界的信号刺激,通过跨膜转换,产生Ca2+、磷质酸肌醇等第二信使,激活多种离子通道及相关的酶,激活一系列的生理生化反应,进而调节气孔运动[36]。Ca2+作为细胞广泛存在的信号分子,在静息态时细胞质基质中游离的浓度较低 (<0.1-0.2 μmol/L) 。细胞内 Ca2+浓度升高主要有两种途径:一是由胞内的钙库 (例如液泡、内质网等)中Ca2+释放到细胞质内,另一是细胞外的Ca2+通过离子通道进入到细胞内,以此来激活相应的靶蛋白或靶酶,引起相应生理生化反应。细胞骨架成份也是Ca2+信号传递的下游分子之一。例如,细胞骨架结合蛋白质MDP25 (microtubule-destabilizing protein 25) ,又称PCaP1 (plasma membrane-associated cation binding protein 1) ,是位于质膜上的一个典型的受Ca2+调节的结合蛋白质。在Ca2+信号下,不仅可以与微管结合,在拟南芥下胚轴细胞伸长生长中发挥重要的负调节作用[37];而且还可以结合微丝,胞内Ca2+水平可决定其亚细胞定位,并增强MDP25切割微丝的活性,进而参与调节拟南芥花粉管生长[38-40]。
另一方面,研究也发现,微丝骨架的动态变化反过来也能调节Ca2+浓度水平。在蚕豆保卫细胞中,采用膜片钳技术施加微丝特异性药物细胞松弛素D或鬼笔环肽 (phalloidin) ,解聚微丝或稳定微丝,会相应激活或阻碍对渗透敏感且张力激活的Ca2+渗透通道 (osmo-sensitive and stretch-activated Ca2+-permeable channel) ,反馈调节 (negative feedback)Ca2+[39]。表明保卫细胞微丝骨架解聚聚合的动态变化通过改变质膜上的Ca2+通道,在Ca2+上游发挥作用。在这一过程中,微丝结合蛋白质是否也有参与呢?本文采用非损伤微测技术结果显示,FC处理短短5 min,突变体cpb-3与野生型保卫细胞均发生Ca2+外流,细胞内Ca2+浓度降低,但突变体的Ca2+外流明显比野生型更剧烈,Ca2+波动幅度更大,表明加帽蛋白CP的β亚基 (CPB) 突变后,Ca2+的跨膜流动产生异常,也就是说FC→CPB→气孔开放信号通路中,CPB可能在Ca2+上游发挥作用。该结果与2007年膜片钳在蚕豆保卫细胞中的报道相符。磷脂酸 (phosphatidic acid,PA) 在膜磷脂中含量丰富,在植物响应外界胁迫中具有重要的信号中介作用。而CP蛋白是目前已知植物微丝结合蛋白质中,唯一一个与PA结合并受PA抑制的蛋白质[21],作为PA的生物感应器 (a PA biosensor) ,将膜上的磷脂信号转化为微丝动态特异性的改变[41]。本文推测,同样位于膜上的Ca2+通道,也许会是这一过程的参与者。此外,Jimenez等[35]发现,拟南芥加帽蛋白CP是一个与膜相关的微丝结合蛋白质 (membrane-associatedactin-bindingprotein) ,在植物细胞内的一些膜被细胞器,例如内质网和高尔基体的膜上都有存在。内质网是已知的细胞内的Ca2+库,对于调节胞内Ca2+浓度同样有着举足轻重的作用。以上报道均为本文CP蛋白可能通过调节保卫细胞Ca2+通道影响细胞内Ca2+浓度变化提供一定支持,但准确具体的作用方式仍需进一步研究。并且,细胞膜上也存在一系列与K+、H+运输和流动相关的载体蛋白质和离子通道,这对于可以直接与膜磷脂酸结合的CP蛋白来说,其调节离子进出的功能也不乏可能性和可行性。
综合以上结果,本实验可以初步表明CPB能够通过调节保卫细胞内微丝骨架的组织重排参与FC诱导气孔开放运动,进而影响叶片蒸腾失水。并且在该信号通路中,还有保卫细胞内外Ca2+、H+和K+跨膜流动的参与。具体通路正如Fig.4所示。

Fig.4 A model of the role of CPB in FC-induced stomatal opening
致谢感谢中国农业大学毛同林教授、清华大学黄善金教授赠予的实验材料以及对本实验的指导。

