RNF125通过泛素化修饰caspase-1 p33活性亚基促进炎症应答
林浩天,范廷辉,耿 晋,杨小盼,王 斌
(1.青岛大学 基础医学院,山东 青岛 266071;2.军事科学院 军事医学研究院生物工程研究所,北京 100071)
细胞的免疫应答可分为固有免疫和适应性免疫,其中固有免疫应答的激活主要通过模式识别受体识别病原相关分子模式(pathogen-associated molecular pattern,简称PAMPs)或损伤相关分子模式(danger-associated molecular patterns,简称DAMPs).NOD样受体(NOD-like receptors,简称NLRs)是常见的模式识别受体之一[1].其介导的炎症小体(inflammasomes)激活后可诱导IL-1β,IL-18等促炎细胞因子的成熟及分泌[2],也可导致由Gasdermin介导的细胞焦亡,引起更大范围的免疫反应[3-4].
Caspases为半胱氨酸天门冬氨酸蛋白酶的简称,caspase-1是一种炎症相关的caspases.在经典炎症小体激活途径中,NLRs识别PAMPs或DAMPs后,会直接或通过ASC募集pro-caspase-1,经自剪切形成具有酶活性的p33/p10亚基[5],该亚基复合物将pro-IL-1β和pro-IL-18剪切成成熟的具有生物学活性的IL-1β和IL-18.虽然非经典炎症小体的激活依赖于caspase-11,但caspase-11被认为位于caspase-1分子的上游[6].所以,caspase-1的活性及其活性亚基p33/p10复合物的持续时间和状态对于炎症小体的信号传导至关重要.Caspase-1的活性除受炎症小体复合物的影响外,还受多层次多水平的调控.在转录水平上,HIP及其分子伴侣HIPPI形成的二聚体可提高caspase-1的表达量[7].在翻译后修饰水平上,PAK-1可以诱使caspase-1磷酸化,增强caspase-1活性[8].除此之外,caspase-1的活性还受多种负调控因子以及伪底物的调控[9-11].但目前关于caspase-1活性亚基p33/p10受调控的研究还比较罕见.
RNF125是由N-末端的Ring结构域、3个锌指结构(C2HC,C2H2,C2H2)和C-末端的泛素相互作用基序(ubiquitin-interacting motif,简称UIM)组成的E3泛素连接酶.Ring结构域、锌指结构发挥其泛素连接酶的活性,而UIM发挥其自身泛素化的功能[12].RNF125最初被发现是一种T细胞激活的调节因子,其在骨髓、脾脏和胸腺内的淋巴组织中高度表达[13].后续的研究还发现RNF125与炎症反应、癌症的发生发展、先天性的抗病毒免疫反应以及过度生长综合征等多种疾病有关[14-19].笔者主要研究了RNF125对caspase-1 p33亚基的调控作用及其生理意义.该研究可为调控固有免疫信号通路提供新的思路,以期为炎症性疾病的治疗提供新的方向.
1 材料与方法
1.1 实验材料
HEK293T和THP-1细胞株购自美国ATCC.RNF125野生型和敲除型小鼠购自中国赛业(苏州)生物科技有限公司.小鼠饲养于无特定的病原体和可控制温度的房间中((23±1) ℃),光/暗周期为12/12 h.所有动物实验均在军事医学研究院动物中心(中国北京)进行,并经过军事医学研究院动物保护和使用委员会批准.
1.2 试剂与仪器
试剂:Flag-Tag HRP Conjugate antibody(A8592)、Anti-Flag M2 affinity gel(A2220)、LPS(L4130)和叶酸(F7876)购自美国Sigma-Aldrich公司;Flag tag Monnoclonal antibody(66008-6-Ig)、HA-Tag polyclonal antibody(51064-2-AP)和Anti-α-Tubulin antibody(11224-1-AP)购自中国武汉三鹰生物技术有限公司;Alexa Fluor/488-山羊抗兔(ZF-0511)购自中国北京中杉金桥生物技术有限公司;Alexa Fluor/555-驴抗小鼠(A0460)购自中国上海碧云天生物技术有限公司;ATP(E057830)购自中国上海一飞生物科技有限公司;HA-Tag HRP Conjugate antibody(M180-7)购自日本MBL公司;Myc-Tag HRP Conjugate antibody(ab1326)购自美国Abcam公司;V5-Tag HRP Conjugate antibody(680604)购自美国Biolegend公司; Normal rabbit IgG antibody(2729s)购自美国CST公司;MG132(tlrl-mg132)购自法国InvivoGen公司;jetPRIME® Transfection Reagent(114-15)购自法国Polyplus-transfection公司;小鼠IL-1β试剂盒(1210122)购自中国北京达科为生物技术有限公司;Glutathione Sepharose 4B(17075601)购自美国GE公司;LipofectamineTM2000 转染试剂(11668019)购自美国Invitrogen公司.
仪器:质粒浓度检测仪(NANODROP 8000)和CO2细胞培养箱(Forma Steries II Water Jacket)购自美国Thermo Fisher Scientific公司;蛋白电泳仪(PowerPac Basic)和蛋白电转仪(Trans-Blot SD Cell)购自美国Bio-Rad公司;凝胶成像分析系统(Tanon 2500)购自中国上海天能科技有限公司;多功能酶标仪(SPARK)购自瑞士TECAN公司;小型低温离心机(5415R)购自德国Eppendorf公司;激光共聚焦显微镜(A1)购自日本Nikon公司.
1.3 细胞培养和转染
HEK293T细胞在含10%胎牛血清的DMEM中培养.THP-1细胞在含10%胎牛血清的RPMI-1640培养基中培养.按照转染试剂说明书,将0~10 μg DNA加入500 μL jetPRIME®缓冲液中,涡旋混合10 s,短暂低速离心.加入2倍DNA量的jetPRIME®转染试剂,涡旋1 s,短暂低速离心.在室温下孵育10 min.之后将转染混合物逐滴加入细胞培养皿中,轻轻混匀,将培养皿放回细胞培养箱,24 h后收集细胞进行分析.
1.4 免疫共沉淀
细胞转染质粒24 h后收集细胞至1.5 mL离心管中,PBS洗3遍.向细胞中加入500 μL含蛋白酶抑制剂的NP40裂解液,将细胞重悬后冰上静置20 min.超声破碎10次,每次间隔2 s.4 ℃、12 000 r·min-1离心10 min.取50 μL上清作为全细胞裂解液(Input),剩余上清加入30 μL Anti-Flag亲和琼脂糖珠,4 ℃摇床旋转孵育过夜.4 ℃、2 000 r·min-1离心3 min,弃上清.加入500 μL NP40洗液,4 ℃旋转洗涤3 min,4 ℃、2 000 r·min-1离心3 min,弃上清,重复洗涤3次.加入100 μL 1×SDS裂解缓冲液,金属浴煮样10 min,4 ℃、12 000 r·min-1离心10 min.取上清进行SDS-PAGE和免疫印迹分析.
1.5 GST pull-down
将活化好的GST-V(BL21),GST-RNF125(BL21)按照1%的比例接种到新鲜的含相应抗生素的LB培养基中,培养至OD600为0.6~0.8时加入终浓度为1 mmol·L-1IPTG,20 ℃诱导12 h.4 500 r·min-1离心10 min收集菌体,并用PBS重悬洗涤1次后加入20 mL NP40裂解液,冰水浴中进行超声破碎(超声7 s、停5 s,反复操作,总时长为40 min,超声功率设置为35%).裂解液4 ℃、12 000 r·min-1离心10 min.GST-V和GST-RNF125各取2 mL上清,加入20 μL Glutathione Sepharose 4B,4 ℃旋转孵育1 h.4 ℃、500×g离心5 min后弃上清并用1 mL PBS重悬,4 ℃旋转洗涤3 min.重复洗涤3次后,分别加入200 μL纯化的Flag-p33,4 ℃旋转孵育过夜.4 ℃、500×g离心5 min,弃上清,并用1 mL PBS重悬洗涤3次.分别加入45 μL 1×SDS上样缓冲液,金属浴煮样10 min,4 ℃、12 000 r·min-1离心10 min.取上清进行SDS-PAGE以及免疫印迹分析.
1.6 免疫荧光
将Flag-p33和HA-RNF125共转染HEK293T细胞后,在包被多聚L-赖氨酸的玻片上进行细胞爬片.细胞在4% PFA中固定20 min,0.2% Triton X-100中打孔15 min,然后用3% BSA封闭1 h.一抗:Flag抗体(1∶200)和HA抗体(1∶200)4 ℃孵育过夜.二抗:PBS洗涤3次后孵育Alexa Fluor/488-山羊抗兔(1∶200)、Alexa Fluor/555-驴抗小鼠(1∶200)检测p33亚基和RNF125.用DAPI (0.5 μg·mL-1)进行细胞核DNA染色.使用Nikon A1激光共聚焦显微镜和Nikon A1 Elements软件(版本4.20)获取荧光图像.
1.7 泛素化分析
将Flag-p33、Myc-Ub和HA-RNF125或RNF125突变体(HA-RNF125 C37,40A)共转染HEK293T细胞.24 h后加入MG132(20 μmol·L-1)作用6 h后,收集细胞,用NP40裂解液裂解.在细胞裂解液中加入Anti-Flag亲和琼脂糖珠,4 ℃旋转孵育,偶联Flag-p33.用Myc抗体检测p33亚基的泛素化水平.同理,用泛素表达质粒Myc-Ub K48和Myc-Ub K63分别与Flag-p33和HA-RNF125共转染HEK293T细胞,免疫共沉淀分析RNF125对p33亚基泛素化方式的影响.
1.8 siRNA技术
实验所用引物序列:siRNF125-1(Forward: CCGUGUGCCUUGAGGUGUUtt;Reverse: ttGGCACACGGAACUCCACAA). siRNF125-2(Forward: CUUGGAUUCUCAUCGGGUAtt;Reverse: ttGAACCUAAGAGUAGCCCAU).
接种THP-1细胞至六孔板中,待细胞密度为70%左右时根据说明书进行转染.先吸取121.25 μL 的Opti-MEM培养基到1个RNAase-free的离心管中,加入3.75 μL(75 pmol)的siRNA;再吸取112.5 μL的Opti-MEM培养基到另1个RNAase-free的离心管中,加入12.5 μL的LipofectamineTM2000 转染试剂.将配好的siRNA加入配好的LipofectamineTM2000 转染试剂中,吹打混匀.室温孵育5 min后,将混合的试剂加入THP-1细胞中,48 h后即可进行相应的实验.
1.9 炎症刺激
LPS(1 μg·mL-1)作用于THP-1细胞4 h后,ATP(5 mmol·L-1)刺激20 min,收集细胞上清,ELISA检测IL-1β的分泌情况.
1.10 叶酸诱导的肾炎模型
取8~10周雌性的RNF125野生型和敲除型小鼠各13只,13只小鼠随机分成2组,1组7只,1组6只.共分成4组,其中野生型和敲除型小鼠中6只的1组作为对照,腹腔注射NaHCO3(250 mmol·L-1),另外2组为实验组,腹腔注射叶酸(25 mg·kg-1,用250 mmol·L-1NaHCO3溶解).2 d后,称量小鼠体重,小鼠摘眼球取血,获得血清.取小鼠血清为样品,检测血清中的尿素(UREA)水平.小鼠腹腔解剖,取出肾脏,PBS浸泡洗去残留血液后,滤纸吸去多余水分,用千分之一分析天平称重.小鼠肾重比=小鼠肾组织重量∶小鼠体重.将各组小鼠的肾组织排好后进行对比、拍照.
1.11 统计学方法
实验数据运用SPSS 22.0软件进行分析处理.2组独立样本之间的比较采用非配对的t检验,***p<0.001,**p<0.01,*p<0.05.
2 结 果
2.1 RNF125与caspase-1 p33活性亚基的相互作用
将Flag标记的RNF125与V5标记的p33共转染HEK293T细胞,用Anti-Flag亲和琼脂糖珠免疫沉淀带有Flag标签的RNF125,用V5抗体检测p33亚基.结果显示,与Flag-RNF125结合的蛋白中可检测到V5-p33,说明RNF125与p33亚基存在相互作用,而阴性对照Flag-V(Flag-vector)与V5-p33没有相互作用(图1(a)).为排除标签对结果的影响,检测RNF125与p33亚基结合的特异性,研究中采取更换标签的方式,再次将HA-RNF125和Flag-p33共转染HEK293T细胞,结果所示,Flag-p33与HA-RNF125之间同样存在特异性结合(图1(b)).GST pull-down的结果表明RNF125可与p33亚基直接相互作用(图1(c)).免疫荧光的结果也显示,RNF125与p33亚基在细胞内会发生共定位(图1(d)).以上结果表明,RNF125可以直接与caspase-1 p33活性亚基发生相互作用.
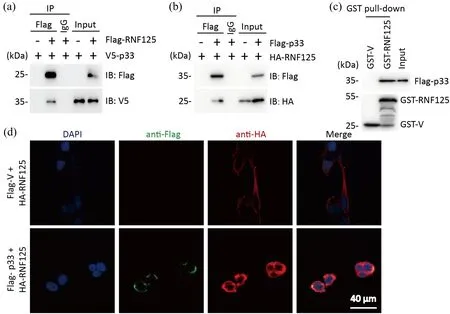
(a)免疫共沉淀检测Flag-RNF125与V5-p33的相互作用;(b) 免疫共沉淀检测Flag-p33与HA-RNF125的相互作用;(a)~(b)IgG为阴性对照,Input为阳性对照;(c) GST pull-down实验分析GST-RNF125与Flag-p33的直接相互作用,GST-V为阴性对照;(d)激光共聚焦显微镜分析RNF125(红色)、p33亚基(绿色)的共定位,蓝色为细胞核DNA,Flag-V为阴性对照.图1 RNF125与caspase-1 p33亚基的相互作用
2.2 RNF125参与caspase-1 p33亚基的泛素化修饰
RNF125作为一种参与泛素化修饰的E3泛素连接酶,可能以caspase-1 p33亚基作为底物,参与其泛素化过程.将Flag-p33,Myc-ubiqutin (Myc-Ub)和HA-RNF125共转染HEK293T细胞,用Anti-Flag亲和琼脂糖珠免疫沉淀Flag-p33,分析p33亚基的泛素化情况.结果所示,RNF125增强了caspase-1 p33亚基的泛素化水平,其E3泛素连接酶的活性突变体RNF125 C37,40A却未影响p33的泛素化水平,说明RNF125能影响caspase-1 p33亚基的泛素化水平(图2(a)).有报道表明,RNF125能够促进底物蛋白的K48或K63聚泛素化修饰.分别将泛素表达质粒Myc-Ub-K48和Myc-Ub-K63与RNF125和p33亚基在HEK293T细胞中共表达,分析RNF125影响p33亚基的泛素化方式.免疫共沉淀的结果显示,RNF125抑制了p33亚基的K48聚泛素化,同时也增强了其K63聚泛素化(图2(b)).因此,RNF125参与了caspase-1活性亚基p33的泛素化修饰.
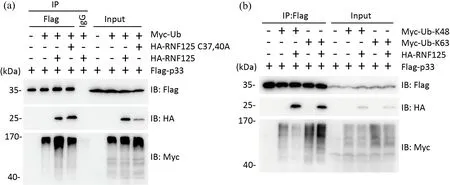
(a)免疫共沉淀检测RNF125对p33亚基的泛素化修饰,IgG为阴性对照,Input为阳性对照;(b) 免疫共沉淀检测RNF125对p33亚基的泛素化修饰方式,Input为阳性对照;每个实验至少进行3次重复.图2 RNF125参与caspase-1 p33亚基的泛素化修饰
2.3 RNF125调控炎症应答过程中的信号传导
以上结果表明RNF125可靶向caspase-1 p33亚基,影响其泛素化.所以,RNF125很可能会影响caspase-1 p33的活性,进而影响炎症反应过程中IL-1β的成熟分泌.将NLRP3,Asc,pro-caspase-1,pro-IL-1β等炎症小体组分的表达质粒与RNF125在HEK293T细胞中共表达后发现RNF125的过表达显著增加了IL-1β的成熟和分泌,而RNF125的功能突变体RNF125 C37,40A对IL-1β分泌的影响不明显(图3(a)).为进一步研究RNF125在炎症应答中的功能,RNF125的特异性siRNA被用于降低THP-1细胞中RNF125的表达水平.在2条siRNF125序列(siRNF125-1和siRNF125-2)中,siRNF125-1可以将RNF125的RNA水平降低至对照的25%,用于后续的实验研究(图3(b)).siRNF125-1降低THP-1细胞中RNF125的表达后,用LPS和ATP刺激细胞,检测THP-1细胞分泌的IL-1β水平.结果所示,敲低RNF125后,IL-1β的分泌显著降低(图3(c)).以上结果表明,RNF125可促进IL-1β的分泌,参与调控炎症应答过程中的信号传导.
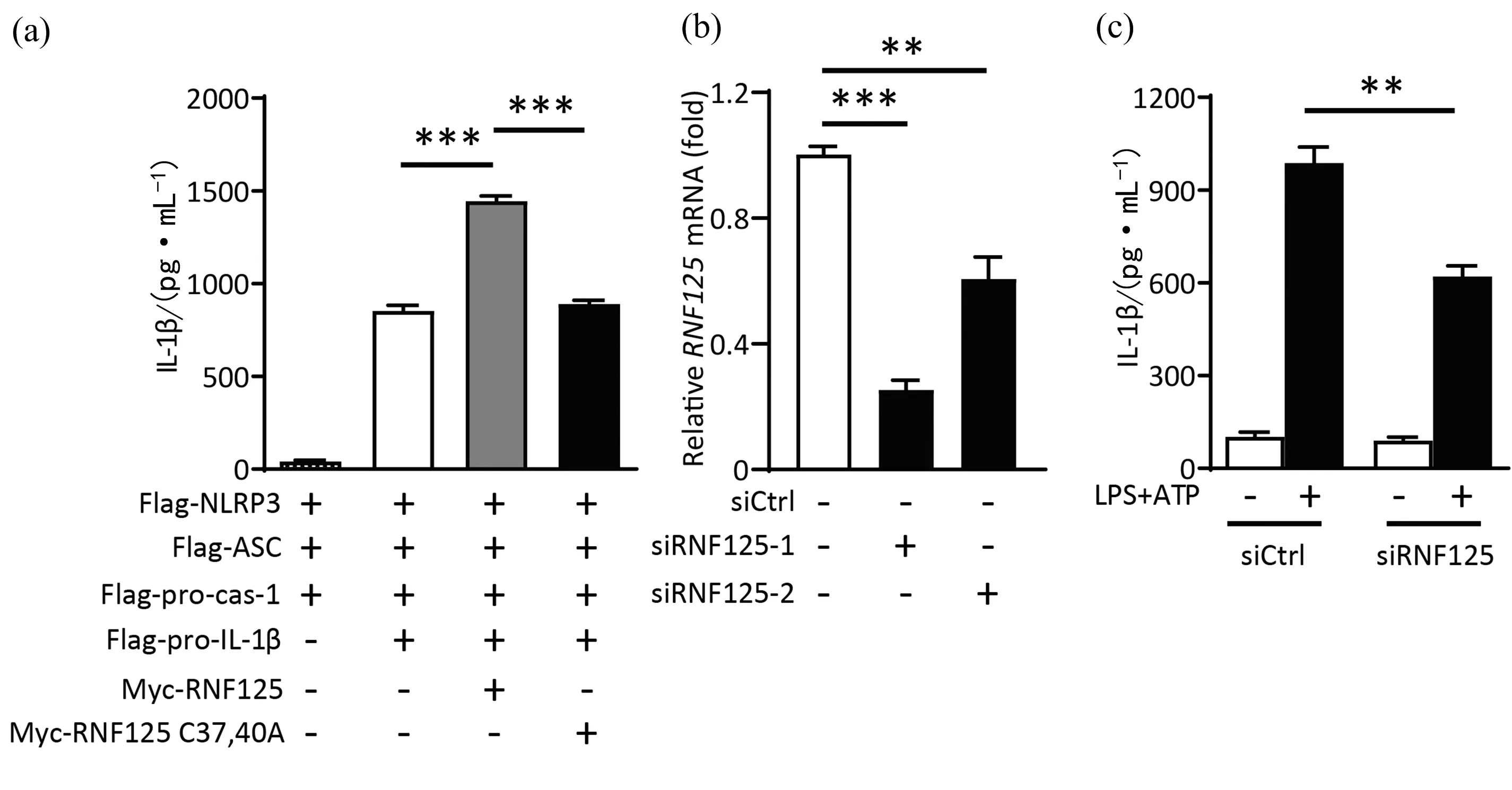
(a)RNF125过表达对炎症应答中IL-1β分泌水平的影响.将NLRP3信号途径中的各个质粒转入HEK293T细胞,构建NLRP3炎症小体信号途径,24 h后,用LPS(1 μg·mL-1)刺激细胞4 h后再用 ATP(5 mmol·L-1)刺激20 min,收集细胞上清液,ELISA分析IL-1β的分泌.(b) RT-qPCR分析RNF125特异性siRNA在THP-1细胞中的敲低能力.(c) 敲低RNF125对炎症应答中IL-1β分泌水平的影响.**p<0.01,***p<0.001.图3 RNF125调控炎症应答过程中的信号传导
2.4 敲除RNF125可缓解叶酸诱导的小鼠肾脏炎症
鉴于RNF125对IL-1β分泌的促进作用,RNF125很可能具有促炎作用.为深入分析RNF125在炎症应答过程中的生理功能,小鼠腹腔注射叶酸(25 mg·kg-1),用于构建RNF125+/+和RNF125-/-小鼠的肾炎模型,观察RNF125在肾炎发展过程中的功能.结果发现,与野生型小鼠相比,RNF125敲除小鼠的肾脏肿胀程度明显减轻(图4(a)),尿素水平显著降低(图4(b)),肾重比也显著降低(图4(c)).以上结果均表明,RNF125的敲除缓解了叶酸诱导的肾脏炎症,RNF125可促进炎症应答.
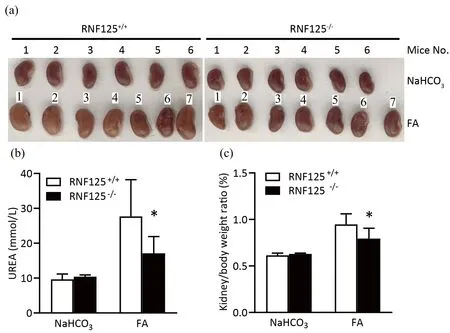
(a)RNF125对肾炎模型小鼠的肾脏肿胀程度的影响;(b)ELISA分析的肾炎模型小鼠血清中UREA水平;(c)肾炎模型小鼠的肾重比.*p<0.05.图4 敲除RNF125可缓解叶酸诱导的小鼠肾脏炎症
3 讨 论
Caspase-1的激活通常发生在炎症小体组装成复合物之后.当caspase-1被招募到炎症小体后,会产生具有活性的caspase-1 p46二聚体,该二聚体在结构域间的连接体上进行自我切割,产生有活性的p33/p10亚基,用于切割pro-IL-1β.但caspase-1 p33/p10亚基很不稳定,会迅速进行第二次自切割,去除CRAD结构域,从炎症小体中释放caspase-1 p20/p10亚基,进而失去活性[5].因此,p33/p10亚基在炎症小体中的持续时间和活化状态在炎症应答信号传导中起着至关重要的作用.然而,目前关于p33/p10调控的研究还很少.笔者的研究发现RNF125可以调控caspase-1 p33活性亚基的泛素化修饰(caspase-1激活的最后一步),这是一种新的caspase-1 p33亚基的调控分子.主要依据有以下几个方面:首先,RNF125与caspase-1 p33亚基具有相互作用;其次,RNF125抑制对p33亚基的K48聚泛素化修饰,促进其K63聚泛素化修饰;再次,对THP-1细胞进行炎症刺激时,敲低内源性RNF125的表达可以显著减少IL-1β的分泌,其原因可能是在siRNF125的细胞中,p33亚基活性降低导致了IL-1β的成熟和分泌减少.K48聚泛素化通常是通过蛋白酶体途径促进底物蛋白的降解,而K63聚泛素化在某些情况下是细胞内信号传导过程中所必需的.至于RNF125通过影响p33亚基的这两种泛素化修饰对其活性影响的具体机制还有待笔者深入研究.有趣的是,作为一种E3泛素连接酶,RNF125却抑制了p33亚基的K48聚泛素化,它很可能像E3泛素连接酶NEDD4-1一样可以招募特异的泛素蛋白酶形成去泛素化复合物[20],从而通过去除caspase-1 p33亚基上的K48聚泛素化链来稳定caspase-1 p33亚基.此外,在笔者的研究中,过表达RNF125促进了caspase-1 p33亚基的总泛素化修饰,但相较于K63聚泛素化的增加,RNF125对K48聚泛素化的抑制更为显著.因此,p33亚基的其他泛素化的方式也可能受到RNF125的调控.这些问题需要进一步的研究.
有报道表明,RNF125是NLRP3 LRR结构域发生K63聚泛素化所必需的,它可以招募另一个针对NLRP3的E3泛素连接酶Cbl-b对NLRP3进行K48聚泛素化,从而导致底物蛋白的降解,产生抑制炎症应答的作用[21].但在笔者的研究中,在LPS+ATP的炎症刺激下,敲低内源RNF125表达的THP-1细胞,可以显著减少IL-1β的分泌,且在该研究未发表的多个炎症模型中RNF125均具有促进炎症应答的功能.这种矛盾可能是由于药物剂量和基因敲除方式的差异所致[22-23].这意味着RNF125在炎症信号传导中的功能可能更为复杂、更为多样化.笔者的研究结果也表明,敲除RNF125可以缓解叶酸诱导的肾炎症状,为肾炎或其他炎症性疾病的干预提供了一个新的靶点.总之,笔者的研究证明了RNF125可作为新的caspase-1 p33活性亚基的调控因子,参与炎症应答,可为炎症应答的调控研究提供新方向,也可为炎症性相关疾病的治疗提供新思路.

