AgNPs的绿色合成及其对杨树组培苗生长的影响
王大成,苏鹏飞,贾会领,丁双双,黄胜威,阚文杰,姚缘圆,侯金艳,吴丽芳,4*
(1.安徽大学 物质科学与信息技术研究院,安徽 合肥 230039;2.中国科学院合肥物质科学研究院 离子束生物工程与绿色农业研究中心,安徽 合肥 230031;3.中国科学技术大学 生命科学学院,安徽 合肥 230031;4.中科太和试验站,安徽 太和 236626)
纳米银(silver nanoparticles,简称AgNPs)作为一种独特的纳米材料,由于其优异的光电、催化及抗菌等性能,被广泛应用于传感器[1]、电极元件[2]、催化剂[3]、生物材料[4]及医疗抗菌[5]等领域.因此,人们开始关注AgNPs的合成.传统的物理和化学方法合成AgNPs存在反应时间长、反应步骤繁琐以及反应过程中存在有毒试剂的使用等缺陷[6].植物提取液合成AgNPs存在反应液制备过程复杂[7]、反应效率低等问题[8].由于通过微生物还原法即生物合成法合成AgNPs具有操作简单、反应条件温和、成本低廉以及绿色环保等优点,被认为是AgNPs生产最具前景的来源[9].此外,利用生物合成方法合成的纳米粒子表面很容易附着蛋白等生物基质,在提高生物溶解性的同时提高了AgNPs的稳定性,使其在生物医学领域更具应用潜力[10].
目前,已分离出多种用于AgNPs合成的菌类[11-13],由于细菌繁殖迅速而在AgNPs合成中脱颖而出[14].但AgNPs合成中亟需筛选1株硝酸银耐受性强且合成效率高的菌株.笔者实验室前期在松褐天牛肠道内筛选到1株奇异变形杆菌(Proteusmirabilis) YC801,研究发现此株奇异变形杆菌能够高效合成纳米硒[15],并初步证实该菌株具有高效合成AgNPs的能力.由于细菌胞外滤液相比于全细胞而言无细胞结构等,用于合成AgNPs不仅操作简单、易于分离,且具有较高的回收效率和产量等优势.
目前,AgNPs作为植物生长调节剂在植物快繁方面表现出越来越多的积极作用,Manh等[16]研究发现1.6 mg·mL-1AgNPs可显著提高越南参体细胞胚的发生和增殖,Spinoso-Castillo等[17]研究表明,在香兰草的组培快繁中,低剂量AgNPs的使用既能抑制微生物污染又能通过提高叶绿素含量、总酚含量,抵抗氧化及脂质过氧化能力来促进幼苗生长.此外,AgNPs在草莓组培快繁体系中能显著提高芽增殖率和不定根诱导率[18].目前,AgNPs对植物生长的研究主要集中在AgNPs对植物抗氧化酶系统的影响[19]及抑制乙烯通路[20]等方面,而在光合作用方面鲜有报道.众所周知,光合作用是植物生命活动中一项重要的生理生态过程,植物生物量的积累离不开光合作用.叶绿素作为植物光合色素中一类重要色素,其含量高低以及最大光化学效率Fv/Fm的大小可作为评判植物光合能力强弱的重要指标[21].
杨树(PopulusL.)作为我国重要的材用树种,在绿化及防风固沙方面也具有重要作用.通过组培方式对其进行快繁,在杨树种苗规模化推广及遗传改良方面起着举足轻重的作用.目前,有关AgNPs对杨树组培苗生长影响方面的研究尚未有报道.笔者以奇异变形杆菌YC801合成AgNPs为主要研究内容,探究菌培养时间、银离子浓度、反应温度、反应时间,以及pH等对菌液上清合成AgNPs的影响.在AgNPs合成的基础上,进一步研究AgNPs对杨树组培苗不定根形成、光合能力等的影响.
1 材料和方法
1.1 供试材料
菌株:所用菌株奇异变形杆菌(Proteusmirabilis) YC801为笔者实验室保藏(NCBI注册号为MK701741).所用培养基为YEP固体培养基和YEP液体培养基.
杨树组培苗:以笔者课题组前期离体再生培养获得的长势均一的无性系84K杨树组培伸长不定芽为实验材料.所用基本培养基为1/2 MS固体培养基(6.8 g·L-1琼脂、20 g·L-1蔗糖培养基皆用1 N NaOH或1 N HCl将pH调整至5.8,于121 ℃,105 kPa条件下高压蒸汽灭菌20 min后,备用).
1.2 主要试剂和仪器
硝酸银(AgNO3)、聚乙烯吡咯烷酮(PVP),分析纯,国药集团化学试剂有限公司;吲哚丁酸(IBA), 美国Sigma Aldrich;超微量生化分光光度计(Scandrop),德国Analytik Jena AG;扫描电子显微镜(S4800), 日本日立;电感耦合等离子体发射光谱仪(ICP-OES, ICP 7400), 美国 Thermo Scientific;叶绿素计(SPAD-502 PLUS), 日本柯尼卡美能达;手持式光谱仪(SpectraPen LM 510)、手持式叶绿素荧光仪(Fluorpe FP 110),捷克 PSI.
1.3 AgNPs的生物合成及条件优化
研究涉及的AgNPs生物合成过程主要包括以下步骤:(1)奇异变形杆菌YC801的活化.将超低温冰箱(-80 ℃)保存的YC801菌株于YEP固体培养基上划线培养,挑取单个菌落,接种到YEP液体培养基中,37 ℃摇床震荡过夜培养.(2)制备菌液上清.将新鲜菌液按1%(v/v)接种到YEP液体培养基中扩大培养;将培养的菌液进行离心(12 000 r·min-1,15 min)获得上清.(3)AgNPs的合成.将AgNO3溶液加入菌液上清中并均匀混合,避光下水浴恒温反应,得到红棕色反应液,将所得反应液进行低速离心(3 000 r·min-1,2 min),去除杂质后用高速低温冷冻离心机进行离心(12 000 r·min-1,20 min),然后用pH=7.0的磷酸盐缓冲溶液洗3次,最后加入0.3% PVP溶液稳定AgNPs颗粒,即得到AgNPs溶液.
为了探究不同培养时间对AgNPs合成的影响,将YC801菌株分别培养不同时间(8,12,16,20,24,28 h),然后在上述合成步骤(1)和步骤(3)不变的条件下进行AgNPs的合成.在此基础上,为优化不同银离子浓度对AgNPs合成的影响,在其他条件不变的前提下,探究不同AgNO3浓度(0,1,3,5,7,10 mmol·L-1)对AgNPs合成的影响.为研究不同温度对AgNPs合成的影响,实验中进一步将水浴温度分别设置为25,40,55,70,85,100 ℃,在其他条件不变的前提下进行AgNPs的合成.为评价不同pH对AgNPs合成的影响,菌液上清的pH由碳酸钠和稀硝酸分别调节至6.0,7.0,8.0,9.0,10.0,11.0,在其他条件不变的情况下,按上述方法合成AgNPs.同时,进一步研究100 ℃水浴不同孵育时间(3,5,7,10,15,20 min)对AgNPs合成的影响.
将在上述最优培养条件所得的YC801菌株的菌液,最优AgNO3浓度、pH、反应温度及孵育时间等条件下合成的AgNPs,高速离心(12 000 r·min-1,20 min)后用pH=7.0的磷酸盐缓冲溶液洗3次,最后加入0.3% PVP溶液稳定AgNPs颗粒,得到AgNPs溶液.
1.4 AgNPs的表征
扫描电子显微镜(TEM):取适量最优条件下合成的AgNPs溶液,超声振荡30 min,移液适量AgNPs在铜网上,晾干,重复几次后获得样品.在扫描电子显微镜下观察AgNPs的形貌及尺寸.
电感耦合等离子体发射光谱仪(ICP-OES):将最优条件下制备的AgNPs溶液稀释1倍,用0.22 μm滤膜过滤,此即是AgNPs母液,过滤后的AgNPs溶液置于4 ℃冰箱备用.取50 μL AgNPs母液加入4 950 μL浓硝酸,过夜硝化,蒸干溶液后加入5 mL超纯水,0.22 μm滤膜过滤后用ICP 7400电感耦合等离子体发射光谱仪(ICP-OES)测定AgNPs浓度.
1.5 不同浓度AgNPs对杨树组培苗生长的影响
为了进一步探究AgNPs对杨树组培苗生长的影响,以1/2 MS为基本培养基,在培养基中添加AgNPs母液使其终浓度分别为0.00,0.05,0.10,0.50,1.00,2.00 mg·L-1进行预实验.将长势均一的高度为2 cm左右的杨树组培不定芽分离成单个芽体后接种于不同浓度的AgNPs培养基中,将培养瓶放置于温度为(23 ± 2) ℃,光照强度为2 000~2 500 lx,光照周期为16/10 h(光照/黑暗)的恒温培养室培养4周后去除杨树组培苗基部的培养基,观察并统计再生植株的株高、不定根长、不定根数及侧根数.
1.6 不同外源处理对杨树组培苗生长的影响
在前期的预实验中,研究发现以IBA作为外源植物生长调节剂时,其浓度为0.5 mg·L-1时最有利于杨树组培苗的生根.因此,实验采用0.5 mg·L-1IBA与AgNPs做对比.以上述实验中不同浓度AgNPs处理的杨树伸长芽获得的最佳促生长的AgNPs浓度为1.0 mg·L-1,选取长势一致的杨树组培苗,分别接种于4组不同外源处理培养基中:(1)对照组(CK)——以1/2 MS为基本培养基;(2)AgNPs组——以1/2 MS为基本培养基 + 1.0 mg·L-1AgNPs;(3)IBA组——以1/2 MS为基本培养基 + 0.5 mg·L-1IBA;(4)IBA-AgNPs组——以1/2 MS为基本培养基 + 1.0 mg·L-1AgNPs+0.5 mg·L-1IBA培养.每个处理设置4个生物学重复,每个重复处理5瓶杨树伸长芽,每瓶接种4个.将接种有杨树伸长芽的培养瓶放置于温度为(23 ± 2) ℃,光照强度为2 000~2 500 lx,光照周期为16/10 h(光照/黑暗)的恒温培养室培养5周后观察各处理组杨树伸长芽的生长状况.
(1)取组培苗在流动水下洗净附着在杨树苗基部的琼脂,擦干水分后,测量株高和不定根长,并记录不定根数和侧根数.(2)根系活力测定:按照北京雷根生物技术有限公司植物根系活力试剂盒(TCC比色法)测定各处理组杨树苗的根系活力.(3)叶绿素相对含量测量:使用叶绿素计(SPAD-502 PLUS)直接夹取叶片检测其叶绿素相对含量SPAD.(4)使用SpectraPen LM 510手持式光谱仪检测培养的光照强度,光照强度的数据将应用于叶绿素荧光仪测试参数的设定;Fluorpe FP 110手持式叶绿素荧光仪测量叶绿素荧光相关指标,记录PS II的最大光化学效率Fv/Fm.
1.7 数据处理
试验数据为3次独立测定的测量值的平均值,并表示为平均值 ± 标准误差,使用Origin 2021软件作图,同时运用SPSS 18.0软件进行单因素方差分析,采用Ducan’s检验分析在0.05水平上的显著性.
2 结果与讨论
2.1 AgNPs的生物合成
紫外可见吸收光谱技术被认为是研究纳米材料制备过程的重要技术之一,且相关研究表明AgNPs水溶液为红褐色或灰棕色[22-24].该研究中YC801上清反应过程中由淡黄色变为红褐色,研究结果表明Ag+向AgNPs转化(图1).这种颜色变化是由于在反应体系中合成的AgNPs颗粒表面等离子体共振(SPR)引起的.紫外吸收光谱显示AgNPs在430 nm(图2)左右有最大吸收峰,研究结果与前人研究的AgNPs紫外吸收光谱在400~450 nm保持一致[25-26].

图1 AgNPs合成前后溶液的颜色变化 图2 AgNPs的UV-Vis图
2.2 AgNPs的条件优化
不同培养时间(8,12,16,20,24,28 h)培养的奇异变形杆菌的菌液对AgNPs合成的影响,结果如图3(a)所示.前人研究表明,在AgNPs合成反应体系中初始银离子浓度对AgNPs的形状和大小都有较大的影响[27].为进一步优化银离子浓度,采用不同浓度的AgNO3与菌液上清反应,不同浓度的AgNO3对AgNPs合成的影响结果如图3(b)所示.
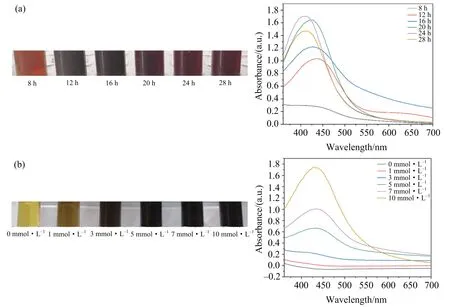
(a)YC801的培养时间对AgNPs合成的影响在反应颜色上的变化及UV-Vis图;(b)银离子浓度对AgNPs合成的影响在反应颜色上的变化及UV-Vis图.图3 AgNPs合成条件优化
通过颜色(图3(a))观察发现,随着YC801培养时间的增加,反应体系的颜色逐渐加深.相应的UV-Vis图显示当菌培养8 h时,在360~700 nm波长范围内,没有出现特征吸收峰;而当菌培养时间在12~28 h范围内菌液均能合成AgNPs,且在培养24 h时特征峰达到最大.相关研究表明特征吸收峰值的大小与溶液中AgNPs颗粒的浓度呈正比关系[23],由此可知,在24 h时合成的AgNPs浓度最大.进一步研究发现,随着菌培养时间的延长,吸收峰发生了蓝移,可推测这一转变是由于银离子快速被还原,同时也说明了奇异变形杆菌在培养过程中随着时间的延长,还原Ag离子的代谢产物先增加后减少,这对AgNPs的生产有重要的指导意义.
图3(b)显示,随着银离子浓度的增加,反应体系的颜色逐渐加深.而相应的UV-Vis显示较低浓度的Ag+反应体系在360~700 nm范围内无明显特征吸收峰,由此证明反应体系中无AgNPs的合成,当AgNO3浓度为10 mmol·L-1时,合成的AgNPs特征峰值对应最大,即此时AgNPs含量最高.
由于反应温度是影响AgNPs形状和大小的关键因素之一,将水浴温度分别设置为25,40,55,70,85,100 ℃,研究水浴温度对AgNPs合成的影响,结果如图4(a)所示.pH的改变导致代谢物质中的电荷转换,碱性pH易引发金属离子的溶解,从而改变合成物的大小和形态[28],结果如图4(b)所示.为研究反应时间对AgNPs合成的影响,分别记录在水浴温度为100 ℃时,分别孵育3,5,7,10,15,20 min对AgNPs合成的影响,结果如图4(c)所示.

(a)温度对AgNPs合成的影响反应颜色变化及UV-Vis图;(b)反应时间对AgNPs合成的影响反应颜色变化及UV-Vis图;(c)pH对AgNPs合成的影响影响反应颜色变化及UV-Vis图.图4 AgNPs合成条件优化
结果表明(图4(a)),在较低温度下溶液颜色转变较小,在25 ℃时未检测到特征峰出现,表明此时反应体系中无AgNPs形成.在较高温度下形成AgNPs的时间更短,效率更高.此外,AgNPs也能在室温下形成,但速度缓慢,而且SPR带较之高温条件相比不尖锐,即合成效率较低[29].
不同pH体系所对应的UV-Vis(图4 (b))显示,在pH=6.0时,无特征吸收峰出现,表示无AgNPs颗粒生成,且随着pH的增加,特征吸收峰值逐渐增加,在pH=10.0时得到最大的特征峰,此时的AgNPs含量最高.而在pH=11.0时峰值又开始下降,推测可能是由于碱性过高,对菌液上清中的有机物质产生一定的影响,进而影响了合成的效率[30].
图4 (c)显示,随着反应时间的增加,反应溶液的颜色越来越深,但水浴时间为15 min时开始有少许沉淀,到20 min时沉淀变多.相应的UV-Vis显示,在反应3 min时即有AgNPs产生,在反应3~15 min内AgNPs的特征峰越来越高,表明AgNPs的浓度越来越高,但在20 min时峰值又急剧下降,SPR吸收急剧下降,AgNPs浓度降低,可能是由于反应时间过长,AgNPs和蛋白等有机质一起团聚沉淀,因而其含量下降[7].因此,选择在100 ℃水浴孵育10 min为最佳反应时间.
综上所述,最优条件下的合成路线为:将培养24 h的YC801菌株的菌液上清加入10 mmol·L-1的AgNO3溶液中,于pH=10,反应温度为100 ℃条件下孵育10 min合成AgNPs,然后将合成的AgNPs高速离心(12 000 r·min-1,20 min)后用pH=7.0的磷酸盐缓冲溶液洗3次,最后加入0.3% PVP溶液稳定AgNPs颗粒,得到AgNPs溶液.
2.3 AgNPs的表征
利用SEM 对AgNPs的形貌进行表征,结果显示菌液上清合成的AgNPs主要为球形或伪球形,纳米颗粒尺寸均匀,分散性良好且无明显的团聚现象(图5(a)).使用粒径分析软件分析颗粒可知,合成的AgNPs颗粒尺寸为20~60 nm(图5(b)).
进一步采用ICP 7400电感耦合等离子体发射光谱仪(ICP-OES)测定AgNPs浓度,得到AgNPs母液浓度为0.848 4 mg·mL-1.
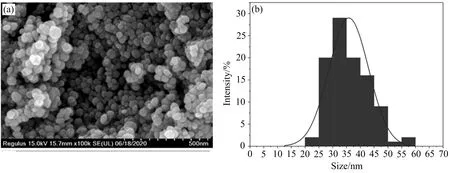
图5 AgNPs的SEM(a)和粒径分布图(b)
2.4 不同浓度AgNPs对杨树组培苗生长的影响
添加不同浓度AgNPs的培养基培养4周后的组培苗的株高、不定根长和不定根数及侧根数如表1和图6所示.当培养基中AgNPs浓度小于2.0 mg·L-1时,随着AgNPs浓度的增加,杨树组培苗的株高逐渐增加,最高可达68.0 9 mm,较CK(47.30 mm)显著增加了43.95%.当培养基中AgNPs浓度为1.0 mg·L-1时,不定根长度为41.83 mm,较CK(29.37 mm)显著增长42.42%.当培养基中添加0.5 mg·L-1AgNPs时,平均侧根数最多,为42条,较CK(15条)显著增加了182.2%.当AgNPs达到2.0 mg·L-1后,杨树组培苗的各项生长指标都有不同程度的下降,开始出现AgNPs对植物的毒性效应,这与前人的研究结果一致[31-33].综上所述,AgNPs处理的杨树组培苗在株高、不定根长和侧根数以及长势上都表现出较好的形态.可以推测一定浓度范围内的AgNPs能够有效促进杨树组培苗的生长.

表1 不同浓度AgNPs对杨树组培苗生长的影响

图6 不同浓度AgNPs对杨树组培苗生长的影响
2.5 不同外源处理对杨树组培苗生长的影响
在探究了不同浓度AgNPs对杨树组培苗生长影响的基础上,进一步进行在最适浓度(1.0 mg·L-1)AgNPs与最适浓度IBA(0.5 mg·L-1)之间的对比实验,温室培养5周后组培苗的生长情况如表2、图7所示.

表2 不同外源处理对杨树组培苗生长的影响

图7 不同外源处理对杨树组培苗生长的影响
与CK比较,3个处理组对杨树组培苗高的生长都有不同程度的促进,尤其是AgNPs处理组明显较其他组别形态好(图7).表2显示,各处理组的株高较CK组均有显著差异,其中AgNPs组(120.53 mm)相比CK组提高了36.67%,而IBA组(106.07 mm)比CK组(88.19 mm)提高20.27%.在不定根长度上AgNPs组(66.59 mm)较CK组(45.71 mm)显著增加了45.68%,较IBA组(53.11 mm)也提高了25.38%.进一步研究发现,各组别与CK相比较在不定根数量上也有显著的提高.在侧根的诱导方面,AgNPs组表现出了绝对优势,较CK组显著增加了86.87%,而AgNPs和IBA联合使用,则没有出现协同作用.
植物生长发育所需的水分和无机养分主要通过根系吸收,根的生长情况和活力水平直接影响地上部分的生长和营养状况及生物量积累,根系活力是衡量其吸收能力的主要指标,它在一定程度上反映了植物的生命活动和新陈代谢的强弱[34].如图8所示,其他不同外源处理间杨树组培苗的根系活力存在显著差异,以AgNPs组最高,较其他处理组分别增加7.90%(IBA-AgNPs),35.76%(IBA),42.69%(CK).表明AgNPs能显著提升杨树幼苗根系活力.
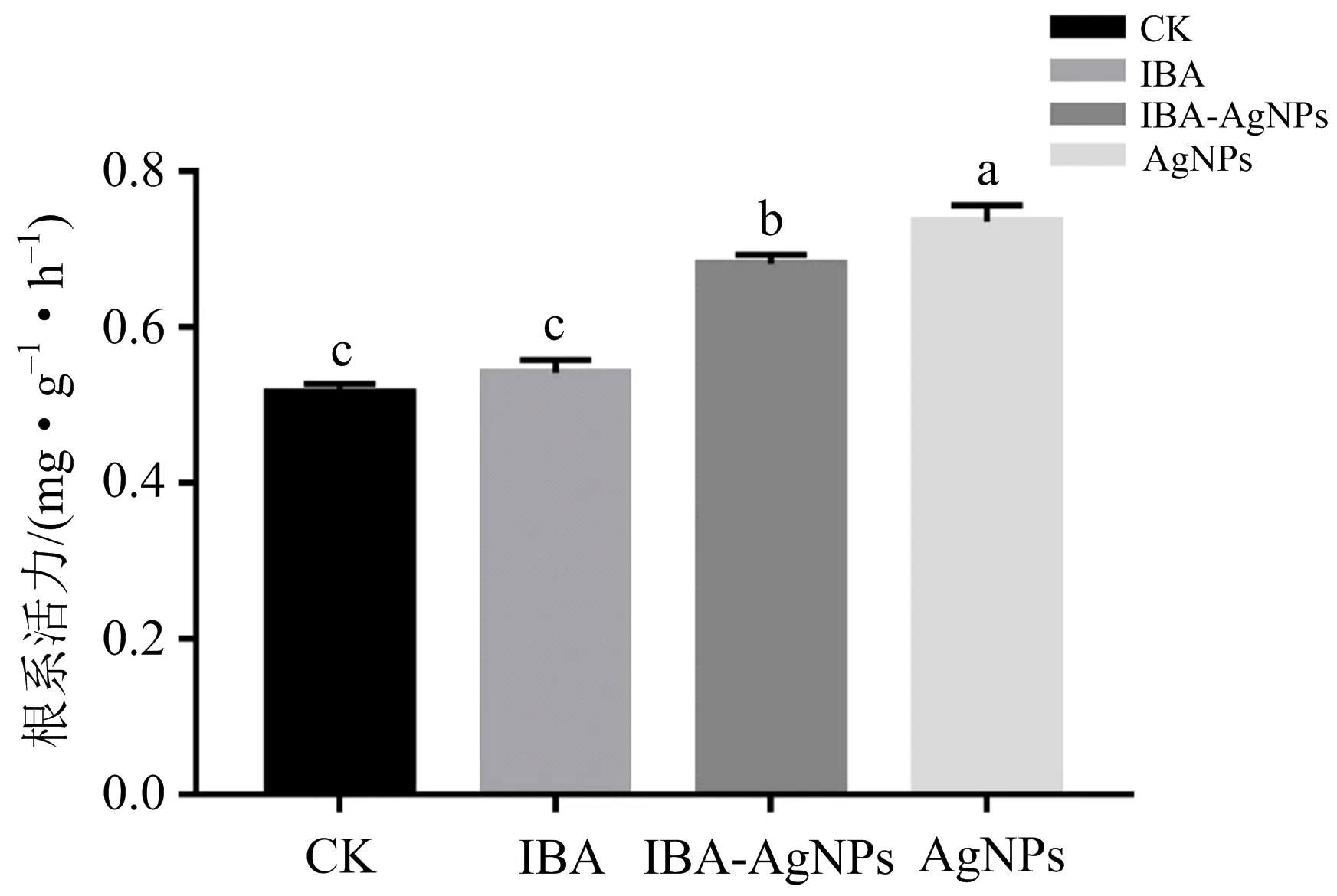
不同小写字母(a,b,c)表示不同外源处理之间存在显著性差异(p<0.05);相同字母表示无显著性差异.图8 不同外源处理对杨树根系活力的影响
纳米粒子与植物体之间的相互作用十分复杂,不仅取决于纳米材料的理化特性、试验浓度,也取决于植物种类、生长阶段或其他介质,还与光照强度、植物体暴露途径等因素息息相关[35].纳米粒子可以通过渗入细胞对植物的生长发育产生影响.AgNPs对植物生长的调控机制目前并不是很清楚,已有研究推测AgNPs是通过改变细胞壁来增强植物细胞对养分的吸收[36].同样在其他纳米材料对植物的影响中也有类似的结论,Khodakovskaya等[37]利用TEM发现纳米碳能进入番茄幼苗的根系,并提高根系的吸水吸肥能力.Servin等[38]研究表明添加TiO2NPs溶液能够促进黄瓜对P,K 等养分的吸收和根系的生长.笔者的研究结果显示,AgNPs对杨树组培苗的生长指标以及根系活力等都有显著的提升,证明了AgNPs在促进植物生长方面的积极作用.
叶绿素是植物进行光合作用的主要色素,叶绿素含量与光合性能密切相关.研究结果(图9(a))表明,外源添加AgNPs对比其他处理组的SPAD值有显著性差异,其中比CK组提高了17.66%,这与前人报道一致[16],即AgNPs浓度在0.4~1.6 mg·L-1范围内有促进人参SPAD值增加的效果,同时促进了植株的生长.以Fv/Fm值作为光系统II(PS II)效率的指标来表示杨树光合作用强度.由图9(b)可知,AgNPs组与其他处理组都有显著性差异,其中AgNPs组较CK组提高了5.33%.表明AgNPs对提升杨树组培苗光合效率有着明显的效果,而添加外源IBA的处理组,则没有显著提高其光合效率.然而,IBA-AgNPs复合处理并没有出现协同效应.
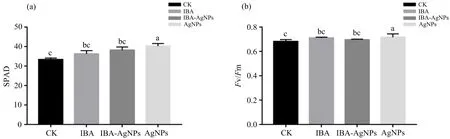
不同小写字母(a,b,c)表示不同外源处理之间存在显著性差异(p<0.05);相同字母表示无显著性差异.图9 不同外源处理对杨树SPAD(a)和光合效率(b)的影响
在组培过程中,由于植物在密闭的容器中培养,包括乙烯等有害气体的不断积累可能会影响其生理代谢[39].研究表明,ACS基因是乙烯合成通路中的限速酶,AgNPs通过抑制ACS基因的表达而减少乙烯的释放[40-41].Young等[42]在ZmACS6缺陷型玉米植株的叶片中,观察到更高水平的叶绿素和蛋白质以及更高的CO2同化速率,表明乙烯可以作为负调节剂来控制叶片中的叶绿素含量.研究发现,AgNPs处理离体小麦和甜菜幼苗时,都显著提高了叶绿素含量[43-44].另外,AgNPs处理后叶绿素含量的增加也可能与植物组织中氮、铁、镁含量的吸收增加有关[17].笔者的实验结果表明,AgNPs处理在叶绿素相对含量SPAD及最大光化学效率方面都有显著提升,促进了植株生长.但AgNPs与植物之间的相互作用还需进一步深入研究.
3 结束语
笔者在前期研究的基础上,进一步探究了奇异变形杆菌培养时间、反应时间、反应温度和AgNO3溶液浓度及pH对菌株胞外上清合成AgNPs的影响.在AgNPs条件优化的基础上,对合成的AgNPs进行了表征.最后,以杨树组培苗为研究对象探究了AgNPs对其不定根形成、根系活力及其生长的影响.
(1) AgNPs合成的最优条件为:以培养24 h的奇异变形杆菌YC801菌液上清与浓度为10 mmol·L-1AgNO3溶液在100 ℃、pH 10的条件下混合反应10 min.
(2) AgNPs合成具有高效性:在最优条件下3 min即开始合成AgNPs,浓度最大可达0.848 4 mg·mL-1,所合成AgNPs在430 nm左右有特征吸收峰,其颗粒呈球形或伪球形,分散性良好,粒径分布在20~60 nm.
(3) 杨树组培苗在添加1.0 mg·L-1AgNPs的培养基培养时,其株高、不定根长、侧根数、根系活力以及形态上都表现出较大的优势.AgNPs处理显著提高了杨树叶绿素含量及光合效率.研究结果表明,绿色合成的AgNPs在植物组培快繁中具有潜在的应用价值.

