血清IL-8、TIMP-1、单核细胞趋化因子-1 在子宫内膜异位症中的表达及与疾病分期的关系
宋宏,尚小巧,田宏
(南阳市第二人民医院妇科二病区,河南 南阳 473000)
子宫内膜异位症是临床常见慢性妇科疾病,可引发月经异常、痛经、慢性盆腔炎等症状,甚至造成不孕,且相关资料统计显示,在育龄妇女中发病率高达10%~15%左右, 严重影响女性生育健康[1-2]。 同时,有文献指出,子宫内膜异位症存在恶性疾病组织侵袭与远处转移的生物学行为, 需及早确诊、及时治疗,降低恶变风险[3]。 白细胞介素-8(Interleukin-8,IL-8)是一种常见炎症细胞因子,参与子宫内膜异位症发病过程[4]。 基质金属蛋白酶抑制 剂-1 (Tissue inhibitor of metalloproteinase-1,TIMP-1)属于金属蛋白酶天然特异性抑制剂,可在细胞增生与癌变时出现上调表达现象[5]。 单核细胞趋化因子-1(Monocyte chemokine-1,MCP-1)可特异性激活单核细胞、巨噬细胞,加快局部免疫炎症发生、发展[6]。 但鲜有三者联合检测在子宫内膜异位症中的报道。基于此,本研究尝试分析血清IL-8、TIMP-1、MCP-1 在子宫内膜异位症中的表达及与疾病分期的关系,旨在为临床诊治提供更多途径。现报告如下。
1 资料与方法
1.1 一般资料 选取我院2017 年1 月至2019 年8月收治的子宫内膜异位症患者117 例作为观察组,另选取同期健康体检女性115 例作为对照组。两组年龄、体质量指数(Body mass index,BMI)、孕次、产次、月经周期、经期时间等一般资料相比,差异无统计学意义(P>0.05),有可比性,见表1。 本研究经我院伦理委员会审批通过。
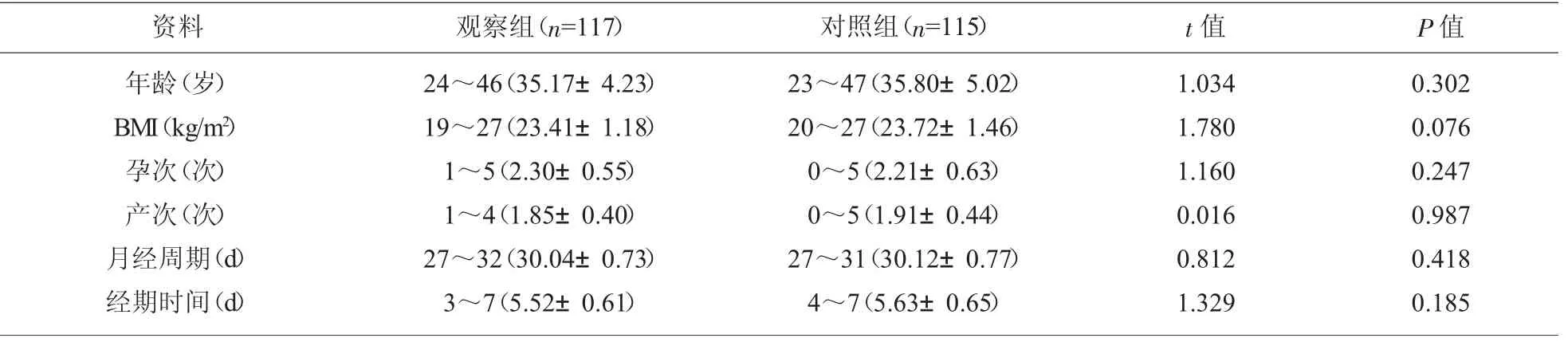
表1 两组一般资料
1.2 选取标准
1.2.1 纳入标准 观察组均经腹腔镜病理活检证实为子宫内膜异位症,且符合《子宫内膜异位症的诊治指南》相关诊断标准[7],参与本研究前未接受过相关治疗;对照组体检各项指标均显示正常;两组均知情本研究,自愿签订知情承诺书。
1.2.2 排除标准 伴有心血管疾病、 造血系统异常者;合并心肝肾等重要脏器严重功能障碍者;参与本研究前3 个月内服用激素治疗者; 合并自身免疫性疾病、过敏性疾病者;存在恶性肿瘤疾病者;伴有糖尿病等严重内科疾病者;妊娠期、哺乳期女性;伴有子宫腺肌症等其他子宫疾病者;临床资料缺失者。
1.3 方法 采集所有受试者5 mL 清晨空腹静脉血,采用离心机进行离心处理,离心速率为2 500 r/min,离心半径为13.5 cm,离心时间为15 min,取上清液,保存于-80 ℃条件下,待检。采用酶联免疫吸附试验法检测血清IL-8、TIMP-1、MCP-1 水平,试剂盒购自美国Assay Designs 公司, 严格按照试剂盒说明书操作。
1.4 观察指标 (1)两组血清IL-8、TIMP-1、MCP-1水平。 (2) 血清IL-8、TIMP-1、MCP-1 诊断价值。(3) 观察组不同疾病分期患者血清IL-8、TIMP-1、MCP-1 水平, 其中疾病分期按照美国生育协会(American fertility society,AFS) 制订的评分法,即AFS 分期分为Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期。(4)血清IL-8、TIMP-1、MCP-1 与疾病分期的关系。 (5)观察组手术前后血清IL-8、TIMP-1、MCP-1 水平变化趋势。
1.5 统计学处理 数据处理使用SPSS 22.0 软件包,计量资料以(±s)表示,两组间比较采用两独立样本t 检验,多组间比较采用方差分析,组内不同时间点比较采用单因素重复测量数据方差分析,以受试者工作特征(Receiver operating characteristic,ROC) 曲线分析血清IL-8、TIMP-1、MCP-1 对子宫内膜异位症的诊断价值,Spearman 相关性分析血清各指标水平与疾病分期的关系,P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清IL-8、TIMP-1、MCP-1 水平 观察组血清IL-8、TIMP-1、MCP-1 水平高于对照组 (P<0.05),见表2。
表2 两组血清IL-8、TIMP-1、MCP-1 水平比较(±s)
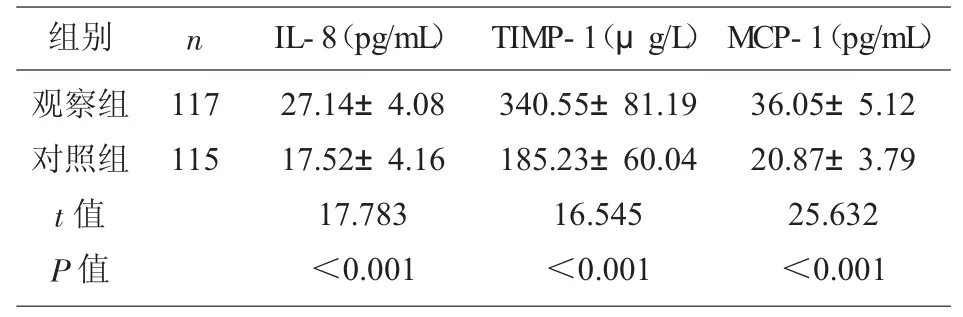
表2 两组血清IL-8、TIMP-1、MCP-1 水平比较(±s)
组别 n观察组对照组t 值P 值117 115 IL-8(pg/mL) TIMP-1(μg/L)27.14±4.08 17.52±4.16 17.783<0.001 340.55±81.19 185.23±60.04 16.545<0.001 MCP-1(pg/mL)36.05±5.12 20.87±3.79 25.632<0.001
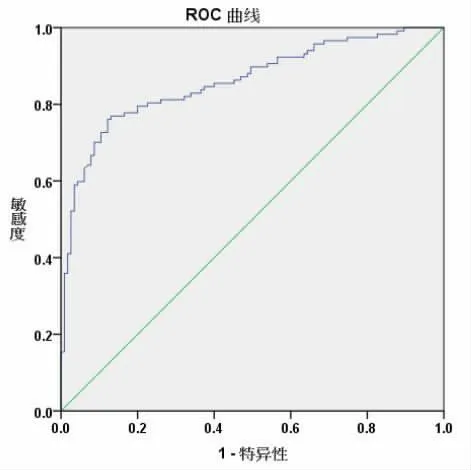
2.2 血清IL-8、TIMP-1、MCP-1 的诊断价值 绘制血清IL-8、TIMP-1、MCP-1 诊断子宫内膜异位症的ROC 曲线,结果显示,血清IL-8 AUC 为0.685,95%CI:0.621~0.744,P<0.001,当截断值>22.75 pg/mL 时,敏感度为69.23%,特异度为60.87%;血清TIMP-1 AUC 为0.809,95%CI:0.753~0.858,P<0.001,当截断值>265.14 μg/L 时,敏感度为64.96%,特异度为84.36%; 血清MCP-1 AUC 为0.765,95%CI:0.705~0.818,P<0.001, 当截断值>31.32 pg/mL 时,敏感度为59.83%,特异度为80.00%。 见图1。
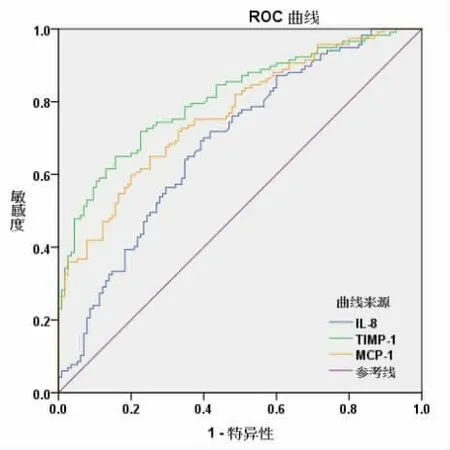
2.3 联合诊断 ROC 曲线显示,血清IL-8、TIMP-1、MCP-1 联合AUC 为0.860,95%CI:0.809~0.902,P<0.001,诊断敏感度为76.07%,特异度为87.83%。
2.4 观察组不同疾病分期患者血清IL-8、TIMP-1、MCP-1 水平 血清IL-8、TIMP-1、MCP-1 水平随疾病分期增加呈逐渐升高趋势(P<0.05),见表3。
表3 观察组不同疾病分期患者血清IL-8、TIMP-1、MCP-1 水平比较(±s)
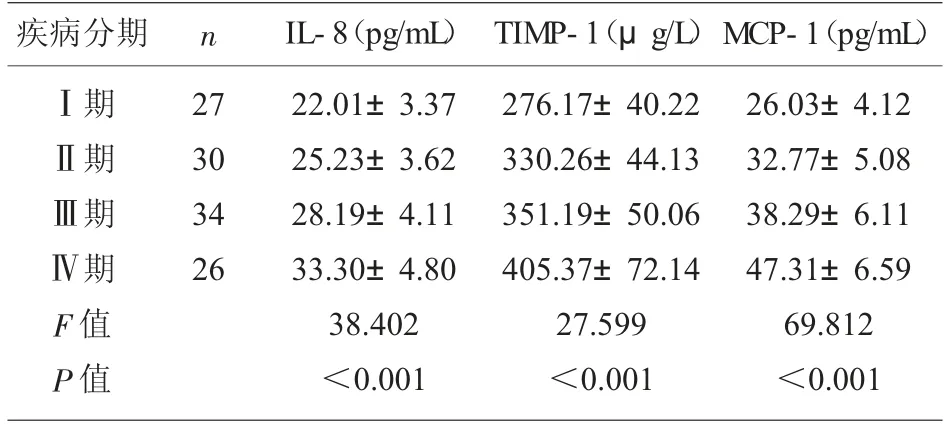
表3 观察组不同疾病分期患者血清IL-8、TIMP-1、MCP-1 水平比较(±s)
疾病分期 nⅠ期Ⅱ期Ⅲ期Ⅳ期F 值P 值27 30 34 26 IL-8(pg/mL) TIMP-1(μg/L)22.01±3.37 25.23±3.62 28.19±4.11 33.30±4.80 38.402<0.001 276.17±40.22 330.26±44.13 351.19±50.06 405.37±72.14 27.599<0.001 MCP-1(pg/mL)26.03±4.12 32.77±5.08 38.29±6.11 47.31±6.59 69.812<0.001
2.5 血清IL-8、TIMP-1、MCP-1 与疾病分期的关系 Spearman 相关性分析, 血清IL-8、TIMP-1、MCP-1 与疾病分期呈正相关(P<0.05),见表4。
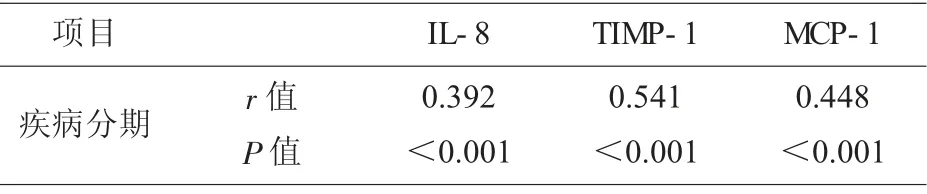
表4 血清IL-8、TIMP-1、MCP-1 与疾病分期的关系
2.6 观察组手术前后血清IL-8、TIMP-1、MCP-1变化趋势 观察组术后3 d、5 d、7 d 血清IL-8、TIMP-1、MCP-1 水平较术前降低, 且呈持续降低趋势(P<0.05),见表5。
表5 观察组手术前后血清IL-8、TIMP-1、MCP-1 变化趋势(±s)
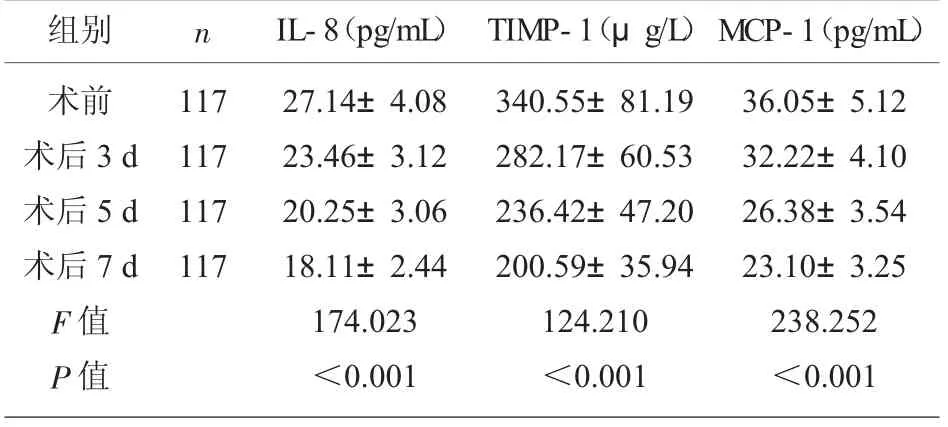
表5 观察组手术前后血清IL-8、TIMP-1、MCP-1 变化趋势(±s)
组别 n术前术后3 d术后5 d术后7 d F 值P 值117 117 117 117 IL-8(pg/mL) TIMP-1(μg/L)27.14±4.08 23.46±3.12 20.25±3.06 18.11±2.44 174.023<0.001 340.55±81.19 282.17±60.53 236.42±47.20 200.59±35.94 124.210<0.001 MCP-1(pg/mL)36.05±5.12 32.22±4.10 26.38±3.54 23.10±3.25 238.252<0.001
3 讨论
子宫内膜异位症在形态表现方面呈良性,但病变部位长时间分泌、 吸收, 可导致周围组织粘连,改变组织间解剖关系,加之其具有反复发作、侵袭性生长、转移等特点,极易干扰受孕器官功能[8-9]。且有数据统计表明,60%~80%子宫内膜异位症患者可能发展为盆腔炎或不孕, 对女性生育能力造成严重不利影响,防治形势极为严峻[10]。目前,临床尚未完全明确子宫内膜异位症发病机制,多认为与机体免疫炎症反应密切相关[11-12]。 故积极探索相关因子改变在疾病发生、 发展中的作用及影响,对临床制定针对性诊治措施具有重要意义。
IL-8 是一种由巨噬细胞、 内膜细胞等分泌的炎症细胞因子,可介导炎症反应发生,加快内皮细胞增殖、迁移,促进新生血管形成[13]。 魏顺英等[14]报道中显示, 与健康体检者[(14.26±7.92)pg/mL]相比, 血清IL-8 在子宫内膜异位症中异常升高表达[(41.23±7.65)pg/mL]。 本研究发现,子宫内膜异位症患者血清IL-8 水平显著高于健康体检女性,与上述报道结果基本一致, 提示IL-8 在子宫内膜异位症发生中发挥重要作用。 推测原因,腹腔内聚集大量炎症细胞,促使巨噬细胞加快合成、释放IL-8,不仅加重炎症反应, 还增加子宫异位内膜基底部毛细血管形成, 进而不断促进异位内膜生长、增殖、浸润[15]。 但ROC 曲线分析,血清IL-8 单独检测在子宫内膜异位症中的诊断价值欠佳, 可能与选取患者生理病理改变、病情程度不同等因素有关。Spearman 相关性证实,血清IL-8 与疾病分期具有正相关关系, 主要是由于子宫异位内膜病情进展过程中,异位内膜组织处于不断增殖状态,造成腹腔、血液内IL-8 水平持续处于高水平状态,导致机体内环境炎症反应加剧, 为疾病发展创造有利条件。因此,血清IL-8 可作为临床评估子宫内膜异位症病情的重要辅助指标。
TIMP-1 是内源性低分子量蛋白质,广泛分布于全身各种体液与组织内, 多种细胞因子可诱导其表达[16]。 临床实践证实,子宫内膜异位症与TIMP-1 表达异常有关[17]。 且韩玉双等[18]观点认为,血清TIMP-1 与子宫内膜异位症发病具有明显相关性。在此基础上,本研究发现,血清TIMP-1 水平不仅在子宫内膜异位症患者中显著升高, 且具有较好诊断价值。 TIMPs 具有抑制胶原酶活性作用,在细胞增生及癌变发生时, 基质金属蛋白酶(MMPs)、TIMPs 均呈现上升趋势,一旦TIMPs 升高程度无法抑制MMPs 活性,则打破两者之间平衡,促使细胞外基质过多降解, 从而加快新生血管形成、增强细胞黏附作用[19]。 故TIMP-1 在子宫异位内膜细胞黏附、生长、种植过程中发挥促进作用。同时,本研究数据证实,血清TIMP-1 与子宫内膜异位症患者疾病分期密切相关, 主要与其加快子宫内膜异位症发生、浸润和转移过程有关。 提示临床可通过检测血清TIMP-1 水平诊断子宫内膜异位症,判断病情程度,为制定针对性治疗措施提供有效信息。
MCP-1 属于单核细胞浸润到组织与肿瘤中的有效介质,能结合单核-巨噬细胞表面受体,增强无增殖能力巨噬细胞活性及数量, 促进疾病发生发展[20]。本研究结果显示,与健康体检女性相比,子宫内膜异位症患者血清MCP-1 水平较高,这与李萍等[21]学者研究中子宫内膜异位症患者血清、腹腔液中MCP-1 水平分别达(37±8)pg/mL、(84±25)pg/mL 的研究结果一致。 可见MCP-1 参与子宫内膜异位症发生过程。 有资料发现,子宫内膜异位症发病初期,子宫内膜基质细胞、细胞外基质的黏附作用可诱导整合素,加快其生成MCP-1,而MCP-1能提高整合素依赖性细胞黏附能力, 从而促进疾病发生、病情进展[22]。 同时,本研究通过Spearman相关性分析发现,血清MCP-1 与疾病分期呈正相关, 可能是由于子宫内膜异位症患者分泌相关细胞因子刺激腹膜间皮细胞合成MCP-1,MCP-1 对异位内膜产生诱导、活化作用,形成正反馈级循环放大效应,从而加快病情进展。
本研究在上述研究基础上进一步对血清IL-8、TIMP-1、MCP-1 单独及联合检测对子宫内膜异位症的诊断价值进行定量分析,结果显示,单独检测时TIMP-1、MCP-1 的诊断效能较高,AUC 值分别为0.809 和0.765,均>0.7,特异度分别达到84.36%和80.00%,但三者的敏感度均较低(<70%);三者联合检测的AUC 值达0.860,敏感度为76.07%,特异度为87.83%,均较单独检测时有不同程度升高,提示联合检测血清IL-8、TIMP-1、MCP-1 水平对子宫内膜异位症具有较高的诊断价值。 此外,本研究还分析了手术前后血清变化趋势,发现术后3 d、5 d、7 d 血清IL-8、TIMP-1、MCP-1 呈持续降低趋势, 说明三者与子宫内膜异位症患者病情改善密切相关。 但本研究选取样本量较少,可能造成数据偏移, 加之未考虑血清检测方法对其水平表达的影响,可能导致与其他研究结果存在一定差异,需作进一步分析与探究。
综上可知,血清IL-8、TIMP-1、MCP-1 在子宫内膜异位症中呈异常升高表达, 联合检测具有良好诊断价值,且与疾病分期密切相关,还有助于为判断术后病情改善提供参考依据。

