非转移人表皮生长因子受体 2阳性乳腺癌新辅助治疗后病理完全缓解的影响因素及列线图模型建立△
金龙,曹菲,安改丽#,张沥,马少君
陕西省人民医院1放疗科,2肿瘤内科,3MRI室,4放射科,西安 710068
世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC)2020年12月发布的全球肿瘤数据显示,乳腺癌新增例数高达226万例,成为全球第一大肿瘤。人表皮生长因子受体 2(human epidermal growth factor receptor 2,HER2)阳性乳腺癌占所有乳腺癌的15%~25%[1]。荟萃研究证实,HER2阳性乳腺癌对新辅助治疗反应性高,获得病理完全缓解(pathological complete response,pCR)的患者表现出无事件生存(eventfree survival,EFS)获益[2]。因此,研究 HER2阳性乳腺癌患者的临床特征,探究其与pCR的相关性,能够为临床治疗提供更多证据。本研究通过分析HER2阳性乳腺癌患者临床特征及与pCR的关系,筛选出接受新辅助治疗受益的HER2阳性乳腺癌患者,为个体化治疗提供客观依据,并建立列线图模型,现报道如下。
1 资料与方法
1.1 一般资料
收集2017年1月至2021年6月陕西省人民医院初治的非转移HER2阳性乳腺癌患者的病历资料。纳入标准:①均经病理检查证实为HER2阳性乳腺癌;②临床资料完整。排除标准:①合并免疫性疾病以及其他恶性肿瘤;②治疗前合并急性感染;③合并血液系统疾病;④合并严重的肝、肾疾病;⑤治疗前曾接受过放疗或化疗;⑥存在远处转移。根据纳入、排除标准,共纳入97例HER2阳性乳腺癌患者。本研究经医院伦理委员会批准通过,所有患者均知情同意并签署知情同意书。
1.2 外周血检测方法
治疗前1周内采集患者外周静脉血。全血计数采用自动血液分析仪检测,包括中性粒细胞计数、淋巴细胞计数、血小板计数、血小板分布宽度(platelet distribution width,PDW)、血红蛋白,计算中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)、血小板/淋巴细胞比值(platelet/lymphocyte ratio,PLR)。采用多项血液生化自动分析仪检测白蛋白。预后营养指数(prognostic nutritional index,PNI)=淋巴细胞计数(×109)×5+血清白蛋白(g/L)。
1.3 新辅助治疗方案及手术方案
所有患者均采用新辅助治疗。单纯化疗26例,其中,多西他赛+多柔比星+环磷酰胺(TAC)方案10例,具体用药:多西他赛75 mg/m2+多柔比星60 mg/m2+环磷酰胺500 mg/m2,每3周1次;多柔比星+环磷酰胺(AC)→多西他赛(T)方案7例,具体用药:多柔比星60 mg/m2+环磷酰胺600 mg/m2,序贯多西他赛100 mg/m2,每2周1次;多西他赛+表柔比星+环磷酰胺(TEC)方案5例,具体用药:多西他赛75 mg/m2+表柔比星100 mg/m2+环磷酰胺600 mg/m2,每3周1次;多西他赛+环磷酰胺(TC)方案4例,具体用药:多西他赛75 mg/m2+环磷酰胺600 mg/m2,每3周1次。单靶治疗58例,其中,多西他赛+卡铂+曲妥珠单抗(TCbH)方案46例,具体用药:多西他赛75 mg/m2+卡铂AUC 6+曲妥珠单抗(8 mg/kg首次,6 mg/kg后续);多西他赛+环磷酰胺+曲妥珠单抗(TCH)方案12例,具体用药:多西他赛75 mg/m2+环磷酰胺600 mg/m2+曲妥珠单抗(8 mg/kg首次,6 mg/kg后续),每3周1次。双靶治疗13例,均为多西他赛+卡铂+曲妥珠单抗+帕妥珠单抗(TCbPH)方案,具体用药:多西他赛75 mg/m2+卡铂AUC 6+曲妥珠单抗(8 mg/kg首次,6 mg/kg后续)+帕妥珠单抗(840 mg首次,420 mg序贯)。所有患者新辅助治疗后均行乳腺癌改良根治术。
1.4 评价标准
所有乳腺癌穿刺活检病理结果均为腺癌。HER2状态为3+或2+,进一步行荧光杂交检测存在基因扩增。雌激素受体(estrogen receptor,ER)及孕激素受体(progesterone receptor,PR)≥1%定义为阳性。新辅助治疗后采用Miller-Payne分级系统[3]进行评价:1级,浸润性肿瘤细胞无改变或仅个别肿瘤细胞发生改变,肿瘤细胞数量总体未减少;2级,浸润性肿瘤细胞轻度减少,但总量仍高,肿瘤细胞减少不超过30%;3级,肿瘤细胞减少30%~90%;4级,肿瘤细胞明显减少超过90%,仅残存散在的小簇状肿瘤细胞或单个肿瘤细胞;5级,肿瘤瘤床部位切片未见浸润性肿瘤细胞,但可存在导管原位癌。乳腺原发灶无浸润性肿瘤细胞且区域淋巴结阴性定义为pCR。
1.5 统计学方法
采用SPSS 21.0软件对数据进行统计学分析,计数资料以例数及率(%)表示,组间比较采用χ2检验;计量资料以均数±标准差(±s)表示,组间比较采用t检验;影响因素的单因素及多因素分析采用Logistic回归分析。采用R语言绘制列线图预测模型,并采用Bootstrap法进行内部验证。以P﹤0.05为差异有统计学意义。
2 结果
2.1 HER 2阳性乳腺癌新辅助治疗后pCR影响因素的单因素及多因素分析
2.1.1 单因素分析新辅助治疗后,非pCR与pCR HER2阳性乳腺癌患者T分期、N分期、Ki-67、治疗周期、肿瘤最大径、PDW及抗HER2治疗情况比较,差异均有统计学意义(P﹤0.05);非pCR与pCR HER2阳性乳腺癌患者年龄、体重指数(body mass index,BMI)、ER、PR、血红蛋白、血小板计数、糖类抗原125(carbohydrate antigen 125,CA125)、白蛋白、NLR、PLR、PNI比较,差异均无统计学意义(P﹥0.05)。(表1)
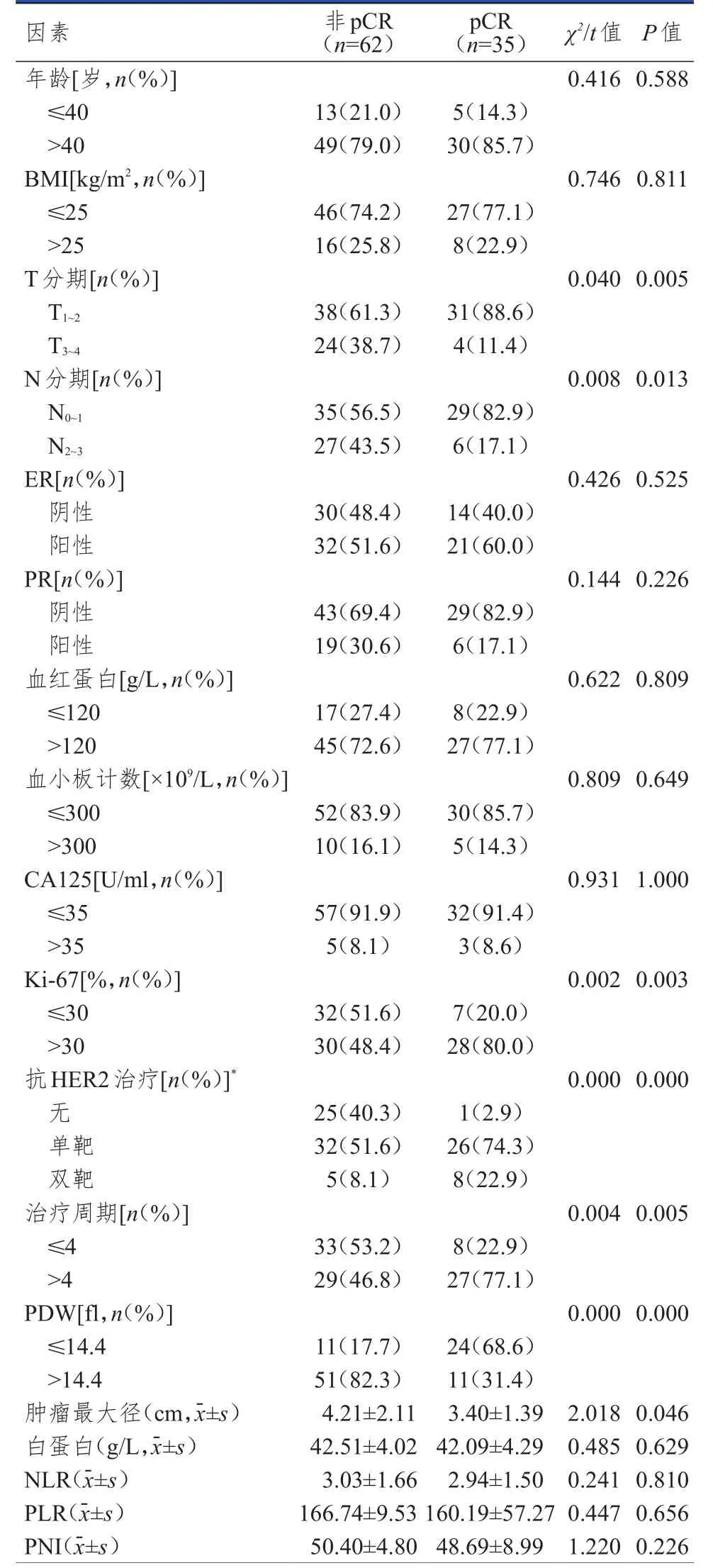
表1 HER 2阳性乳腺癌新辅助治疗后pCR影响因素的单因素分析
2.1.2 多因素分析以单因素分析中差异有统计学意义的T分期(T1~2期=1,T3~4期=0)、N分期(N0~1期=1,N2~3期=0)、Ki-67(﹥30%=1,≤30%=0)、抗 HER2治疗(双靶=2,单靶=1,无=0)、治疗周期(﹥4=1,≤4=0),PDW(≤14.4 fl=1,>14.4 fl=0)及肿瘤最大径(连续变量)为自变量,HER2阳性乳腺癌患者新辅助治疗后病理结果(pCR=1,非pCR=0)为因变量进行多因素Logistic回归分析,结果显示,Ki-67、PDW及抗HER2治疗情况均为HER2阳性乳腺癌患者新辅助治疗后pCR的独立影响因素(P﹤0.05)。(表2)
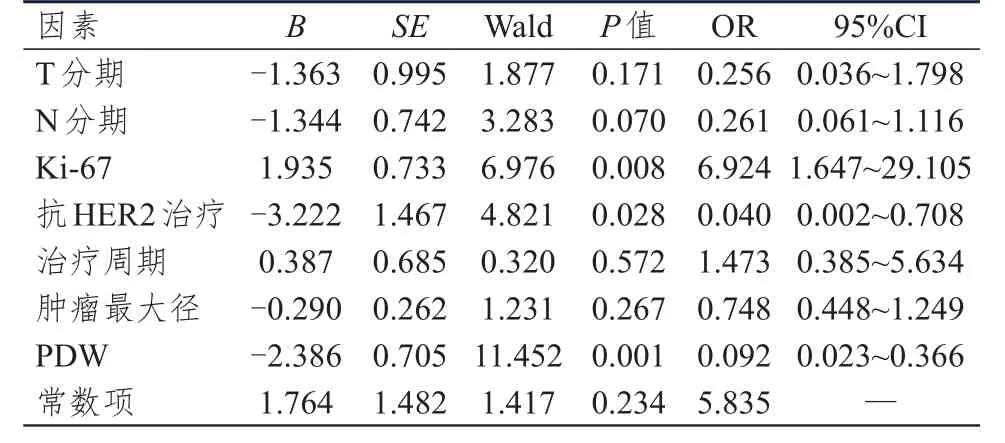
表2 HER 2阳性乳腺癌新辅助治疗后pCR影响因素的多因素分析
2.2 列线图模型的建立与评价
根据多因素Logistic回归分析结果构建列线图(图1)。利用Bootstrap对列线图预测模型进行验证,自抽样1000次,其C-index值为0.847(95%CI:0.793~0.868,P=0.002)。列线图模型校准曲线中实际曲线与理想曲线贴合良好(图2)。内部验证该模型预测值与真实值符合度平均绝对误差为0.048。
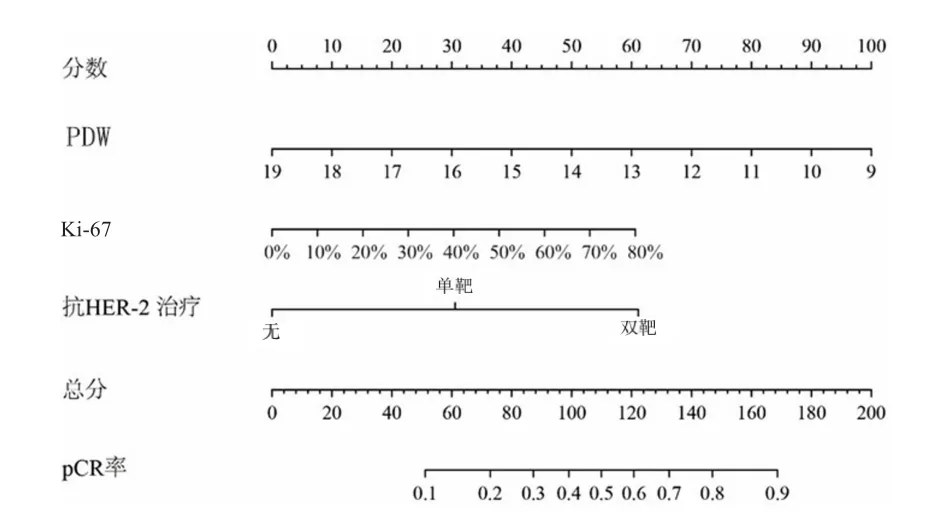
图1 预测HER 2阳性乳腺癌新辅助治疗后pCR的列线图
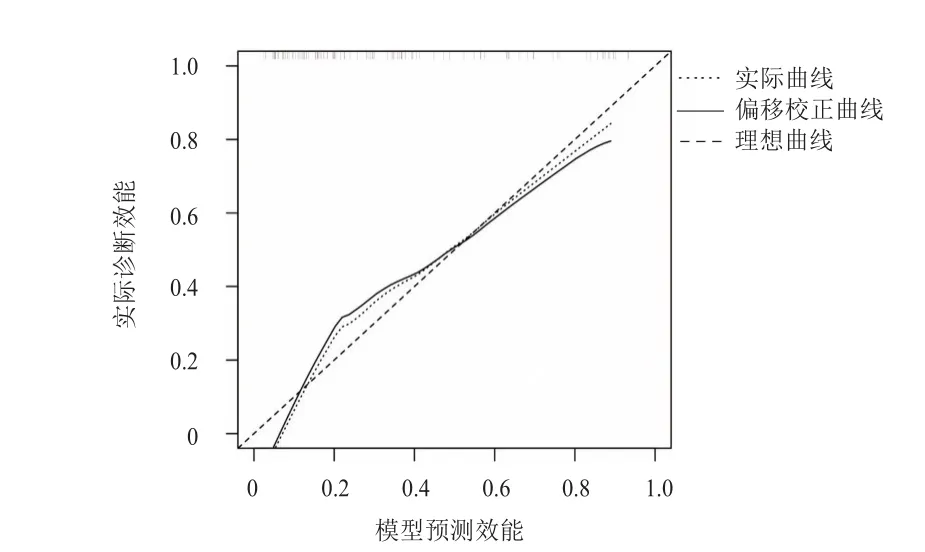
图2 列线图模型预测HER 2阳性乳腺癌新辅助治疗后pCR与实际发生情况的校准图形
3 讨论
HER2阳性乳腺癌具有侵袭力强、生存率低、对辅助治疗敏感的特点[4]。研究表明,HER2阳性与三阴性乳腺癌更易获得高pCR率[2]。HER2阳性乳腺癌新辅助治疗可以获益已得到广泛共识[5]。但在临床工作中,分期相同的患者接受同样的新辅助治疗方案往往pCR率也不尽相同,筛选具有相应临床特征的敏感病例临床意义重大。其中,激素受体状态与HER2阳性乳腺癌新辅助治疗疗效的相关性尚不明确。刘世伟等[6]研究表明,激素受体阴性是HER2阳性乳腺癌新辅助治疗后pCR的独立预测因素,多项研究也得到相同结论[7-9],但同时,一些研究中激素受体状态并不被认为是独立预测因素[10-11]。本研究病例中,ER、PR阳性患者与ER、PR阴性患者pCR率比较,差异均无统计学意义。
血小板是肿瘤微环境中的重要部分,它可以促进肿瘤的生长、转移和血管生成。PDW是血小板形态和活化的指标[12]。研究表明,乳腺癌预后与PDW相关[13-14]。除乳腺癌外,目前研究还证实PDW与多种肿瘤预后相关。高水平PDW与鼻咽癌、喉癌、食管癌的不良预后相关[15-17],低水平PDW与肝癌及胃癌的不良预后相关[18-19]。PDW与新辅助治疗后反应的相关性研究较少,项爱斋等[20]研究表明,PDW≤13.3%为乳腺癌新辅助治疗后pCR的独立预测因素。本研究中,PDW为HER2阳性乳腺癌新辅助治疗后pCR的独立影响因素,与上述研究结果一致。
Ki-67是细胞增殖相关的核抗原,表达高低与细胞周期中的有丝分裂相关。大多数细胞毒性药物要求细胞处于细胞周期中期,因此推测具有低增殖能力的肿瘤可能对化疗具有耐药性[21]。国际乳腺癌Ki-67工作组(International Ki-67 in Breast Cancer Working Group,IKWG)的共识认为Ki-67≤5%或≥30%可用于预测预后[22]。大部分中国专家认为Ki-67﹥30%为高表达[23],但是一个适用于判断预后的阈值可能不适用于新辅助研究或药效学评估[24]。研究提示Ki-67≥20%可预测ER阳性乳腺癌对多西紫杉醇辅助治疗的有效性[25]。Shi等[26]同样以Ki-67≥20%为cut-off值,证实其为HER2阳性及三阴性乳腺癌新辅助治疗后pCR的独立预测因素。尽管多项研究中Ki-67具有不同的cut-off值,但结果一致认为较高的Ki-67伴随着高pCR率[27]。本研究以30%为cut-off值,也得到了相同的结论。
PEONY研究基于亚洲HER2阳性乳腺癌人群发现,双靶与单靶治疗相比,总体病理完全缓解(total pathological complete response,tpCR)率显著提高(39.3%vs 21.8%,P=0.001)[28]。在本研究中,双靶治疗患者pCR率高于单靶治疗患者,双靶治疗明显提高了HER阳性乳腺癌新辅助治疗后的pCR率,具有独立预测HER2阳性乳腺癌新辅助治疗后pCR的价值。然而,由于本研究属于回顾性研究,尚需大样本前瞻性研究予以验证。
综上所述,PDW≤14.4 fl、Ki-67﹥30%、双靶抗HER2治疗均具有预测HER2阳性乳腺癌新辅助治疗后pCR的临床价值,有助于判断远期预后及指导新辅助治疗决策。

