全自动凝血分析仪检测2种诱导剂诱导的血小板聚集试验参考区间的建立
寿玮龄,陈倩,徐雯,马超超,吴卫(.中国医学科学院 北京协和医学院 北京协和医院检验科,北京 00730;.新乡医学院第三附属医院检验科,河南 新乡 453000)
血小板聚集试验(platelet aggregation test, PAgT)是评估机体血小板功能、监测抗血小板治疗效果等的重要指标。PAgT 光学法(light transmission aggregometry,LTA)的检测原理为通过在富血小板血浆(platelet rich plasma,PRP)中加入不同种类、不同浓度诱导剂,使血小板聚集,导致PRP 浊度变化,透光率增加,检测系统将浊度变化转变为电信号,连续记录血小板聚集曲线,从而得到血小板最大聚集率(maximum platelet aggregation rate,MPAR)等参数。LTA 与临床事件相关性较好,临床应用广泛,被称为血小板聚集功能检测的“金标准”[1-2]。二 磷酸 腺 苷(adenonisine disphosphate,ADP)和花生四烯酸(arachidonic acid,AA)是常用的2种诱导剂。根据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)H58-A指南、国际血栓与止血学会(International Society on Thrombosis and Haemostasis,ISTH)共识等推荐,ADP 诱导剂常用终浓度为2、5和10 μmol/L,AA诱导剂常用终浓度为0.5 和1.0 mmol/L[3-6]。Sysmex公司CN系列和CS系列全自动凝血分析仪进行LTA,可减少手工加样误差,同时可使用多种诱导剂,检测用量少,一定程度上可减少患者采血负担。目前国内外尚无CN3000 及CS5100 全自动凝血分析仪的PAgT参考区间的报道。本研究按照CLSI EP28-A3c 文件要求[7],通过募集表观健康成年人,采用CN3000 和CS5100 全自动凝血分析仪进行不同终浓度ADP、AA 诱导的PAgT,用非参数法(non-parametric method)建立上述诱导剂诱导PAgT的MPAR值的表观健康人群参考区间。
1 对象与方法
1.1 研究对象 自2021年5月至12月,募集年龄18~70 岁表观健康人共134 例,按照18 ~30 岁、31~40岁、41~50岁、>50 岁分为4 个年龄段,男女比例分布均匀。入选标准:(1)体质指数(BMI)在参考区间18.0 ~28.0 kg/m2内;(2)女性未处于妊娠期及哺乳期(1年内);(3)无皮肤黏膜出血史及相关家族史;(4)未服用抗血小板药物及其他导致血小板功能异常的药物,包括吲哚美辛、酚妥拉明、双嘧达莫、青霉素类药物、肝素等;(5)近3 个月内未服用中药制剂;(6)无主要器官系统严重疾病,3个月内体检结果提示肝肾功能正常;(7)近2 周内无发热感冒等症状,近3个月未献血;(8)吸烟量每日不超过5支;(9)每日饮酒量小于100 mL;(10)近1个月内作息正常。
通过调查问卷了解研究对象姓名、年龄、BMI、饮食、医疗记录等基本信息;签署知情同意书后入组。排除标准:(1)入组至标本采集前不满足上述表观健康入选标准;(2)采血前24 h 摄入咖啡因,吸烟、饮酒及参加剧烈运动;(3)自愿退出;(4)标本采集处理后不满足LTA检测要求。
本研究已通过中国医学科学院北京协和医院伦理委员会批准(伦理审查批件编号:HS-2459)。
1.2 仪器与试剂 CN3000 全自动凝血分析仪、CS5100全自动凝血分析仪、XS-800i 全自动血细胞分析仪及配套血小板聚集功能ADP 检测试剂盒(批号:F1903231)、AA检测试剂盒(批号:FA0578)由日本Sysmex公司提供。试剂配制及分装、保存按照试剂说明书要求进行,ADP 终浓度分别为2、5和10 μmol/L,AA终浓度分别为0.5和1.0 mmol/L。
1.3 标本采集与处理 清晨采集研究对象空腹静脉血,0.109 mol/L 枸橼酸钠与静脉血按1 ∶9 比例混匀。采集标本时在针插入血管见回血后应立即释放止血带;采血过程不超过1 min。标本采集后室温静置30 min,以200×g离心10 min获得PRP,后将剩余标本以1 500×g 离心10 min 获取乏血小板血浆(platelet poor plasma,PPP)。离心后标本无黄疸、乳糜及溶血。
1.4 标本检测 计数PRP 中血小板数,剔除PRP血小板计数小于150×109/L的标本,PRP 血小板计数增高时不进行调整。20 μL 0.9%NaCl 溶液添加到140 μL PPP 中,660 nm波长下设置为透光强度基线;20 μL 诱导剂添加到140 μL PRP 中,测定660 nm波长下透光度的变化,计算MPAR。标本采集后4 h内完成检测。
1.5 重复性 检测10 个不同终浓度诱导剂诱导的MPAR,各取正常水平临床标本1 人份,每份标本重复检测11次,计算后10次检测结果的算术平均值、标准差和变异系数(CV)。
1.6 统计学分析 采用Excel、JMP Trail 16、SPSS 21.0软件和R语言4.0.5(reference intervals 1.2.0版本)进行数据分析。按照CLSI EP28-A3c 文件,首先进行数据正态性分布检验,对非正态分布数据进行“Box-Cox”正态转换后,使用Turkey 法对数据进行离群值剔除(低限,Q1-1.5×IQR;高限,Q3+1.5×IQR:IQR =Q3-Q1)。独立样本多组间比较采用Kruskal-Wallis H 检验,两组之间的比较用Mann-Whitney U检验;配对样本间比较采用Wilcoxon 符号秩检验,P<0.05 表示差异有统计学意义。按非参数方法计算参考区间,取数据分布的第2.5 百分位数和第97.5百分位数作为参考下限(lower reference limit,LL)和参考上限(upper reference limit,UL),并计算90%置信区间(confidence intervals,CI)。
2 结果
2.1 重复性 不同终浓度ADP 和AA诱导的MPAR的不精密度,以CV表示,均小于5.00%。见表1。
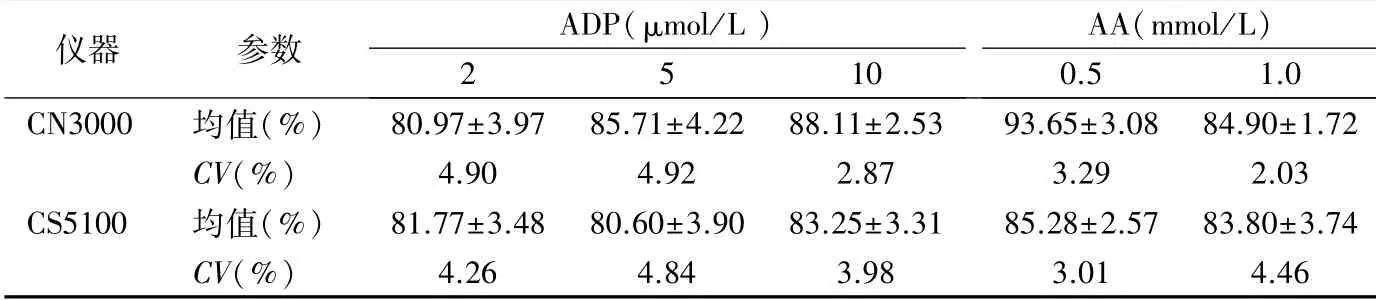
表1 不同终浓度ADP 和AA诱导的MPAR重复性
2.2 表观健康人ADP 和AA诱导的MPAR生物参考区间建立
2.2.1 数据分布 134 例入选者中男性69 例,女性65例,18 ~30 岁30 例,31 ~40 岁32 例,41 ~50岁36 例,>50 岁36 例;男女比例在各年龄段均匀分布。CN3000 和CS5100 系统上AA 终浓度0.5 mmol/L诱导的MPAR 分别剔除离群值3 个和4个,其他终浓度诱导剂诱导的MPAR各剔除离群值1个。PRP 血小板计数为(306.9±71.8)×109/L,所有PRP 血小板计数均大于150×109/L。
2.2.2 不同性别及年龄段间MPAR 比较 根据非参数秩和检验结果提示,2 个检测系统检测不同终浓度ADP、AA诱导的MPAR 在男女之间差异均无统计学意义(P均>0.05),见表2。2个检测系统检测不同终浓度ADP、AA诱导的MPAR在4 个年龄段间差异均无统计学意义(P均>0.05),见表3。

表2 不同性别间ADP 和AA诱导的MPAR(%)

表3 不同年龄段间ADP 和AA诱导的MPAR(%)
2.2.3 同系统不同终浓度诱导剂间MPAR 及不同检测系统间MPAR比较 2 个检测系统ADP 终浓度2、5 μmol/L(CN 系列Z =-2.634,P =0.001;CS系列Z =-4.996,P =0.000),CS 系列AA 终浓度0.5、1.0 mmol/L(Z =-3.361,P =0.008)之间MPAR差异有统计学意义。根据Wilcoxon 符号秩检验分析,除外AA 终浓度1.0 mmol/L(Z =-2.319,P =0.020),其他不同种类不同终浓度诱导剂诱导的MPAR在CN3000和CS5100 两系统间差异均无统计学意义(P均>0.05)。
2.2.4 ADP 和AA 诱导的MPAR 参考区间建立 取数据分布第2.5 百分位数和第97.5 百分位数作为LL和UL,表观健康人不同终浓度ADP、AA诱导的MPAR参考区间及90%CI结果见表4。

表4 表观健康人ADP、AA诱导的MPAR的参考区间
3 讨论
本研究中2 个检测系统不同终浓度ADP 和AA诱导的MPAR 重复性分别为2.87%~4.92%和2.03%~4.46%,与文献报道[8]基本一致,远低于试剂说明书正常标本最大聚集率的CV%≤20%的标准,满足临床检测需求。
与Platton 等[9]纳入42 例表观健康人在Sysmex CS2X00系统上采用第2.5和第97.5百分位数的结果相比较,本研究ADP 终浓度2 μmol/L 参考区间与其接近,但文献中ADP 终浓度5 μmol/L 和10 μmol/L 时生物参考区间分别是44%~98%和48%~106%,与本研究结果存在差异,本研究中AA 2个终浓度生物参考区间结果与该文献相比也存在差异;但本研究中AA 终浓度1.0 mmol/L 则与Stratmann等[10]在CS2100 系统上结果接近。王佳等[11]建立的ADP 终浓度2 μmol/L 手工法参考区间为(60.83±4.29)%,高于本研究中仪器法结果。试剂 说 明 书 ADP 终 浓 度 2 μmol/L 和 AA 1.0 mmol/L生物参考区间分别为59.1%~98.3%和63.2%~100%,其下限均与本研究结果存在差异。同时,本研究结果显示,AA 终浓度1.0 mmol/L 时MPAR在CN3000和CS5100 两系统间差异有统计学意义,提示不同检测系统参考区间存在差异,实验室建立或验证本实验室检测系统不同浓度诱导剂诱导的MPAR参考区间则十分重要。
CLSI H58-A文件显示,在不同年龄组间MPAR参考区间差异无统计学意义[3]。邓新立等[12]研究提示60 ~80 岁以上高龄人群中ADP 终浓度5 μmol/L诱导的MPAR结果差异无统计学意义,建议AA终浓度0.25 mmol/L诱导的MPAR在60~69岁人群参考区间为37.12%~88.47%,70 ~90 岁人群参考区间为37.45%~88.97%。本研究局限之处在于募集志愿者年龄20 ~66 岁范围内不同终浓度ADP 和AA诱导的MPAR 在年龄间差异无统计学意义,缺乏在低龄和高龄人群中PAgT 检测结果的参考区间的建立及验证。

