肝脓肿介入治疗辽宁专家共识(2022)
辽宁省周围血管病及肿瘤介入诊疗技术质控中心
肝脓肿是指致病微生物侵入并定植于肝脏导致的严重感染性疾病,主要临床表现为发热、寒战、肝区疼痛等[1]。肝脓肿的发病率存在地域差异,我国大陆地区的发病率为(1.07~3.59)/10 万,而在我国台湾地区高达17.59/10万[2],且其发病率在全球范围内有逐年升高趋势。 目前,介入联合抗生素已成为肝脓肿的主要治疗手段, 介入治疗具有操作简便、微创、经济以及安全有效等优点[3]。 但在临床实践中,常遇到肝脓肿合并脓毒性休克、低血小板血症等给介入治疗提出挑战; 亦存在肝脓肿多发、范围巨大、液化差以及多房等情况,导致介入治疗后效果不佳[4]。目前,国内外尚缺乏肝脓肿介入治疗相关的共识或指南。 鉴于此,通过查阅国内外相关文献,结合我国国情,组织辽宁省内有关专家在严谨探讨的基础上制定本共识,旨在为广大临床工作者提供肝脓肿介入治疗的有益指导。
1 肝脓肿分类及病因
1.1 肝脓肿分类
致病菌侵入肝脏后未能得到有效清除将导致肝脓肿形成。 根据病原体不同,通常分为细菌性肝脓肿(pyogenic liver abscess, PLA)、阿米巴性肝脓肿及真菌性肝脓肿等[5],其中PLA 在临床工作中最常见,约占80%。 因此,本共识中的肝脓肿特指PLA。依据感染场所可分为:社区获得性肝脓肿和医院获得性肝脓肿。 社区获得性肝脓肿指在院外细菌感染引起的肝脓肿,而医院获得性肝脓肿是指肝恶性肿瘤介入治疗及胆道手术等操作后继发的肝脓肿,两者在致病菌等多个方面均存在较大差异[6],见表1。

表1 社区获得性肝脓肿与医院获得性肝脓肿的区别
1.2 PLA 病因
PLA 感染途径主要有:胆道、门静脉、肝动脉及邻近感染灶的直接蔓延[7]。 胆石症、胆管肿瘤、胆道相关手术及胆道蛔虫等易引起细菌经胆道上行诱发肝脓肿[8]。 腹腔内感染性病变的致病菌可经门静脉系统入肝诱发肝脓肿,例如阑尾炎、憩室炎及炎症性肠病等。 肺炎、感染性心内膜炎等引起的菌血症经体循环-肝动脉途径也能引起肝脓肿。 膈下脓肿、胆囊炎和肾周脓肿等可直接蔓延至肝脏造成肝脓肿。 近年来,隐源性肝脓肿在PLA 中所占比例越来越高,其定义为致病菌来源不明、且未发现潜在的致病原因[9]。 肺炎克雷伯菌等条件性致病菌在肠黏膜屏障破坏的情况下侵入门静脉可能是隐源性肝脓肿的发病原因。 研究显示,隐源性肝脓肿患者结直肠癌发生率显著升高[7,10],值得临床关注。 PLA感染途径见图1。
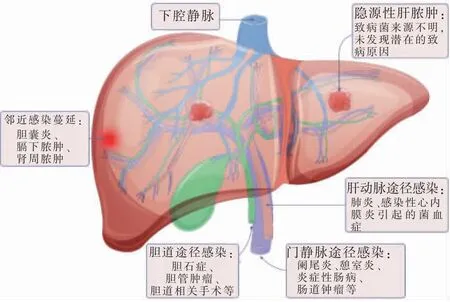
图1 肝脓肿感染途径
2 PLA 形成的危险因素
目前认为,肝、胆、胰腺疾病及腹腔手术史是PLA 潜在的危险因素。 除此之外,危险因素还包括:糖尿病(尤其是血糖控制不佳者)、高毒力肺炎克雷伯菌在肠道内定植、肠道疾病(腺瘤、结直肠癌等)、免疫功能缺陷性疾病、肝硬化、乙醇中毒及药物滥用等[11-14]。另外,存在胆肠吻合术病史的肝肿瘤患者在行肝动脉化疗栓塞术或局部消融术后易并发PLA[15-16]。
3 诊断
PLA 诊断主要依据临床症状、体征、实验室及影像学检查和细菌培养结果。
3.1 PLA 临床表现及体征
典型临床表现为高热、寒战、肝区疼痛等[1],其他常见症状包括周身乏力、恶心、呕吐、体质量减轻等,部分并发迁徙性感染的PLA 患者可出现呼吸道感染症状、视力受损或精神状态改变等[4,17]。 查体可见肝大、心动过速及低血压等,部分脓肿破裂患者可出现腹膜刺激征[18]。
3.2 实验室检查
实验室检查常见外周血中白细胞计数、C 反应蛋白(CRP)、降钙素原(PCT)及IL-6 等升高。白蛋白降低,转氨酶、碱性磷酸酶及胆红素水平升高等肝功能损伤改变[19]。动态监测实验室指标对PLA 的诊断治疗有重要指导作用。
3.3 影像学检查
影像学检查是PLA 诊断的重要手段,敏感度可达96%,主要包括超声、CT 和MRI。 超声表现为不规则液性暗区,内可见密集的细小光点及坏死的组织分隔带,超声是PLA 介入治疗的主要影像引导方式。CT 在肝脓肿的诊断上应用最普遍,CT 平扫为单发或多发的低密度病灶,可含气。 增强CT 上脓肿病灶边缘可呈典型“靶征”及周围肝组织的异常灌注,亦可见多发分隔或呈簇状改变及肝静脉血栓性静脉炎[20-21]。MRI 表现常为T1WI 不均匀低信号,T2WI高信号。增强MRI 上脓肿病灶的强化表现类似增强CT,其对脓肿壁及分隔的显示优于CT。 增强CT 及MRI 影像特征不仅对PLA 的诊断和鉴别诊断起重要作用,还与患者的预后密切相关。 因脓腔内可存在分隔、 坏死组织碎片等, 建议采用增强CT、MRI或超声造影来评估脓肿液化程度。
3.4 细菌培养
血液及脓液的细菌培养结果是确诊肝脓肿的关键证据。 脓液的细菌培养阳性率高于血液培养,但仍有约30%的脓液细菌培养结果为阴性[22-24]。 因此,近年来16SrDNA 及宏基因组测序技术被应用于临床,可以快速、精确地检出致病微生物,尤其是对于血或脓液培养阴性的PLA 患者,可协助临床医生及时、准确地实施抗感染治疗[25]。
3.5 鉴别诊断
依据上述特点,PLA 的诊断多无困难。 但如遇到抽吸或引流后无脓性液体且细菌培养结果为阴性、抗炎治疗效果不佳等情况时,需要与下列疾病进行鉴别。
①阿米巴肝脓肿: 多继发于阿米巴痢疾后,起病缓慢,可有高热或不规则发热、盗汗。 大多数脓液为棕褐色液体,无臭味,镜检可找到阿米巴滋养体。血清学阿米巴抗体阳性,粪便中可找到阿米巴滋养体或包囊。
②肝原发恶性肿瘤:部分肝恶性肿瘤以发热为主诉就诊,易与不典型肝脓肿相混淆,而其中肿块型肝内胆管细胞癌与早期肝脓肿的鉴别困难[26]。 需结合病史、实验室检查及影像资料综合分析,必要时行穿刺活检明确诊断。 临床中要高度警惕当肝恶性肿瘤坏死并发感染时,亦可抽吸出脓性液体[27]。
③肝转移瘤:对于有肝、胆、胰恶性肿瘤病史的患者,容易发生胆源性肝脓肿,也容易出现多发肝转移瘤。 有研究显示,动脉期病灶边缘肝实质不规则强化、病灶边缘强化持续到门静脉期是肝脓肿的重要征象[28]。 当两者难以鉴别时,可经验性抗感染治疗后,动态观察病灶变化情况。
④肝癌栓塞后综合征:肝癌经皮肝动脉化疗栓塞术(TACE)后常有发热、腹痛等症状,但发热持续时间一般较短,多为低热,少有寒战。 合并脓肿形成时多有高热、寒战,影像学检查病灶内可见气体影及气液平, 有助于鉴别诊断。 但需要注意的是,在TACE 术中使用明胶海绵或微球栓塞后病灶内也可有小气泡形成。
4 肝脓肿的介入治疗
介入穿刺引流联合抗生素已经成为PLA 的一线治疗方式,以其微创、安全、操作简便及疗效确切等优势得到普遍认可。 PLA 介入治疗的总体目标为早期干预、缓解症状、充分引流、排尽脓液、阻止病情进展、促进早日康复。
4.1 介入治疗的适应证及禁忌证
适应证:单纯抗生素治疗后效果不佳,病灶最大径>3 cm,影像学显示存在一定的液化区域的肝脓肿。
相对禁忌证:介入治疗没有绝对禁忌证,但存在下列情况时,应该仔细权衡手术带来的收益和风险,在患方知情同意并充分理解风险时可行介入治疗。 相对禁忌证包括:①不能被有效纠正的严重凝血功能异常;②严重心肺功能不全或血流动力学不稳定;③缺乏相对安全的穿刺通道;④患者不能配合手术,或者体位摆放不能达到手术要求。
4.2 术前准备
①检查及治疗准备:术前常规完善血细胞分析、肝肾功能、血清离子、凝血功能及心电图等检查。 术前影像学检查包括肝脏超声、 增强CT 或增强MRI 等,主要评估脓肿病灶的位置、大小、液化程度及内部分隔情况,力求在不伤及邻近正常解剖结构的前提下实现最大范围的引流。 介入治疗的常用器材包括穿刺针,导丝及引流管(常用8~12 F)。
②知情同意:术前充分告知患者及家属手术治疗的目的、方法、疗效、并发症及引流管的护理方法等,并要求其签署知情同意书。
4.3 手术过程
治疗方式选择:肝脓肿的介入治疗主要包括经皮穿刺抽吸术(percutaneous needle aspiration,PNA)和经皮穿刺引流术(percutaneous catheter drainage,PCD)。 PNA 为穿刺成功后直接进行脓液抽吸,不留置引流管。 适用于直径<5 cm 且液化良好的脓腔,可多次抽吸,还可避免带管所带来的不适[29]。 PCD 是肝脓肿的主要治疗方式,尤其是针对直径>5 cm 的肝脓肿[30-31]。一项前瞻性随机对照研究发现,PCD 与PNA 相比,可显著缩短抗生素使用时间,增加临床治疗成功率[32]。
PCD 操作过程①麻醉方式:一般采用局部麻醉(2%利多卡因),对于无法配合治疗的患者必要时可行全身麻醉。 术中密切监测心率、血压等生命体征。②穿刺点选择:参照术前的影像学检查结果确定合适的穿刺点、最短的穿刺路径,并尽量经过正常肝组织,主要依据脓肿大小、位置、毗邻血管、病灶与肝表面的距离、肋膈角胸膜反折及肺下缘的位置等。准确评估穿刺路径安全性是保证手术成功及减少穿刺并发症的重要前提。 ③图像引导方式:推荐采用超声联合DSA,即超声引导穿刺,透视引导下引流管放置,实现了穿刺引流全过程的可视化。 CT 也是临床中较常用的引导方式, 尤其适用于肝脏深部、体积较小的病灶,但无法实时观察且辐射剂量较大。锥形束CT(cone-beam CT,CBCT)联合透视也是安全有效的引导方式[33]。 ④穿刺和造影:穿刺基本技术包括一步法和两步法[34],穿刺技术的选择主要依据脓肿病灶大小、位置以及术者的习惯等。 一步法(Trocar 技术)操作步骤:影像引导下,将引流管、硬质推送杆及穿刺针芯的同轴组合直接穿刺入脓腔,穿刺成功后,拔除针芯,待脓液顺利引出,固定推送杆,将引流管置入脓腔内;两步法(Seldinger技术)操作步骤:影像引导下,将穿刺针成功穿刺入脓腔后,拔出针芯,待脓液顺利引出,引入导丝后,沿导丝退出穿刺针外套管,再将引流管沿导丝置入脓腔内,必要时用扩张管辅助扩张穿刺通道。 穿刺过程中嘱患者屏气,影像下确认针尖位于脓腔内则确认穿刺成功[34]。 为提高细菌培养的阳性率,穿刺成功后,建议在注射对比剂之前抽吸适量脓液标本送检,行细菌培养及药物敏感试验。 为了降低菌血症风险, 尽可能抽出足量脓液减轻脓腔压力后,再缓慢注入适量对比剂进行脓腔造影,观察脓腔范围等。 根据术前影像特征、术中造影情况,判断引流是否充分, 必要时在不相通的脓腔内置入多枚引流管,引流管尽可能置于脓腔最低点或者较大径的腔内,以便有效地排出脓液。 ⑤引流管冲洗:引流管留置期间,记录每日脓液的引流量、性质、颜色等。 术后短期内引流量突然减少时, 要注意引流管阻塞可能,可使用无菌注射器抽吸引流管,也可用5~10 mL 0.9%NaCl 溶液冲洗引流管, 必要时复查CT 或者DSA 下脓腔造影观察,调整引流管位置[35]。 有研究报道,经引流管注入尿激酶能稀释脓液、降解纤维蛋白、破坏隔膜,进而促进脓肿液化及排出[36-37]。 目前尚无循证医学证据显示脓腔内注入糜蛋白酶、胰蛋白酶及抗生素等能改善PLA 的引流效果。
4.4 特殊情况下的介入治疗
①液化不良PLA 的介入治疗: 液化不良PLA影像表现为病灶实性成分(CT 值≥20 HU)占50%以上,呈多发分隔或簇状改变,常导致术后引流不彻底。 应用增强CT、超声造影延迟期及肝胆特异性造影剂增强MR 的肝胆期评价病灶液化程度更为准确[38]。 临床实践中发现,多发分隔或簇状表现的肝脓肿中的液化范围并不会随着病程延长而显著增大(图2)。因此,只要脓肿内存在一定的液化区,则建议及时进行穿刺引流,有助于更快地控制感染。
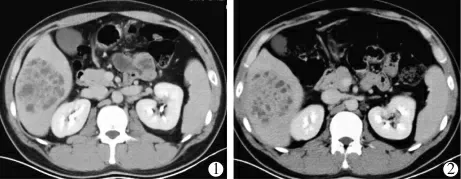
图2 液化不良的肝脓肿
②巨大肝脓肿的介入治疗:研究显示患者肝脓肿直径越大,病情越严重,病死率越高[39]。 因此,对于巨大肝脓肿,需要制订更为积极的治疗方案。 因巨大肝脓肿常呈多房, 单根引流管置入后引流不充分时,建议置入多根引流管(图3),增加引流范围[40]。
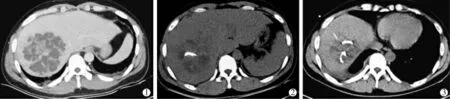
图3 巨大肝脓肿的介入治疗
③合并凝血功能障碍肝脓肿的介入治疗:凝血功能障碍定义为血小板计数≤50×109/L 或凝血酶原时间国际标准化比值(INR)≥1.5[41]。 建议对此类患者积极纠正凝血功能障碍,如输注凝血因子或血小板等。 有研究显示合并凝血功能障碍的肝脓肿患者进行穿刺引流,并不会明显增加出血风险[41-42]。因此,在纠正凝血障碍的同时,建议实施穿刺引流,以便有效控制感染,且控制感染是恢复凝血功能的重要前提。
④破裂肝脓肿的介入治疗:既往对于自发性破裂肝脓肿,推荐外科手术治疗。 但近年来发现经皮穿刺引流联合抗生素治疗自发性破裂肝脓肿效果良好,且操作简便、创伤小[43]。 肝脓肿破裂后多在肝外局部形成包裹,对原发脓肿及破裂后的包裹积液进行引流可有效控制感染[44]。
⑤肝脓肿并发迁徙性感染的介入治疗: 现阶段,肺 炎 克 雷 伯 菌(K.pneumoniae,KP)已 经 成 为PLA 的主要致病菌,KP 所致肝脓肿(K.pneumoniae liver abscess,KPLA)易并发迁徙性感染,被定义为侵袭性肺炎克雷伯菌肝脓肿综合征(invasive K.pneumoniae liver abscess syndrome, IKPLAS)[4],常累及肺、眼、脑及肌肉软组织等,可短期内发展为脓毒性休克,危及生命。 对于这类患者,更应尽早行肝脓肿穿刺引流治疗, 同时注重多学科协助诊治,尤其是眼内炎,要及时诊治,避免失明等严重后果。
4.5 介入治疗的效果评价
介入治疗技术成功指引流管留置于目标脓腔内,且顺利引出脓液[35]。 临床成功指在技术成功的基础上,发热等感染症状缓解,白细胞、CRP 等炎症指标基本恢复正常[35]。 近年来,穿刺引流抵抗概念被提出来,即穿刺成功后,脓液顺利引流,但临床症状不缓解,炎性指标不降低,且病灶减小不明显,这类患者的住院时间和抗生素使用时间明显延长[45]。还应该注意, 影像学表现为多房或簇状的脓肿,引流后短期内脓肿范围缩小不明显, 但感染症状改善、炎症指标下降,也应属于治疗有效(图4)。

图4 肝脓肿引流后短期范围未缩小
4.6 介入治疗并发症预防及处理
肝脓肿介入治疗的并发症发生率较低,常见并发症包括:出血、感染、脓肿破裂等[35]。
出血:少量出血无需特殊处理,门静脉或肝静脉损伤12~24 h 后可自行止血,但是损伤肋间动脉或较大的肝动脉分支则需要动脉造影及栓塞治疗。术前应评估病灶旁血管情况,选择下位肋骨上缘穿刺避免损伤肋间动脉[46]。 胸膜损伤继发的出血是严重的并发症,由于胸腔负压的作用,常引起致命性出血,因此,术前评估病灶与肋膈角的距离,术中穿刺时嘱患者屏气,必要时在DSA 下观察肋膈角。
继发性感染:肝脓肿穿刺引流继发感染,一方面是由于穿刺或置管过程中破坏脓肿壁及分隔等,可能损伤内部血管;另一方面向病灶内注入对比剂时可能压力过大,导致致病菌进入损伤血管造成菌血症。 尤其是对术前CT 显示存在肝静脉血栓性静脉炎的患者(图5)。因此,穿刺成功后建议先抽出足量脓液减轻病灶内压力后,再缓慢注入适量对比剂观察,尽量降低菌血症风险。

图5 肝脓肿合并血栓性静脉炎
脓肿破裂:介入治疗引起的肝脓肿破裂,可导致严重的腹腔感染甚至感染性休克。 脓肿与被膜之间肝实质厚度<1 cm 时穿刺后易破裂[35],因此规划的穿刺路径要尽可能保证足够厚度的正常肝实质,同时要注意置管的深度。 对于脓肿破裂后形成的包裹积液,要积极引流(图6)。
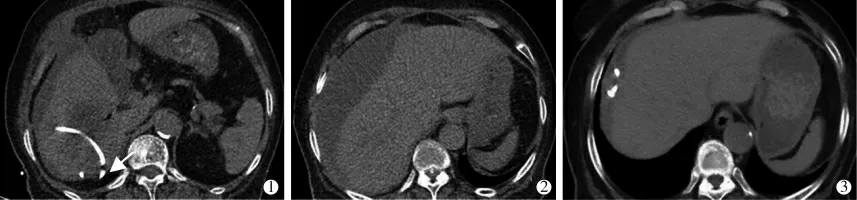
图6 经皮穿刺引流后肝脓肿破裂
4.7 拔管指征
目前国内外尚无严格的拔管标准。 结合文献及专家讨论意见,本共识建议引流管的拔除指征为连续72 h 无发热,复查白细胞、CRP 等炎症指标基本恢复正常,影像学显示脓腔明显缩小(最大径<2 cm),且连续3 d 引流量<10 mL/d[47]。临床症状显著改善但未达拔管指征者,可带管出院,定期门诊随访达到标准后拔管。 考虑到目前在各个医疗中心可能根据医生习惯及患者依从性的不同而拔管标准存在差异, 但总体原则应为介入治疗达到临床成功后,再拔除引流管。
5 肝脓肿的其他治疗
5.1 抗生素治疗
KP 主要的耐药原因是产超广谱β-内酰胺酶(extended-spectrum beta-lactamase,ESBL)。 一项研究分析了100 株致肝脓肿的KP 分离株的耐药情况,其中产ESBL 占14%;对阿米卡星、亚胺培南、美洛培南、头孢他啶的耐药率为0,考虑到社区获得性肝脓肿的致病菌主要为KP, 在经验性选择抗生素时可选择除氨苄西林外的其他抗生素;该研究还显示胆道疾病史是致肝脓肿KP 产ESBL 的独立危险因素[48],因此对于既往有胆道病史的PLA 要警惕多重耐药风险。 有研究建议经验性使用覆盖厌氧菌的广谱抗生素对PLA 的治疗更有益[49]。 另有研究显示,对于KP 所致肝脓肿,氟喹诺酮类药物优于β-内酰胺类药物,可缩短静脉用药时间,减少住院费用[50]。由于医院内获得性肝脓肿致病菌较为复杂,且常为多重耐药菌[51],抗生素选择要兼顾革兰阳性球菌及革兰阴性杆菌。 待脓液或血细菌培养及药物敏感试验结果回报后,及时调整抗生素[52]。
5.2 外科手术干预
肝脓肿在下述情况时需要外科手术干预,主要手术方式是脓肿切开引流[53-55]。①肝脓肿范围大、分隔较多, 经皮穿刺引流及抗生素治疗后效果不佳;②肝脓肿破裂出现急性腹膜炎;③肝脓肿伴有需要外科手术治疗的肝胆疾病。 慢性肝脓肿或者肝脓肿无法与肝癌合并感染鉴别者, 建议行肝部分切除术。 如果肝脓肿位置适合,可优选腹腔镜手术减少创伤[56-57]。
6 肝脓肿的预防
肝脓肿的预防重点在于早期干预致肝脓肿的高危因素。 糖尿病患者要积极控制血糖,因为血糖控制不佳与肝脓肿的发生、发展密切相关。 有研究显示,二甲双胍、阿司匹林等能降低糖尿病患者肝脓肿发生率[58-59]。对于合并胆道结石疾病的患者,要通过外科手术积极解除隐患。 日本的一项大样本研究表明,肝癌行TACE 术时,给予预防性抗生素治疗能减少术后肝脓肿发生率[15]。
7 患者愈后随访
临床工作中,常常忽略对肝脓肿患者的长期随访,但越来越多的研究发现罹患过肝脓肿的人群在多种疾病的患病率上明显高于一般人群。 研究显示, 肝脓肿患者发生其他感染性疾病的风险显著增加,包括急性胰腺炎、肺炎和眼内炎等[60-63]。 有研究显示, 肝脓肿患者胃肠道及肝胆恶性肿瘤的发病率显著升高[64-66]。 一系列基于大样本的流行病学研究显示,肝脓肿与多种疾病的患病率有关,如肝脓肿患者髋部骨折发生率高于对照组, 随访过程中急性肾功能损伤的风险增加1.5 倍, 肝脓肿患者预后中风风险显著增加等[67-69]。 因此,肝脓肿患者治愈后仍需要充分的医学监测, 警惕相关疾病发生。
本共识旨在为肝脓肿的介入治疗提出指导性意见,但并非唯一的实践指南。 在临床实践中,需根据患者的个体化特征,所属地的医疗资源以及医疗机构的特殊性而进行个体化的实施,本共识的制订不排除其他干预措施的合理性。 本共识与任何商业团体无利益冲突。
[参与本共识讨论专家(按所在单位排序):刘兆玉(中国医科大学附属盛京医院)、郑加贺(中国医科大学附属盛京医院)、畅智慧(中国医科大学附属盛京医院)、赵 健(中国医科大学附属盛京医院)、王海瑞(中国医科大学附属盛京医院)、卢再鸣(中国医科大学附属盛京医院)、温 锋(中国医科大学附属盛京医院)、孙 巍(中国医科大学附属盛京医院)、徐 锋(中国医科大学附属盛京医院)、邵海波(中国医科大学附属第一医院)、冯 博(中国医科大学附属第一医院)、牛 猛(中国医科大学附属第一医院)、潘 鑫(中国医科大学附属第四医院)、谢锋(辽宁省人民医院)、王 峰(大连医科大学附属第一医院)、宋 磊(大连医科大学附属第二医院)、周 军(大连大学附属中山医院)、董福仁(锦州医科大学附属第一医院)、朱 杰(营口市中心医院)、于 涛(葫芦岛市中心医院)、张德辉(盘锦市中心医院)、任东铭(鞍钢总医院)、李仲文(丹东市中心医院)、孟 浩(辽阳市中心医院)。 执笔:畅智慧、王海瑞、赵 健]

