经导管动脉化疗栓塞成功转化的初始不可切除肝癌术前预测模型的临床研究
徐李刚, 张 巍, 钱 晟, 瞿旭东, 颜志平, 王建华, 刘萍萍, 王 栋,杨国威, 刘 嵘
经导管动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)已广泛用于临床,能有效改善肝细胞癌(hepatocellular carcinoma, HCC)患者的预后,其可以通过缩小肿瘤、灭活子灶使肿瘤降期获得Ⅱ期切除的机会[1-6]。 研究表明,包括TACE等不同疗法降期后, 行补救性肝切除术(salvation liver resection,SLR)的HCC 患者5 年生存率为25%~57%,与初始可切除肝癌的疗效相当(5 年OS 为30%~60%)[7]。 但是,这些研究多为回顾性研究,采取补救性外科切除多凭外科医生的临床经验,未对TACE 治疗后补救性外科切除最合适的候选人群和手术时机进行深入探讨。
Nomogram 已经在膀胱癌、肾癌、肝癌等疾病的预后评估方面发挥了重要作用[8-10],具有预测准确、个体化等特点。 本研究通过基于外科手术前数据的Cox 回归模型构建TACE+SLR 治疗初始不可切除HCC 的SLR 术前选择性预后预测模型。
1 材料与方法
1.1 研究对象
选择2010 年1 月至2016 年12 月在复旦大学附属中山医院接受TACE+SLR 治疗的HCC 患者393 例。入组标准:①肝组织病理学证实为HCC;②SLR前接受TACE 治疗,TACE 次数不限;③不可切除的HCC[中国肝癌分期(CNLC)中Ⅱb、Ⅲa 期,或因病灶较大、处于高危部位不可切除的部分Ⅰb、Ⅱa 期[2]];④ECOG 0~2 分;Child-Pugh A/B 级。 排除标准:①SLR 前接受消融治疗、放射治疗、全身系统治疗等其他抗肿瘤治疗患者;②影像学证实存在肝外转移CNLC(Ⅲb 期);③随访资料不完整者。根据上述纳入和排除标准, 最终纳入119 例患者。本研究经复旦大学附属中山医院伦理委员会批准(B2021-068R)。
1.2 方法
TACE:采用Seldinger 技术穿刺股动脉,在DSA下进行腹腔动脉、 肠系膜上动脉造影确认肿瘤情况,然后通过微导管缓慢注入化疗药物与超液化碘化油乳剂进行超选择栓塞肿瘤滋养动脉分支,最后用明胶海绵颗粒和/或空白微球加强栓塞。化疗药物和碘油剂量根据肿瘤大小及患者肝功能调整[11]。
SLR:在1 次或数次TACE 治疗后患者达到SLR的要求时即可进行手术。 一般至少在末次TACE 治疗3 周以后进行SLR。 肝切除术参照文献[12]。 经开腹探查证实肿瘤可切除后,采用Pringle 技术阻断入肝血流,钳夹法进行肝切除[13]。 本研究首选解剖型肝切除术,当无法进行解剖切除术时,选择非解剖切除术作为替代术式。
1.3 随访
电话随访患者生存状态,随访3 年,末次随访日期为2019 年12 月31 日。 总生存期为从HCC 肝切除日期到死亡或末次随访日期。
1.4 统计学分析
用SPSS V.25 进行数据分析。 组间比较用卡方检验。Kaplan-Meier 曲线描述生存情况。通过Cox 多元回归分析确定独立预后影响因子。 运用R 3.6.3 软件(http://www.rproject.org/)构建Nomogram 模型。利用C 指数检验Nomogram 模型的预测效能。 然后通过校准曲线检验预测模型的区分性能。 P<0.05 为差异有统计学意义。
2 结果
2.1 患者一般资料
119 例患者年龄为(52±12)岁,其中男性106 例(89.1%)。乙型肝炎104 例(87.4%),伴肝硬化99 例(83.2%),伴门静脉高压9 例(7.6%);Child-Pugh A级108 例(90.8%),B 级11 例(9.2%);肿瘤位于肝左叶16 例(13.4%),肝右叶76 例(63.9%);肿瘤直径为(8.9±3.3)cm;伴发血管侵犯35 例(29.4%);CNLC分期Ⅰb 期47 例(39.5%)、Ⅱa 期20 例(16.8%)、Ⅱb期17 例(14.3%)、Ⅲa 期35 例(29.4%)。AFP 为268.4(9.1,12 142)ng/mL;总胆红素为11(8.3,16.1) mg/dl,AST 为32(26,39)U/L;ALT 为30(21,40)U/L;碱性磷酸酶为99(82,125)U/L。 SLR 前TACE 1 次62 例(52.1%)、2 次35 例(29.4%);末次TACE 距SLR 时间为52(43,67)d。
2.2 生存分析
随访36 个月,119 例患者中,生存期≥36 个月82 例(长期生存组),生存期<36 个月37 例(短期生存组)。 存活时间为2~110 个月。 生存曲线结果显示,1、2、3 年的OS 分别为90.8%、80.6%、68.6%。
2.3 长期生存组与短期生存组SLR 前各项指标比较
两组病灶数目、是否伴有血管浸润、AFP、肿瘤直径、AST、是否伴有门脉癌栓(PVTT)、TACE 前后AFP 变化水平、TACE 前后肿瘤负荷变化、CNLC 分期等方面有明显的不同。 见表1。
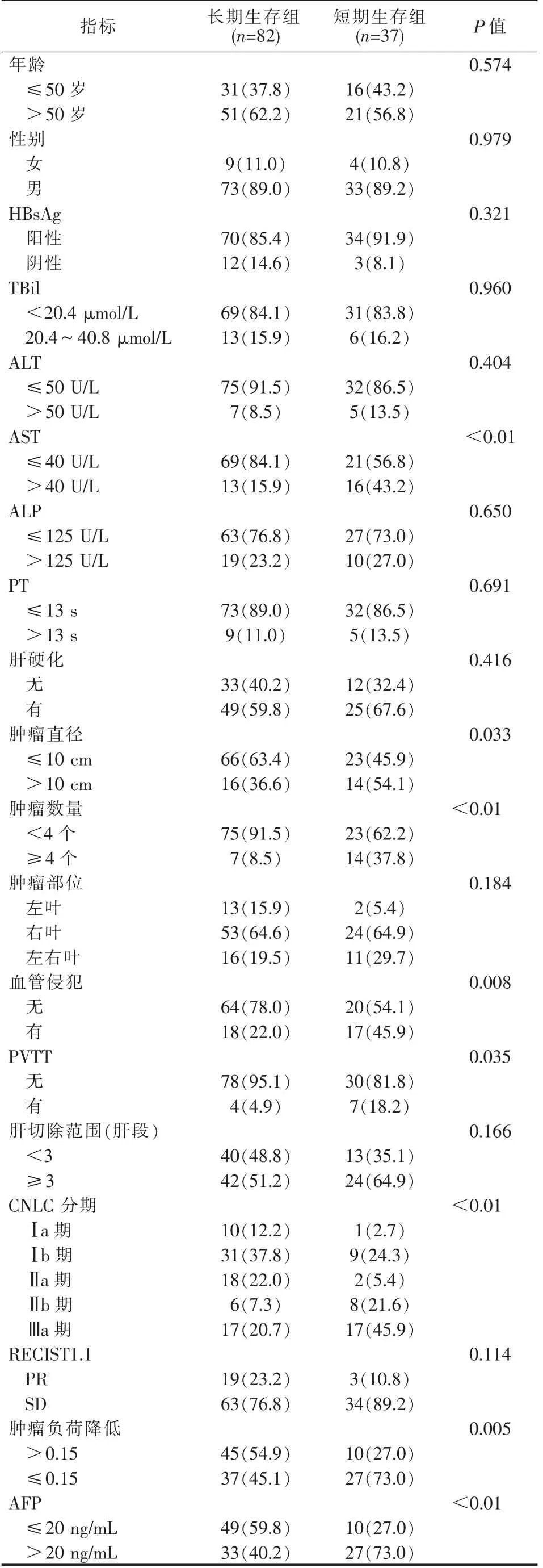
表1 长期生存组与短期生存组SLR 前各项指标比较[例(%)]
2.4 Cox 多因素分析长期生存的影响因素
将上述差异有统计学意义的指标纳入Cox 多因素分析,结果显示,AFP、肿瘤数目、PVTT、肿瘤直径和肿瘤负荷下降与长期生存独立相关,见表2。
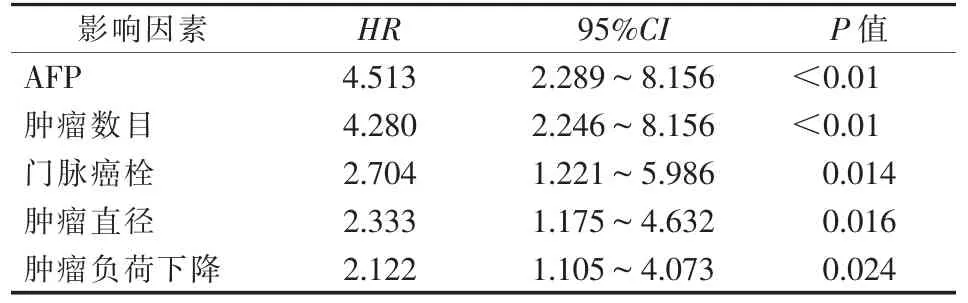
表2 Cox 多因素分析长期生存的影响因素
2.5 构建SLR 术前选择性预后预测模型-Nomagram
将上述5 个影响因素进行整合,建立SLR 术前预测预后的Nomagram 模型, 见图1。 该Nomogram模型对TACE+SLR 治疗初始不可切除肝癌患者的长期生存预测具有良好的准确性, 其C-Index 为0.781(95%CI:0.714~0.848)。 SLR 术后3 年的生存概率校准图表明模型有较好的一致性,见图2。

图1 基于SLR 前关键因素构建的Nomogram 模型

图2 基于SLR 前独立预后因素预测术后3 年间生存概率的校准曲线
3 讨论
本研究结果表明,TACE+SLR 治疗初始无法切除HCC 患者的3 年OS 为68.6%, 与文献报道的54%~76%结果相当[7,14];且AFP、肿瘤数目、PVTT、肿瘤直径和肿瘤负荷下降与长期生存独立相关,Nomogram 预测模型整合了上述5 个因素, 具有较好的准确性。 临床工作中可采用该模型预测患者TACE+SLR 治疗后的生存期,从而筛选出SLR 的最优候选人群以指导临床治疗。
AFP 是影响HCC 肝切除术后生存期的主要危险因素。 研究人员对HCC 患者肝切除后预后因素进行了较大规模的评估, 认为AFP 水平是HCC 切除术后独立预后因素[15-16]。 本研究结果显示,SLR 前AFP>20 ng/mL 患者3 年内的死亡风险是AFP≤20 ng/mL 患者的4.513 倍,表明SLR 前AFP 水平是TACE 治疗初始不可切除肝癌患者的SLR 前独立危险因素。
肿瘤大小、肿瘤数目、PVTT 是影响肝癌患者预后的主要因素[16-19]。 本研究中,长期生存组SLR 前肿瘤数目<4 个、肿瘤直径≤10 cm、不伴PVTT 的患者比例均高于短期生存组。 表明SLR 前肿瘤数量、 肿瘤大小和PVTT 对TACE 治疗初始不可切除肝癌患者的预后有显著影响。
本研究选择RECIST 1.1 进行短期疗效评估,主要是基于进行SLR 的考量,需要对病灶全部根治性切除,这无关于肿瘤活性灶的大小,而是基于整个病灶的大小。 此外,TACE 治疗后肿瘤负荷下降明显的患者组远期疗效较好, 肿瘤负荷下降≥0.15 HCC 患者1、2、3 年总体生存率分别为95.5%、85.4%和74%,下降不足0.15 的分别为76.7%、66.2%和52.3%。 国内外的研究发现,对TACE 治疗反应良好的患者行SLR 远期疗效较好[20-22],表明肿瘤负荷的变化对于SLR 至关重要。
本研究的局限性:①是单中心、小样本回顾性研究;②未对消融、外放疗以及靶向、免疫等其他治疗后补救性肝切除患者进行研究; ③建立的Nomogram 尚无前瞻性和多中心验证, 其价值还需深入探讨。
综上所述,TACE 联合SLR 治疗初始不可切除肝癌患者疗效确切。 基于SLR 前AFP 水平、癌灶数目、 肿瘤负荷下降水平、PVTT、 主瘤最大径构建的Nomogram 预测模型能较好地预测初始不可切除肝癌患者接受TACE+SLR 治疗的预后,对临床具有一定的指导意义。

