通过关联分析鉴定与花生脂肪酸含量相关分子标记
吴贝,刘念,黄莉,罗怀勇,周小静,陈伟刚,郭建斌,淮东欣,夏友霖,雷永,廖伯寿,姜慧芳*
(1.中国农业科学院油料作物研究所/农业农村部油料作物生物学与遗传育种重点实验室,湖北 武汉,430062;2.四川省南充市农业科学研究所,四川 南充,637000)
花生是我国主要的油料和经济作物,我国花生生产和消费多年居世界首位[1]。2019 年全国花生的种植面积为463.35 万公顷,总产量为1 751.96 万吨[2]。我国花生产量的一半以上用作榨油,花生油年消费量超300万吨[1,3]。
花生籽仁油脂主要由8 种脂肪酸组成,分别为棕榈酸、硬脂酸、油酸、亚油酸、花生酸、花生烯酸、山嵛酸和木蜡酸。其中,棕榈酸、油酸和亚油酸是最主要的3 种脂肪酸,总含量约为总脂肪酸含量的90%[4]。研究发现摄入过多的棕榈酸会增加心房纤维性颤动的风险[5,6],而油酸可降低血浆中的低密度脂蛋白和胆固醇含量,起到预防心血管疾病的作用[7]。亚油酸相较于油酸受热不稳定,易氧化酸败[8]。因此,提高花生油酸含量、降低亚油酸和棕榈酸含量将有利于提升花生油的健康品质并延长其货架期,是花生品质育种的重要方向之一。
花生脂肪酸含量为数量性状,易受环境影响[9]。利用双亲分离群体已开展了3 种花生脂肪酸含量QTL的研究,并定位了多个油酸、亚油酸和棕榈酸环境稳定的数量位点[10~17]。其中,同时控制3种脂肪酸的QTL 稳定位点仅定位在A09 和B09 染色体上[11~13]。而利用自然群体定位花生油酸、亚油酸、棕榈酸的关联位点的研究报道较少,并未检测到同时与3 种脂肪酸关联的位点[18]。已知花生A09 和B09染色体上的QTL 位点分别来自FAD2A和FAD2B基因。这两个基因同时突变可将油酸提高到75%以上,亚油酸降低到5%以下,棕榈酸降低到7%以下。目前这两个基因的突变位点已广泛运用到花生高油酸育种中[8,19~21];然而相较于高油酸菜籽油的脂肪酸组成(棕榈酸约为2%)[22],高油酸花生油的棕榈酸含量仍然偏高。因此,需要鉴定更多的控制花生3种主要脂肪酸的优异等位位点,指导分子标记辅助选择育种,进一步改良花生油的脂肪酸组成。
本研究利用292 份中国花生种质资源材料及583 个SSR 标记基因型数据对花生8 种脂肪酸组成进行关联分析,在多个环境下鉴定与棕榈酸、油酸、亚油酸性状同时关联的稳定位点,并开发相关标记辅助目标性状的选择。
1 材料与方法
1.1 材料
用于关联分析的292份中国花生种质资源材料由来自我国17 个省份的222 个品种、55 个选育品系和15个地方品种组成,分别在中国农业科学院油料作物研究所武汉实验基地(2015 年、2016 年、2017年)和四川省南充农业科学院实验基地(2017 年)共四个环境下种植(附表1,首页OSID 码)。田间试验采用完全随机区组设计,3次重复。每个材料种植1行12个植株,行长2 m,行距0.3 m,遵循标准的田间管理。
1.2 方法
1.2.1 脂肪酸的测定及数据处理 依据国标法(GB/T5510-2011)处理花生种子,用Agilent 7890B气相色谱仪测定8 种花生脂肪酸甲酯含量。利用Microsoft Excel 进行数据统计和分析,利用SPSS软件进行方差分析、正态分布检验和相关性分析。
1.2.2 标记-性状关联分析 利用TASSEL 软件的Q+K混合线性模型(MLM模型)对SSR标记与8种脂肪酸含量的相关性进行了研究[23]。群体结构(Q)和亲缘关系矩阵(K)分别由STRUCTURE V2.1软件和SPAGeD软件计算获得[24,25]。
1.2.3 DNA 提取、PCR 扩增及聚丙烯酰胺凝胶电泳 利用改良的CTAB 法从花生幼嫩叶片中提取基因组DNA[17]。分别采用1% 琼脂糖凝胶电泳和NanoDrop(Thermo Fisher Scientific, USA)检测DNA的质量和含量。引物序列来源于本实验室和其它实验室开发的SSR 标记[26~29]。PCR 反应体系10 µL包括全式金2×EcoTaq PCR SuperMix(+dye)5µL、基因组DNA 模板10~20 ng,引物对0.4 µmol/L。PCR反应条件为:94℃预变性3 min;94℃变性30 s、引物特异Tm+10℃复性45 s(每个循环降低1℃)、72℃延伸45 s,共10 个循环;94℃变性30 s、引物特异Tm 复性45 s、72℃延伸45 s,共30 个循环;最后72℃延伸5 min,4℃保温(附表2,首页OSID 码)。PCR 产物经6%的变性聚丙烯酰胺凝胶电泳分离,银染显影后读带。FAD2A和FAD2B基因型鉴定参考张照华等方法[30]。利用Microsoft Excel 整理带型数据并分析对应基因型。
2 结果与分析
2.1 292 份花生种质资源群体脂肪酸组成的表型分析
对四个环境下的292 份中国花生种质的8 种脂肪酸组成表型的平均值进行分析,棕榈酸含量的变异范围为6.08%~14.64%,油酸含量的变异范围为35.33%~80.85%,亚油酸含量的变异范围为1.21%~40.99%,其它5 种脂肪酸(硬脂酸、花生酸、花生烯酸、山嵛酸、木蜡酸)含量均不高于6.10%(表1)。8 种脂肪酸组成的变异系数范围为11.71%~24.26%,从大到小依次为亚油酸、硬脂酸、花生烯酸、油酸、花生酸、棕榈酸、木蜡酸和山嵛酸(表1)。8 种脂肪酸组成在资源群体中呈连续正态或偏正态分布,其广义遗传率分别为棕榈酸0.92、硬脂酸0.85、油酸0.95、亚油酸0.95、花生酸0.85、花生烯酸0.84、山嵛酸0.77、木蜡酸0.76(表1,图1)。

图1 花生292份种质资源脂肪酸组成频次分布图Fig.1 Frequency distribution of fatty acids in the 292 peanut

表1 花生292份种质资源材料脂肪酸组成统计分析Table 1 Statistical analysis of fatty acid compositions in the 292 peanut accessions
相关性分析发现油酸和亚油酸的相关性最高且呈极显著负相关,相关系数为-0.99(表2)。棕榈酸与油酸呈极显著负相关,与亚油酸呈极显著正相关,相关系数分别为-0.93 和0.92。硬脂酸与花生酸呈极显著正相关,与花生烯酸呈极显著负相关,相关系数分别为0.93 和-0.62。此外,相关性较高的还有花生烯酸和木蜡酸,呈极显著正相关,相关系数为0.67。山嵛酸与其他7种脂肪酸的相关系数的绝对值均不超过0.5。

表2 292份种质资源脂肪酸组成相关性分析Table 2 Correlation coefficients in fatty acids in the 292 peanut accessions
2.2 脂肪酸组成的关联分析
本课题前期利用随机分布在基因组上的简单序列重复(SSR)多态性标记对292 份花生材料进行基因型分型,获得了583个多态性位点,群体的平均遗传多样性为0.51,多态信息量(PIC)平均值0.45。利用该基因型数据进行群体结构(K)和亲缘关系(Q)分析,292 份材料可分为两个亚群,两亚群间的配对FST值为0.16,遗传距离为0.27[31]。采用K+Q矩阵的混合线性模型(MLM 模型),对四种环境下292 份花生种质的脂肪酸组成表型数据和SSR 标记数据进行关联作图。8 种脂肪酸在四个环境(2015年武汉、2016 年武汉、2017 年南充、2017 年武汉)分别鉴定出8~15、5~12、3~13 和4~13 个,共计113 个关联位点。3 种主要脂肪酸(棕榈酸、油酸和亚油酸)在四个环境可重复检测到的关联位点分别为9、14、14 个。其它5 种脂肪酸四个环境可重复检测到的关联位点较少,分别为硬脂酸7 个、花生酸7 个、花生烯酸7个、山嵛酸4个、木蜡酸5个(表3)。

表3 292份种质资源中与脂肪酸组成显著关联位点统计Table 3 Statistical analysis of significant associated loci for fatty acid compositions in the 292 peanut accessions
棕榈酸可重复检测到的关联位点定位在染色体A02、A03、A08、A09上,表型贡献率在四个环境分别 为 3.73%~11.88%、3.75%~10.33%、4.47%~10.36%、3.36%~9.55%;油酸可重复检测到的关联位点定位在染色体A02、A03、A05、A08、A09、B08 和B10 上,表型贡献率在四个环境分别为3.14%~16.10%、3.44%~15.22%、3.01%~16.44%、3.51%~14.57%;亚油酸可重复检测到的关联位点也定位在染色体A02、A03、A05、A08、A09、B08 和B10 上,表型贡献率在四个环境分别为4.17%~15.42%、3.57%~13.90%、3.09%~15.58%、3.51%~13.76(表4、3)。与上述3种脂肪酸均关联的多环境稳定标记有8个,分别为A02染色体上的ARS748,A03染色体上的AHGS3647、AHGS2050 和AHGS0314,A08 染色体上的AGGS704 和A09 染色体上的AGGS1096、AGGS1136、AGGS694_2。这8 个SSR 标记的等位位点的数量为2~4 个,其优异等位位点分别为AHGS3647-253bp、 AHGS2050-226bp、 ARS748-247bp、 AHGS0314-147bp、 AGGS1096-222bp、AGGS1136-199bp 和 AGGS694_2-183bp 和AGGS704-216bp(附表4,首页OSID码)。

表4 292份种质资源中可重复检测到与3种主要脂肪酸显著关联的标记信息Table 4 Loci with significant association signals for three major fatty acids compositions repeatedly detected in the 292 peanut accessions
2.3 3种主要脂肪酸关联标记验证
为了评价关联标记在花生育种中的利用价值,我们利用花生微微核心种质资源分别于2016 年、2017 年在中国农业科学院油料作物研究所武汉实验基地(E1、E2)和2017 年四川省南充农业科学院实验基地(E3)共三个环境下的油酸、亚油酸、棕榈酸表型作为测试数据。图2 可见,微微核心种质资源在三个环境中的棕榈酸含量分别为7.70%~13.81%(E1),8.07%~14.68%(E2)和 8.41%~13.89%(E3);油酸含量分别为37.99%~68.61%(E1),36.58%~65.78%(E2)和37.98%~63.54%(E3);亚油酸含量分别为12.73%~39.05%(E1),15.72%~40.73%(E2)和16.87%~38.79%(E3)。在8 个同时与3 种主要脂肪酸稳定关联的标记中,有3个标记等位位点扩增片段差异大,易于区分,故选取这3 个标记(AHGS3647、AHGS2050、ARS748)鉴定微微核心种质资源基因型。研究结果发现标记AHGS2050 和AHGS3647 在微微核心种质资源中与油酸、亚油酸、棕榈酸含量显著相关。微微核心种质资源中具有标记AHGS2050 优异等位位点(AHGS2050-226bp)材料在三个环境下3 种主要脂肪酸组成分别为棕榈酸9.64%±1.26%(E1),10.00%±1.36%(E2),10.31%±1.24%(E3);油酸57.47%±7.33% (E1) ,55.54%±6.73% (E2) ,54.07%±6.59%(E3);亚 油 酸 分 别 为21.62%±6.37%(E1),24.27%±5.82%(E2),25.41%±5.78(E3)。具有标记AHGS2050 非优异等位位点(AHGS2050-234bp)的材料在三个环境下3 种主要脂肪酸组成分别为棕榈酸11.61%±1.24%(E1),11.86%±1.10%(E2),12.19%±1.22%(E3);油酸46.73%±6.34% (E1) ,44.28%±5.56% (E2) ,44.08%±5.84%(E3);亚油酸30.68%±5.35%(E1),33.58%±4.79%(E2),33.45%±4.83%(E3)。由此可知,AHGS2050-226bp 优异等位位点可提高油酸含量9.99%~11.26%,并降低8.04%~9.31%的亚油酸和1.86%~1.97%的棕榈酸。99 份材料中具有标记AHGS3647 优异等位位点(AHGS3647-253bp)材料在三个环境下3种主要脂肪酸组成分别为棕榈酸9.82%±1.39% (E1) ,10.15%±1.34% (E2) ,10.37%±1.30%(E3);油酸56.52%±7.39%(E1),54.42%±7.04%(E2),53.51%±6.74%(E3);亚油酸22.40%±6.58% (E1) ,25.16%±6.12% (E2) ,25.63%±5.86%(E3)。具有标记AHGS3647 非优异等位位点(AHGS3647-239bp)材料在三个环境下分别为棕榈酸11.72%±1.18%(E1),11.97%±1.02%(E2),12.32%±1.04%(E3);油酸46.37%±6.03%(E1),43.99%±5.18%(E2),43.72%±5.42%(E3);亚油酸30.96%±5.12%(E1),33.78%±4.46%(E2),33.72%±4.48%(E3)。由此可知,AHGS3647-253 bp 优异等位位点可提高油酸含量9.79%~10.44%,并降低8.09%~8.62%的亚油酸和1.81%~1.95%的棕榈酸(附表5,图2)。
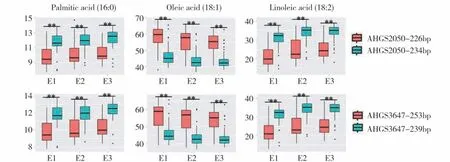
图2 脂肪酸关联标记在99份花生微微核心种质中的验证Fig.2 Confirmation of fatty acid-associated markers in 99 peanut mini-core germplasm
3 讨论与结论
关联分析在四个环境(2015 年武汉、2016 年武汉、2017年南充、2017年武汉)下鉴定到关联标记数为15 个(棕榈酸)、12 个(硬脂酸)、15 个(油酸)、17个(亚油酸)、16个(花生酸)、15个(花生烯酸)、13个(山嵛酸)、10 个(木蜡酸)。其中棕榈酸、硬脂酸、油酸和亚油酸在多环境稳定关联标记占比较高,分别为60.00%、58.33%、93.33%、和82.35%。同时,这4种脂肪酸组成的广义遗传率均高于0.92,说明这4种脂肪酸的的表型变异主要受到基因型影响。
相关性分析显示油酸和亚油酸呈高度负相关,相关系数为-0.99,而且两者可重复检测到的关联位点总体一致(14个关联位点仅1个不同)。棕榈酸和油酸、亚油酸的相关性也很高,相关系数分别为-0.93和0.92。棕榈酸可重复检测到的关联标记有9 个,这9 个标记同时也是油酸性状的关联标记,其中8 个还与亚油酸关联。此外,硬脂酸与花生酸正相关,相关系数为0.93。硬脂酸可重复检测到的关联标记有7个,这些位点同样也与花生酸性状关联。以上结果表明相关性很高的脂肪酸之间所关联的位点往往是一致的。原因可能是这些脂肪酸在代谢通路上存在上下游的联系,所以表现为一个位点(基因)同时影响不同脂肪酸组成。例如,FAD2基因突变会同时导致油酸升高和亚油酸降低,而油酸本身是亚油酸合成直接底物。
棕榈酸、油酸和亚油酸的总含量约占花生脂肪酸含量的90%,是影响花生油脂品质最重要的3 种脂肪酸。研究报道显示这3种脂肪酸的摄入量与心血管疾病相关[5~7]。此前研究发现,棕榈酸相关位点可在A01,A02,A04,A05,A07,A08,A09,A10,B01,B02,B03,B04,B06,B08,B09,B10染色体上检测到;油酸相关位点可在除A06,A10 外的18 条染色体上均检测到;亚油酸相关位点可在除A10 外的19 条染色体上均检测到[10~18]。其中,同时与这3种脂肪酸关联的位点定位在染色体A04,A07,A08,A09,B08,B09 和B10 上。在本研究中,同时与油酸、亚油酸、棕榈酸稳定关联的标记共8 个,A02 和A08 染色体上各1 个,A03 和A09 染色体上各3 个。A09 上的3个关联标记在基因组上的物理位置(AGGS1096 为113.89 Mb,AGGS1136为112.34 Mb,AGGS694_2为112.45 Mb)均与FAD2A的位置(114.19 Mb)接近。而FAD2A基因是控制油酸转变为亚油酸的关键基因,突变后可提高油酸并降低亚油酸和棕榈酸[21,32]。本文的结果也表明这3 个标记对于棕榈酸、油酸和亚油酸的表型贡献率分别可达11.88%、16.44%和15.58%,与前人的结果一致。此外,之前的研究未发现A03 染色体具有同时与3 种脂肪酸关联的位点。而本研究在多环境重复检测到3个标记关联在A03 染色体上,且它们的物理位置接近(AHGS3647为117.19 Mb,AHGS0314 为121.65 Mb,AHGS2050为125.06 Mb)。为了排除群体中FAD2A和FAD2B基因等位变异对评估3个新的关联标记表型效应的影响,我们鉴定了292 份中国花生种质资源材料FAD2A和FAD2B基因型。其中,FAD2A和FAD2B的双突背景材料仅7 份,FAD2A单突变材料70 份,FAD2B的单突变材料0 份,其余215 份材料两位点均未发生突变。由于双突变材料太少,只分析了在FAD2A单突变的背景下3 个标记的表型效应(附表6)。AHGS2050 优异等位位点可平均提高4.31%的油酸,并降低3.79%的亚油酸和0.81%的棕榈酸。AHGS3647 优异等位位点可平均提高3.23%油酸含量,同时降低2.79%的亚油酸含量和0.49%的棕榈酸。AHGS0314 优异等位位点可平均提高2.83%油酸含量,同时降低2.48%的亚油酸含量和0.51%的棕榈酸。以上结果说明这3个标记可以在FAD2A基因突变背景下继续提高油酸,降低亚油酸及棕榈酸含量。利用花生微微核心种质资源中进一步证实,标记AHGS2050 和AHGS3647 在三个环境下均与3种脂肪酸高度相关。AHGS2050 优异等位位点可稳定提高9.99%的油酸,并降低至少8.04%的亚油酸和1.86%的棕榈酸。利用AHGS3647优异等位位点可提高至少9.79%油酸含量,同时降低至少8.09%的亚油酸含量和1.81%的棕榈酸。本研究选取了292 份具有广泛代表性的中国花生种质资源开展花生脂肪酸性状的关联分析,在4 个环境下共鉴定得到113 个位点与8 种脂肪酸性状相关。在A03 染色体上首次发现了与油酸、亚油酸、棕榈酸同时关联的稳定位点,在微微核心种质中证实具有该位点关联标记(AHGS2050 和AHGS3647)优异等位位点可同时降低棕榈酸和亚油酸含量,提高油酸含量。使用AHGS2050 和AHGS3647 标记可以在花生育种中辅助选择具有高油酸、低棕榈酸、低亚油酸品系。

