北方强冬性甘蓝型冬油菜生长锥与抗寒性的关系研究
李学才,金姣姣,马骊,武军艳,陈其鲜,曾瑞,曾秀存,崔小茹,孙万仓*
(1.甘肃农业大学农学院/甘肃省共建干旱生境作物学国家重点实验室/甘肃省油菜工程技术研究中心/甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州,730070;2.甘肃省旱地冬小麦种质创新与应用工程研究中心/省级2011协同创新中心/陇东学院农林科技学院,甘肃 庆阳,745000;3.甘肃省农业技术推广总站,甘肃 兰州,730070;4.河西学院,甘肃 张掖,734000)
植物的生长锥(shoot apical meristem,SAM)是植物茎顶端分生组织的一部分,其生命活动最为活跃旺盛,是植物各类器官分化、形成、发育的“发源”区域,往往呈锥形。生长锥特性是遗传力较高的遗传性状,也容易受环境条件影响。多个作物上的研究发现,生长锥在形态上的变化与植物所受外界环境的影响密不可分[1,2]。对于越冬作物,生长锥的行为关系到能否越冬问题。孙万仓等[3]研究发现,新育成的抗寒性不同的北方白菜型冬油菜品种生长锥形态具有较大差异,且一般能够在甘肃河西走廊、北京等北方地区越冬的强抗寒白菜型冬油菜品种具有生长点凹陷、匍匐生长的特性。
生长锥的行为受一系列基因家族调控,SHOOT MERISTEMLESS(STM)和WUSCHEL(WUS)是茎分生组织发育的2 个重要基因,调控着分生组织的形成。STM基因属于I 类KNOX 亚家族,编码的同源域KNOX 家族蛋白能延迟分化[4],KNATM 是拟南芥中的一个新KNOX 蛋白家族成员,只存在于双子叶植物中[5],能在烟草的腋芽和顶端分生组织中特异表达[6]。WUS基因编码的同源域蛋白主要在干细胞中心表达,维持顶端分生组织中干细胞数量的动态平衡[7],下胚轴、真叶和幼苗分生组织中STM 与WUS蛋白可以相互作用共同调控CLV3基因的表达[8],胚胎中的WUS 是CLV3 的唯一激活因子。当CLV3 蛋白积累到一定量之后会反过来抑制STM基因与WUS基因的表达,这种反馈环使顶端分生组织大小适宜又连续不断[9,10]。CUC2(CUP-SHAPED COTYLEDON2)属于植物特有的NAC 家族NAM 超家族成员,在植物顶端分生组织的形成、器官原基的形成和叶边缘形态建成中发挥重要作用[11~13],转NAM基因的番茄植株矮小,顶端分生组织的形成受到抑制[14]。CUC2、STM、WUS、CLV3之间形成一定的反馈关系,可相互作用共同调节顶端分生组织的发育,如拟南芥的缺失突变体trn1-3,其顶端分生组织的相关标识基因CLV3、WUS、STM等表达量发生异常[15]。NAC 转录因子成员NAM和CUC1/2/3基因调控着植物的根、茎、叶、花和果实发育,如矮牵牛nam-突变体不能形成顶端分生组织[16],SNAC 家族基因NAC47和NTL 家族基因NAC62能提高转基因植株的耐冻性。
北方地区冬季严寒,干旱少雨(雪),冬油菜越冬条件严酷。强冬性白菜型冬油菜新品种越冬期生长锥凹陷,有利于抗御北方地区冬季的剧烈气温变化和土壤温度变化,保障安全越冬[17]。甘蓝型冬油菜品种的植物学形态与生物学特性不同于强冬性白菜型冬油菜品种。在河北石家庄及甘肃庆阳等地试验发现,长江流域及黄淮海的甘蓝型冬油菜品种在北纬35°左右的北方地区种植,表现为生长锥凸起,不能越冬,而部分生长锥较低品种则可安全越冬并获得较高产量[3]。因此,研究强冬性甘蓝型冬油菜生长锥与抗寒性之间的关系,对北方甘蓝型冬油菜的品种选育具有重要理论意义和应用价值。该研究通过观察强冬性甘蓝型冬油菜生长锥形态、测量其高度,分析生长锥相对高度与抗寒性之间的相关性,克隆生长锥调控基因,并进行功能分析,以期明确甘蓝型冬油菜生长锥在抗寒中的重要作用及其关键调控基因表达模式,为强冬性甘蓝型冬油菜强抗寒品种选育提供理论依据。
1 材料与方法
1.1 材料及菌株载体
选用了12个冬性不同的甘蓝型冬油菜品种,包括强冬性材料VHTSG10、VHNTS158、VHNS45-4、VHNPZ269-1、VHTS309-10、VH8(G)、VH 天油2266和VHTS309-4;冬性材料VHTS309-3 和VHTS312-2;弱冬性材料VH 天油2288和VH 新油23号。根据前期研究[18],依据半致死温度(LT50)确定该12 个材料的抗寒性由强到弱依次是:VHTSG10 >VHNTS158 > VHNS45-4 > VHNPZ269-1 >VHTS309-10 >VH8(G)>VH 天油2266 >VHTS309-4 >VHTS309-3 >VHTS312-2 >VH 天油2288 >VH新油23号。
胶回收试剂盒(AxyPreTM DNA Gel Extraction Kit)购于康宁生命科学有限公司;大肠杆菌(Escherichia coli)DH5α 和植物总RNA 提取试剂盒购于天根生化科技(北京)有限公司;反转录试剂盒(Prime-ScriptTM RT Master Mix RR036A)和载体试剂盒(pMD 19-T Simple Vector)购于大连TaKaRa 公司;普通2×TaqPCR MasterMix 酶和D2000 DNA Ladder购于北京中科瑞泰生物科技有限公司;X-gal(5-溴-4-氯-3-吲哚-β-D-半乳糖苷)和IPTG(异丙基-β-D-硫代半乳糖苷)来自本实验室保存。
1.2 方法
1.2.1 生长锥显微观察 通过AxioCam MRc 5 体视显微镜解剖生长锥,对越冬初期的甘蓝型冬油菜生长锥进行观察拍照。参考王跃华等[19]方法制作石蜡切片,并对越冬期甘蓝型冬油菜的生长锥进行显微观察。生长锥扫描电镜观察:(1)固定液稀释:将25%的电镜专用戊二醛溶液用pH 7.4 的磷酸缓冲液稀释为2.5%。(2)样品固定:用体视显微镜解剖出越冬期末期甘蓝型冬油菜茎尖生长锥,切取茎顶端5×5 mm 大小的组织,于2.5%戊二醛固定液固定24 h。(3)漂洗:经35%、50%、70%、90%、95%和100%无水乙醇20 min 漂洗两次。然后逐级过渡到叔丁醇中,纯叔丁醇中每次漂洗10 min,最后将组织放在纯叔丁醇中,4℃冰箱过夜。(4)用冰盒携带制备好的样品到电镜室进行干燥,粘样,金属镀金,并扫描观察。
1.2.2 引物设计和实时荧光定量 根据其在甘蓝型油菜(Brassica napus)中的编码序列,通过Premier 5.0 软件设计引物(表1),并由生工生物工程(上海)股份有限公司合成。使用Premix TaqTM(SYBR Green)试剂盒和QuantStudio 5荧光定量PCR 仪进行RT-PCR 扩 增,以cDNA 为 模 板,Bnactin为 内 参基因[20]。

表1 本研究所用qPCR引物Table 1 qRT-PCR primers used in this study
1.2.3 基因表达分析 查阅文献获得与生长锥调控相关基因,分别是STM(Gene ID:106444191)、CUC2(Gene ID: 106390278)、NAC(Gene ID:106438092)、KNATM(Gene ID:106414665)、WUS(Gene ID: 106364211) 和CLV3(Gene ID:111198561)。以常温处理与低温处理的幼苗(4℃,40 d)为材料,在顶芽下1 mm部位切取2 mm3大小的生长锥组织,测定低温处理较常温处理生长锥的基因表达量变化。
1.2.4 基因克隆 提取甘蓝型冬油菜生长锥的总RNA,采用Bio Mater5超微量紫外分光光度计测定浓度和纯度,并通过1%琼脂糖凝胶电泳检测总RNA质量。利用反转录试剂盒进行反转录RNA,得到单链cDNA,测定浓度稀释至50 ng·µL-1。由NCBI(https://www.ncbi.nlm.nih.gov)中甘蓝型油菜的编码序列,设计BnSTM全长特异性引物(F: ATGGAAAGTGGTTCCAACAGCACTTC;R: TCAAAGCATGGTCGAGGAGATGTG),以cDNA 为模板,进行PCR扩增。扩增体系如下:2×Taq PCR MasterMix 5µL;前引物0.5µL,后引物0.5µL,模板1µL,ddH2O 3µL。扩增产物经1%的琼脂糖凝胶电泳检测(预期产物长度1149 bp),进行琼脂糖凝胶回收,回收产物与pMD-19T 载体16℃连接过夜,转化大肠杆菌DH5α,通过蓝白斑筛选阳性克隆送测序。
1.3 生物信息学分析
以NCBI 寻找完整开放阅读框,DNAMAN 软件进行序列比对分析,ProParam 软件进行蛋白理化性质分析和氨基酸疏水性分析,利用在线软件WoLF PSORT 进行亚细胞定位预测,TMHMM 软件预测跨膜结构,SignalP 软件进行信号肽预测,利用NCBIConserved Domains 预测保守结构域,SOPMA 软件预测蛋白二级结构,采用SWISS-MODEL 预测蛋白质三级结构,ExPASy-PROSITE 预测蛋白质活性中心,以DNAMAN 软件进行多序列比对,通过MEGA 6.06软件进行系统进化树分析。
1.4 绿色荧光融合蛋白表达载体构建
1.4.1 载体构建 采用Gateway®技术,去除终止密 码 子,添 加Partial attB1/attB2 接 头(AttB1:GGGGACAAGGTTTGTACAAAAAAGCAGGCT;AttB2: GGGGACCACTTTGGTACAAGAAAGCTGGGT),将目的片段通过BP 酶反应连接到入门载体pDONR/Zeo 上,从阳性菌株中提取正确的质粒,通过LR酶反应重组到表达载体pEarley Gate103中。将该质粒转化大肠杆菌DH5α(卡那霉素抗性,Kan),对单菌落进行PCR 鉴定并送测序,以确保目的基因序列正确。
1.4.2 农杆菌转化 采用液氮速冻法转化农杆菌GV3101,将含重组质粒的农杆菌通过离心收菌,接种于LB 培养基(终浓度20 µg·mL-1Rif 和50 µg·mL-1Kan),200 r·min-128℃倒置培养2~3 d。挑取单菌落进行PCR 鉴定,将阳性菌液扩大培养,用50%甘油保存在-80℃超低温冰箱中。
1.5 亚细胞定位
通过注射法瞬时转染本氏烟草,在LSM800(ZEISS,Germany)激光共聚焦显微镜下观察并拍照。
1.6 数据处理
采用Excel 2010 和SPSS 22 统计软件对数据进行分析并作图。
2 结果与分析
2.1 不同冬性甘蓝型冬油菜品种生长锥形态观察
通过AxioCam MRc 5 体视显微镜解剖观察发现,不同冬性品种间生长锥存在较大差异,其中明显区别于其他品种的是强冬性的VHTSG10(图1D),生长锥表面光滑透明,体积矮小,生长锥凸起较低;而冬性弱的品种VH 新油23 号(图1O)和VH天油2288(图1N)等生长锥组织形成明显的细胞凸起。

图1 甘蓝型冬油菜生长锥形态(×100倍)Fig.1 Morphology of growing points of Brassica napus(×100)
为进一步研究甘蓝型冬油菜的生长锥形态,以冬性较强的VHTSG10、VHTS309-4、VHNPZ269-1、VH8(G)和冬性较弱的VH 天油2288、VH 新油23 号等品种的生长锥为试验材料,进行石蜡切片观察发现,不同抗寒性品种的生长锥高度明显不同。其中强冬性性品种VHTSG10(图2A)和VHTS309-4(图2B)生长锥较低,分别为132.5 µm 和215.4 µm,原套表面的细胞排列紧密,细胞核较大,生长锥基部有一层排列紧密染色较深的细胞群将原体与下部细胞分开,而冬性弱的品种VH 天油2288(图2E)和VH 新油23(图2F)生长锥较高,分别为357.8µm 和575.6µm,原套细胞染色加深,细胞间隙较大。
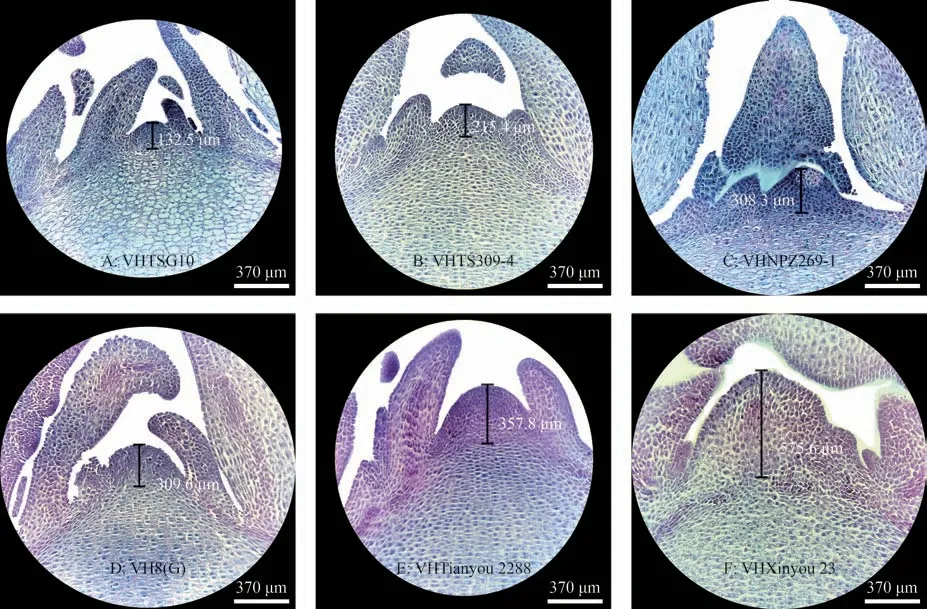
图2 甘蓝型冬油菜生长锥形态差异(×10)Fig.2 Morphological difference of growth point of winter rape(B.napus)
根据石蜡切片结果,选择强冬性VHTSG10、VHTS309-4 和弱冬性的VH 天油2288、VH 新油23号为材料,通过扫描电镜观察发现,强冬性材料VHTSG10 和VHTS309-4 的生长锥较低,表面平整光滑,呈半球馒头形,高度分别为148.70 µm(图3A)和157.39µm(图3B),弱冬性材料VH天油2288和VH 新油23 号的生长锥较高,表面有许多幼嫩的小突起分生组织,高度分别为172.17µm(图3C)和181.74µm(图3D)。

图3 甘蓝型冬油菜生长锥扫描电镜观察Fig.3 Scanning electron microscope observation on the growth point of winter rape
2.2 甘蓝型冬油菜生长锥相对高度
根据本研究前期预测定数据,观察同一生育时期生长锥相对高度(图4),发现弱冬性品种VH 天油2288 与强冬性品种VHTSG10 的生长锥相对高度差异显著。

图4 测定甘蓝型冬油菜的生长锥相对高度Fig.4 Measuring the relative height of growing points in Brassica napus
分析12 个冬性不同的甘蓝型冬油菜生长锥相对高度发现,随着甘蓝型冬油菜叶龄增加(图5),生长锥高度明显增加:三叶期不同品种间生长锥相对高度差异不显著;五叶期VH 天油2288 的生长锥相对高度为1.05 cm,显著高于VHTSG10 等强冬性材料(P<0.05);七叶期VHTSG10 的生长锥相对高度为0.90 cm,显著低于VHTS309-3等冬性材料和VH天油2288等弱冬性材料(P<0.05)。
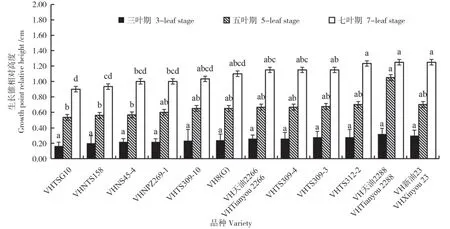
图5 不同冬性甘蓝型冬油菜的生长锥的相对高度Fig.5 Relative height of growth points of winter rape with different winterness
2.3 低温胁迫下生长锥分化调控基因的表达
相关基因的表达分析表明(图6),低温处理后生长锥调控相关基因均上调表达。BnSTM基因的表达量基本呈现随品种抗寒性减弱而升高的趋势,在生长锥较低的强抗寒材料VHTSG10 中表达量最低,上调了1.343 倍(图6A);BnCUC2基因的表达量基本呈现随品种抗寒性减弱而降低的趋势,在生长锥较低的强抗寒材料VHTSG10品种中表达量最高,上调了19.726 倍(图6B)。BnCLV3、BnWUS、Bn-NAC、BnKNATM基因在不同品种中相对表达量无明显规律(图6C~F)。

图6 调控生长锥分化相关基因响应低温处理的表达分析Fig.6 Expression of genes related to regulating growth point differentiation in response to low temperature treatment
分析不同叶龄调控生长锥分化基因的表达模式发现,随着苗龄增加,BnSTM和BnCUC2基因的表达量变化呈先升高后下降趋势,且在五叶期的表达量均显著高于三叶期和七叶期(P<0.05)(图7)。BnSTM基因的表达量变化幅度在强抗寒材料VHTSG10中最小,五叶期和七叶期较三叶期分别增加0.367倍和0.035倍(图7A);BnCUC2基因的表达量的变化幅度在强抗寒材料VHTSG10中最小,五叶期较三叶期增加0.118 倍,七叶期较三叶期下降0.197倍(图7B)。

图7 不同叶龄调控生长锥分化相关基因的表达分析Fig.7 Expression analysis of genes related to growth point differentiation regulated by different leaf age
对12个甘蓝型冬油菜材料的抗寒性、生长锥相对高度与生长锥调控相关基因相对表达量三者的相关性分析发现(表1):BnSTM基因表达量与半致死温度(LT50)和不同叶龄的生长锥相对高度存在中强正相关关系。BnCUC2基因表达趋势与BnSTM基因相反,与LT50和生长锥相对高度存在紧密负相关关系,|r|均大于0.672**。LT50与生长锥相对高度相关性分析表明,LT50与生长锥相对高度存在很强的正相关性,r最高达0.99**。

表1 调控生长锥分化相关基因表达的相关性分析Table 1 Correlation analysis of regulating the expression of genes related to growth point differentiation
2.4 生长锥分化调控关键基因的克隆
根据本研究数据,BnSTM和BnCUC2与生长锥高度的相关性较高,可以认为这2 个基因是生长锥分化调控的关键基因,因BnCUC2基因的CDs 序列与前人研究结果一致,本研究不再重新克隆[17]。从NCBI 中查找甘蓝型油菜(B.napus)STM的CDs 序列,以抗寒品种VHTSG10 与弱抗寒品种VH 天油2288 的生长锥cDNA 为模板,根据编码序列设计特异性引物进行PCR 扩增(见1.2.4),克隆到一条长度为1149 bp 的单一条带,扩增产物经凝胶电泳回收、大肠杆菌转化、蓝白斑筛选和菌落PCR,将阳性克隆的菌液送测序。
通过NCBI 寻找开放阅读框发现,VHTSG10 和VH 天油2288 的BnSTM基因含有完整ORF,长度为1149 bp。蛋白理化性质分析表明,VHTSG10 的BnSTM 蛋白由382 个氨基酸组成,属于不稳定亲水性蛋白(图8A)。亚细胞定位预测表明BnSTM 蛋白定位于细胞核中,存在2 个跨膜结构域(图8B),无信号肽(图8C),存在KNOX1、KNOX2、ELK 和Homeobox_KN 四个结构域(图8D)。二级结构预测显示,BnSTM 蛋白的二级结构中α-螺旋占37.17%,β-折叠占4.45%,无规卷曲占51.05%,延伸链占7.33%(图8E)。采用SWISS-MODEL 在线软件预测BnSTM 蛋白的三级结构,模型覆盖度为44.76%(图8F)。存在ELK、HOMEOBOX_2 和HOMEOBOX_1等3个活性中心(图8G)。

图8 甘蓝型冬油菜VHTSG10 的STM蛋白生物信息学分析Fig.8 Bioinformatics analysis of STM protein in VHTSG10
将强冬性材料VHTSG10 中克隆到的STM 蛋白序列与VH 天油2288、基因库的甘蓝型油菜(B.napus)(NM_001316059)、甘蓝(B.oleracea)、白菜型油菜(B.rapa)、萝卜(Raphanus sativus)等11 个材料的STM 蛋白序列进行亲缘关系比对,结果表明(图9),VHTSG10 与VH 天油2288、甘蓝型油菜、甘蓝和白菜型油菜的亲缘关系较近。通过多序列比对发现,VHTSG10 与VH 天油2288 中STM基因编码的蛋白质相似性达99.74%,与甘蓝型油菜和白菜型油菜中STM基因编码的蛋白质相似性均达到98.69%,与萝卜和甘蓝中的STM基因编码的蛋白质相似性分别达到97.12%和92.67%,而与乳浆草(Euphorbia esula)的序列同源性仅为53.66%。

图9 甘蓝型冬油菜VHTSG10中的STM蛋白氨基酸序列比对系统进化树分析Fig.9 Sequence alignment of amino acids and phylogenetic analysis of STM proteins sequence in VHTSG10
2.5 亚细胞定位分析
将VHTSG10 的BnSTM 融合绿色荧光蛋白GFP,成功构建表达载体pEarley Gate103-BnSTMGFP,转化农杆菌GV3101,并通过注射法瞬时转染烟草,利用激光共聚焦显微镜对BnSTM 蛋白进行亚细胞定位观察。结果表明,35S∶GFP 的绿色荧光蛋白广泛分布在质膜上,而35S∶BnSTM-GFP 绿色荧光蛋白主要分布在细胞核中,与预测结果一致(图10)。

图10 BnSTM 蛋白的亚细胞定位Fig.10 Subcellular localization of BnSTM
3 讨论与结论
较春性、半冬性、冬性甘蓝型冬油菜而言,强冬性甘蓝型冬油菜需要通过低温春化才能进入生殖生长,而感受低温的主要部位是生长锥[21]。甘蓝型冬油菜生长锥凸起较高、下胚轴较长,会使生长锥在冬季裸露于地表,容易受干旱、低温等逆境影响[22],故甘蓝型冬油菜较白菜型冬油菜抗寒性弱,与其生长锥与下胚轴特性是有关的。本研究发现,冬性强弱不同的甘蓝型冬油菜品种生长锥高度具有明显差异,强冬性的抗寒品种的生长锥相对高度较低,避免裸露于地表或裸露在地表的体积较小,受低温损伤也就较轻,利于规避北方冬季冻害,而冬性较弱的品种生长锥高度较高,不利于规避冻害。研究表明,生长锥高低与其分化相关,生长锥分化要经历一系列生理生化过程,在连续的生长锥分化过程中[23],随着低温下生长锥及相关器官的分化,生长锥内的淀粉物质越来越多[24],营养物质大量消耗,细胞浓度下降,易造成细胞结冰受冻致死[4]。强冬性材料生长锥较弱冬性材料低,这可能与春化阶段生长锥分化迟缓,营养物质消耗较少,细胞浓度较高有关[2]。冬小麦研究也表明,冬小麦耐低温能力不同主要与生长锥的分化程度有关,抗寒性弱的品种生长锥伸长较早[25]。半致死温度(LT50)是目前广泛用于植物抗寒性评价的常用指标[26],本研究证实冬性强弱不同的品种间LT50具有显著差异,强冬性的VHTSG10等品种LT50明显低于弱冬性的VH 新油23 号与VH 天油2288,且生长锥高度与LT50存在正相关关系。以LT50为评价指标评价的参试材料抗寒性由强到弱的位次与参试材料的感温性由强到弱的特性一致,表明北方甘蓝型冬油菜的生长锥高度与抗寒性是密切相关的,可用于判定抗寒性弱强。
拟南芥顶端分生组织生长发育过程研究发现,CUC2与STM基因共同调控其顶端分生组织的形成,STM是CUC2的下游基因[25],CUC2受STM的调控[27]。本研究发现,BnSTM基因、BnCUC2基因的表达与抗寒性和生长锥相对高度相关性显著,低温引起基因上调表达,但生长锥高度较低的强抗寒材料,BnSTM基因表达量较低,BnCUC2基因表达量较高,与前期研究结果一致[17]。VHTSG10 中BnSTM基因在细胞核表达,编码蛋白序列存在KNOX1、KNOX2、ELK 和Homeobox_KN 四个结构域,BnSTM蛋白在调控生长锥分化时存在的差异,可能与碱基突变引起的编码氨基酸发生改变有关。但STM 蛋白序列在VHTSG10和白菜型油菜、甘蓝和萝卜中相似性很高,说明STM 蛋白对生长锥分化的调控作用在不同物种间功能保守。
北方甘蓝型冬油菜的生长锥高度与抗寒性是密切相关的,是判定抗寒性弱强的重要性状。STM基因响应低温胁迫在细胞核上调表达,表达量与强冬性甘蓝型油菜的苗期生长锥高度和LT50存在正相关关系,与抗寒性存在负相关关系,STM 蛋白在白菜型油菜、甘蓝和萝卜等物种间功能保守,是调控生长锥分化的关键基因。

