缺氧诱导前列腺基质细胞HIF-1α与自噬在前列腺癌中的作用与机制研究
黄光毅 白俊超 蒋则平 朱武安
我国前列腺癌的发病率逐年升高。目前,传统的前列腺癌治疗方案为雄激素剥夺治疗(androgen deprition treatment,ADT),包括药物抗雄激素以及手术去势,以阻止雄激素结合到雄激素受体上的方式来抑制前列腺癌的生长。然而,传统的药物治疗并不能完全抑制前列腺癌的进程,大多数前列腺癌患者在经过ADT治疗后均会以非激素依赖的方式复发[1-4]。研究表明,前列腺增生的发生不仅与雄性激素和老龄有关,而且可能与前列腺细胞相对缺氧密切相关[5-6]。缺氧诱导自噬,从而引起转化生长因子-β1(TGF-β1),成纤维细胞生长因子-2(FGF-2)和FGF-7等释放,可能在前列腺癌的发生中发挥重要作用[7-9]。低氧诱导因子-1(hypoxiainducible factor-1,HIF-1)可激活目的基因的转录,调控生物体内的氧平衡,对机体器官或局部组织适应低氧环境具有重要作用[10-12]。本研究探讨HIF-1α在缺氧诱导的前列腺基质细胞自噬调节与增殖分化发生的机制,为治疗前列腺癌提供理论依据。
1 材料与方法
1.1 材料 人前列腺基质永生化细胞WPWY-1,由中国科学院上海生命科学研究院细胞资源中心提供。
1.2 试制 DMEM培养基(添加NaHCO31.5 g/L),95%;3-MA,均由美国sigma提供;优质胎牛血清,5%,由美国Gibco提供;DMSO,由北京索莱宝提供;胰蛋白酶,由美国Promega提供;兔抗LC3 II、兔抗大鼠HIF-1α多克隆抗体、兔抗LC3II一抗、Beclin1单克隆抗体、内参β-actin(1∶1000)、羊抗兔HRP二抗,均由英国Abcam提供;HIF-1α靶 shRNA、DNA 寡核苷酸链和PCR引物由博士德公司提供;TGF-β1,FGF-2,FGF-7试剂盒,由上海慧颖提供;pShuttleH1表达载体由第三军医大学提供;西罗莫司、MTT、吖啶橙、PMSF、BCA蛋白定量试剂盒、RIPA裂解液、ECL显影液、上样缓冲液,均由上海碧云天提供。
1.3 实验设备 定量PCR仪,由美国Applied Biosystems生产;电泳槽,由日本ATTO生产;杂交炉(UVP)、UVP凝胶成像系统,由美国GOS7600S生产;PCR仪,PTC-100,由美国MJ生产;蛋白/核酸分析仪,DU640,由BECKMAN生产;荧光显微镜及显微成像系统,由德国AXIOSKOP生产;酶标仪,由奥地利TECAN生产;倒置荧光显微镜,DMI3000 B,由德国LEICA公司生产;二氧化碳培养箱、振荡器,由赛默飞世尔科技中国有限公司生产;低温离心机,由德国Eppendorf生产;超灵敏多功能成像仪,由美国GE Healthcare生产;恒温培养箱,grp-9080,由美国通用公司提供。
1.4 实验方法 (1)建立缺氧诱导的前列腺基质细胞自噬模型:前列腺基质永生化细胞WPWY-1复苏、培养、传代,待细胞状态良好后,使用含有5%优质胎牛血清的DMEM培养液,于37℃,5%CO2,O2分别为5%,10%,14%,17%,20%,25%,30%,及饱和湿度下的培养箱中培养。培养2 h、4 h、8 h、16 h、24 h、48 h后通过形态学观察,MTT分别进行前列腺基质细胞增殖检测,Western Blot检测细胞HIF-1α的表达,ELISA法检测前列腺基质细胞TGF-β1,FGF-2和FGF-7的含量,以确定缺氧促进基质细胞生长的时间依赖关系和缺氧处理的最佳时间点,从而建立缺氧诱导的前列腺基质细胞自噬模型。(2)HIF-1α腺病毒载体以及靶向HIF-1α siRNA腺病毒载体的构建:①HIF-1α靶向性腺病毒载体:扩增HIF-1α基因,并在基因两端加上Bgl II与Sal I内切酶接头,连接至腺病毒穿梭质粒pShuttleH1,卡那霉素筛选克隆,鉴定后命名为Shuttle-HIF-1α,线性化后与Adeasy骨架质粒大肠杆菌内重组,卡那霉素筛选克隆。将其线性化后转入HEK293细胞,放置15~20 d,冻融法裂解细胞,获取病毒原液。利用病毒原液感染大量HEK293细胞,纯化病毒颗粒,并命名为Ad-HIF-1α,滴度测定后-80℃保存。②靶向HIF-1α基因siRNA腺病毒载体:合成双链寡核苷酸并克隆人pShuttleH1载体,pShuttleH1-siHIF-1α线性化后电转化到含pAdEasy-1的BJ5183感受态细菌中获取重组质粒,脂质体转染HEK293细胞获取重组腺病毒Ad-siHIF-1α,滴度测定后-80℃保存。(3)缺氧条件下自噬或HIF-1α对前列腺基质细胞增殖,以及对TGF-β1,FGF-2和FGF-7的影响:取前列腺基质永生化细胞WPWY-1,分为自噬抑制组、自噬促进组、HIF-1α上调组、HIF-1α下调组、低氧对照组,其中自噬抑制组使用含10 mmol/L自噬抑制剂3-MA、5%含优质牛胎血清DMEM培养液,自噬促进组使用含自噬促进剂西罗莫司、5%含优质牛胎血清DMEM培养液,HIF-1α上调组WPWY-1细胞转染Ad-HIF-1α,HIF-1α下调组WPWY-1细胞转染Ad-siHIF-1α,使用含5%含优质牛胎血清DMEM培养液,低氧对照组WPWY-1细胞不作处理,HIF-1α上调组、HIF-1α下调组、低氧对照组均使用含5%含优质牛胎血清DMEM培养液。所有组均按缺氧诱导的前列腺基质细胞自噬模型培养条件进行培养。检测各组细胞增殖、自噬率,及HIF-1α,LC3 II,Beclin1,TGF-β1,FGF-2和FGF-7的表达。(4)检测方法:①MTT法检测WPWY-1细胞增殖活力:将WPWY-1细胞按1×104/孔种植到96孔板中,加入MTT20 μL,培养4 h,向每孔加入DMSO 150 μL,采用酶联检测仪570 nm波长测定吸光度A,以吸光度A评价细胞增殖活力。② Western Blot检测细胞HIF-1α、LC3 II、Beclin1的表达[13]:使用冷PBS清洗WPWY-1,裂解细胞提取总蛋白,采用Bradford法测定蛋白浓度,蛋白变性后每孔上样量为20μg,以100 V 8%聚丙烯酰胺凝胶电泳90 min,转膜,5%脱脂奶粉封闭,TBST洗涤后分别加入兔抗大鼠HIF-1α多克隆抗体(1∶500)、兔抗LC3II一抗(1∶1,000)、Beclin1单克隆抗体(1∶1,000)和内参β-actin(1∶1,000)4℃孵育过夜,羊抗兔HRP二抗(1∶10,000),室温孵育45 min。洗膜后ECL 显影,压片5 min,定影。扫描胶片后,采用Image J软件对图片进行分析,WPWY-1细胞HIF-1α表达水平为目标条带与内参条带的面积比值。③ELISA法检测TGF-β1,FGF-2和FGF-7的含量:收集WPWY-1细胞上清液,严格按照TGF-β1、FGF-2、FGF-7 ELASA试剂盒使用说明进行操作,测定上清液中 TGF-β1,FGF-2和FGF-7的含量。④自噬率的测定及计算[14]:所有组WPWY-1细胞于培养结束前0.5 h,在细胞培养液加入1μg/mL吖啶橙染液,常温条件下染色30 min,然后使用PBS无菌液清洗,于倒置荧光显微镜下观察记录细胞染色情况。高倍镜下随机观察计数200个细胞,若细胞质内出现绿色荧光,则为自噬阴性细胞;若出现红色酸性自噬小体,则为自噬阳性细胞。自噬阳性细胞比例为自噬率。
1.5 统计学方法 采用SPSS 13.0统计学软件。计量数据以(±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 缺氧诱导的前列腺基质细胞自噬模型 (1)形态学观察:光镜下观察,不同氧浓度条件下培养,初期前列腺基质永生化细胞WPWY-1均呈成肌细胞样,后随培养时间的延长,低氧条件下WPWY-1呈现不同程度增大,且大小不均一,核呈梭形或卵圆形,多为双层腺样;氧充足条件下WPWY-1持续呈典型成肌细胞样,且大小均匀。(2)WPWY-1细胞增殖活力、HIF-1α、TGF-β1,FGF-2和FGF-7:低氧条件下WPWY-1细胞增殖活力(吸光度A)明显高于氧充足条件,其中以10%氧浓度培养24 h细胞增殖活力最高,见图1。同时检测HIF-1α、TGF-β1,FGF-2和FGF-7,结果与细胞增殖活力检测结果基本一致,见图2~5。结果表明,低氧能促进前列腺基质永生化细胞WPWY-1增殖,以氧浓度为10%,培养时间为24 h最佳。后续实验以此培养条件建立前列腺基质细胞WPWY-1自噬模型。
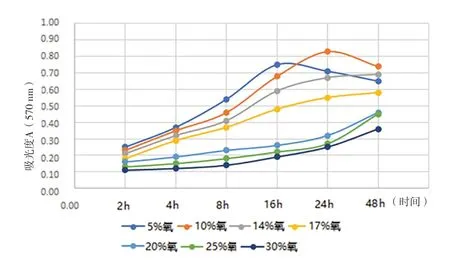
图1 不同氧浓度条件下不同时点WPWY-1细胞增殖水平
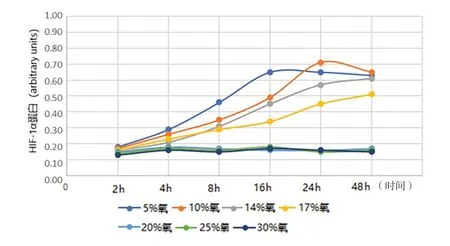
图2 不同氧浓度条件下不同时点WPWY-1细胞HIF-1α表达水平
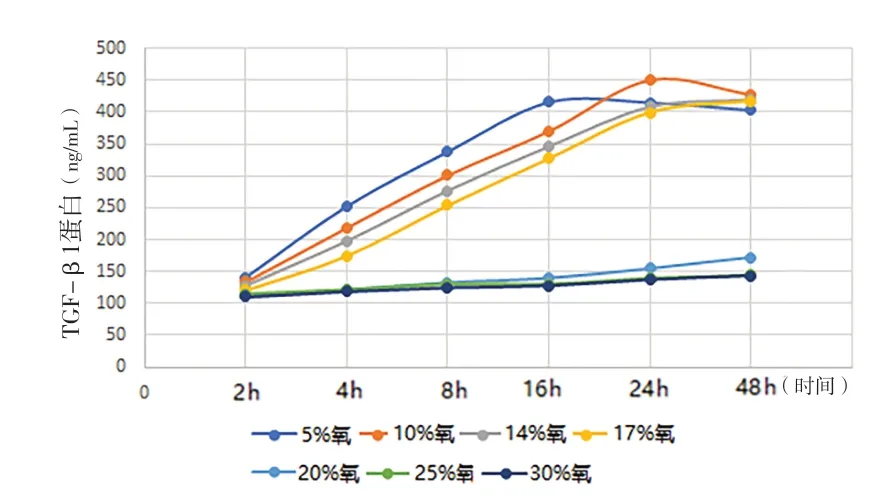
图3 不同氧浓度条件下不同时点WPWY-1细胞TGF-β1表达水平
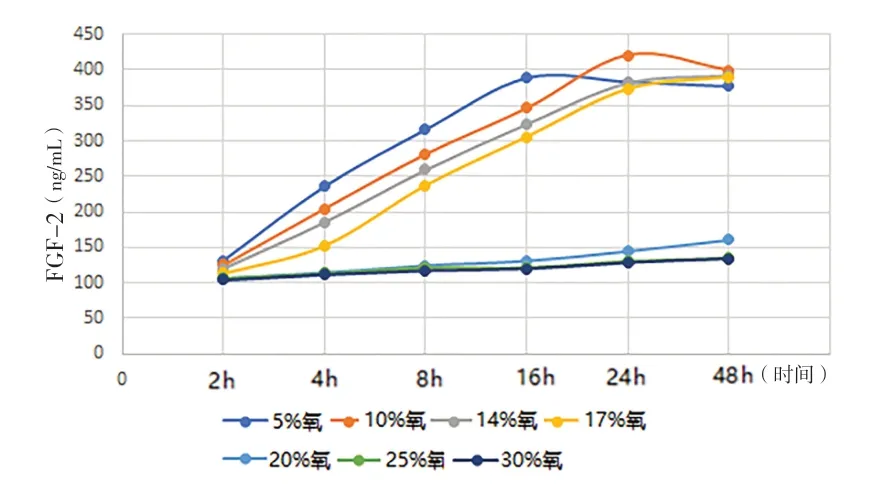
图4 不同氧浓度条件下不同时点WPWY-1细胞FGF-2表达水平
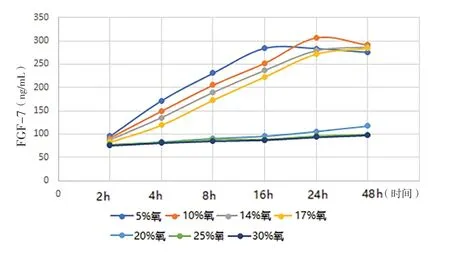
图5 不同氧浓度条件下不同时点WPWY-1细胞FGF-7表达水平
2.2 各组WPWY-1细胞增殖活力、HIF-1α、自噬率、LC3 II的比较 与低氧对照组比较,自噬抑制组和HIF-1α下调组WPWY-1细胞增殖活力、LC3 II、Beclin1降低(P<0.05),自噬率增加(P<0.05)。自噬促进组和HIF-1α上调组WPWY-1细胞增殖活力、LC3 II、Beclin1增加(P<0.05),自噬率降低(P<0.05)。自噬抑制组与自噬促进组比较及HIF-1α上调组与HIF-1α下调组比较,WPWY-1细胞增殖活力、自噬率、LC3 II、Beclin1,差异均有统计学意义(P<0.05)。HIF-1α上调组和HIF-1α下调组HIF-1α比低氧对照组增加或降低(P<0.05),但自噬抑制组与自噬促进组HIF-1α与低氧对照组比较差异无统计学意义(P>0.05)。见表1,图6。
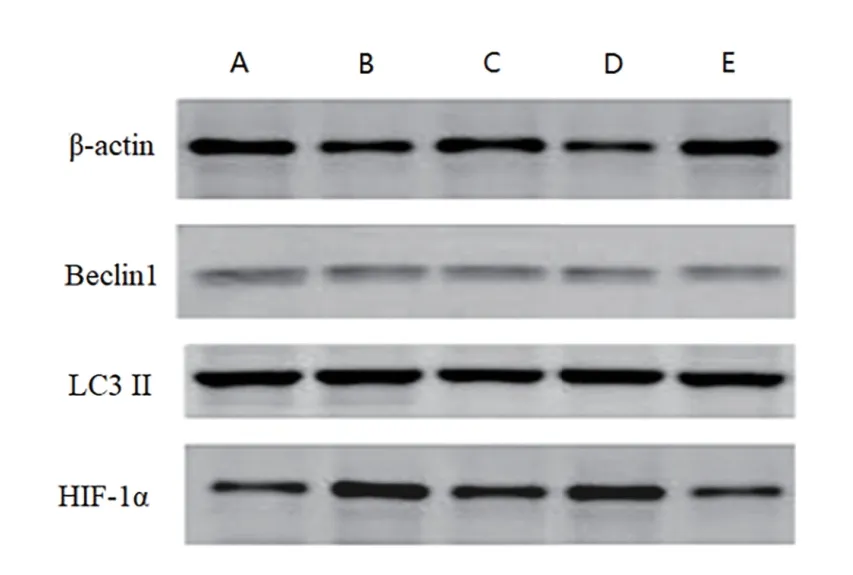
图6 Western blot检测各组HIF-1α、LC3 II、Beclin1的表达量
表1 各组WPWY-1细胞增殖活力、HIF-1α、自噬率、LC3 II比较(±s)
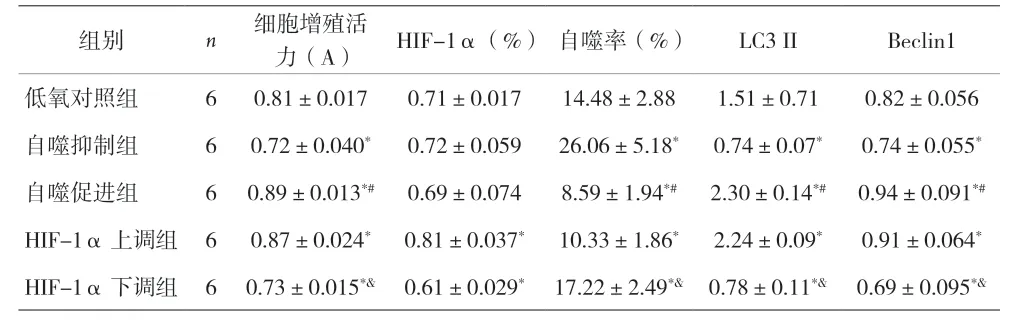
表1 各组WPWY-1细胞增殖活力、HIF-1α、自噬率、LC3 II比较(±s)
注:与低氧对照组比较,*P<0.05;与自噬抑制组比较,#P<0.05;与HIF-1α上调组比较,&P<0.05
组别 n 细胞增殖活力(A) HIF-1α(%)自噬率(%) LC3 II Beclin1低氧对照组 6 0.81±0.017 0.71±0.017 14.48±2.88 1.51±0.71 0.82±0.056自噬抑制组 6 0.72±0.040* 0.72±0.059 26.06±5.18* 0.74±0.07* 0.74±0.055*自噬促进组 6 0.89±0.013*# 0.69±0.074 8.59±1.94*# 2.30±0.14*# 0.94±0.091*#HIF-1α上调组 6 0.87±0.024* 0.81±0.037* 10.33±1.86* 2.24±0.09* 0.91±0.064*HIF-1α下调组 6 0.73±0.015*& 0.61±0.029* 17.22±2.49*& 0.78±0.11*& 0.69±0.095*&
2.3 各组WPWY-1细胞TGF-β1、FGF-2、FGF-7比较 与低氧对照组比较,自噬抑制组和HIF-1α下调组WPWY-1细胞TGF-β1,FGF-2和FGF-7降低(P<0.05),自噬促进组和HIF-1α上调组WPWY-1细胞TGF-β1,FGF-2和FGF-7增加(P<0.05)。自噬抑制组与自噬促进组比较及HIF-1α上调组与HIF-1α下调组比较,WPWY-1细胞TGF-β1、FGF-2、FGF-7差异均有统计学意义(P<0.05)。见表2。
表2 各组WPWY-1细胞TGF-β1、FGF-2、FGF-7比较(±s)
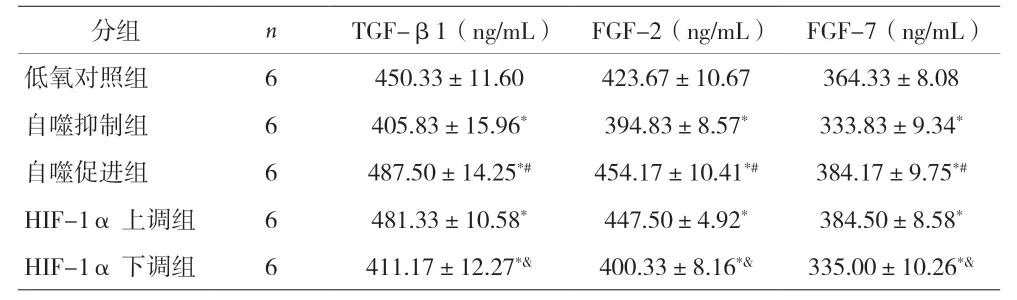
表2 各组WPWY-1细胞TGF-β1、FGF-2、FGF-7比较(±s)
注:与低氧对照组比较,*P<0.05;与自噬抑制组比较,#P<0.05;与HIF-1α上调组比较,&P<0.05
分组 n TGF-β1(ng/mL) FGF-2(ng/mL) FGF-7(ng/mL)低氧对照组 6 450.33±11.60 423.67±10.67 364.33±8.08自噬抑制组 6 405.83±15.96* 394.83±8.57* 333.83±9.34*自噬促进组 6 487.50±14.25*# 454.17±10.41*# 384.17±9.75*#HIF-1α上调组 6 481.33±10.58* 447.50±4.92* 384.50±8.58*HIF-1α下调组 6 411.17±12.27*& 400.33±8.16*& 335.00±10.26*&
3 讨论
随着年龄的增长,人体各脏器和组织细胞的功能都会生产非疾病性的退行性改变。中老年男性的这种退行性改变,可导致前列腺血流量减少,形成前列腺组织相对缺血缺氧环境[15]。SAITO等[6]利用自发性高血压大鼠研究前列腺血流量和前列腺增生症的关系,发现SHR前列腺血流量降低,明显促进前列腺癌的形成,且缺氧能够诱导前列腺基质细胞释放TGF-β1和FGF-2/7等生长因子。本研究采用不同氧浓度培养前列腺基质永生化细胞WPWY-1,研究发现低氧环境能增强细胞增殖分化,上调HIF-1α表达,TGF-β1,FGF-2和FGF-7等生长因子水平均明显高于常氧或富氧环境,细胞增殖活力增加,进一步证实低氧可促进前列腺基质细胞释放TGF-β1,FGF-2和FGF-7,从而诱导前列腺基质细胞增殖分化,并破坏前列腺上皮细胞结构,但严重缺氧环境细胞增殖程度受到一定限度,与文献研究结果一致[11]。
自噬(Autophagy)是一种机体生存、分化、发育、代谢必需的溶酶体降解途径,其主要功能是保护机体免受各种致病因素的侵袭,并参与多种疾病如肝病、癌症、神经变性病等的发生[16-17]。低氧是诱导细胞自噬的最常见原因[18]。低氧通过限制活性氧簇(reactive oxygen species,ROS)的产生和阻断一磷酸腺苷活化蛋白激酶/哺乳动物雷帕霉素靶蛋白(AMP-activated protein kinase/ mammalian target of rapamycin,AMPK/MTOR)信号通路,同时促进自噬信号蛋白LC3的Ⅰ型向Ⅱ型转变,抑制过量自噬,促进髓核细胞的增殖[19-20],其中LC3 II是细胞自噬水平的标志物。自噬抑制剂3-MA、自噬促进剂西罗莫司能抑制或促进胞质型LC3 I向自噬体膜蛋白LC3 II的转化,从而抑制或促进自噬的激活[21]。本研究使用自噬抑制剂3-MA、自噬促进剂西罗莫司分别处理WPWY-1,发现两组细胞增殖活力、自噬率、LC3 II、Beclin1、TGF-β1、FGF-2、FGF-7差异有统计学意义(P<0.05),与低氧对照组比较差异也有统计学意义(P<0.05)。表明自噬在前列腺基质细胞的增殖和分化中发挥重要作用。
低氧能诱导前列腺基质细胞增殖和释放转化生长因子TGF-β1,FGF-2和FGF-7,是良性前列腺增生的重要致病因素之一。而HIF-1已被确定为组织细胞适应低氧的关键介质,受到氧浓度水平的严密调节,几乎在所有细胞类型中表达,是一种高度保守的转录因子,其中HIF-1α赋予低氧诱导HIF-1转录活性的敏感性和特异性[22-23]。有研究报道,体外、体内转染HIF-1α均可促进肺癌细胞A549的生长,其机制可能与能促进细胞恶性增殖和抑制凋亡有关。潘克俭等[24]通过构建针对HIF-1α的人HIF-1α siRNA表达载体,转染SW480细胞,研究发现HIF-1α在缺氧条件下,对SW480细胞的增殖有促进作用。田跃军等[25]研究认为,HIF-1α与前列腺癌发生、发展过程密切相关,可能是前列腺癌的一个潜在的肿瘤生物标志物。本研究构建HIF-1α靶向性腺病毒载体Ad-HIF-1α、靶向HIF-1α基因siRNA腺病毒载体Ad-siHIF-1α,转染WPWY-1细胞,研究发现通过上调或下调WPWY-1细胞HIF-1α的表达,可促进或抑制TGF-β1、FGF-2、FGF-7等细胞生长因子的释放,从而调节WPWY-1细胞的增殖分化,其作用机制与自噬信号通路LC3 II、Beclin1有关。LC3 II和Beclin1作为自噬信号通路上的两个重要分子,在自噬发生过程中发挥关键作用。本研究显示,通过调节WPWY-1细胞HIF-1α的表达,可调控自噬信号通道蛋白LC3 II、Beclin1,调节自噬水平,从而控制TGF-β1、FGF-2、FGF-7等细胞生长因子的释放,实现WPWY-1细胞增殖分化的调控。HIF-1α表达上调,则增强自噬信号通道蛋白LC3 II、Beclin1的表达,自噬受到抑制,TGF-β1、FGF-2、FGF-7等细胞生长因子的释放增加,细胞增殖活力增强。反之,则细胞增殖活力降低。表明HIF-1α可能是前列腺基质细胞增殖分化的关键介质,其作用是通过调控自噬来实现。虽然前列腺基质细胞的增殖分化本身与前列腺癌的发生和发展无直接的关联性。但前列腺基质细胞的增殖分化的本质是自噬,其是前列腺癌的启动子或抑制剂,能通过PI3K/Akt/mTOR信号通路和LC3过表达,参与前列腺癌的发生和发展过程。
综上所述,低氧诱导前列腺基质细胞HIF-1α表达上调,通过增强自噬通路中的信号蛋白Beclin1 和LC3II的表达,调控细胞自噬水平,从而促进细胞释放TGF-β1、FGF-2、FGF-7等细胞生长因子,诱导自噬诱发前列腺基质细胞增殖分化,参与前列腺癌的进展。其中HIF-1α可能是低氧诱导自噬诱发前列腺基质细胞增殖分化的关键介质,有望成为前列腺癌新的治疗靶点。

