云南地区非小细胞肺癌10种驱动基因突变联合检测分析
苏国苗 王娟 李振辉 潘国庆 李彦熙 刘士岳 曾定涛 杨哲 雷梓★
肺癌目前已经成为全球发病率和死亡率增长最快的肿瘤之一,对人群健康和生命构成严重的威胁。2020年全球新增1 930 万例癌症病例中,肺癌发病率位居第二,仅次于乳腺癌,然而死亡率位居第一,在中国,特别是非小细胞肺癌(non⁃small cell lung cancer,NSCLC)位居恶性肿瘤之首[1]。云南地区的肺癌发病率和死亡率,特别是宣威地区在中国乃至全世界都位居前列,其相关驱动基因研究和个体化治疗越来越受到重视。全面了解NSCLC 基因突变谱,能够帮助临床选择合适的靶向药物进行治疗,从而有效延长患者生存期。常见驱动基因(如EGFR、ALK、ROS1等)的靶向治疗药物阿法替尼、奥希替尼等上市,肺癌患者治疗疗效得到显著改善[2]。因此,本次研究探讨NSCLC多驱动基因联合检测对临床诊疗的意义,为临床个体化治疗提供重要的参考依据。
1 材料与方法
1.1 研究对象
收集2016年7月至2021年7月昆明医科大学第一附属医院经病理诊断为NSCLC 的云南地区样本227 例,其中福尔马林固定石蜡包埋组织204例,细胞涂片23 例;男性101 例,女性126 例;年龄范围22~89 岁,中位年龄55 岁;腺癌213 例、鳞癌12 例、腺鳞癌1 例、大细胞癌1 例;原发灶184 例,转移灶43 例。本研究经医院伦理委员会批准。
1.2 肿瘤样本采集及DNA、RNA 提取
病理医师镜下筛片,调取蜡块进行切片装管(厚度:6~10 μm,数量8~12片)。使用厦门艾德生物医药有限公司的石蜡组织DNA 和RNA 提取试剂盒,按照说明书提取石蜡组织肿瘤样本的DNA 和RNA。
1.3 NSCLC 驱动基因检测
采用美国ABI公司QPCR仪(型号:7500),依据突变扩增阻滞系统(ARMS 法)的原理检测NSCLC 10种基因。检测试剂盒(基因突变检测试剂盒⁃荧光PCR 法)采用厦门艾德生物医药有限公司,每次实验均设定阴、阳对照及内参照,并根据试剂盒说明书判读结果。
1.4 统计学方法
采用SPSS 26.0 软件进行统计学分析;计数资料以n(%)进行描述,采用χ2检验;理论频数<5 的则采用Fisher 确切概率法检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 NSCLC 10 种驱动基因突变联合检测情况
227 例NSCLC 标本中,10 种驱动基因的总突变率为78.85%(179 / 227)。EGFR突变频率最高,KRAS突变位居第二,ALK融合位居第三。见图1。

图1 227 例NSCLC 患者10 种基因突变频率分布Figure 1 Frequency distribution of 10 gene mutations in 227 patients with NSCLC
通过对不同样本10 基因突变检测比较显示:原发灶的突变检出率与转移灶比较,术后石蜡样本突变检出率与细胞学样本比较,差异无统计学意义(P均>0.05)。见表1。
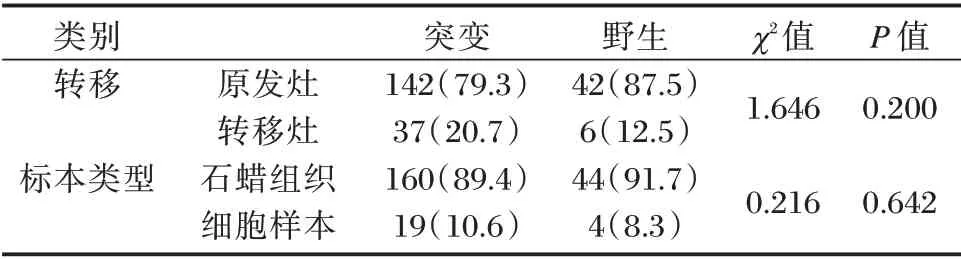
表1 不同样本10 基因突变检测率比较[n(%)]Table 1 Ratio of detection rate of 10 gene mutations in different samples[n(%)]
2.2 EGFR 基因突变特点
在227 例NSCLC 患者中,共检出EGFR基因突变102 例(44.93%)。主要以19Del 和21 号外显子L858R为主型,占总突变率的78.43%。见表2。
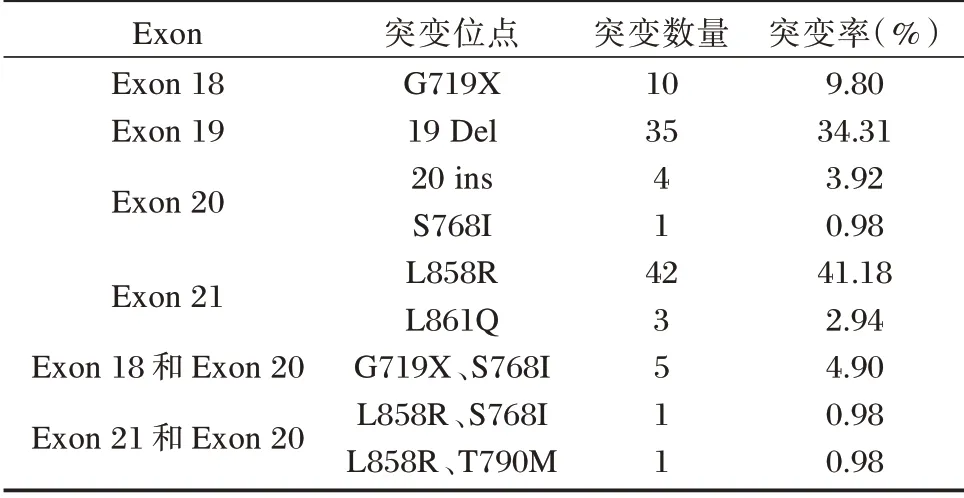
表2 EGFR 基因突变与临床病理特征的关系Table 2 Relationship between EGFR gene mutation and clinicopathological features
2.3 10 种基因突变与临床特征关系分析
10 种基因突变数据分析显示:EGFR基因突变率在女性患者高于男性患者,腺癌患者高于非腺癌患者,不吸烟患者高于吸烟患者,差异有统计学意义(P<0.05)。HER2基因突变率在女性患者高于男性患者,差异有统计学意义(P<0.05)。见表3。
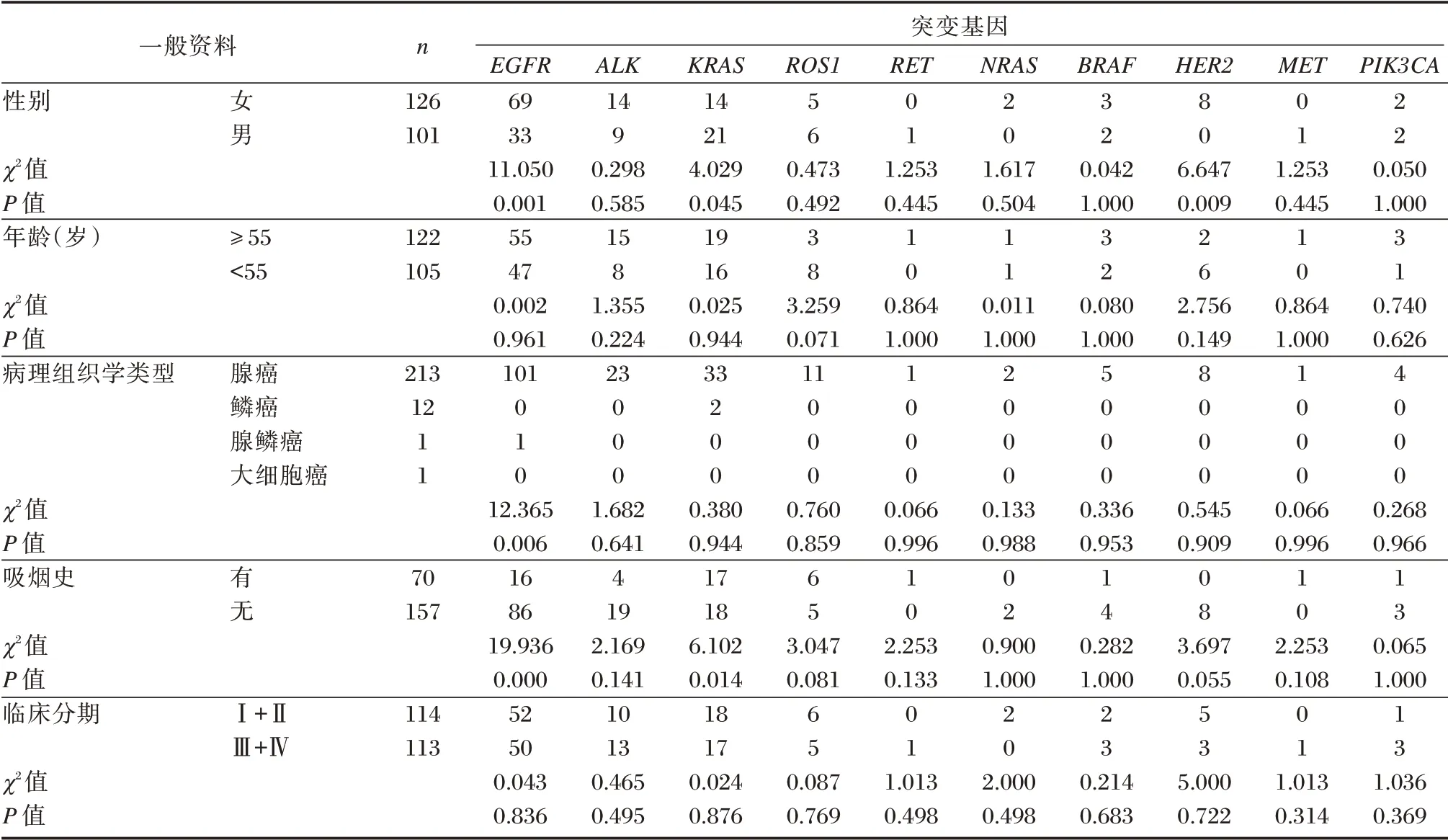
表3 NSCLC 患者EGFR 基因突变类型及检出率Table 3 Type and proportion of EGFR gene mutation in NSCLC patients
3 讨论
在NSCLC 靶向治疗前,全面了解肿瘤基因突变状态才能实施有效的个体化治疗。NSCLC 患者10 基因联合检测已是临床NSCLC 个体化治疗的重要参考依据[3]。EGFR属于酪氨酸激酶I 型受体,是上皮生长因子(epithelial growth factor,EGF)细胞增殖和信号传导的受体,其功能缺失或其相关信号通路中关键因子的活性或细胞定位异常,与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡有着密切的关系[4⁃5]。ALK基因属于胰岛素受体家族,通过基因重排进而激活下游信号通路导致癌变发生,可与多种基因发生融合,主要以EML4⁃ALK融合突变最为常见[6]。ROS1基因定位于6q21 染色体,在NSCLC 中主要与CD74、SLC34A发生融合,激活ROS1酪氨酸激酶区及下游JAK/STAT、PI3K/AKT、RAS/MAPK 等信 号通路,进而引起肿瘤的发生[7]。KRAS基因在NSCLC患者中以G12C 和G12V 突变最为常见[8]。BRAF基因在EGFR信号通路中位于KRAS下游,其突变引起编码氨基酸的改变,导致编码蛋白持续被激活,细胞恶性增殖引起癌变,以15 号外显子V600E突变位点为主。NRAS基因常见Exon⁃3 外显子Q61R/K/L/H 突变;PIK3CA基因常见Exon⁃9 和20号外显子E545K 和E545Q 突变;HER2基因常见20号外显子的插入突变;RET基因常见12 号外显子融合突变;MET基因突变常见14 号外显子缺失突变,在NSCLC 患者中多作为EGFR基因突变患者接受TKI 治疗后产生的耐药突变而继发性存在[9⁃10]。
既往相关研究数据显示,在中国人群中,NSCLC 患者EGFR突变阳性率最高(39.0%),其次是KRAS(8.0%)和ALK(5.5%),ROS1(2.1%)和BRAF(0.6%)突变阳性率相对较低[11]。本研究与前期研究数据基本吻合,造成检测结果组间差异的原因可能是研究的人群差异和采用的检测方法灵敏度不同,以及检测样本来源的不同。同时,通过对云南地区不同样本10 基因突变检测比较显示石蜡组织或细胞样本、原发灶或转移灶,都能够用于肿瘤驱动基因突变检测,与相关研究报道一致[12]。
国内外针对EGFR基因突变的最新研究显示,EGFR是NSCLC 最常见的驱动基因突变,在亚洲人群突变频率约50%[13],主要存在于外显子18、19、20、21,最常见的类型为19 号外显子缺失和21 号外显子L858R点突变,且多见于肺腺癌为主,亚裔、女性、非吸烟者,且瘤体积更小、分期更早的人群,更易从靶向治疗中获益[14]。本次研究EGFR基因突变的检出率为44.93%,以19 号外显子缺失和21 号外显子L858R 点突变为主;女性患者突变率高于男性患者;腺癌患者的突变率高于非腺癌患者;不吸烟患者中的突变率高于吸烟患者;与患者年龄、TNM 分期无关。
在中国EGFR基因的突变存在显著的地域差异,相关文献报道,广西与华南地区的EGFR基因主要以19 号外显子缺失突变为主[15⁃16],四川与云南地区以21 号外显子L858R位点突变为主[17⁃18]。本研究结果显示,云南地区NSCLC 患者中,EGFR基因主要以21 号外显子L858R位点突变为主,19 Del次之,与相关报道一致。
因此,NSCLC 患者10 种基因突变联合检测可一次获得更多基因突变信息,为分子靶向用药提供更加全面的指导信息,对于临床取材量少标本意义重大,并且10 种基因联合检测有利于发现相应靶向治疗的敏感基因及耐药基因,从而更精确的筛查靶向治疗的适应人群和判断靶向治疗的疗效,更全面地指导临床治疗。
综上所述,云南地区NSCLC 患者10 种基因突变以EGFR基因突变率最高,与样本是否转移、样本类型均无关;EGFR突变以19Del 和21 号外显子L858R 为主型,多见于女性、无吸烟史及腺癌患者,与年龄及TNM 分期无关。HER2基因突变多见于女性患者,与患者年龄、是否吸烟、组织学类型以及TNM 分期无关。ALK、ROS1、KRAS、BRAF、NRAS、PIK3CA、RET及MET基因与NSCLC 患者性别、年龄、是否吸烟、组织学类型、TNM 分期均无关。

