对比评估双能CT、MRI定量参数对直肠癌KRAS基因突变的价值
林晓强,韩 涛,景梦园,邓靓娜,张 斌,周俊林
1兰州大学第二医院放射科,兰州 730030
2兰州大学第二临床医学院,兰州 730030
3兰州大学第二医院甘肃省医学影像重点实验室,兰州 730030
4医学影像人工智能甘肃省国际科技合作基地,兰州 730030
KRAS是细胞生长中重要的调节蛋白基因,该基因编码的突变导致GTP水解酶活性丧失,进而持续活化使细胞增殖癌变[1]。KRAS基因突变存在于30%~40%的结直肠癌肝转移患者中,并且与复发、转移和总生存时间降低有关[2- 3]。多项临床研究表明具有KRAS基因突变的结直肠癌无法从抗表皮生长因子受体(epidermal growth factor receptor,EGFR)的靶向治疗中获益,因此,KRAS基因突变状态可作为结直肠癌抗EGFR治疗疗效的预测生物标志物[4- 5]。CT及MRI是目前应用于直肠癌术前评估的主要成像手段,双能CT及MRI衍生序列的定量参数对比图像特征能更好地反映组织病理学改变,目前已有研究表明能谱CT及MRI定量参数对预测结直肠癌基因突变的可行性[6- 8],本研究对比评估两种成像手段的定量参数,比较两者对直肠癌KRAS基因突变的诊断效能。
对象和方法
对象收集2017年8月至2021年4月兰州大学第二医院的直肠癌患者。纳入标准:(1)在术前10 d内接受三期能谱CT及MR平扫及扩散加权成像(diffusion-weighted imaging,DWI)检查,两种检查时间间隔不超过3 d;(2)在兰州大学第二医院行手术并由病理确诊为直肠腺癌的患者;(3)具有完整的临床病理资料;(4)进行KRAS基因突变检测的患者。排除标准:(1)合并其他恶性肿瘤患者;(2)术前经过抗肿瘤治疗如新辅助治疗、放化疗或光动力治疗等;(3)图像质量过差,难以显示病灶;(4)临床资料不全的病例。满足以上入组标准共计50例患者,男32例、女18例。29例为KRAS野生型、21例为KRAS突变型。肿瘤分期包括T1期2例、T2期6例、T3期36例、T4期6例。肿瘤的组织学分型均为腺癌。
方法采用回顾性病例对照研究,术前临床基线资料的获取包括患者的性别、年龄、癌胚抗原水平、糖类抗原125水平、糖类抗原199水平(carbohydrate antigen 199,CA199),术后病理基线资料包括术后病理T分期、脉管侵犯、神经侵犯及淋巴结转移。
双能CT扫描:采用GE宝石能谱机(Discovery CT750HD,GE Healthcare,USA)行平扫及三期能谱CT扫描。对所有患者均采用能谱成像进行平扫及增强三期扫描。扫描前培训患者做平静呼吸以最大化地降低呼吸运动伪影,扫描范围从膈顶到耻骨联合以下。宝石能谱CT管电压为高、低能量(140、80 keV)瞬时切换,自动毫安技术,层厚5 mm,层间距5 mm,螺距0.984∶1。增强扫描时通过正中静脉以流率5.0 ml/s团注非离子型对比剂碘海醇(320 mgI/ml),造影剂剂量为1 ml/kg,动脉期能谱扫描采用阈值法,感兴趣区(region of interest,ROI)放置于膈顶的主动脉区域,至80 HU触发扫描,在注射造影剂后的25~30 s、60~70 s和120~150 s进行动脉期、静脉期和延迟期的扫描。
磁共振扫描:采用飞利浦 3.0 T超导 MR (Philips MR Ingenia 3.0 T)成像系统,32通道线控阵表面线圈。主要序列及参数:重复时间=3000 ms,回波时间=80 ms,层厚为 3 mm,矩阵 260×260,视野范围=260 mm×260 mm,体素为 1 mm×1 mm,激励次数=1,翻转角 90°,获取肿瘤病灶矢状位图像,大体了解病灶在直肠位置,再行轴位、冠状位T2加权成像(T2 weighted image,T2WI)扫描及斜轴位、冠状位DWI扫描。行 DWI 成像时,选用单次激发自旋平面回波序列,b值选择0、1000 s/mm2。
KRAS基因突变(外显子2、3、4):通过PCR使用突变扩增阻滞系统方法进行检测。
图像后处理及数据分析双能CT扫描完成后将原始数据重建为层厚1.25 mm、层间距1.25 mm的薄层图像并上传至GE ADW4.7工作站(GE Healthcare,Milwaukee,WI,USA),由1名高年资主治医师使用专用能谱分析软件通过盲法完成图像后处理及数据分析。分别在动脉、静脉及延迟期的70 keV单能量能谱图像上选取病灶的最大层面,并在每个层面以及邻近上下两个层面上放置3个ROI,避开明显的血管及坏死区域(在各期图像上均表现未增强的区域),ROI的形状由圆形至椭圆形不等,每个ROI约占该层肿瘤层面实体部分的1/3,尽量确保三期能谱ROI大小形态及位置一致,ROI的平均大小为42.47 mm2,共计9个ROI,并计算ROI的平均值(图1A、1B、1C)。数据分析包括:(1)测量病灶的三期有效原子序数、碘(水)浓度(iodine concentrations,IC)(mg/cm3)及水(碘)浓度并计算标准化碘浓度(normalized iodine concentration,NIC),NIC值计算公式为:NIC=IC肿瘤组织/IC髂内动脉;(2)在静脉期图像上约第二骶椎平面测量直肠上静脉(superior rectal vein,SRV)直径,测量取相关层面的最小直径(直肠上静脉回流在此平面接近水平走行,以周围为脂肪组织作为衬底显示更为清楚)[9]。
磁共振图像扫描完成后上传PACS工作站。由上述医师使用盲法进行ROI勾画,在相同患者的能谱CT图像绘制结束后立即进行,ROI的放置选取病灶的最大层面进行3次勾画并取平均值(图1D)。数据获取及分析包括:(1)结合DWI和T2WI获取肿瘤的分段,以折线法测量病灶下缘距离肛缘的距离,低于5 cm者记录为低位直肠癌,高于10 cm者记录为高位直肠癌,5~10 cm记录为中位直肠癌;(2)在T2WI图像上测量最大纵向肿瘤长度(longitudinal tumor length,LTL)及最大轴向肿瘤长度(axial tumor length,ATL),并计算ATL/LTL,LTL定义为沿肠管长轴方向肿瘤上缘到下缘的距离,ATL定义为病灶最大层面肿瘤外缘至肠腔内肿瘤内缘的距离[9- 10];(3)测量肿瘤实性成分ADC值,其中包括最小ADC值(最小ADC值定义为最大层面所有ROI中获得的最小ADC值)、平均ADC(average ADC,aADC)值及相对ADC(relative ADC,rADC)值,计算公式为:rADC=aADC/病灶同层臀大肌aADC值。

ADC:表观扩散系数;圆圈为感兴趣区;所有感兴趣区均放置于肿瘤实性组织处
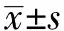
结 果
两次测量的一致性同一观察者两次测量的双能CT及MRI定量参数的ICC值均大于0.7(P均<0.05),其中动脉期碘浓度值的ICC值最低(ICC=0.894),两次测量具有较好的可重复性。
术前临床资料KRAS突变与野生型组患者的性别、年龄、分段及部分血清肿瘤标志物指标(癌胚抗原、糖类抗原125)差异均无统计学意义(P均>0.05);CA199异常组KRAS基因突变率高于正常组,差异有统计学意义(P=0.036)(表1)。
双能CT及MRI定量参数比较KRAS突变与野生型组患者的双能CT及MRI定量参数比较显示,突变型组的静脉期标准化碘浓度值高于野生型组,差异有统计学意义(P=0.016);其余能谱CT参数以及直肠上静脉宽度差异均无统计学意义(P均>0.05)(表2)。突变型组aADC与rADC均低于野生型组,差异有统计学意义(P=0.008,P=0.002);最小ADC值、ATL、LTL及ATL/LTL差异均无统计学意义(P均>0.05)(表2)。
术后病理指标比较KRAS基因突变组对比野生型组具有更高的淋巴管血管侵犯率(P=0.034),两组患者的其他术后病理指标差异均无统计学意义(P均>0.05)(表3)。
临床病理资料、双能CT和MRI定量参数诊断效能比较对差异有统计学意义的指标绘制ROC曲线,结果显示CA199、淋巴管血管侵犯、能谱参数静脉期标准化碘浓度值、aADC及rADC值曲线下面积分别为0.639、0.646、0.693、0.721及0.755,rADC对KRAS基因突变的AUC值高于aADC值、静脉期标准化碘浓度值、CA199及淋巴管血管侵犯,以低于0.488作为截止值诊断KRAS基因突变的敏感性为82.8%、特异性为61.9%(图2、表4)。

表1 野生型与突变型直肠癌术前临床基线资料比较
表2 野生型与突变型直肠癌双能CT和MRI定量参数比较
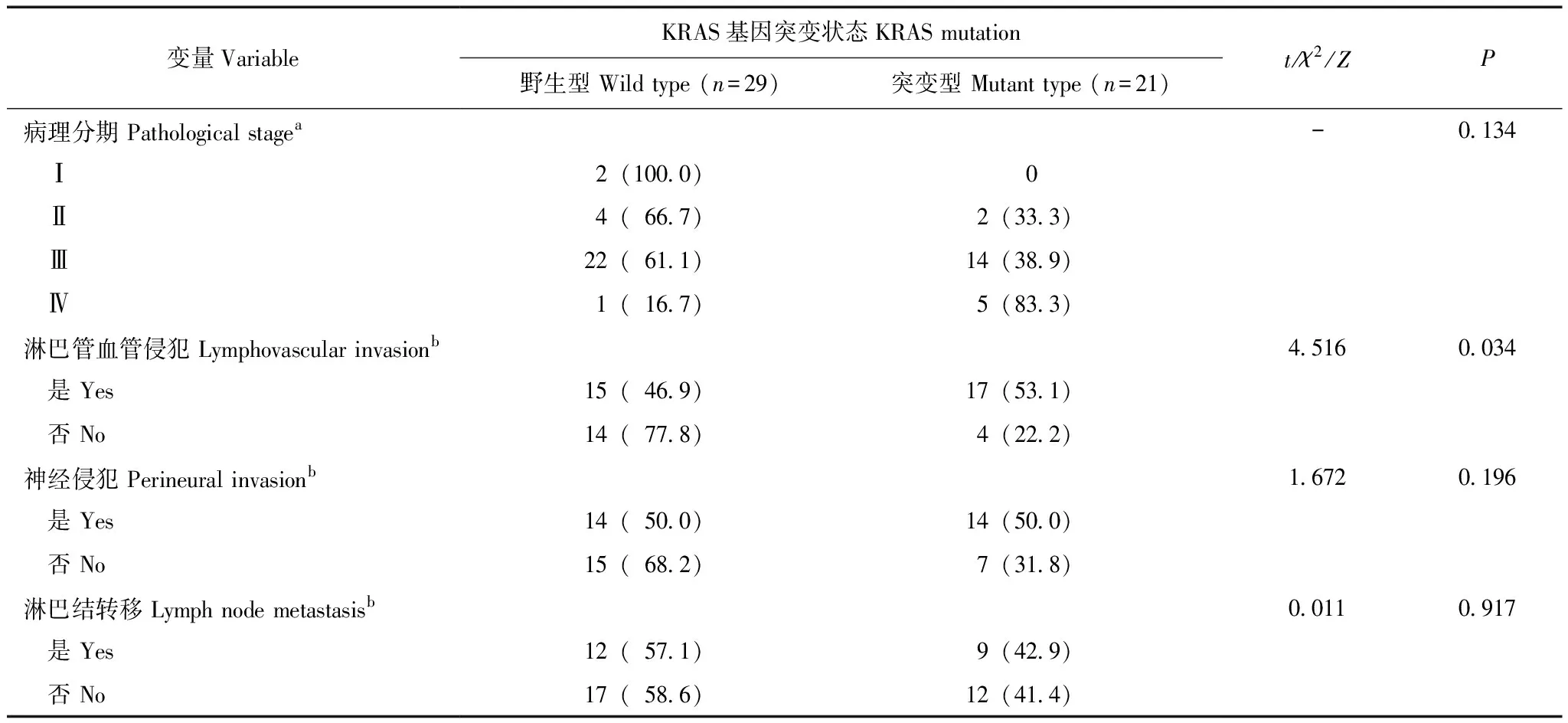
表3 术后病理指标对直肠癌KRAS基因突变的相关性[n(%)]

图2 临床病理指标、双能CT及ADC定量参数诊断直肠癌KRAS基因突变的受试者工作特征曲线
讨 论
美国国家综合癌症网络指南推荐将RAS基因检测作为疑似或确诊的转移性结直肠癌抗EGFR治疗前的先决条件[11]。对于失去手术机会的部分转移性结直肠癌患者,影像学检查具有可重复性高、全面评估等优点,对比侵入性活检取点的不稳定性,更有助于指导临床选择靶向治疗的方向。
既往大样本量研究显示KRAS基因突变在女性及65岁以上人群中更多见[12],并且血清标志物如CA199可作为独立预测因子预测直肠癌KRAS基因突变[13];多种临床病理学因素与结直肠癌KRAS基因突变密切相关,并且常指向不良预后[14- 15]。本研究除淋巴管血管侵犯外,其他临床病理指标如性别、年龄、术后病理分期、神经侵犯与淋巴结转移情况均未显示与KRAS基因突变有相关性,这可能是由于本研究样本量较小所致。本研究以37 U/ml将CA199分组为正常/异常组,异常组较正常组具有更高的KRAS基因突变率,所得结果与之前的文献[16]较为一致。基于图像特征的定性或半定量指标如肿瘤形态、SRV、ATL/LTL等在既往研究中具有一定价值[6,10,17],但受制于操作者主观性强、诊断准确性及诊断效能较低等原因导致诊断价值有限,本研究亦引入SRV、ATL/LTL与直肠癌KRAS基因突变行相关性分析,但未显示有差异。
能谱CT成像作为一种功能成像手段,除常规的图像特征外,还可提供基于能谱曲线、有效原子序数、碘图等的多种定量参数[18],对于组织碘含量的测定能有效反映局部组织的血流灌注情况[19],而DWI及其定量参数ADC值能够无创反映组织中水分子的扩散状态,KRAS基因突变与血管内皮生长因子和组织因子活性具有相关性,即与肿瘤内更丰富的血管生成和血管旁结构有关[20- 21],为本研究的理论基础。目前多项研究显示能谱CT、ADC参数与结直肠癌KRAS基因突变具有相关性[6,10,22- 23]。本研究以AUC值作为标准对比两种成像方式对直肠癌KRAS基因突变的诊断效能,显示静脉期能谱参数NIC与DWI参数aADC值、rADC诊断效能相近,其中rADC的诊断效能较能谱参数更高。静脉期能谱参数较动脉期、延迟期诊断效能更好,这与Cao等[6]研究认为动脉期参数诊断效能最佳的结论有较大差异,分析原因认为在静脉期碘值摄取及分布更加充分、均匀,更能全面反映病灶的整体情况。此外,在Ⅲ期直肠癌中的事后分析结果显示,LTL和aADC在Ⅲ期直肠癌中差异有统计学意义,突变组LTL[5.05(2.27)]、aADC[0.818(0.072)]均低于野生组[6.00(2.50)、0.876(0.099)],KRAS基因突变的肿瘤进展更倾向息肉状的生长模式[24],但ATL并未显示出差异,这可能与肿瘤的检查前灌肠准备不足有关。而aADC在Ⅲ期直肠癌中的趋势符合本研究的主要结果。本研究表明尽管双能CT和ADC参数在预测直肠癌KRAS基因突变方面效能相近,但后者对于避免辐射损伤和造影剂过敏方面更具优势。
本研究存在一定的局限性:(1)本研究样本量较小,部分指标如SRV、ATL/LTL、动脉期碘值及标准化碘浓度值等在以往研究中得到验证,但本研究未显示与直肠癌KRAS基因突变具有相关性,或与本研究样本量较小有关,抑或是既往研究将结直肠癌作为整体进行研究而未对亚组分别进行相关性分析的原因;(2)本研究仅基于肿瘤最大层面水平的二维图像,不足以反映肿瘤总体的异质性,进一步使用三维图像的研究或许能取得更好的结果;(3)由于本研究的数据主要分布在Ⅲ期直肠癌,进一步扩充样本量根据T分期进行分层分析可能会更有优势;(4)本研究作为回顾性研究,入组患者存在不可避免的选择性偏倚,这有可能影响诊断效能。
综上,本研究探讨了术前临床指标如性别、年龄及肿瘤标志物与影像学指标如肿瘤分段、SRV、ATL/LTL、双能CT及MRI定量参数对直肠癌KRAS基因突变的诊断效能,综合各指标考虑,笔者认为MRI定量参数rADC较能谱参数及其他临床指标在术前无创评估直肠癌KRAS基因突变方面更有优势,但直肠癌的临床关键问题如远处转移瘤的筛查等还需要其他影像学检查方式的参与。因此,对于影像学定量参数对直肠癌的术前评估体系的作用仍需要进一步研究。

