艾芬地尔对脑缺血再灌注大鼠脑细胞NR2B亚基表达的影响及脑保护作用
李振宇,王天栋,李作鹏,张 金
急性缺血性脑卒中(acute ischemic stroke,AIS)是人类致残、致死的主要病因之一。随着医疗技术的进步,静脉溶栓与机械取栓已广泛应用于临床,脑血流再通率显著提高[1]。研究显示,静脉溶栓桥接机械取栓脑血管再通率可达88%[2]。然而,血流再通后所致的缺血再灌注损伤(ischemia reperfusion injury,IRI)可加重神经细胞坏死[3]。所以,再灌注后的神经保护非常关键。
NR2B为N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)的亚基之一,此亚基通常表达于海马、丘脑与前脑皮层等区域的神经细胞突触外细胞膜。正常情况下,此亚基会结合谷氨酸(glutamate,Glu),使NMDAR活化,从而使神经细胞得以维持正常机能。若出现脑缺血与再灌注,Glu过量积聚使NMDAR过表达,从而引起一系列致细胞坏死或凋亡过程即兴奋性氨基酸(excitatory amino acid,EAA)毒性作用[4]。艾芬地尔(Ifenprodil)是一类高选择性NMDAR阻滞剂,对过度激活的NMDAR具有抑制作用,使其生成的兴奋性毒性下降,释放神经保护效能[5]。本研究探讨艾芬地尔对脑缺血再灌注后各阶段NR2B亚基表达状况的影响与脑保护作用。
1 材料与方法
1.1 实验动物 清洁级雄性SD大鼠67只,9~11周龄,体质量250~310 g,由山西医科大学动物实验中心提供,实验动物生产许可证:SCXK(晋)2019-0004。于屏蔽环境实验室进行实验,湿度40%~55%,温度22~26 ℃,明暗光照12 h/12 h。
1.2 实验试剂及材料 ①艾芬地尔(上海陶素公司生产),将25 mg 艾芬地尔溶于0.1 L生理盐水中制成艾芬地尔溶液;②兔抗大鼠NMDAR-NR2B多抗由北京博奥森公司生产;③SABC-POD[兔免疫球蛋白G(IgG)]试剂盒(即用型)、羊抗兔IgG(由生物素标记)由武汉博士德公司生产;④2,3,5氯化三苯基四氮唑(TTC)(北京索莱宝公司生产),将5 g TTC溶于250 mL的0.4%磷酸缓冲盐溶液(PBS)中得到2%的TTC溶液;⑤鱼线(威海汉鼎鱼具公司生产,规格:0.26 mm),将0.26 mm型号鱼线制成4.5 cm长,分别于2 cm、3 cm处做标记,头端加热至尖端圆润,并涂以硅胶,风干24 h备用。
1.3 实验分组 采用随机数字表法将大鼠分为假手术组、艾芬地尔 1 h组、艾芬地尔 2 h组、艾芬地尔 3 h组、对照1 h组、对照2 h组、对照3 h组。除假手术组7只大鼠外,剩余每组10只大鼠。若造模未成功,则补齐各组数量。
1.4 模型制备及给药 把大鼠置于屏蔽实验室内,适应性饲养5~7 d。建模前1 d禁食,无需禁水。借助线栓法完成大鼠大脑中动脉缺血再灌注损伤模型的构建:称重后用10%的水合氯醛30 mg/100 g腹腔麻醉。切开颈中线偏左3 mm区域皮肤,分离筋膜及肌肉,暴露迷走神经、颈总动脉(CCA)及分支血管,在颈总动脉近心端(距分叉部位约1.2 cm处)用3-0号线进行结扎,CCA远心端、颈外动脉(ECA)近心端分别备一缝合线,借助显微血管夹将颈内动脉(ICA)血流阻断,在CCA(距分叉部位约1 cm处)剪一切口,通过切口把线栓插至ICA血管夹部位,结扎CCA备线,将显微血管夹打开,顺势缓慢匀速送入线栓,到达大脑中动脉处可感受到阻力,插入深度为(18.5±0.5)mm。艾芬地尔 1 h、艾芬地尔2 h、艾芬地尔3 h组动物再灌注0.5 h前[6]均腹腔注入2 mg/kg 艾芬地尔,对照组注入等量生理盐水,假手术组不进行处理;再灌注时剪开ECA及CCA远心端结扎线栓,在CCA远心端再次打1个松结,待撤出线栓,马上扎紧松结;缝合皮肤;假手术组则分离CCA与分支血管,只需对CCA进行结扎。
1.5 检测方法
1.5.1 神经功能缺损评分 参照Chang等[7]的评估标准对大鼠缺血再灌注损伤后1 d的神经功能缺损情况进行评分。其中,未见症状计0分;躯干向栓塞对侧弯曲、栓塞对侧前肢屈曲计1分;能够向两侧行走,将尾部提起使其悬空,可朝栓塞对侧打转计2分;向栓塞对侧行走划圈计3分;行走费力或无法行走计4分。将得分1~4分的动物作为入组对象,剔除昏迷大鼠。
1.5.2 梗死体积测定 缺血再灌注1 d后,随机从艾芬地尔 1 h组、艾芬地尔 2 h组、艾芬地尔 3 h组、对照1 h组、对照2 h组、对照3 h组中选取4只大鼠,10%的水合氯醛麻醉后断头法处死,取出脑部组织,用生理盐水冲洗后立即置入-20 ℃冰箱15~20 min,以2.5 mm为厚度冠状切脑组织,共计5片。将脑组织切片放入2%的TTC溶液中,37 ℃避光孵育40 min(每10 min翻面1次)后摄像,采用Image Pro-Plus 6.0软件计算梗死区体积。
1.5.3 免疫组织化学染色法检测NR2B亚基表达 制作脑组织石蜡切片并进行免疫组织化学染色(immunohistochemistry,IHC):脱蜡;内源性过氧化物酶(PO)灭活;抗原修复;封闭;一抗孵育,滴加稀释比为1∶100的一抗,4 ℃下作用10~12 h,37 ℃复温0.5 h,PBS溶液(酸碱度7.2~7.6)冲洗3遍,每遍5 min;二抗孵育,滴加羊抗兔IgG,37 ℃下孵育0.5 h后PBS溶液(酸碱度7.2~7.6)冲洗3遍,每遍5 min;SABC孵育;显色;复染;封片。置高倍显微镜下观察结果并拍照,采用Image Pro-Plus 6.0软件进行数据处理。

2 结 果
2.1 各组神经功能缺损评分比较 假手术组未见神经功能缺损为0分。艾芬地尔 1 h组神经功能缺损评分低于对照1 h组,艾芬地尔 2 h组神经功能缺损评分低于对照2 h组,差异均有统计学意义(P<0.05);艾芬地尔3 h组与对照3 h组神经功能缺损评分比较,差异无统计学意义(P>0.05)。说明早期应用艾芬地尔可使脑缺血再灌注损伤后神经功能缺损得到明显改善。详见表1。
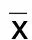
表1 各组神经功能缺损评分比较(±s) 单位:分
2.2 各组脑梗死体积比较 假手术组未见梗死病灶。艾芬地尔 1 h组脑梗死体积小于对照1 h组、艾芬地尔 2 h组脑梗死体积小于对照2 h组,差异均有统计学意义(P<0.05);艾芬地尔3 h组与对照3 h组脑梗死体积比较,差异无统计学意义(P>0.05)。详见表2、图1。
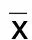
表2 各组脑梗死体积比较(±s) 单位:%

图1 各组脑梗死情况
2.3 各组NR2B亚基阳性表达比较 各组动物额叶皮层细胞浆、细胞膜中均可见NR2B亚基表达。艾芬地尔1 h组、艾芬地尔2 h组、艾芬地尔3 h组NR2B亚基表达呈上升趋势,各组间比较,差异均有统计学意义(P<0.05);对照1 h组、对照2 h组、对照3 h组NR2B亚基表达呈上升趋势,各组间比较,差异均有统计学意义(P<0.05)。与假手术组比较,对照1 h组与艾芬地尔 1 h组NR2B亚基表达水平较低,差异有统计学意义(P<0.01);对照3 h组NR2B亚基表达水平较高,差异有统计学意义(P<0.05)。艾芬地尔 1 h组比对照1 h组NR2B亚基表达水平低、艾芬地尔 2 h组比对照2 h组NR2B亚基表达水平低、艾芬地尔 3 h组比对照3 h组NR2B亚基表达水平低,差异均有统计学意义(P<0.05)。详见表3、图2。
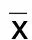
表3 各组NR2B亚基阳性表达比较(±s)

图2 各组NR2B亚基阳性表达免疫组化染色(×400)
3 讨 论
在医疗技术发展下,急性缺血性脑卒中血管再通率大幅提升。然而,缺血再灌注损伤却会使脑组织遭受第二次打击。在当前治疗脑缺血方面,最优方案为脑血流再通和神经保护的联合[8]。缺血后NMDAR介导的兴奋性氨基酸(EAA)毒性效应是细胞凋亡、坏死的关键因素[9]。缺血后脑细胞功能受损导致大量谷氨酸在细胞周围蓄积,使NMDAR过度活化,引起毒性效应。NMDAR在神经元促生存和促死亡信号通路中有双重作用,非选择性拮抗NMDAR,不仅能使生存信号途径受抑,还可使神经细胞受损,引发重度不良反应[10]。因此,更好的选择是单独阻断NMDAR的促死亡效应,而保留促生存通路[11]。实验证实,由NMDAR引起的兴奋性毒性作用主要由含NR2B亚基的NMDAR过度激活导致[12],此类受体活化会导致细胞内钙超载,钙离子大量蓄积,激活一氧化氮合酶、磷脂酶A2、核酸内切酶,损伤细胞。此外,NR2B亚基同时能够使下游促死亡信号途径活化,造成细胞凋亡[13]。故选择性NR2B受体拮抗剂是副作用更小、更有效的神经保护药物。
艾芬地尔属于选择性NR2B受体拮抗剂,其分子量达400.49,能够与NR2B亚基上多胺位点结合,抑制后者的变构调节作用,从而削弱NMDAR(内含NR2B亚基)活性[14-15]。研究显示,艾芬地尔可使脑缺血损伤中EAA毒性效应减弱、减小梗死体积、缓解脑水肿,发挥脑保护效能[16-17]。但是,Araki等[17]研究大鼠全脑缺血模型的结果显示,艾芬地尔无脑保护功能。故艾芬地尔治疗脑缺血损伤的结果缺乏统一性,其脑保护功能尚需通过更为广泛的研究来明确。虽然艾芬地尔作为神经保护药物仍存在争议,但既往发表的文章多应用在永久性缺血模型,缺血再灌注后的意义仍有待评估,且具体的作用机制不是很明确,因此,本研究探讨了艾芬地尔在缺血再灌注大鼠模型中对NR2B亚基表达研究。
研究显示,兴奋性氨基酸Glu在损伤后立即触发兴奋性毒性,但在损伤后不久则开始促进神经修复,与其兴奋毒性作用相比,Glu介导的神经保护作用更为持久[18]。研究发现,既往发表的研究中病人入组的时间较长,缺血半暗带几乎消失,常导致阴性结果或显示出过多的副作用[19]。本研究结果显示,大鼠脑缺血后神经机能明显受损,分别对比艾芬地尔 1 h组、艾芬地尔 2 h组和对照1 h组、对照2 h组发现,大鼠神经缺损评分减少、梗死体积减小,但对比艾芬地尔 3 h组、对照3 h组发现神经功能缺损评分、梗死体积皆未见明显不同,可见艾芬地尔可于脑缺血早期再灌注后抑制神经功能损伤,减小脑梗死体积,若梗死时间较长,则对神经功能缺损与梗死体积无帮助。
Zhang等[20]研究发现,鞘内注射艾芬地尔能够使大鼠背根神经节(DRG)压迫模型内脊髓NR2B亚基表达量大幅下调,故判断艾芬地尔除了可阻断脑神经细胞NR2B亚基,还可能对NR2B亚基表达具有抑制作用;该研究还发现,艾芬地尔能够于缺血早期(2 h内)再灌注后下调NR2B表达,产生脑保护效能,在缺血时间增加的情况下,其虽然能够继续抑制NR2B表达,却未见脑保护效能[21]。本研究结果显示,对照1 h组与假手术组比较,再灌注后NR2B亚基明显减少,此结果在艾芬地尔组更具显著性,在NR2B亚基表达上,对照3 h组较假手术组偏高,判断脑缺血早期血管再通后艾芬地尔的应用可能会改善预后。
综上所述,艾芬地尔能够于脑缺血初期再灌注后改善缺血再灌注损伤。艾芬地尔不仅对NR2B受体具有拮抗作用,还能够在脑缺血早期下调NR2B受体表达,从而削弱此亚基介导的兴奋性氨基酸毒性效应,发挥神经保护作用。但其具体作用机制尚需通过更为深入的研究来明确。

