益气消毒方对炎症性贫血模型大鼠造血功能的影响
徐丽萍 宋欣伟 戴巧定 关天容 张艳 蔺娜 王吉安
浙江中医药大学附属第一医院 杭州 310006
炎症性贫血(anemia of inflammation,AI)广泛存在于类风湿关节炎(rheumatoid arthritis,RA)患者中,我国RA患者贫血发生率高达51.40%~72.06%[1]。研究表明,RA伴AI患者疾病活动度更高,躯体功能更差,达到缓解的比例更低,治疗花费更高,且贫血越严重,影像学进展越快[2-3],治疗难度更大,预后更差[4]。白细胞介素-6(interleukin-6,IL-6)在RA伴贫血的机制中发挥核心作用[5-6],一方面通过促进滑膜细胞增殖、破骨细胞激活、类风湿因子等自身抗体生成等多种途径,导致或加重RA;另一方面还能够刺激肝细胞释放铁调素(hepcidin),铁调素可抑制网状内皮组织区域巨噬细胞内铁的释放、十二指肠上皮细胞对铁的吸收,以及骨髓红系祖细胞对铁的利用,从而导致贫血[7]。目前针对RA伴AI患者,多以糖皮质激素、IL-6受体阻断剂托珠单抗为主要治疗手段,但前者不良反应大,后者价格昂贵[8-10]。中医药纠正贫血有效低毒,具一定优势,益气消毒方(Yiqi Xiaodu prescription,YQXD)系宋欣伟全国名老中医传承工作室的常用经验方,用于辅助治疗自身免疫性血细胞减少效果良好。前期临床研究证实,该方能够显著提高自身免疫性疾病患者外周血细胞计数[11],但作用机制尚未明确。基于此,本研究以胶原诱导型关节炎伴炎症性贫血(collagen-induced arthritis with anemia of inflammation,CIA-AI)大鼠模型为对象,探究YQXD纠正AI的相关机制,以期为临床推广提供依据。
1 材料和方法
1.1 动物 无特殊病原体(specific pathogen free,SPF)级健康雄性Wistar大鼠40只,5周龄,体质量(150±10)g,由浙江中医药大学动物实验中心提供[实验动物使用许可证号:SYXK(浙)2021-0012],实验程序均按照中国科学技术部制定的“实验动物护理和使用指导意见”进行(批准编号:IACUC-2021115-13)。大鼠饲养于22℃的恒温环境,昼夜周期各12 h,使用标准饲料并每周称取体质量。
1.2 实验仪器 BX51T-PHD-J11型显微镜购于日本奥林巴斯公司;RM2016型切片机购于德国莱卡公司;MEK-6400C型全自动血细胞分析仪购于日本SYSMEX有限公司;AE100型电子天平购于瑞士METTER公司;MDF-382E型低温冰箱为日本三洋公司产品。
1.3 药物与试剂 YQXD由浙江中医药大学附属第一医院中药房提供,临床60 kg成人每日剂量为党参20 g,白术12 g,茯苓15 g,水牛角30 g,金银花15 g,连翘12 g,牡丹皮10 g,全蝎3 g,蜈蚣3 g,蕲蛇3 g,按照临床等效剂量换算公式[12],换算得出动物等效剂量即YQXD低剂量13.4 g/(kg·d),2倍使用剂量即中剂量26.8 g/(kg·d),4倍使用剂量即高剂量53.6 g/(kg·d)。由医院制剂室配置成颗粒剂,临用前用蒸馏水配置成相应浓度的混悬液。注射用人IL-6购于美国PeproTech公司(批号:200-06-20);大鼠IL-6、铁蛋白(ferritin)和hepcidin酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒均购于江苏晶美生物科技有限公司 (批号:ELK1158、ELK3783、ELK8206);血清铁(Fe)测定试剂盒购于南京建成生物工程研究所(批号:A039-1-1);伊红(hematoxylin,H)、苏木素(eosin,E)染液均购于上海华蓝生物科技公司(批号:17372-87-1、517-28-2)。
1.4 方法
1.4.1 动物分组与给药
1.4.1.1 动物分组 适应性饲养1周后,随机预留5只大鼠为正常组,另35只参照文献[13]方法制备CIA大鼠模型。具体造模方法:大鼠尾部皮下注射牛Ⅱ型胶原与完全弗氏佐剂的混合乳剂0.2 mL/只,并于第7天注射牛Ⅱ型胶原与不完全弗氏佐剂的混合乳剂0.1 mL/只,进行二次免疫。关节炎指数≥1分,表示造模成功。关节炎指数评分标准:0分:无发红、肿胀;1分:踝关节或膝关节轻度发红、肿胀;2分:踝关节或膝关节重度发红、肿胀;3分:整个脚掌包括趾端严重发红、肿胀;4分:不能负重。造模成功的25只CIA大鼠,连续7 d腹腔注射0.1 μg·mL-1的IL-6溶液0.4 mL,诱导CIA-AI模型。造模后第7天以血球计数器进行大鼠外周血红细胞(red blood cell,RBC)计数,以确定造模是否成功,RBC<7.8×1012/L表示造模成功[14-15]。 将造模成功的20只大鼠按随机数字表法分成4组:模型组及YQXD低、中、高剂量组,每组各5只。
1.4.1.2 给药方式 YQXD低剂量组大鼠予临床等效剂量(35 mg·mL-1),中剂量组予2倍等效剂量(70 mg·mL-1);高剂量组予4倍等效剂量(140 mg·mL-1),正常组及模型组每日分别予注射用水灌胃,各组灌胃均为2 mL,持续2周。
1.4.2 样本采集 大鼠末次给药1 h后,0.3%戊巴比妥钠(30 mg·kg-1)腹腔注射麻醉,腹主动脉取血1 mL,抗凝待用,另取4 mL全血于促凝管中,3 000 r·min-1离心15 min,取血清-20℃保存待用。分离肝脏并称质量,另外将右侧股骨保存于4%的多聚甲醛中,固定待用。
1.4.3 脏器指数测定 取上述分离的肝脏和单侧完整股骨,称定质量并计算脏器指数,脏器指数(mg·g-1)=脏器质量(mg)/动物体质量(g)。 测定完成后剪取每份肝脏组织100 mg左右,制备组织匀浆,-20℃保存待用。
1.4.4 全自动血细胞分析仪检测外周血细胞水平取上述抗凝管中的全血,采用全自动血细胞分析仪,检测外周血细胞水平,包括外周血中白细胞(white blood cell,WBC)、RBC、血小板(platelet,PLT)计数,以及HGB、平均红细胞体积(mean red blood cell volume,MCV)水平。
1.4.5 苏木素-伊红(hematoxylin-eosin,HE)染色检测股骨骨髓病理形态学变化 取浸泡于固定液中的完整股骨,4℃下存放15 d后,常规石蜡包埋后切片,将厚度3~5 μm的组织切片附于多聚赖氨酸附膜的载玻片上,60℃过夜,HE染色,光镜下观察骨髓细胞形态结构变化。
1.4.6 ELISA检测血清与肝组织匀浆IL-6、铁蛋白、hepcidin水平 取冻存的血清与肝组织匀浆样本,按照ELISA试剂盒说明书,检测各组大鼠血清与肝组织匀浆中IL-6、铁蛋白和hepcidin水平。
1.4.7 比色法测定血清与肝组织匀浆中铁水平 取冻存的血清与肝组织匀浆样本,按照血清铁测定试剂盒说明书,检测各组大鼠血清与肝组织匀浆中的铁水平。
1.5 统计学分析 采用SPSS 25.0统计软件进行统计学分析,计量资料以±s表示,组间比较采用单因素方差分析,若方差不齐,用Dunnett's T3检验,两两比较采用最小显著性差异法(least-significant difference,LSD)检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠脏器指数比较 与正常组比较,模型组大鼠肝脏指数升高(P<0.05);与模型组比较,YQXD高剂量组肝脏指数下降(P<0.05),低、中剂量组肝脏指数差异无统计学意义(P>0.05)。与正常组比较,模型组大鼠的单侧股骨指数显著下降(P<0.01);与模型组比较,YQXD低、中、高剂量组单侧股骨指数上升(P<0.05,P<0.01),并呈剂量相关性。 见表1。
表1 各组大鼠脏器指数比较Tab.1 Comparison of organs index in each group (±s, mg·g-1)

表1 各组大鼠脏器指数比较Tab.1 Comparison of organs index in each group (±s, mg·g-1)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01。Note:Compared with normal group, *P<0.05, **P<0.01;compared with model group, ▲P<0.05,▲▲P<0.01.
组别 肝脏指数 单侧股骨指数正常组 0.0345±0.00071 0.665±0.021模型组 0.0360±0.00081* 0.618±0.062**YQXD 低剂量组 0.0355±0.00071 0.635±0.007▲YQXD 中剂量组 0.0355±0.00212 0.645±0.021▲YQXD高剂量组 0.0345±0.00071▲ 0.655±0.021▲▲
2.2 各组大鼠外周血细胞比较 与正常组比较,模型组WBC、RBC计数和HGB水平均明显下降(P<0.01),但PLT、MCV差异无统计学意义(P>0.05)。 与模型组比较,YQXD干预后WBC、RBC和HGB水平出现剂量依赖式升高(P<0.05,P<0.01),PLT和MCV差异无统计学意义(P>0.05)。 见表2。
表2 各组大鼠外周血细胞比较Tab.2 Comparison of peripheral blood cells in each group (±s)
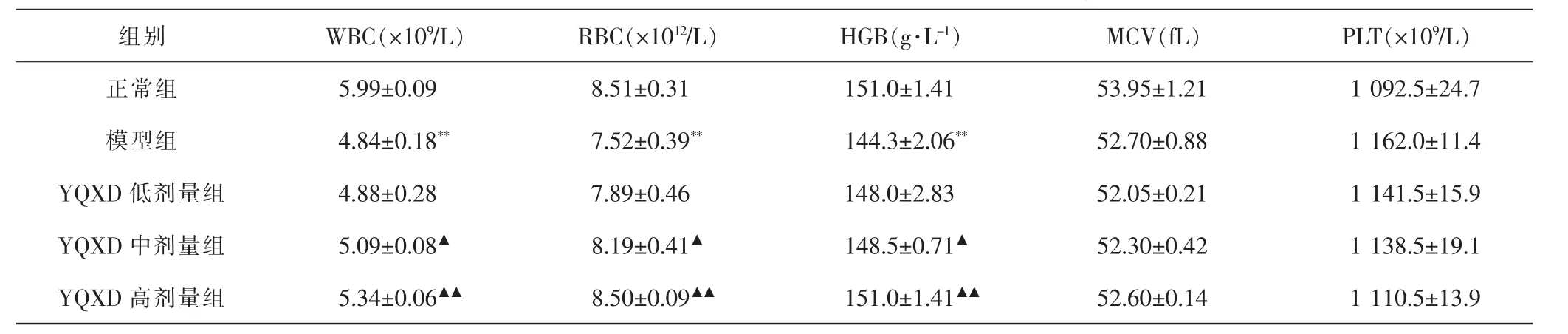
表2 各组大鼠外周血细胞比较Tab.2 Comparison of peripheral blood cells in each group (±s)
注:与正常组比较, **P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01。Note:Compared with normal group, **P<0.01;compared with model group, ▲P<0.05,▲▲P<0.01.
组别 WBC(×109/L) RBC(×1012/L) HGB(g·L-1) MCV(fL) PLT(×109/L)正常组 5.99±0.09 8.51±0.31 151.0±1.41 53.95±1.21 1 092.5±24.7模型组 4.84±0.18** 7.52±0.39** 144.3±2.06** 52.70±0.88 1 162.0±11.4 YQXD 低剂量组 4.88±0.28 7.89±0.46 148.0±2.83 52.05±0.21 1 141.5±15.9 YQXD 中剂量组 5.09±0.08▲ 8.19±0.41▲ 148.5±0.71▲ 52.30±0.42 1 138.5±19.1 YQXD 高剂量组 5.34±0.06▲▲ 8.50±0.09▲▲ 151.0±1.41▲▲ 52.60±0.14 1 110.5±13.9
2.3 各组大鼠股骨骨髓病理形态学比较 正常组大鼠股骨骨膜、髓腔和软骨组织结构清晰,髓腔内可见丰富的细胞成分(粒细胞、巨核细胞、有核细胞等),未见脂肪细胞和纤维组织。模型组粒细胞和巨核细胞减少,髓腔内充填水肿的血管纤维脂肪组织。与模型组比较,YQXD各剂量组骨髓造血情况逐渐改善,髓腔内脂肪细胞逐渐减少。见图1。

图1 各组大鼠股骨骨髓病理形态学(HE染色,100×)Fig.1 Pathological morphology of femoral bone marrow in each group(HE stain, 100×)
2.4 各组大鼠血清及肝组织匀浆IL-6、铁蛋白、hepcidin水平比较 与正常组比较,模型组大鼠血清及肝组织匀浆中IL-6、铁蛋白、hepcidin水平显著升高(P<0.01)。与模型组比较,YQXD高剂量组大鼠血清及肝组织匀浆中IL-6、铁蛋白、hepcidin水平明显降低(P<0.05),中、低剂量组差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠血清及肝组织匀浆IL-6、铁蛋白、hepcidin水平比较Tab.3 Comparison of IL-6, ferritin and hepcidin levels in serum and liver tissue homogenate in each group (±s)
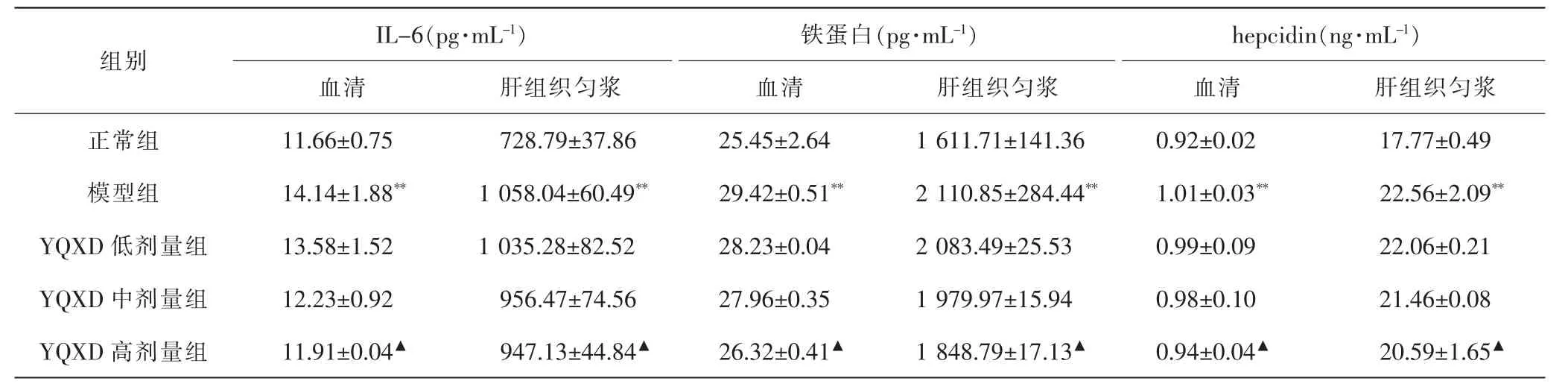
表3 各组大鼠血清及肝组织匀浆IL-6、铁蛋白、hepcidin水平比较Tab.3 Comparison of IL-6, ferritin and hepcidin levels in serum and liver tissue homogenate in each group (±s)
注:与正常组比较, **P<0.01;与模型组比较,▲P<0.05。Note:Compared with normal group, **P<0.01;compared with model group, ▲P<0.05.
I L-6(p g·m L-1) 铁蛋白(p g·m L-1) h e p c i d i n(n g·m L-1)血清 肝组织匀浆 血清 肝组织匀浆 血清 肝组织匀浆正常组 1 1.6 6±0.7 5 7 2 8.7 9±3 7.8 6 2 5.4 5±2.6 4 1 6 1 1.7 1±1 4 1.3 6 0.9 2±0.0 2 1 7.7 7±0.4 9模型组 1 4.1 4±1.8 8** 1 0 5 8.0 4±6 0.4 9** 2 9.4 2±0.5 1** 2 1 1 0.8 5±2 8 4.4 4** 1.0 1±0.0 3** 2 2.5 6±2.0 9**Y Q X D 低剂量组 1 3.5 8±1.5 2 1 0 3 5.2 8±8 2.5 2 2 8.2 3±0.0 4 2 0 8 3.4 9±2 5.5 3 0.9 9±0.0 9 2 2.0 6±0.2 1 Y Q X D 中剂量组 1 2.2 3±0.9 2 9 5 6.4 7±7 4.5 6 2 7.9 6±0.3 5 1 9 7 9.9 7±1 5.9 4 0.9 8±0.1 0 2 1.4 6±0.0 8 Y Q X D高剂量组 1 1.9 1±0.0 4▲ 9 4 7.1 3±4 4.8 4▲ 2 6.3 2±0.4 1▲ 1 8 4 8.7 9±1 7.1 3▲ 0.9 4±0.0 4▲ 2 0.5 9±1.6 5▲组别
2.5 各组大鼠血清及肝组织匀浆中铁水平比较 与正常组比较,模型组大鼠血清及肝组织匀浆中铁水平明显降低(P<0.05);与模型组比较,YQXD高剂量组大鼠血清及肝组织匀浆中铁水平显著升高(P<0.01)。 见表4。
表4 各组大鼠血清及肝组织匀浆中铁水平比较Tab.4 Comparison of iron level in serum and liver tissue homogenate in each group (±s, mg·L-1)

表4 各组大鼠血清及肝组织匀浆中铁水平比较Tab.4 Comparison of iron level in serum and liver tissue homogenate in each group (±s, mg·L-1)
注:与正常组比较,*P<0.05;与模型组比较,▲▲P<0.01。Note:Compared with normal group, *P<0.05;compared with model group,▲▲P<0.01.
铁水平血清 肝组织匀浆正常组 2.1 5 6±0.7 9 4 4.0 2 9±3.1 2模型组 1.5 9 3±0.1 4* 3 3.7 3 9±4.1 8*Y Q X D 低剂量组 1.6 1 9±0.1 6 3 4.7 7 3±2.5 2 Y Q X D 中剂量组 1.6 8 6±0.8 9 3 5.8 2 6±4.1 4 Y Q X D 高剂量组 1.7 8 1±0.2 5▲▲ 3 6.8 7 9±3.1 2▲▲组别
3 讨论
贫血影响着全世界1/3的人口[16],而AI是临床常见的贫血类型,不仅给患者造成乏力、疲劳、心功能衰竭等机体功能下降的临床症状,更会加速基础病情发展,增加治疗难度,甚至成为某些疾病的独立死亡因素,RA患者的现状即是如此。理论上只要RA患者关节炎症得到控制,AI的情况就能随即改善,但实际上并非完全如此,非甾体消炎止痛药、免疫抑制剂,以及拮抗肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)类生物制剂,均能不同程度地控制关节炎症,但对贫血的改善效果不够理想;尽管糖皮质激素及IL-6拮抗剂能同时改善部分患者的RA及AI病情,但因药物不良反应、价格等各种影响因素,临床长期使用受到限制。
贫血属中医虚劳之血虚范畴,中医认为其根本病机是脾肾亏虚,病位在髓,治疗上需运用血肉有情之品以补益脾肾,阴阳同补,促进气血恢复[17-18],但临床实践发现上述治疗对于AI收效甚微。YQXD系宋欣伟全国名老中医传承工作室最常用的有效经验方,用于辅助治疗自身免疫性血细胞减少。宋师基于“久病入络”理论,认为免疫性血细胞减少症的发生与瘀毒浸润骨髓之络(即现代医学的骨髓微环境)有关,瘀毒有先天、后天之分,先天瘀毒即禀赋不足,基因缺陷带来的病理改变;后天瘀毒,即免疫异常介导的各类免疫细胞过度分泌的炎症因子带来的病理改变。团队针对先天不足、后天瘀毒入络的病机,拟定了YQXD,方中以健脾益气之黄芪、党参、白术为基础,具有培补后天之本的功效,辅以水牛角、金银花、连翘、牡丹皮清热凉血解毒,全蝎、蜈蚣、蕲蛇等虫类药搜风通络、攻毒散结,共奏益气消毒、搜剔髓络、刺激造血之效。前期研究发现,YQXD治疗干燥综合征引起的白细胞减少具有显著疗效,提示其治疗结缔组织病血液系统受累的有效性[11],同时临床也观察到YQXD治疗RA合并AI患者的疗效确切,但其机制未明。
目前,以多次多点注射Ⅱ型胶原和(或)完全弗氏佐剂的方式,建立AI动物模型较为多见[19-21],本研究在CIA模型基础上联合腹腔注射IL-6,建立CIA-AI模型大鼠,更符合临床实际。造模成功后的大鼠呈正细胞正色素性贫血,血清铁水平降低,铁蛋白、炎症因子IL-6以及hepcidin水平升高,脏器指数、骨髓造血功能亦有显著下降,而YQXD干预后,上述指标有不同程度的改善,提示YQXD纠正RA患者AI的作用机制涉及IL-6、hepcidin等核心因子。 见图2。

图2 YQXD纠正CIA-AI模型大鼠贫血的作用机制假设Fig.2 Hypothesis on the mechanism of YQXD in relieving anemia in CIA-AI model rats
骨髓是机体主要造血组织,其造血功能受多种信号通路因子调控,其中IL-6、hepcidin占据主导地位[5、7]。IL-6是一种多效细胞因子,具有促进骨髓造血干细胞增殖、分化的作用,主要由巨噬细胞、T淋巴细胞和B淋巴细胞产生。RA等慢性炎症状态下,机体免疫细胞分泌更多的IL-6,后者刺激肝细胞释放hepcidin,一方面抑制巨噬细胞内铁的释放,以及十二指肠上皮细胞对铁的吸收;另一方面阻碍骨髓红系祖细胞对铁的利用。本研究中,经腹腔注射IL-6的模型组大鼠,其贫血情况更严重,血清及肝组织匀浆中IL-6、hepcidin、铁蛋白水平显著升高,而铁水平明显下降,此外骨髓组织中粒细胞和巨核细胞明显减少,髓腔内充填着大量水肿的血管纤维脂肪组织,证实了IL-6在RA伴贫血发病机制中的核心作用。同时,本研究还证实了YQXD能不同程度修复慢性关节炎大鼠的骨髓病理损伤,减少骨髓内增生的脂肪细胞,增加造血细胞数量,但低剂量YQXD效果尚不理想。本研究探讨了YQXD免疫调节作用的机制,为临床治疗AI提供一定的理论基础。但是,该研究仅集中于骨髓造血细胞和免疫相关指标,而其他相关指标需要进一步研究阐明。

