双层核壳结构Al/PVDF/MO亚稳态分子间复合物的制备、表征及其热反应特性研究
姜一帆,于宪峰,李 辉,李 娜,张建侃,蒋周峰,张 明,李瑞勤,戴亚堂,赵凤起
(1.西安近代化学研究所 燃烧与爆炸技术重点实验室,陕西 西安 710065;2.中国人民解放军63961部队,北京 100012;3.西南科技大学 环境友好能源材料国家重点实验室,四川 绵阳 621010)
引 言
铝粉作为一种金属燃料,具有能量密度高、热反应性能好、储量高、成本低等优点,常被用来提高火炸药配方的能量与武器装备的毁伤威力[1-3]。微米铝粉具有活性铝含量高、单位质量和体积热值高、配方和工艺适应性好等优点,已被成功应用于高威力炸药与高能固体推进剂[4-6]。然而,微米铝粉的点火温度较高,热反应效率低,在炸药配方中燃烧缓慢且易导致含铝炸药长贮性能下降,在含铝高能推进剂燃烧过程中易形成铝凝团,导致能量无法完全释放,这些都严重制约了火炸药配方性能的提升及微米铝粉的进一步应用[7-11]。为了提高微米铝粉的热反应速率及能量利用率,防止铝粉氧化,改善含铝火炸药的长贮性能,国内外研究工作者开展了大量的研究工作,发现铝粉表面包覆改性是提升铝粉性能的有效手段之一,并取得了较好的使用效果[12-14]。
针对微米铝粉点火延迟高、热反应速率慢、燃烧效率不高及燃烧过程中产生铝凝团等方面的缺点,使用氟聚物包覆铝粉是一种有效的解决途径。氟聚物具有较好的力学性能、抗氧化性、耐热性及耐腐蚀性,包覆铝粉后不仅能够有效抑制铝粉氧化,保持铝粉反应活性,改善贮存性能;而且能够提升体系能量释放,促进铝粉燃烧速率和燃烧效率的提升[15]。研究表明,铝-氟聚物具有更好的燃烧反应性能,一方面,氟聚物可以与铝粉表面的Al2O3反应,使铝粉发生破壳燃烧,进而大幅提升铝粉的反应活性,使其释能更加完全;另一方面,Al与F反应的放热量(56.1kJ/g)大约是Al与O反应放热量(31.0kJ/g)的两倍,氟聚物可以与Al反应生成AlF3,同时放出大量的热[15-16]。此外,用氟聚物包覆铝粉能够有效降低含铝火炸药配方的点火温度,增加放气量,并有效改善铝粉团聚的问题[17-19]。聚偏氟乙烯(PVDF)是最常用的氟聚物和氧化剂之一,具有良好的机械性能、热稳定性、溶解性和强氧化性。Ke等[20]用溶剂/非溶剂法制备了Al/PVDF复合材料,与铝粉相比,Al/PVDF具有更好的疏水性、抗老化性、耐腐蚀性和反应放热性;Yang等[21]用静电喷雾法制备了核壳结构的Al@PVDF复合材料,由于Al@PVDF核壳结构中燃料和氧化剂紧密而充分地接触,使Al@PVDF复合材料获得了更好的燃烧性能。过渡金属氧化物(如CuO、NiO等)在含铝高能固体推进剂配方体系中不仅可以充当氧化剂,与Al发生铝热反应,而且能够催化推进剂氧化性组分(AP、GAP等)的燃烧分解反应,进而提高推进剂的燃烧性能,改善弹道性能,有效调节复合推进剂的燃速与压强指数[22-27];Lyu等[28]用静电纺丝法制备了Al/CuO/PVDF复合材料,该材料与物理混合物相比拥有更好的抗氧化能力,此外,添加少量的氧化石墨烯能大幅提升复合材料的密度和反应热等性能;He等[29]制备了核壳结构nAl@PDA@CuO MIC,研究结果表明由于Al核与CuO壳层实现了纳米尺度上的紧密接触,使nAl@PDA@CuO与传统MIC材料相比具有更高的初始反应温度(528.4℃),更大的氧化放热量(2934.8J/g),更低的燃烧温度(1606℃)和更高的燃烧效率。
综上所述,在铝粉表面包覆有机氟聚合物,一方面可以有效抑制铝粉氧化,另一方面又能够促进铝粉破壳燃烧,从而提升铝粉的能量释放效率。过渡金属氧化物(CuO、NiO等)在低温阶段能够作为燃烧催化剂,促进推进剂氧化性组分的分解和燃烧;在高温阶段又能够与Al发生铝热反应,促进热量释放,提升推进剂能量水平。因此,为提高微米铝粉释能速率与释能效率,本研究首先设计了溶剂/反溶剂法和低温液相沉淀法,分两步合成了Al/PVDF/NiO和Al/PVDF/CuO亚稳态分子间复合物,然后通过SEM和FIB-SEM分析了MIC材料的形貌特征和双层核壳复合结构特征,通过氧弹量热仪和同步热分析量热仪(TG-DSC)研究了不同MIC材料的热反应特性,完成了对MICs材料的热反应性能及燃烧效率评价,最后通过对比实验和TG-DSC研究了微观结构对MIC材料燃烧性能的影响,以期能进一步提升高能固体推进剂的比冲效率。
1 实 验
1.1 试剂与仪器
铝粉(Al),平均粒径13μm,纯度大于99%,西安航空动力研究所;聚偏氟乙烯(PVDF)、十二烷基硫酸钠(SDS)、尿素、硫酸铜(CuSO4·5H2O)、硫酸镍(NiSO4·6H2O),均为分析纯,纯度均不小于99%,阿拉丁化学试剂有限公司;无水乙醇(纯度≥99.7%)、N,N-二甲基甲酰胺(DMF,纯度≥99.5%),成都市科隆化学品有限公司;浓硫酸(H2SO4),质量分数95.0%~98.0%,四川西陇化工有限公司。
德国IKA磁力搅拌器,艾卡(广州)仪器设备有限公司;HW-5L油浴加热装置及电动搅拌器,西安禾普生物科技有限公司;开启式真空/气氛管式炉,天津中环电炉股份有限公司;D/MAX-2400X型射线粉末衍射仪,日本理学公司;K-Alpha型X射线光电子能谱仪,美国赛默飞公司;Crossbeam 350型聚焦离子束扫描电子显微镜(FIB-SEM),德国蔡司公司; 449 F3型同步热分析(TG-DSC),德国耐驰公司;ZDHW-HN7000C微机自动量热仪,鹤壁市华能电子科技有限公司。
1.2 样品制备
1.2.1 核壳结构Al/PVDF亚稳态分子间复合材料的制备
(1)Al粉表面处理。将平均粒径为13μm的Al粉加入DMF溶剂中,搅拌5min使其均匀分散。配置质量分数为3%的H2SO4溶液,将其倒入Al粉分散液中(DMF与质量分数3% H2SO4溶液的体积比为1∶1),置于通风橱里搅拌反应30min。
(2)Al/PVDF的合成。将PVDF加入DMF溶剂中,PVDF与Al粉的质量比为1∶(10~20),然后油浴加热至50℃,并在该温度条件下搅拌至完全溶解,得到淡黄色透明的PVDF溶液。将Al粉前处理分散液加热至60℃,将配置好的PVDF溶液以17mL/min的速度加入Al粉前处理分散液中,并在60℃条件下搅拌反应4h;待反应结束后自然冷却至室温,静置除去上清液后离心收集沉淀物,蒸馏水和乙醇依次洗3次后冷冻干燥,即得到核壳结构Al/PVDF复合材料。
1.2.2 双层核壳结构Al/PVDF/MO亚稳态分子间复合材料的制备
将制得的Al/PVDF与表面活性剂SDS加入蒸馏水中(SDS与Al/PVDF的质量比为1∶100~150),通过超声、搅拌处理使SDS完全溶解,Al粉在水中均匀分散;加入相应的金属盐(硫酸镍或硫酸铜),其中金属盐与Al/PVDF的质量比为1∶(3~5),搅拌条件下水浴加热升温至80℃。配置尿素水溶液,其中尿素与金属盐的质量比为(3~5)∶1,将配置好的尿素水溶液缓慢滴加入Al/PVDF反应体系中,并在80℃条件下反应3h;待反应结束后自然冷却至室温,静置除去上清液后离心收集沉淀物,用蒸馏水洗涤至中性后冷冻干燥,即得到Al/PVDF/MO前驱体。
将合成的Al/PVDF/MO前驱体装入石英方舟中,并放置在真空管式炉中心位置,在空气条件下,从室温开始,以5℃/min的升温速率加热至300℃后保温2h,反应结束后自然冷却至室温,即得双层核壳结构Al/PVDF/MO亚稳态分子间复合材料。
1.3 结构与形貌表征及性能测试
采用X射线粉末衍射(XRD)、X射线光电子能谱及扫描电子显微镜-元素面分布(SEM Mapping)对制得的Al/PVDF/MO亚稳态分子间复合材料进行组分与结构分析。
采用扫描电子显微镜(SEM)和聚焦离子束扫描电子显微镜(FIB-SEM)对制得样品的微观形貌及微观结构进行分析。
采用同步热分析TG-DSC法对制得的双层核壳结构Al/PVDF/MO亚稳态分子间复合材料及物理混合样品的热反应性能进行测试。测试样品质量为5~10mg,测试气氛为空气,测试温度范围为室温~1500℃,升温速率为20℃/min。
采用氧弹量热法测试双层核壳结构Al/PVDF/MO亚稳态分子间复合材料的燃烧热。测试样品质量为0.2~0.3g,测试气氛为高纯氧气,压力≥3MPa。
2 结果与讨论
2.1 样品组成与结构分析
2.1.1 XRD分析
分别将低温液相法制备的两种双层核壳结构Al/PVDF/MO亚稳态分子间复合材料进行XRD分析,测试结果见图1。

图1 Al/PVDF/NiO和Al/PVDF/CuO的XRD谱图Fig.1 XRD patterns of Al/PVDF/NiO and Al/PVDF/CuO
由图1可知,Al/PVDF/CuO和Al/PVDF/NiO复合物的XRD谱图呈现出相似的特征,所有衍射峰的位置与相对强度和标准卡片(JCPDS No.04-0787)中面心立方结构的Al高度匹配,2θ角为37.65°、43.67°、64.92°、78.55°和83.00°处的衍射峰,分别对应于Al的(1 1 1)、(2 0 0)、(2 2 0)、(3 1 1)和(2 2 2)晶面,没有其他的杂质峰存在,证明PVDF和金属氧化物在包覆过程中没有与Al发生化学反应,主要是以分子间复合物的形式存在,且两个包覆层也没有对Al的晶相和结构产生明显的影响。XRD谱图中没有出现Al2O3的特征衍射峰,证明在液相合成过程中Al并未发生明显的氧化。此外,Al/PVDF/CuO和Al/PVDF/NiO复合物谱图中均未检测到相应氧化物的特征衍射峰,这可能是因为复合物中金属氧化物的含量较少,且在Al颗粒表面均匀分散;也可能是因为包覆的金属氧化物是无定形的,本身没有明显的衍射峰。
2.1.2 XPS分析
利用XPS对Al/PVDF、Al/PVDF/NiO及Al/PVDF/CuO亚稳态分子间复合物进行了表征,结果如图2所示。


图2 Al/PVDF、Al/PVDF/NiO和Al/PVDF/CuO的XPS谱图Fig.2 XPS spectra of Al/PVDF,Al/PVDF/NiO and Al/PVDF/CuO
从图2(a)可以看出,Al/PVDF主要由Al、C、F、O 4种元素构成,证明PVDF成功包覆在铝颗粒的表面,且制得的样品纯度较高。此外,Al/PVDF/NiO样品中还包含Ni和S元素,Al/PVDF/CuO样品中还包含Cu和S元素,其中,金属元素的存在说明金属氧化物成功地包覆在Al/PVDF表面,而S元素则是由于液相合成过程中加入的SDS表面活性剂未去除干净导致的。从图2(b)中可以看到,Al/PVDF在结合能为687.86eV处有一个明显的峰,而Al/PVDF/NiO和Al/PVDF/CuO谱图中也能观测到相应的特征峰,证明复合材料表面均含有PVDF包覆层。与Al/PVDF相比,Al/PVDF/NiO和Al/PVDF/CuO中F 1s的峰值均向较低电子结合能方向发生偏移并伴随有半峰宽的展宽,可能与形成新的氟化物有关,结合能从687.86eV向低结合能方向移动了约1.9~2.5eV,表明包覆金属氧化物前后PVDF聚合链中F所处的化学环境不一致[30]。可能是由于液相合成过程中加入了少量阴离子型表面活性剂SDS,与F产生了静电相互作用,或者是由于金属氧化物包覆层与PVDF间存在相互作用,使得F周围的化学环境发生改变,从而导致F 1s峰位置向电子结合能低的方向移动。由图2(c)可知,位于856.9eV和862.5eV处的两个强峰分别是Ni 2p3/2的主峰和卫星峰,主要是由Ni—O键相互作用产生,证明了Ni2+的存在,而两个位于874.6eV(主峰)和880.7eV(卫星峰)处的峰也是NiO中Ni 2p1/2的特征峰[31]。因此,该包覆层可能是NiO。通过电感耦合等离子体发射光谱法(ICP-OES)测得复合物中Ni的质量分数为1.59%,因此,计算可得复合物中NiO包覆壳层的质量分数为2.02%。由图2(d)可以看到,在934.7eV和954.8eV处有两个明显的主信号峰,它们分别对应于CuO中Cu 2p3/2和Cu 2p1/2态的特征峰[32]。除了主信号峰外,在更高电子结合能(940.3、943.3和961.9eV)处出现了强震动卫星峰,这是Cu2+d轨道部分充满(3d9)的典型特征[33]。总而言之,特征峰位置及震动卫星峰的出现都印证了CuO的生成。采用ICP-OES法测得Al/PVDF/CuO复合物中Cu的质量分数为2.50%,计算得到复合物中CuO包覆壳层的质量分数为3.13%。
2.1.3 SEM及FIB-SEM分析
为了进一步了解铝粉与PVDF、金属氧化物之间的相互复合状态,研究复合材料的微观结构特征,采用扫描电子显微镜对样品进行观察,结果见图3。

图3 13μm Al粉、Al/PVDF、Al/PVDF/NiO和Al/PVDF/CuO的SEM照片 Fig.3 SEM images of 13μm Al,Al/PVDF,Al/PVDF/NiO and Al/PVDF/CuO
从图3(a)中可以看到,13μm铝粉原料呈现规则圆球形颗粒状形貌,且颗粒表面比较光滑。由图3(b)可以看到,与Al粉相比,包覆PVDF后Al/PVDF颗粒表面形貌发生了明显的变化,虽然颗粒仍然保持球形形貌,但颗粒表面凹凸不平,比较粗糙,明显包覆了一层有机物,可以看出PVDF壳层包覆均匀且完整。图3(c)和(d)分别展示了包覆氧化镍和氧化铜后颗粒的形貌特征,包覆金属氧化物的过程并没有破坏颗粒原有的球形形貌,但是与Al/PVDF相比,包覆金属氧化物后颗粒的表面形貌发生了进一步的变化。包覆NiO后,Al/PVDF/NiO颗粒呈花球状结构,颗粒表面均匀分布一层直立式纳米片, NiO纳米片包覆均匀且完整,片层厚度约为20~40nm,直径小于100nm。Al/PVDF/CuO中包覆的CuO也是纳米片状结构,片层厚度约为30~50nm,直立或平铺分布于颗粒表面,氧化铜纳米片有轻微团聚,分布相对均匀,且能较好地包覆于颗粒表面。
通过图4中的FIB-SEM及SEM-Mapping图像,可以更加直观地获得复合材料的微观结构及包覆均匀性等信息。以Al/PVDF/NiO为例,利用聚焦离子束将颗粒切开,从剖面图中可以清晰地看到该颗粒以Al为核心,直径约为10.5μm,铝核外包覆有均匀、完整的壳层,壳层厚度约为300nm,但由于放大倍率及分辨率的原因,未能完全区分PVDF壳层和氧化镍壳层。但是,通过进一步的SEM-Mapping图谱,更加直观、清晰地看到Al、O、F和Ni元素分布。颗粒以铝粉为核,PVDF壳层和氧化镍壳层均匀包覆在Al的表面,形成双层核壳结构。此外,谱图还充分说明了微米铝粉和PVDF及氧化镍实现了纳米尺度上的均匀符合,实现了氧化剂和活化层/还原剂界面接触面积的最大化,有利于提高微米铝粉的燃烧性能。

图4 Al/PVDF/NiO MIC的FIB-SEM及SEM-Mapping图Fig.4 FIB-SEM and SEM-Mapping images of Al/PVDF/NiO MIC
2.2 热反应性能
采用TG-DSC同步热分析方法,初步探究了液相法制备的核壳结构亚稳态分子间复合物的热反应性能,测试气氛为空气,测试温度范围为室温~1500℃,升温速率20℃/min。13μm铝粉和核壳结构Al/PVDF在空气气氛下的TG-DTG及DSC曲线如图5所示。

图5 13μm Al粉和Al/PVDF的TG-DTG和DSC曲线 Fig.5 TG-DTG and DSC curves of 13μm Al and Al/PVDF
由图5(a)和(b)可知,加热过程中铝粉发生了3个阶段的变化,第一阶段(610~680℃)微米铝发生熔融过程,伴随着少量氧化产生的质量增加,这与DSC曲线中670℃处的熔融吸热峰相对应;第二阶段(840~1100℃),此时TG曲线中出现了明显的氧化增重过程,增重率达到12.0%,这与DSC曲线中1038℃处的第一个氧化放热峰相呼应,放热量为2452J/g,该放热过程为熔融的Al与空气中的氧气反应生成Al2O3而导致的氧化放热过程;第二阶段结束后TG曲线中出现了一小段平台期,约1300℃后开始了第三阶段的氧化增重过程,这可能是由于熔融的Al与氧气反应生成的Al2O3覆盖在Al的表面形成了一层氧化物壳层,从而抑制了Al的进一步氧化,而随着温度的进一步升高,发生了破壳燃烧效应,因此Al的质量再次发生氧化增重,到达1500℃时的增重率仅为28.3%。在微米Al表面包覆PVDF后能够明显改善微米铝的热反应性能。由图5(c)和(d)可知, Al/PVDF核壳型MIC的氧化过程与铝粉基本类似,区别在于Al/PVDF在300~600℃发生少量失重,失重率为4.54%,并伴随少量放热,这可能是由于氟聚物壳层受热分解与铝发生氧化反应生成AlF3而导致的氧化放热过程,而氟铝反应可以在600℃以下进行完全[34],因此,850℃以上的氧化增重过程为铝与氧气反应过程,仅有Al2O3生成。Al/PVDF核壳型MIC的第二阶段放热峰温为1066℃,略高于铝粉(1038℃),这可能是由于前期反应生成的AlF3(熔点1040℃)发生高温相变吸热导致的;Al/PVDF的放热量为5209J/g,约为铝粉的2.1倍,该放热过程为单质铝与空气发生氧化反应而导致氧化增重过程,增重率为31.3%,增重率是铝粉的2.6倍;此外,到达1500℃时Al/PVDF的增重率为55.0%,氧化增重率远高于铝粉。因此,氟聚物包覆能够对铝粉起到表面改性的作用,有利于减少Al2O3在Al表面积累,从而促进Al提前发生破壳燃烧,大大提升铝粉的热反应效率和氧化放热量。
为了进一步提升Al/PVDF的热反应性能,在Al/PVDF的表面包覆了一层过渡金属氧化物,图6为Al/PVDF/NiO和Al/PVDF/CuO双层核壳结构MIC的TG-DTG及DSC曲线。由图6(a)和(b)可知,Al/PVDF/NiO的初始放热峰温为990℃,该放热过程为铝粉与空气反应的氧化放热过程,与Al粉和Al/PVDF的初始放热峰温(1038℃和1066℃)相比分别降低了48℃和76℃,反应活性明显增强;且Al/PVDF/Ni的初始氧化反应放热量为7408J/g,分别是Al和Al/PVDF的3.0和1.4倍,放热量大大提升。除此之外,Al/PVDF/NiO双层核壳结构MIC的初始氧化过程放热更为集中,反应温度跨度为982~1003℃,反应时间仅为1.05min,与Al粉(4.65min)和Al/PVDF(1.2min)相比,反应速率分别提升了77.4%和12.5%。
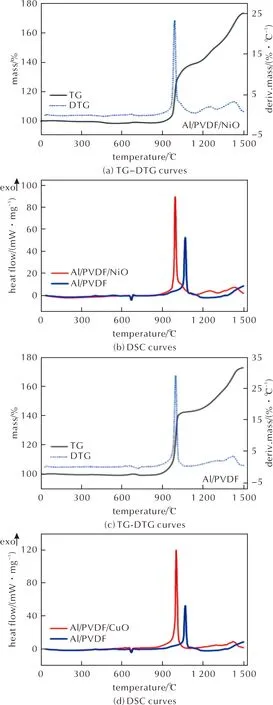
图6 Al/PVDF/NiO和Al/PVDF/CuO双层核壳结构MIC的TG-DTG及DSC曲线Fig.6 TG-DTG and DSC curves of double core-shell structured Al/PVDF/NiO and Al/PVDF/CuO MICs
由图6(a)可知,Al/PVDF/NiO的TG曲线在982~1003℃的放热区间对应一个质量急剧增加的过程,样品质量增加率为40.0%,远高于Al粉(12.0%)和Al/PVDF(31.3%),表明在该温度区间内Al/PVDF/NiO的氧化反应速率特别快,热反应效率更高,热反应能力大大提升,这与DSC测试结果吻合。到达1500℃时,Al/PVDF/NiO双层核壳结构MIC的质量增加率达到75.15%,氧化反应总放热量为9574J/g,证明NiO包覆能够进一步提升MIC的热反应能力,加快氧化反应速率,提高氧化反应放热量。
从图6(c)可知,在994~1014℃温度范围内,Al/PVDF/CuO的TG曲线发生了明显的质量快速增加的过程,样品质量增加率高达42.4%,1014~1200℃时TG曲线出现了一小段平台,随后又发生了第二阶段氧化反应过程,与第一阶段相比增重速率较慢,到达1500℃时的样品质量增加率为72.42%,远高于Al粉(28.3%)和Al/PVDF(55.0%),表明双层核壳结构Al/PVDF/CuO MIC材料的热反应性能更好,热反应效率更高。如图6(d)所示,Al/PVDF/CuO的最强放热峰峰温为997℃,比Al粉(1038℃)和Al/PVDF(1066℃)分别提前了39℃和69℃,该过程对应于铝粉与空气反应的氧化放热过程,证明Al/PVDF/CuO双层核壳结构MIC的热反应活性明显增强;此外,Al/PVDF/CuO双层核壳结构MIC的氧化过程放热量更大且放热更为集中,反应时间仅为1.0min,反应速率与Al粉相比提升了78.5%;第一阶段氧化放热量高达8462J/g,分别是Al粉、Al/PVDF和Al/PVDF/NiO的3.5倍、1.6倍和1.14倍,氧化过程总放热量高达10864J/g,具有最高的氧化放热能力。与Al/PVDF相比,Al/PVDF/MO双层核壳结构MIC的热反应性能进一步提升,主要是因为:(1)在双层核壳结构复合物中,PVDF位于中间层,外层的金属氧化物壳层能够有效抑制PVDF分解产物向外扩散与挥发,促进PVDF分解产物与Al及其表面Al2O3壳层反应生成AlF3,因此,Al/PVDF/MO的TG曲线中300~600℃阶段失重远低于Al/PVDF(4.54%),Al/PVDF/MO的热反应活性与反应速率比Al/PVDF有了进一步的提升;(2)670℃左右Al粉开始熔融,大于850℃高温条件下,熔融Al与最外层的金属氧化物接触引发铝热反应,从而释放出大量的热,因此,Al/PVDF/MO的DSC放热量与燃烧释能效率比Al/PVDF有了进一步的提高。
为了进一步评估制备的MIC材料的热反应效率,采用氧弹量热法测量了其燃烧热,测试压力为3MPa,在高纯氧气气氛中使材料完全燃烧,测量得到其定容燃烧热,见表1。
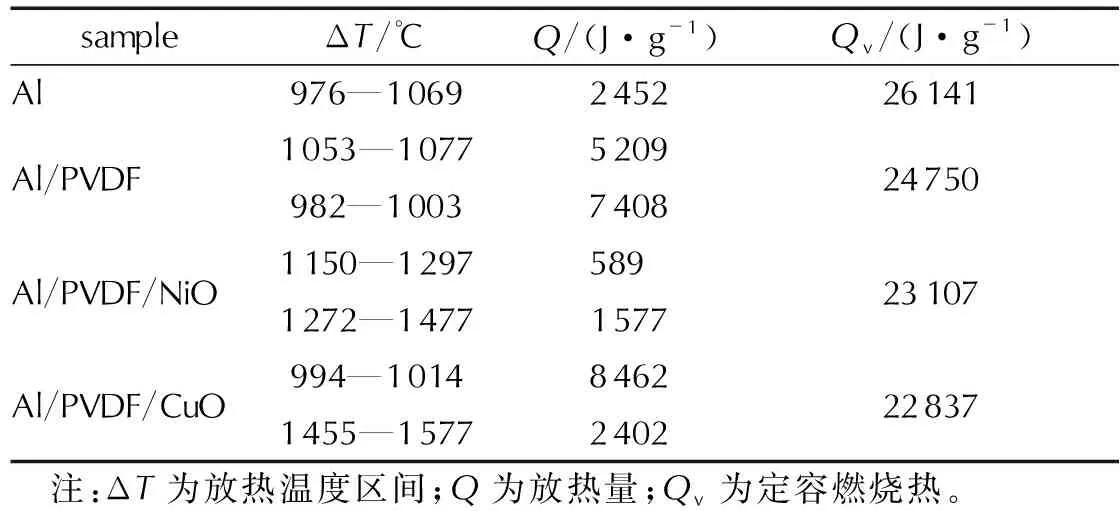
表1 Al粉和核壳结构MIC的热反应性能Table 1 The thermal reactivity properties of Al and core-shell structured MICs
由表1可知,Al、Al/PVDF、Al/PVDF/NiO和Al/PVDF/CuO的定容燃烧热分别为26141、24750、23107和22837J/g(复合物未扣除PVDF和金属氧化物的含量)。其中,Al的燃烧热最高,由于Al的热值较高,因此引入包覆层后使复合含能材料的燃烧热有所下降,且包覆层越多,包覆层越厚,燃烧热下降也越明显。
以氧气条件下的定容燃烧热作为材料极限放热量,用DSC测试中的总放热量占极限放热量的百分比作为燃烧效率的衡量指标。根据计算结果,Al在测试条件下燃烧效率仅为9.38%,而包覆PVDF壳层后燃烧效率翻倍,达到21.05%,再包覆NiO或CuO壳层后,燃烧效率再次翻倍,Al/PVDF/NiO和Al/PVDF/CuO双层核壳结构MIC的燃烧效率分别为Al粉的4.4倍(41.43%)和5.1倍(47.57%),证明包覆PVDF壳层和过渡金属氧化物壳层能够有效提高复合材料的燃烧效率。
2.3 微观结构对材料热反应性能的影响
为了进一步分析微观核壳结构对Al/PVDF/MO亚稳态分子间复合材料热反应性能的影响,在空气气氛下对双层核壳结构Al/PVDF/CuO、核壳结构Al/PVDF与纳米氧化铜物理混合物(Al/PVDF+CuO)以及Al、PVDF、纳米CuO物理混合物(Al+PVDF+CuO)进行了TG-DSC测试,结果如图7所示。由图7可见,三组分的物理混合物Al+PVDF+CuO热反应性能最差,在TG曲线中氧化反应样品质量增加速率最慢,到达1200℃时的样品质量增加率仅为36.1%,且DSC放热峰峰温位于1018℃,总放热量为7973J/g。与Al+PVDF+CuO相比,将PVDF包覆在Al颗粒表面形成核壳结构后,Al/PVDF+CuO混合物在1200℃时的样品质量增加率提高了4.4%,且DSC放热峰峰温下降了13℃,总放热量达到了10630J/g,且放热过程更加集中,证明Al与PVDF构建分子间紧密接触的核壳结构能够有效提高其热反应活性,促进其热反应速率和效率的提升,更有助于提高放热量。进一步构建双层核壳结构后,Al/PVDF/CuO的热反应性能进一步提升,氧化反应增重速度大大提升,达到1200℃是的样品质量增加率比Al+PVDF+CuO和Al/PVDF+CuO分别提升6.3%和1.9%,且氧化反应放热峰峰温进一步下降到了997℃,放热峰更加尖锐,半峰宽更窄,证明构建双层核壳结构能够最大程度地提高MIC材料的热反应活性,提升热反应速率和反应效率,使放热反应过程更加集中。

图7 Al/PVDF/CuO与物理混合样品Al+PVDF+CuO和Al/PVDF+CuO的TG曲线和DSC曲线Fig.7 TG and DSC curves of Al/PVDF/CuO, physical mixed Al+PVDF+CuO and Al/PVDF+CuO samples
3 结 论
(1)双层核壳结构的Al/PVDF/NiO和Al/PVDF/CuO复合材料均为花球形貌,13μm Al为核心, PVDF壳层为中间层,最外层是纳米片状结构的NiO或CuO,包覆层厚度约为300nm。
(2)采用TG-DSC法评价了复合材料的热反应活性。Al/PVDF/NiO和Al/PVDF/CuO的氧化放热峰温分别为990℃和997℃,相比Al粉和Al/PVDF具有更高的热反应活性;初始放热量分别提升至7408J/g和8462J/g,放热过程集中;氧化反应速率与Al粉相比分别提升了77.4%和78.5%;到达1500℃时的质量增加率分别为75.15%和72.42%,氧化反应总放热量分别为9574J/g和10864J/g,燃烧效率分别是Al粉的4.4倍和5.1倍。
(3)采用氧弹量热法测试了材料的燃烧热,评价了材料在空气气氛中的燃烧效率。Al、Al/PVDF、Al/PVDF/NiO和Al/PVDF/CuO的定容燃烧热分别为26141、24750、23107和22837J/g;燃烧效率分别为9.38%、21.05%、41.43%和47.57%。复合材料的燃烧热虽然略有下降,但燃烧效率大幅提升。
(4)双层核壳结构有助于提升Al/PVDF/MO复合材料的热反应活性、热反应速率和热反应效率,放热反应过程更加集中。
——热量

