CuO/MWCNTs复合材料降解双酚A的光催化性能
车乃菊,李银辉,杨帆,刘国平,张增利,李成亮*
(1.土肥高效利用国家工程研究中心,山东农业大学资源与环境学院,山东 泰安 271018;2.山东省东营市垦利区农业农村局,山东 东营 257500;3.山东省东营市东营区农业农村局,山东 东营 257000)
双酚A(BPA)是一种内分泌干扰化合物,被广泛用于制造聚合物,因此已不可避免地暴露于环境中。尽管BPA 暴露的剂量非常低,但其仍然会对人类健康造成不利影响,目前已在人的尿液中检测到BPA。近年来,各国对BPA 在废水中的排放标准进行了规定,日本和美国分别将BPA 排放限值定为小于2.5 mg·L和0.5 mg·L,而中国设定的最大排放限量为1 mg·L。
到目前为止,已有很多去除废水中BPA 的技术被报道,如吸附、反渗透、高级氧化工艺、光降解等。在广泛的废水处理工艺中,多相光催化是将难降解有机化合物转化为无害产品(如CO和HO)最有效的方法之一,该技术操作条件温和,通用性强,可利用阳光作为廉价可再生能源,优良的催化材料是该技术推广和改良的重点。
光催化技术的核心在于光催化材料,半导体光催化剂是目前常用于光催化技术的材料之一。氧化铜(CuO)是一种窄带隙(1.2~1.8 eV)的金属氧化物,属于p 型半导体材料,可以在可见光下作为光催化材料降解有机污染物。但单一的CuO 光生电子易与空穴复合,同时存在量子效率和光催化活性低的问题。而纳米级半导体材料存在颗粒小,催化完成后难回收的问题。将CuO 与碳材料进行复合,不仅能提高光催化性能,而且也是解决催化剂回收问题的有效途径。碳纳米管(Carbon nanotubers,CNTs)具有较大的比表面积和独特的光学性能,不需要能带内的动量弛豫即可发生光子发射和吸收。将负载半导体后得到的材料作为光催化剂,可以提高光催化效率,在光催化降解有机污染物方面发挥重要作用。
本研究对制备的氧化铜/多壁碳纳米管(CuO/MWCNTs)复合物进行结构性能表征,并以BPA 为降解目标进行一系列光催化试验,包括对CuO/MWCNTs 和Nano-CuO 的光催化性能进行比较,以及分别考察催化剂用量、溶液浓度、溶液pH及介质离子浓度对两种材料降解BPA 的影响,以探究CuO/MWCNTs光催化降解BPA的潜力。
1 材料与方法
1.1 试剂与材料
BPA 由南京大学污染控制与资源化研究国家重点实验室合成并提供(分析纯);纳米氧化铜(Nano-CuO)购自上海麦克林生化科技有限公司(粒径为40 nm);原始MWCNTs购自深圳纳米港公司(管径为20~40 nm)。CuO/MWCNTs在本实验室制备完成。
1.2 光催化试验
1.2.1 材料的相关表征与性能测试
利用扫描电镜观察CuO/MWCNTs和Nano-CuO的表面形态;使用紫外可见漫反射仪(岛津UV-3600),以硫酸钡为固体白板作为参照扫描基线,扫描范围为200~800 nm,测定CuO/MWCNTs 和Nano-CuO 的光吸收性能;使用X 射线衍射仪(Bruke D8 ADVANCE)对材料进行X 射线衍射,分析材料的成分和晶体结构;使用傅里叶红外光谱仪(Nicolet 6700,Thermo Fisher Scientific)对材料进行官能团的分析和分子结构的鉴定。
1.2.2 光催化降解试验
在紫外光照射,催化剂用量为2 g·L,BPA 浓度为20 mg·L(纯水配制),pH 为7 的条件下,分别在0.5、1、3、5、7、9、12、24、48、72 h 时取样1 mL。用正辛醇萃取BPA 后用三重四极杆气质质谱仪进行定量测定:毛细管柱规格为30 m×0.25 mm×0.25 μm,氦气载气流速为1 mL·min。不分流注射样品1 μL,仪器的进样口温度保持在250 ℃,柱温先在80 ℃保持1 min,然后以15 ℃·min升至270 ℃保持8 min。每个处理重复3次。
分组设置5 个两种催化剂用量(1、2、3、4、5 g·L)、6 个溶液初始浓度(5、10、15、20、25、30 mg·L)、5 个溶液pH(3、5、7、9、11)、5 个介质离子强度(0、5、10、20、50 mmol·L)的BPA 溶液,每个处理重复3次。在其他试验条件一致的情况下,紫外光光照24 h 后,用正辛醇进行萃取,利用三重四极杆气质质谱仪进行定量测定。
1.2.3 数据处理
采用Excel 2003、SPSS 软件进行数据分析与处理,采用Origin 2019b 进行图表的制作和一级动力学模型的拟合。
2 结果与讨论
2.1 材料表征与性能分析
2.1.1 扫描电镜(SEM)分析
Nano-CuO表面较为光滑,形貌不规整,大小不均匀,聚集为一团(图1a)。CuO/MWCNTs 基本无团聚,块状物质(CuO)表面存在毛刺状或管状物质,放大倍数观察为CNTs(图1b)。CuO/MWCNTs 中大量的CNTs 穿插在CuO 中或缠绕CuO,使CuO/MWCNTs 分散开,减少了团聚,进而使催化剂与BPA 有更多的接触面积;此外,CuO/MWCNTs 中CuO 的表面较为粗糙。这些结构特点均可促进光催化剂作用的发挥。

图1 两种光催化材料的SEM图Figure 1 SEM images of two kinds of photocatalytic materials
2.1.2 傅里叶红外光谱(FTIR)分析

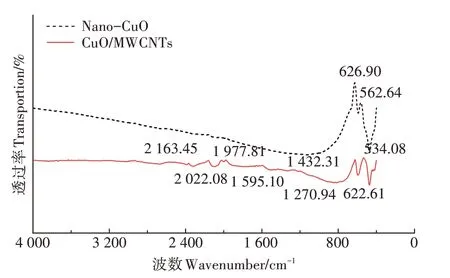
图2 两种光催化材料的FTIR谱图Figure 2 FTIR spectra of two kinds of photocatalytic materials
2.1.3 X射线衍射(XRD)分析
Nano-CuO 和CuO/MWCNTs 的XRD 图谱(图3)显示,两种催化剂的衍射峰均很明显,具备尖锐的峰型,且与标准卡片比对发现Nano-CuO 基本无杂质峰,说明其具有较好的结晶度。Nano-CuO 在2为32.629°、35.662°、38.853°、48.954°、53.614°、58.547°、61.730°、65.987°、66.597°、68.363°、72.780°、75.529°处的衍射峰分别对应CuO(110)、(-111)、(111)、(-202)、(020)、(202)、(-113)、(022)、(-311)、(220)、(311)、(-222)晶面(PDF#65-2309)。CuO/MWCNTs 基本具备Nano-CuO 的典型衍射峰,但其峰值明显低于Nano-CuO 的 衍 射 峰。此 外,CuO/MWCNTs 在2为26.381°处明显存在石墨(002)晶面(PDF#41-1487)的衍射峰,在2为29.632°、36.502°、42.401°、61.518°、73.697°处存在CuO(110)、(111)、(200)、(220)、(311)晶面(PDF#65-3288)的衍射峰,说明CuO/MWCNTs中同时存在CuO和CuO。
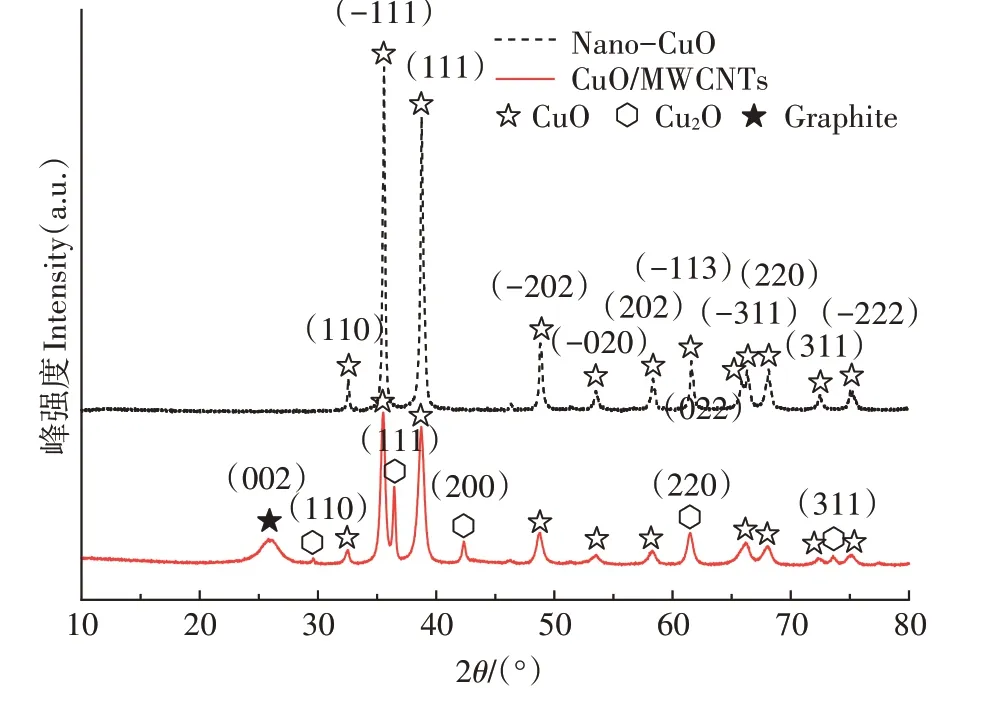
图3 两种光催化材料的XRD图Figure 3 XRD patterns of two kinds of photocatalytic materials
2.1.4 紫外可见漫反射光谱(UV-Vis DRS)分析
在200~800 nm 波长范围内,CuO/MWCNTs 的吸光度均大于Nano-CuO的吸光度(图4),说明MWCNTs的存在一定程度上提高了催化剂的吸光性,可以获得更多的能量。此外,CuO是一种与可见光区域匹配的窄带隙半导体,对可见光强烈吸收,但在小于400 nm 的紫外光(实验光)区域,CuO/MWCNTs 的吸光度明显比Nano-CuO 的吸光度高,说明CNTs 可以促进材料对紫外光的利用,进而改善材料的光催化性能。
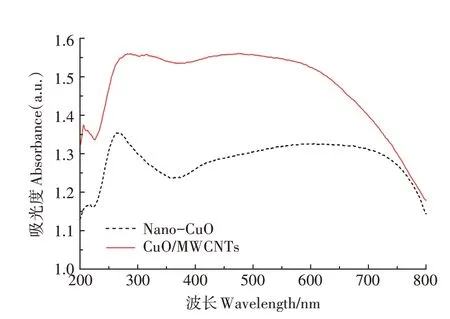
图4 两种光催化材料的UV-Vis DRS谱图Figure 4 UV-Vis DRS spectra of two kinds of photocatalytic materials
2.2 光催化试验
2.2.1 光催化降解动力学试验
两种催化剂对BPA 的光催化降解趋势是随着光照时间的增加,BPA 的光催化降解率增加,最终在24 h后达到平衡,其中CuO/MWCNTs 作用下BPA 的降解率约为56%,Nano-CuO 作用下BPA 的降解率约为21%(图5)。相同条件下对比两种光催化剂对BPA的降解结果,在相同取样时间点上,CuO/MWCNTs 的降解率分别高出Nano-CuO 14.28、18.40、26.35、31.66、31.51、33.66、29.56、35.30、35.41、22.81 个百分点,与UV-Vis DRS 光谱分析的结果相吻合。CuO/MWCNTs光催化性能高于Nano-CuO 的原因可能有3 个:①CNTs 具有良好的导电性,可以提高光生载流子的分离,且光生载流子在CNTs上以一维方向快速移动,可以有效减少光生电势的抑制作用,提高量子效率;②CNTs 作为CuO 的载体可以减轻CuO 聚集问题,促进CuO 和BPA 的接触,提高催化剂的利用率;③CNTs具有较大的比表面和π电子结构,可以和BPA的两个苯环π电子发生π-π色散作用,使得BPA可以快速到达CuO和CNTs表面,进而充分利用光生电子和空穴。

图5 Nano-CuO和CuO/MWCNTs光催化降解BPA的动力学曲线Figure 5 Adsorption kinetics of the photocatalytic degradation of BPA on Nano-CuO and CuO/MWCNTs
CuO/MWCNTs 和Nano-CuO 两种材料对BPA 的光降解速率结果显示,两种材料作用下BPA 的光催化降解速率先较快后逐渐放缓,最终在光照时间为24 h 左右时BPA 不再降解,且CuO/MWCNTs 存在下BPA 的光催化降解速率更快。出现这种趋势的原因可能是:在光催化反应初始阶段,反应体系中BPA 浓度大,而且CuO 受紫外光照射时间增加后激发的电子-空穴数量也增加,催化剂活性较高,因此反应速率大;随着反应的继续进行,溶液中的BPA 浓度逐渐降低,催化剂的空余吸附位点减少,反应速率降低。
在此基础上,对两种光催化剂降解BPA随时间变化的结果进行动力学拟合(图6),一级动力学模型为:
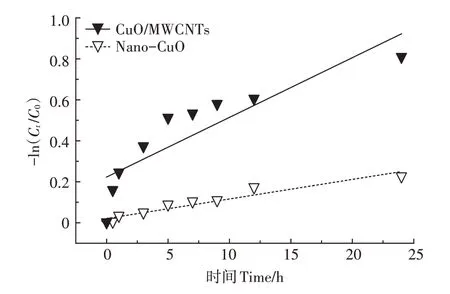
图6 Nano-CuO和CuO/MWCNTs光催化降解BPA的一级动力学拟合曲线Figure 6 First-order kinetic fitting curves for the photocatalytic degradation of BPA on Nano-CuO and CuO/MWCNTs

式中:、C分别为BPA 的初始浓度和降解时间为(h)时的浓度,mg·L;为单位时间内BPA的降解量,即表观反应速率常数,h;为常数。
拟合结果显示(表1),CuO/MWCNTs 光催化降解BPA 的动力学常数为0.029 13 h,高于Nano-CuO光催化降解BPA 的动力学常数(0.009 55 h),但是相关系数()仅为0.776 7,说明该体系中BPA 的降解不是单纯的一级反应,而是多种反应共同作用的结果。综上表明CuO/MWCNTs 的光催化速率高于Nano-CuO,也进一步说明CNTs 的加入可以加快BPA光催化降解的速度。

表1 Nano-CuO和CuO/MWCNTs光催化降解BPA的一级动力学拟合结果Table 1 Fitting results of first-order kinetics for photocatalytic degradation of BPA on Nano-CuO and CuO/MWCNTs
2.2.2 催化剂用量对BPA光催化降解的影响
在1~5 g·L的催化剂用量范围内,随剂量的增大,BPA 光催化降解率也增加(图7)。这是因为更多的催化剂产生更多的羟基用以捕获光生电子空穴,进一步生成光催化反应的主要氧化剂·OH,从而增加BPA 光催化降解率。但是随着催化剂用量的增加,相同的催化剂增加量导致的BPA 降解率增加的幅度在减少。此外,在催化剂1~5 g·L的剂量范围内,相同投加量下,CuO/MWCNTs 对BPA 的降解率远高于Nano-CuO。其他条件相同时,与催化剂用量为1 g·L相比,催化剂剂量为5 g·L时CuO/MWCNTs 对BPA 的降解率增加了57.11 个百分点,但Nano-CuO对BPA的降解率增幅仅为9.16个百分点。结合CNTs的结构和性能分析,其原因可能是CNTs 的一维结构以及优良的电子传导能力,有效促进了电子传递和氧化还原反应进行。

图7 Nano-CuO和CuO/MWCNTs投加量对BPA光催化降解的影响Figure 7 The effect of dosage of Nano-CuO and CuO/MWCNTs on the photocatalytic degradation of BPA
2.2.3 溶液初始浓度对BPA光催化降解的影响
在供试的BPA 溶液浓度范围内,增大溶液浓度,两种光催化剂对BPA 的光催化降解率先增加后降低(图8)。其中,在5~15 mg·L的浓度范围内,BPA 浓度的增加使其与CNTs 之间的驱动力增强,吸附或光催化的概率增大。然而,电子-空穴的产生有限,当浓度不断升高时,光催化降解产生的中间产物增加,其与BPA 的竞争增加,使BPA 的光催化降解率下降。此外,在其他变量一致时,CuO/MWCNTs 对BPA 的降解率是Nano-CuO 的2.54~3.05倍,该结果可能与CNTs具有一定数量的官能团及吸附位点有关。
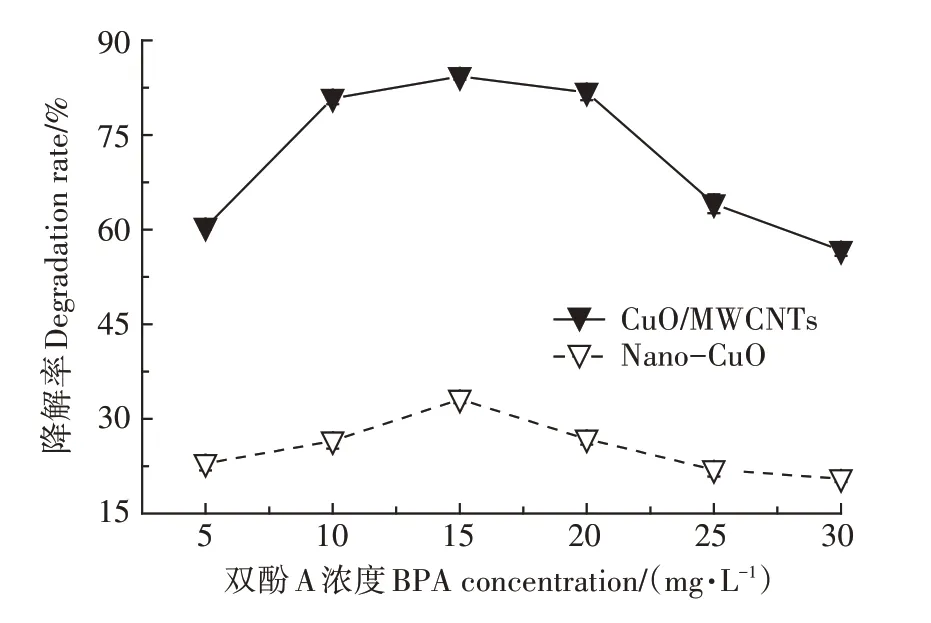
图8 初始浓度对BPA光催化降解的影响Figure 8 The effect of initial concentration on the photocatalytic degradation of BPA
2.2.4 溶液pH对BPA光催化降解的影响
在溶液pH为3~11范围内,随溶液pH升高,Nano-CuO 与CuO/MWCNTs 对BPA 的光催化降解率不断降低(图9),与MOUSSAVI 等得到的影响趋势相同。pH 较低时,吸附在CuO 上的氧可以与大量的H生成HO,进而产生羟基自由基,促进光催化反应的进行。随着pH 的增加,一方面·OH 的氧化还原电位降低,光催化效率降低;另一方面,Zeta 电位测试结果显示CuO/MWCNTs 的等电点为6.46(图10),且随着pH 的增大,CNTs 表面的负电荷增多,而在碱性条件下,BPA 也带负电(pa=9.6),两者之间产生静电排斥,使吸附效果降低,进而影响BPA 的光催化降解率。此外,相同条件下,CuO/MWCNTs 存在下的光催化降解率远高于Nano-CuO 存在下的光催化降解率。在pH 为3 时,CuO/MWCNTs 对BPA 的光催化降解率是Nano-CuO的4.53倍。

图9 溶液pH对BPA光催化降解的影响Figure 9 The effect of pH on the photocatalytic degradation of BPA

图10 CuO/MWCNTs的Zeta电位Figure 10 The Zeta potential of CuO/MWCNTs
2.2.5 介质离子强度对BPA光催化降解的影响
在0~50 mmol·L的NaCl介质浓度范围内,Nano-CuO 与CuO/MWCNTs 对BPA 的光催化降解率随介质离子强度的增强而逐渐降低(图11),这与李晓蕊等研究阴离子对真空紫外光化学降解BPA 的影响时得到的结果相同。这可能是因为NaCl 中Cl与·OH 反应或吸收VUV(Vacuum ultraviolet),加上Na的存在导致光生空穴与光生电子之间发生短路的问题,光生载流子失活且光生载流子复合率增加,从而降低了降解率。但CuO/MWCNTs 作用下BPA 的光催化降解率仍是Nano-CuO 的4.51~21.41 倍。这是因为CuO/MWCNTs 中的CNTs 表面存在包括羧基、羟基和羰基等在内的多种官能团,且呈现负电性,可以吸附部分Na,减弱NaCl对光催化降解的抑制。

图11 离子强度对BPA光催化降解的影响Figure 11 The effect of ionic strength on the photocatalytic degradation of BPA
3 结论
(1)CuO/MWCNTs 同时具备氧化铜和碳纳米管的官能团和晶型结构,在测试光波长范围内,CuO/MWCNTs较Nano-CuO具有更高的吸光度。
(2)CuO/MWCNTs 和Nano-CuO 两种光催化剂作用下,双酚A(BPA)的降解均在24 h 内达到平衡,其中CuO/MWCNTs 对BPA 的光催化降解效果更好。供试范围内,两种材料对BPA 的光催化降解率均受催化剂投加量、溶液pH、离子强度以及BPA 浓度的影响,且在相同条件下CuO/MWCNTs 受到的影响更大,但其光催化降解率仍高于Nano-CuO。综合比较表明,CuO/MWCNTs 比Nano-CuO 具有更好的BPA 光催化降解性能和稳定性,是一种值得推广应用的光催化降解材料。

