不同密度海藻酸钙复合微球的制备及其对Cu(Ⅱ)吸附行为的研究
詹李明,李建华,黄雅雯,蓝森美,冯芳芳,陈作义,柳晓俊,赵丹华
(广东第二师范学院化学与材料科学学院,广东 广州 510303)
由于工农业经济的快速发展,重金属工业废水排放量越来越多,严重污染水体和土壤环境,对人体健康造成极大威胁[1-2]。由于重金属稳定性强、收集难、毒性大,研发有效的重金属废水处理工艺已成为保障水体安全的当务之急。在重金属废水处理工艺中,吸附法[3]因操作简便、效果显著、成本低等优点备受关注。常见的吸附剂有活性炭[4]、膨润土[5]、壳聚糖[6]和海藻酸钠[7]等。乙二胺四乙酸二钠(EDTA-2Na)是一种具有六配位原子的良好络合剂,可与多种金属离子结合形成稳定络合物[8],若将其引入吸附材料中,可提高吸附效率。
作者通过调控EDTA-2Na与CaCO3、海藻酸钠与EDTA-2Na/CaCO3的配比,采用原位化学交联法制备毫米级海藻酸钙复合微球,然后经酸化处理制备具有不同密度的三维多孔海藻酸钙复合微球:漂浮型海藻酸钙微球(FCAM)、沉浸型海藻酸钙微球(ICAM),通过扫描电镜和红外光谱对其形貌和结构进行分析;并将复合微球FCAM、ICAM用于含Cu(Ⅱ)废水的吸附,考察复合微球投加量、Cu(Ⅱ)初始浓度、吸附时间、体系pH值等对吸附效果的影响,探究吸附动力学及吸附热力学。
1 实验
1.1 试剂与仪器
海藻酸钠、乙二胺四乙酸二钠(EDTA-2Na)、盐酸,天津大茂化学试剂厂;碳酸钠、氯化铜,天津福晨化学试剂厂;氯化钠、氢氧化钠,广州化学试剂厂;氯化钙,上海润捷化学试剂有限公司。所有试剂均为分析纯。
S-4800型扫描电镜,日本日立公司;TENSOR-37型红外光谱仪,美国Bruker公司;TAS-990型原子吸收分光光度计,北京普析通用仪器有限责任公司;84-1A型同步转速数显磁力搅拌器,上海司乐仪器有限公司;DHG-905型电热恒温鼓风干燥箱,上海浦东荣丰科学仪器有限公司。
1.2 不同密度海藻酸钙复合微球的制备
将2.5%海藻酸钠溶液与EDTA-2Na/CaCO3(EDTA-2Na与CaCO3物质的量比分别为1∶2.5、1∶1)溶液按一定比例混合,于300 r·min-1磁力搅拌10 min,得混合凝胶溶液;取混合凝胶溶液3.5 mL滴入2%氯化钙溶液中,静置固化60 min,得海藻酸钙复合微球;用去离子水洗涤海藻酸钙微球3次,置于0.1 mol·L-1盐酸中酸化一段时间,取出,洗涤至中性,即得不同密度海藻酸钙复合微球FCAM、ICAM。
1.3 不同密度海藻酸钙复合微球对Cu(Ⅱ)的吸附实验
在50 mL锥形瓶中加入一定浓度含Cu(Ⅱ)废水、复合微球FCAM或ICAM,室温(25 ℃)下静置吸附一定时间,待吸附平衡后测定Cu(Ⅱ)浓度,按式(1)计算平衡吸附量(qe,mg·g-1):
(1)
式中:c0、ce分别为Cu(Ⅱ)的初始浓度及吸附平衡浓度,mg·L-1;V为废水体积,L;m为复合微球投加量,g。
通过单因素实验考察复合微球投加量、Cu(Ⅱ)初始浓度、吸附时间、体系pH值等对吸附效果的影响,并对吸附行为进行动力学及热力学分析。
2 结果与讨论
2.1 复合微球的形貌和结构分析
2.1.1 SEM表征(图1)
由图1可知,复合微球FCAM、ICAM均呈蜂窝状且具有疏松多孔的结构,其原因是酸化过程中,H+渗入微球内部与其中的碳酸钙反应释放出二氧化碳,从而产生了大量三维多孔的结构,不仅增大了复合微球的比表面积,而且也提供了大量的传质通道,利于复合微球对Cu(Ⅱ)的吸附;与复合微球ICAM相比,复合微球FCAM的微孔多而密集,其原因是在制备过程中,复合微球FCAM的碳酸钙含量较高,酸化处理时释放出较多的二氧化碳所致。

图1 复合微球FCAM(a、b)、ICAM(c、d)的SEM照片 Fig.1 SEM images of composite microspheres FCAM(a,b)and ICAM(c,d)
2.1.2 FTIR表征(图2)
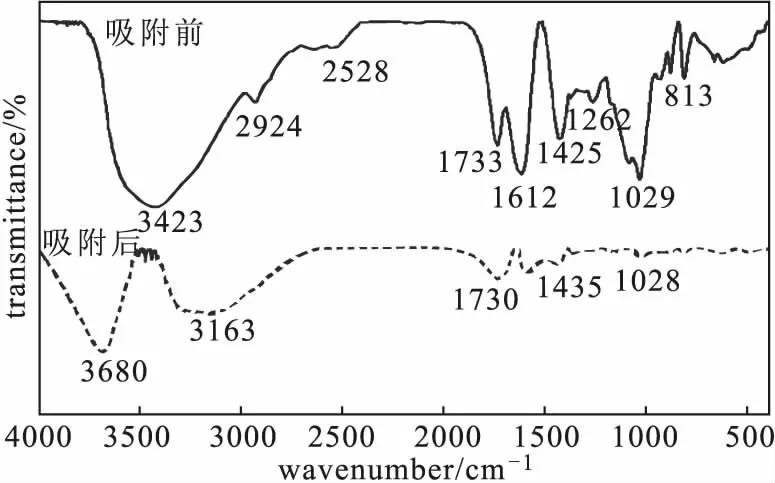
图2 复合微球吸附前后的FTIR图谱Fig.2 FTIR spectra of composite microspheres before and after adsorption
由图2可知,吸附前,3 423 cm-1处宽峰归属于分子中游离的-OH,表明大量-OH存在于复合微球表面;2 924 cm-1处吸收峰由EDTA-2Na、海藻酸钠中-CH2的C-H伸缩振动产生;2 528 cm-1处吸收峰由EDTA-2Na中-COOH和-OH的伸缩振动产生;1 733 cm-1、1 425 cm-1处吸收峰分别由-COOH中C=O、C-O的伸缩振动产生,表明复合微球表面存在大量-COOH[9],可以提供大量的吸附位点,利于复合微球吸附更多的Cu(Ⅱ);1 612 cm-1处尖峰由EDTA-2Na中N-H的面内弯曲产生;1 262 cm-1处吸收峰由海藻酸钠中苯羟基的C-O伸缩振动产生;1 029 cm-1处尖峰由EDTA-2Na中C-N的伸缩振动产生[9];813 cm-1处吸收峰由C-H的面外弯曲产生。吸附后,3 423 cm-1处的-OH吸收峰消失,于3 680 cm-1和3 163 cm-1处出现2个新的吸收峰;其它吸收峰强度明显减弱,可能是复合微球中活性基团-COOH、-OH、-NH2与Cu(Ⅱ)发生了络合作用所致,但主要官能团并未发生变化。
2.2 吸附效果影响因素分析
2.2.1 复合微球投加量对吸附效果的影响
在室温、Cu(Ⅱ)初始浓度为100 mg·L-1、吸附时间为300 min、体系pH值为4.7的条件下,考察复合微球投加量对吸附效果的影响,结果如图3所示。
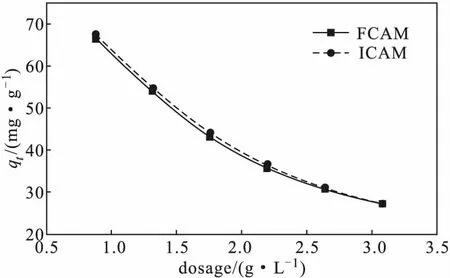
图3 复合微球投加量对吸附效果的影响Fig.3 Effect of dosage of composite microspheres on adsorption
由图3可知,复合微球FCAM、ICAM对Cu(Ⅱ)的吸附量均随其投加量的增加逐渐降低。其原因可能是随着复合微球投加量的增加,废水中大部分Cu(Ⅱ)被复合微球吸附,且存在Cu(Ⅱ)的吸附-解吸过程,致使复合微球中较多的活性吸附位点变得无效,故吸附量逐渐降低。
2.2.2 Cu(Ⅱ)初始浓度对吸附效果的影响
在室温、复合微球投加量为1.76 g·L-1、吸附时间为300 min、体系pH值为4.7的条件下,考察Cu(Ⅱ)初始浓度对吸附效果的影响,结果如图4所示。

图4 Cu(Ⅱ)初始浓度对吸附效果的影响Fig.4 Effect of initial concentration of Cu(Ⅱ) on adsorption
由图4可知,复合微球FCAM、ICAM对Cu(Ⅱ)的吸附量均随Cu(Ⅱ)初始浓度的升高逐渐升高。当Cu(Ⅱ)初始浓度较高时,存在较大的传质推动力,促进了Cu(Ⅱ)与复合微球之间的静电及非静电吸附作用,使得两者接触几率增加,复合微球表面的活性吸附位点被充分利用,能够吸附更多的Cu(Ⅱ)[10-11]。
2.2.3 吸附时间对吸附效果的影响
在室温、复合微球投加量为1.32 g·L-1、Cu(Ⅱ)初始浓度为90 mg·L-1、体系pH值为4.7的条件下,考察吸附时间对吸附效果的影响,结果如图5所示。
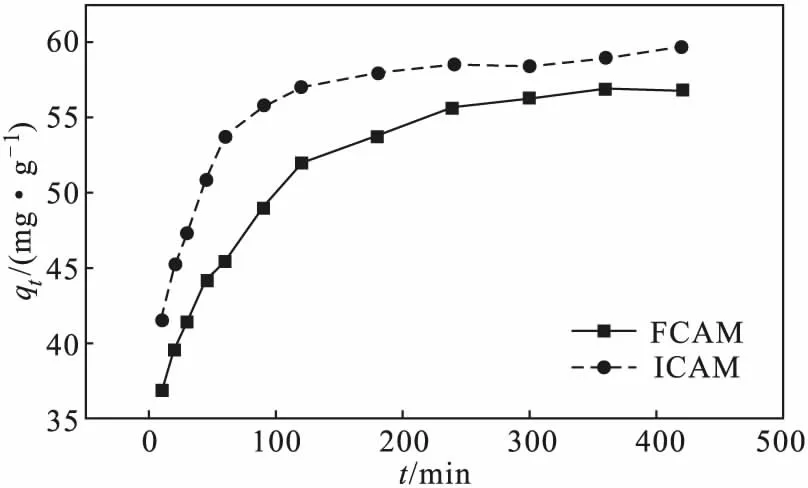
图5 吸附时间对吸附效果的影响Fig.5 Effect of adsorption time on adsorption
由图5可知,复合微球FCAM、ICAM对Cu(Ⅱ)的吸附过程均可分为快速、慢速、动态平衡3个阶段。0~100 min处于快速吸附阶段,此时曲线斜率较大,这是由于吸附开始时复合微球表面存在大量的活性吸附位点,复合微球与溶液间存在较大的浓度差,固液间传质推动力大[12-14],吸附速率较快;100~300 min处于慢速吸附阶段,吸附量变化较小,其主要原因是复合微球表面活性吸附位点减少,复合微球与溶液间存在静电斥力,不利于进一步吸附;300 min后,吸附处于动态平衡阶段,复合微球表面活性吸附位点逐渐达到饱和,吸附量变化不明显。故复合微球对Cu(Ⅱ)的吸附平衡时间为300 min。另,复合微球ICAM的初始吸附量较FCAM的高,是因为复合微球ICAM沉浸在底部,由于重力作用,溶液传质速率较快,故吸附速率较快。
2.2.4 体系pH值对吸附效果的影响
文献[15]报道,当pH>5时,Cu(Ⅱ)会发生水解。因此,本实验在室温、复合微球投加量为1.32 g·L-1、Cu(Ⅱ)初始浓度为90 mg·L-1、吸附时间为300 min的条件下,考察体系pH值在1~5范围内对吸附效果的影响,结果如图6所示。
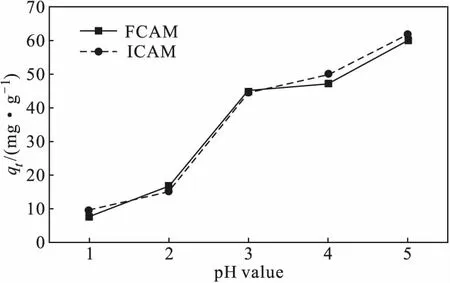
图6 体系pH值对吸附效果的影响Fig.6 Effect of pH value of system on adsorption
由图6可知,复合微球FCAM、ICAM对Cu(Ⅱ)的吸附量均随着体系pH值的增大逐渐升高,在pH值为5时达到最高,其中,复合微球ICAM对Cu(Ⅱ)的吸附量达到61.84 mg·g-1。其原因可能是:H+与Cu(Ⅱ)存在竞争吸附,在强酸性条件下,体系中H+浓度较大,导致复合微球表面的有效负电荷较少,对Cu(Ⅱ)的吸附量相应较低;随着体系pH值的增大,复合微球表面的活性吸附位点脱质子化,对Cu(Ⅱ)的静电吸附相应增强,吸附量相应升高[16]。
2.3 复合微球的吸附动力学研究
吸附动力学[17-19]主要研究吸附速率随时间的变化规律和各种因素对吸附过程的影响,不仅可以计算吸附速率,还能推测吸附机理。将数据分别进行准一级动力学方程、准二级动力学方程和颗粒内扩散方程拟合,以探究复合微球对Cu(Ⅱ)的吸附原理及吸附类型。其公式如下:
准一级动力学方程:ln(qe-qt)=lnqe-K1t
(2)
(3)
颗粒内扩散方程:qt=Kidt0.5+C
(4)
式中:qe为平衡吸附量,mg·g-1;qt为t时刻的吸附量,mg·g-1;t为吸附时间,min;K1为准一级动力学常数,min-1;K2为准二级动力学常数,g·mg-1·min-1;Kid是颗粒内扩散系数,mg·g-1·min-0.5;C为与反应边界层有关的常数,mg·g-1。
分别用准一级动力学方程、准二级动力学方程和颗粒内扩散方程对复合微球吸附Cu(Ⅱ)的动力学数据进行拟合,得到各方程相关参数(表1)。

表1 复合微球吸附Cu(Ⅱ)的动力学参数
由表1可知,准二级动力学方程对复合微球FCAM、ICAM吸附Cu(Ⅱ)过程的拟合程度更高,计算得到的平衡吸附量与实验数据更接近。表明复合微球FCAM、ICAM对Cu(Ⅱ)的吸附主要是化学吸附。
在室温、复合微球投加量为1.32 g·L-1、Cu(Ⅱ)初始浓度为90 mg·L-1、吸附时间为300 min、体系pH值为5的条件下,复合微球对Cu(Ⅱ)吸附过程的颗粒内扩散曲线如图7所示。

图7 复合微球对Cu(Ⅱ)吸附过程的颗粒内扩散曲线 Fig.7 Intraparticle diffusion curves for adsorption process of Cu(Ⅱ) by composite microspheres
由图7可知,qt-t0.5曲线两头弯曲、中间直线且不经过原点,呈现多段线性,表明颗粒内扩散是复合微球FCAM、ICAM吸附Cu(Ⅱ)过程的限速步骤,由于拟合度不高,说明不是唯一的限速步骤。故复合微球FCAM、ICAM对Cu(Ⅱ)的吸附过程可分为2个阶段:(1)由于复合微球表面具有大量活性吸附位点,位点与分子之间产生物理吸附作用,表现为吸附速率较快的表面吸附阶段;(2)随着活性吸附位点被占据,Cu(Ⅱ)进入复合微球FCAM、ICAM的孔隙,表现为吸附速率较慢的孔道内扩散阶段,受颗粒内扩散和化学作用所控制。
2.4 动边界模型
动边界模型可用于描述多孔材料的吸附行为,以研究固-液体系的吸附限速步骤,一般认为吸附过程包括3个步骤:液膜扩散(吸附质在吸附剂表面扩散)、颗粒内扩散(吸附质在吸附剂内部扩散)、化学反应(吸附质通过化学反应与吸附剂结合)[20]。其线性表达式分别为:
液膜扩散:-ln(1-F)=kt
(5)
(6)
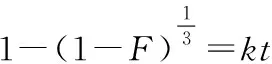
(7)
式中:F为离子交换度,F=qt/qe;k为速率常数。
复合微球FCAM、ICAM吸附Cu(Ⅱ)过程的动边界模型限速步骤参数见表2。
由表2可知,复合微球FCAM、ICAM吸附Cu(Ⅱ)过程中,液膜扩散步骤-ln(1-F)与t拟合程度最佳,R2分别为0.990 4和0.992 9;颗粒内扩散和化学反应步骤的速率常数相对较小,分别为0.003 51、0.004 90、0.002 42、0.003 40。故吸附过程的主要限速步骤为颗粒内扩散和化学反应。其原因可能为Cu(Ⅱ)与FCAM、ICAM表面的活性基团(如-OH、-COOH等)产生范德华力及静电作用力,快速扩散到FCAM、ICAM的表面;随后由于浓差作用,穿透FCAM、ICAM表面大小不一的多孔结构,在内部进行扩散,与FCAM、ICAM形成络合作用力和其它物理作用力,最终达到吸附平衡。

表2 动边界模型限速步骤参数
2.5 复合微球的吸附热力学研究
2.5.1 等温吸附模型拟合
数学模型可以很好地反映溶液中吸附量与残留浓度之间的关系,Langmuir、Freundlich两种等温吸附方程被广泛用于吸附热力学研究,根据拟合数据的相关度,可以得到吸附质与吸附剂之间的吸附类型。其公式如下[20-21]:
(8)
(9)
式中:ce为吸附平衡浓度,mg·L-1;qe为平衡吸附量,mg·g-1;qm为最大吸附量,mg·g-1;KL为Langmuir常数,L·mg-1;KF为Freundlich常数,mg·g-1;n为Freundlich常数。
分别用Langmuir等温吸附方程、Freundlich等温吸附方程对复合微球吸附Cu(Ⅱ)过程数据进行回归分析,结果见表3。
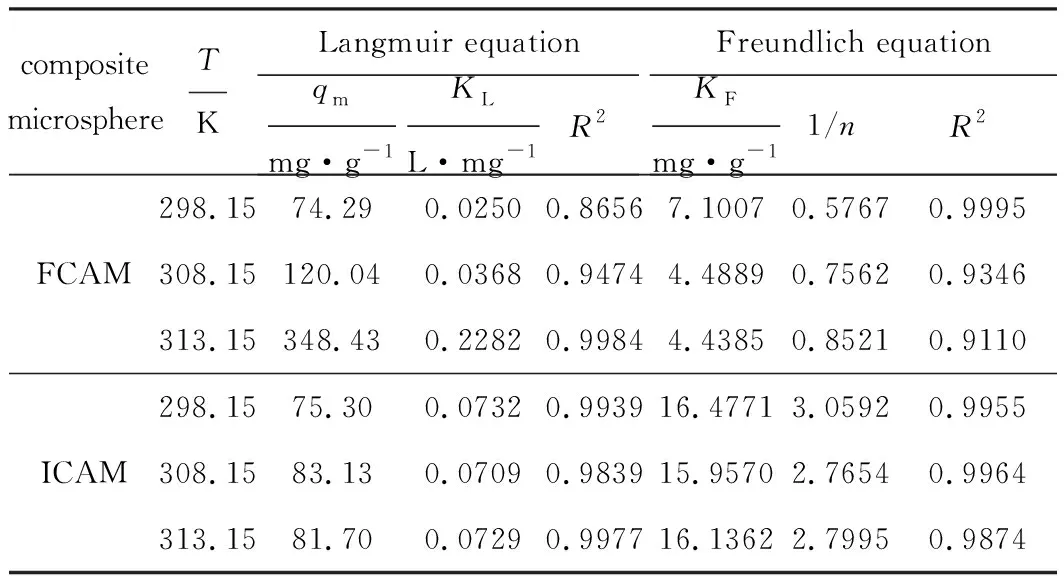
表3 复合微球吸附Cu(Ⅱ)的等温吸附方程参数
由表3可知,在298.15~313.15 K范围内,复合微球FCAM、ICAM对Cu(Ⅱ)的吸附更符合Freundlich等温吸附方程,表明复合微球FCAM、ICAM与Cu(Ⅱ)的结合方式更倾向于多层吸附[22];复合微球FCAM、ICAM对Cu(Ⅱ)的吸附量整体随温度的升高逐渐升高,说明温度越高越有利于吸附,吸附过程为吸热的化学吸附过程;复合微球FCAM对Cu(Ⅱ)的吸附量受温度影响更大,可能是因为复合微球FCAM吸附Cu(Ⅱ)的过程受重力影响较大,而温度升高使分子运动加快,更有利于吸附更多的Cu(Ⅱ)。
2.5.2 吸附热力学参数
根据Van′t Hoff方程对吸附实验结果进行热力学分析,计算吸附过程的吉布斯自由能变ΔG、焓变ΔH,以确定吸附过程的热效应和可行性。其公式如下[23]:
(10)
ΔG=-RTlnK
(11)
ΔG=ΔH-TΔS
(12)
式中:K为吸附平衡常数,L·g-1;qe为平衡吸附量,mg·g-1;c0和ce分别为Cu(Ⅱ)的初始浓度和吸附平衡浓度,mg·L-1;V为溶液体积,L;m为吸附剂投加量,g;T为热力学温度,K。
复合微球FCAM、ICAM吸附Cu(Ⅱ)过程的热力学参数见表4。
由表4可知:(1)ΔG<0且数值随温度升高趋于更负,说明复合微球FCAM、ICAM对Cu(Ⅱ)的吸附过程可自发进行,侧面反映升高温度有利于吸附,吸附作用主要是固液两相浓度差所致的传质推动力以及EDTA-2Na与Cu(Ⅱ)的络合作用,属于物理化学吸附;
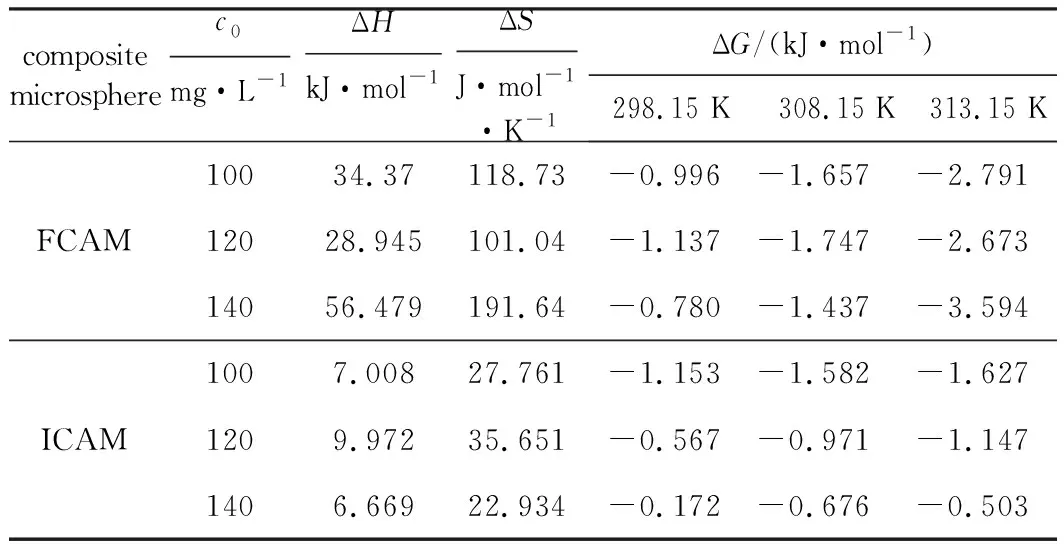
表4 复合微球吸附Cu(Ⅱ)的热力学参数
(2)ΔH>0,说明吸附过程吸热,与Freundlich等温吸附方程的拟合结果一致;(3)ΔS>0,说明吸附过程是熵增过程,Cu(Ⅱ)在吸附剂表面逐渐呈无序状态。
3 结论
以EDTA-2Na/CaCO3、海藻酸钠为原料,以氯化钙为固化剂,调控EDTA-2Na与CaCO3、海藻酸钠与EDTA-2Na/CaCO3的配比,采用原位化学交联法制备了不同密度的海藻酸钙复合微球FCAM、ICAM。该复合微球制备工艺简单,成本低。室温下,在复合微球投加量为1.32 g·L-1、Cu(Ⅱ)初始浓度为90 mg·L-1、吸附时间为300 min、体系pH值为5时, 复合微球ICAM对Cu(Ⅱ)的吸附量为61.84 mg·g-1。该复合微球对Cu(Ⅱ)的吸附过程符合准二级动力学方程,符合Freundlich等温吸附方程,吸附可自发进行。该复合微球在工业废水处理领域具有广阔的市场发展前景。

