不同薄壳山核桃品种的根际土壤真菌群落结构研究
汤玉洁, 刘俊萍, 储国林, 刘帅, 彭方仁
(1.南京林业大学林学院,江苏 南京 210037; 2.南京林业大学南方现代林业协同创新中心,江苏 南京 210037)
根际即指植物根部周围的土壤区域,是承接土壤与植物界面的中间媒介。而根际微生物作为根际活跃区系中重要组成部分,在土壤界面上能够促进土壤有机质、腐殖质及营养元素的分解、形成、转化和循环过程[1],成为评价土壤环境条件和肥力参数指标之一;在植物界面上可以调控植物生产力、抗逆性和生长发育等方面[2-3],达到促进植物生长、提高产量的目的。研究表明,土壤环境和宿主植物都会影响根际微生物的组成[4],而在植物因素中,除了宿主、年龄等差异外,品种的不同也会对根际微生物的群落结构造成影响,在茶树(Camelliasinensis)[5]、苎麻(Boehmerianivea(L.)Gaudich.)[6]、马铃薯(SolanumtuberosumL.)[7]等植物中均有相关论述。因此,有关根际微生物的研究在提高土壤有效利用,维持植物生长发育等方面有着重要意义。
近年来,随着高通量测序等分子生物学技术的兴起,使得根际微生物特征的研究得到了进一步发展。在森林生态系统中,根际微生物与林木根系之间存在着相互作用[8],其多样性及群落组成在一定程度上反映林木的健康和生长情况。其中,真菌可以与根系建立共生关系,形成外生菌根、内外生菌根及丛枝菌根等类型[9]。DE VRIES等[10]的研究表明,干旱条件下真菌比细菌具有更强的稳定性和抗逆性,但在已有认知的数据中仅3%~8%的真菌物种得到命名[11],其研究体系略显不足。因此,作为根际微生物中一类重要资源,真菌具有不可忽视的作用与地位。
薄壳山核桃[Caryaillinoinensis(Wangenh.)K. Koch]是胡桃科(Juglandaceae)山核桃属(Carya)的重要干果经济林树种,集经济、环境、生态综合效益于一体,市场潜力巨大。研究薄壳山核桃根际微生物的生物群落特征是开发利用有益微生物资源及实现薄壳山核桃产业可持续发展的有效途径之一。研究表明,薄壳山核桃品种与根际细菌多样性存在联系[12],但有关不同品种根际真菌群落的研究较少。目前,薄壳山核桃真菌相关研究多以生物防治[13]为主,在土壤界面上集中于单一真菌群体研究,如块菌[14]、丛枝菌根真菌[15]等,缺乏对薄壳山核桃根际土壤真菌群落特征的整体认知。
李永荣等[16]筛选出了6个包括波尼(Pawnee)、马罕(Mahan)、金华(Jinhua)在内的综合经济性状高的薄壳山核桃品种,适宜推广种植。其中,波尼和金华是“中果型”品种,马罕则是“大果型”品种。研究表明,在生长特性、光合能力及果实性状等方面3个品种存在差异[17-18],但品种间地上部分生物学特性的不同是否会导致地下根际土壤真菌存在差异还不清楚。因此,本研究选择以上3个品种的薄壳山核桃根际土壤为研究对象,采用高通量测序技术分析根际土壤真菌群落组成、多样性及主要生态功能,同时进一步探究土壤因子与根际土壤真菌群落结构的关系,以期为调控根际微生物组构建,实现薄壳山核桃有益微生物资源的开发利用提供相关理论依据,在推动薄壳山核桃产业可持续发展及维护林木健康等方面具有重要意义。
1 材料与方法
1.1 试验地概况
试验地选择位于江苏省句容市后白镇张庙村的南京林业大学薄壳山核桃试验基地(31°52′47″N,119°9′5″E)。该试验地地处丘陵地带,属亚热带季风气候,夏季高温多雨,冬季低温少雨,年平均气温为15.6 ℃,活动积温4 840 ℃,年均降水量可至1 018.6 mm,无霜期达229 d。土壤类型为黄棕壤土,土壤密度为1.39~1.50 g·m-3,孔隙度为44 %~48 %,pH值为6.3,全氮含量为1.38 g·kg-1,有效磷、速效钾含量分别为37.88、188.80 mg·kg-1[19]。
1.2 试验设计与材料
试验材料为种植在同一薄壳山核桃试验林中的3个7 a生主栽品种:波尼、马罕、金华,其基本长势如表1所示,种植期间灌溉、施肥及其他管护措施保持一致。

表1 采样地不同薄壳山核桃品种的生长情况Table 1 Growth of different varieties of pecan in sampling area
试验采取单因素完全随机化设计,以根际土样为试验样本,设置6个生物学重复,同时为保证取样的代表性,减少组内误差,遵循多点取样的原则,每一树木选择4点(东、南、西、北)取样,并将3株树木的根际土样混为1个样本,即1次重复,采样方法参照前人研究[20-21]的抖落法取样,3个品种共选取54株样树,获得18份根际土样。
1.3 研究方法
1.3.1 根际土壤的采集 于2020年9月在上述试验林内每品种随机选取18株树龄相同、生长健壮、无病虫害的薄壳山核桃树木,距离树干基部0.5 m为半径范围,距离地表0~60 cm深度,设置“东”“南”“西”“北”方位的4个取样点进行挖土,采集土壤中直径2 mm以下的细根。首先将不含根系的大块土样抖落,再借助无菌的小刷子将黏附根系周围(<5 mm)的土壤刷下,3株树下4个取样点的土壤混匀作为1份根际土样,土样装入无菌袋中带回实验室。在实验室内除去18份根际土样中的杂物并过2 mm筛:一部分新鲜土样在-80 ℃下保存,用于根际土壤微生物分析及土壤铵态氮、硝态氮含量测定;另一部分自然风干后用于剩余土壤性质指标测定。

1.3.3 根际土壤DNA的提取 称取0.5 g新鲜土壤按照FastDNA®Spin Kit for Soil试剂盒上操作步骤进行土壤微生物DNA的提取,以1%琼脂糖凝胶电泳检测DNA质量(5 V·cm-1, 20 min),利用NanoDrop 2000分光光度计检测DNA纯度及浓度。
1.3.4 根际土壤微生物序列的扩增及高通量测序 提取的DNA作为模板,以真菌通用引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)对真菌ITS基因的ITS1区域进行PCR扩增。PCR选择TaKaRa rTaq DNA聚合酶,20 μL反应体系,反应条件及扩增程序为 95 ℃预变性3 min,35个循环数(95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸45 s);然后72 ℃延伸10 min,最终10 ℃停止并保存。每个样本3次重复(PCR仪:ABI GeneAmp®9700型)。
扩增结束后回收PCR产物并经过纯化、检测、定量,下一步利用Illumina Miseq技术测序平台(PE300)进行文库构建、测序等后续操作,委托至上海美吉生物医药科技有限公司操作。原始数据已上传至NCBI SRA数据库(序列号:PRJNA777363)。
1.3.5 数据的处理及分析 测序的原始数据(Raw Data)利用fastp(version 0.20.0)和FLASH(version 1.2.7)软件进行质控、过滤、拼接得到有效的测序数据(Effective Tags)。
通过UPARSE软件(version 7.1)在97 %的相似度下对序列进行分类操作单元(OTU)聚类并去除嵌合体,经过RDP classifier(version 2.2)并比对Unite真菌数据库(Release 7.2,置信度阈值0.7)得到不同分类水平下物种分类注释的OTU数据,以各样本最小数据量为标准作均一化处理,后续均基于抽平处理后的数据进行分析。
α多样性分析:采用Mothur软件计算Alpha多样性指数,包括指示群落丰富度(Sobs、Chao、Ace)、群落多样性(Shannon、Simpson)和群落覆盖度(Coverage)的参数。
β多样性分析:利用R语言软件进行基于weighted_unifrac距离矩阵的PCoA分析、Adonis检验(vegan包)和PLS-DA分析(mixOmics包)。其中PLS-DA(Partial Least Squares Discriminant Ana-lysis),即偏最小二乘法判别分析,是一种有监督的多变量统计分析方法。其原理是利用偏最小二乘回归建立关系模型,通过数据降维及增强组间系统差异来处理分类和判别的问题。研究表明,当PCoA分析无法很好地显示样本区分时,通过有监督的PLS-DA分析可以对样本划分的分组进行线性判别和分类建模,从而实现有效分离和识别样本的分组[23]。
通过R语言软件进行门(Phylum)、科(Family)、属(Genus)分类下群落丰度柱形图(Others<0.01)绘制、土壤环境因子与微生物的CCA分析(vegan包)及Spearman相关性热图绘制(pheatmap package);利用Kruskal-Wallis秩和检验进行样本物种间的差异分析(P<0.05),FDR多重检验校正P值;利用LEfSe软件中的线性回归分析(LDA>3.5)判定具有显著差异物种的影响效果;比对FUNGuild数据库进行真菌功能预测。
2 结果与分析
2.1 不同薄壳山核桃品种的根际土壤真菌多样性分析
本次测序共得到1 028 467条有效序列,平均长度约为258 bp,总碱基数达265 432 017 bp,经过最小样本序列数40 014为标准均一化处理后共得到720 252条有效序列,1 765个OTU。
对波尼、马罕和金华3个品种的根际土壤进行真菌稀释曲线分析,如图1所示。各样本曲线在测序量到达一定深度后进入缓慢上升期,逐渐趋向于平坦。说明试验中测序数据量合理,均一化处理并不会对数据有大量的损失,测序深度足够覆盖到大多数真菌类群,增加测序量只会产生少量的新物种。
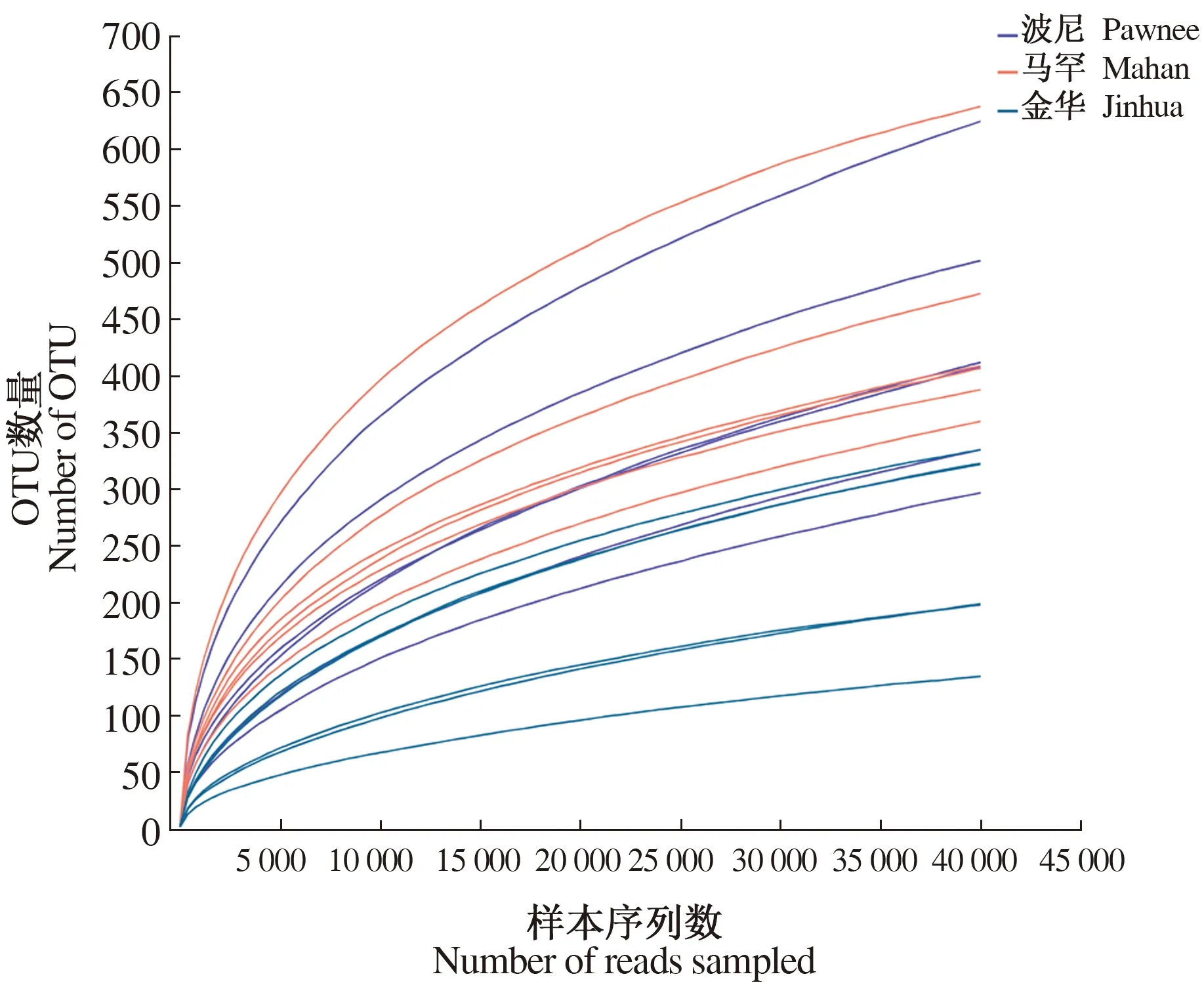
图1 不同薄壳山核桃品种的根际真菌稀释曲线图Fig.1 Dilution curves of rhizosphere soil fungi under different varieties of pecan
对波尼、马罕和金华3个品种根际土壤真菌的α多样性指数进行分析,结果如表2所示。Sobs指数以马罕最高,显著高于金华根际样本43.57 %;Chao和Ace指数以波尼高于马罕且两者差异不显著。因此,金华根际土壤真菌的丰富度和多样性显著低于马罕、波尼2个品种。另外,3个品种根际样本的Coverage均在0.99以上,结合稀释曲线图说明本研究样本测序量及测序深度的合理性,可以很好地反映不同薄壳山核桃品种的根际土壤真菌群落情况。

表2 不同薄壳山核桃品种的根际土壤真菌Alpha多样性指数Table 2 Alpha diversity index of rhizosphere soil fungi under different varieties of pecan
2.2 不同薄壳山核桃品种的根际土壤真菌群落组成分析
在波尼、马罕和金华3个品种的根际样本中共检测出14个门类、231个科类及458个属类真菌类群。制作门、科、属水平上的群落丰度柱形图用于反映根际土壤真菌组成的优势情况及相对丰度占比,如图2所示。
在门水平上,3个品种的根际土壤真菌主要由子囊菌门(Ascomycota)、担子菌门(Basidiomycota)及被孢霉菌门(Mortierellomycota)组成,平均合计占比达99.28%。其中,子囊菌门(Ascomycota)和担子菌门(Basidiomycota)是主要优势类群,平均丰度分别为59.32%、39.26%。而被孢霉菌门(Mortierellomycota)丰度占比较小,仅在马罕根际样本中达到1%以上(图2-a)。
在科水平上,3个品种的根际土壤真菌主要包括盘菌科(Pezizaceae)、革菌科(Thelephoraceae)、火丝菌科(Pyronemataceae)、层腹菌科(Hymenogastraceae)、丛赤壳科(Nectriaceae)等,其中盘菌科(Pezizaceae)、革菌科(Thelephoraceae)在3个品种的根际土壤中均占有一定优势,平均丰度分别为27.25%、25.38%(图2-b)。
在属水平上,3个品种的根际土壤真菌主要包括unclassified_f__Pyronemataceae、Delastria、unclassified_f__Thelephoraceae、滑锈伞属(Hebeloma)、丝盖伞属(Inocybe)等,其中unclassified_f__Thelephoraceae在3个品种的根际土壤中均占有一定优势,平均占比在25%以上(图2-c)。
由此可以看出,3个品种根际门类真菌的物种组成相似;在科、属水平上,盘菌科(Pezizaceae)、革菌科(Thelephoraceae)及unclassified_f__Thelephoraceae是薄壳山核桃根际土壤真菌的优势物种。另外相较于其他2个品种,金华根际土壤真菌的组成结构明显较为单一。
2.3 不同薄壳山核桃品种的根际土壤真菌结构差异性分析
根据样本中真菌OTU组成的差异情况进行PCoA分析,并结合Adonis进行组间差异检验,用于反映样本差异及距离并判断差异的显著性,结果如图3(a)所示,其中R2值代表分组因素对样本差异的解释度,R2越大解释度越高;P值小于0.05,说明本次检验的可信度高。PC1和PC2的解释度分别为45.22%、28.30%,累积达到73.52%;样本点越接近,表明样本物种组成越相似,而3个品种的根际土壤真菌OTU样本离散分布,分组区分效果并不理想(R2=0.419 9,P=0.002)。
进一步通过PLS-DA分析结果如图3(b)所示,可以看出3个品种根际样本分布各自为一类,说明不同薄壳山核桃品种的根际土壤真菌群落存在显著差异(P<0.05),其中波尼和马罕样本分布更为接近,相似度更高,而金华与其他2个品种差异更大。
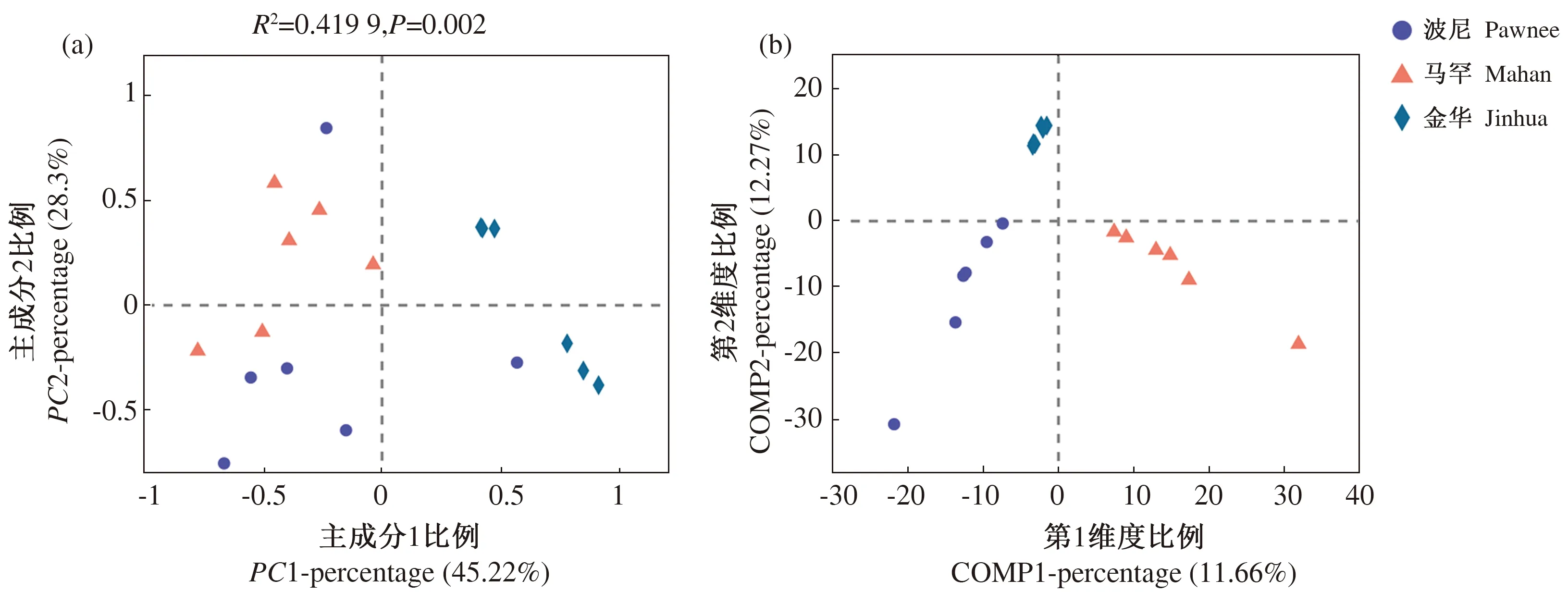
图3 不同薄壳山核桃品种根际土壤真菌OTU组成的PCoA图(a)及PLS-DA图(b)Fig.3 Principal co-ordinates analysis(a)and partial least squares discriminant analysis (b)
在属水平上,对波尼、马罕和金华3个品种根际样本中丰度前15的真菌群落进行Kruskal-Wallis秩和检验,用于找出不同样本中具有显著差异的物种,结果如图4所示。利用LEfSe分析中的LDA分值可判别具有显著差异物种的影响程度,LDA值越高,其差异效果越明显,统计具有显著差异的真菌LDA值(LDA>3.5)如表3所示。
在3个品种根际样本中,Delastria、滑锈伞属(Hebeloma)、unclassified_f__Pyronemataceae、毛壳菌属(Chaetomium)、镰刀菌属(Fusarium)、脆锈伞属(Naucoria)等真菌具有显著差异(P<0.05),其中,Delastria(LDA=5.44)在金华根际土中显著富集,相对丰度为61.01%;unclassified_f__Pyronemataceae(LDA=5.11)在波尼根际土中显著富集,相对丰度为27.01%;滑锈伞属(Hebeloma)(LDA=4.64)、脆锈伞属(Naucoria)(LDA=4.45)在马罕根际土中显著富集,相对丰度分别为9.88%、5.67%,这些物种均表现出较大的差异影响和较高的丰度优势。由此可知,3个品种的根际土壤各自形成了具有一定富集效应的标志真菌群。

图4 不同薄壳山核桃品种的根际土壤属类真菌组间差异比较图Fig.4 Statistical comparison of the relative abundance of rhizosphere soil fungi under different varieties of pecan
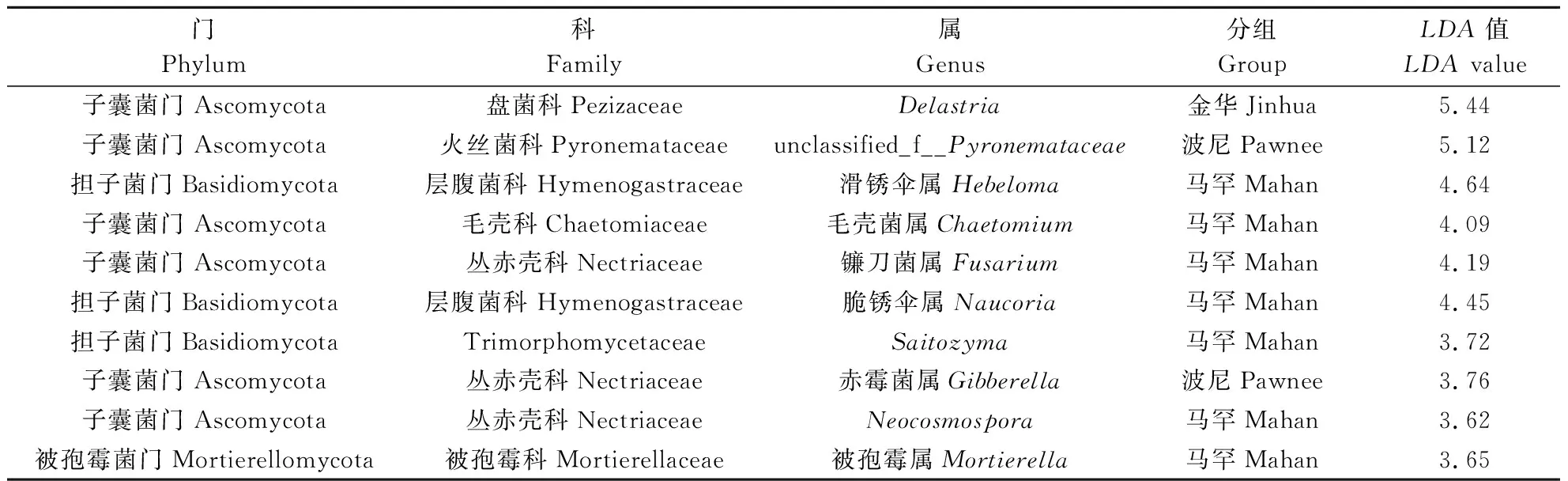
表3 不同薄壳山核桃品种的根际土壤属类真菌差异判别分析表(LDA>3.5)Table 3 LEfSe analysis of rhizosphere fungi under different varieties of pecan (LDA>3.5)
2.4 不同薄壳山核桃品种的根际土壤因子与真菌关联分析
由表4可知,金华根际土壤铵态氮含量显著低于波尼和马罕(P<0.05);pH值及有效磷含量均为波尼和马罕高于金华根际土壤,而硝态氮及速效钾含量为马罕根际土壤最低,全氮含量为波尼根际土壤最低。
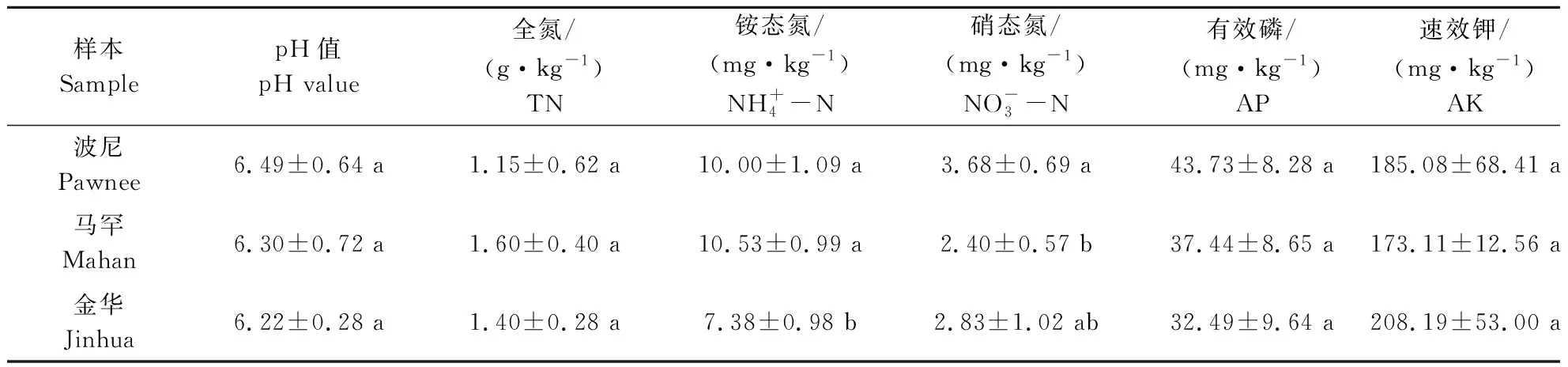
表4 不同薄壳山核桃品种的根际土壤化学性质分析Table 4 Chemical properties of rhizosphere soil under different varieties of pecan
根际土壤化学性质指标与真菌的关联分析如图5-a所示。第一、二排序轴解释度分别为15.06%、10.99%,共计26.05%。其中pH值(r2=0.532,P=0.004)、铵态氮(r2=0.469,P=0.007)及有效磷(r2=367,P=0.032)是影响根际土壤真菌群落结构的主要环境因子,呈现显著相关性。
属水平上丰度前15的根际真菌与土壤化学性质的Spearman相关性热图如5-b所示,可以看出根际细菌物种与特定的土壤因子之间存在相关性。其中,在3个品种根际土壤中具有富集效应的标志真菌unclassified_f__Pyronemataceae与铵态氮、pH值及有效磷呈现显著正相关性,Delastria与铵态氮呈显著负相关性,滑锈伞属(Hebeloma)则与pH值呈显著正相关性(P<0.05)。
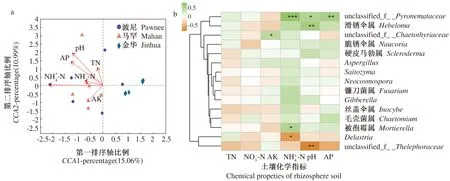
图5 薄壳山核桃根际土壤因子与真菌的关联分析图Fig.5 Correlation analysis of rhizosphere soil factors and fungi in pecan
2.5 不同薄壳山核桃品种的根际土壤真菌功能预测分析
对波尼、马罕和金华3个品种根际样本进行FUNGuild真菌功能预测,结果如图6所示,注释功能真菌占比在96%以上。以营养方式(Trophic Mode)划分,3个品种根际样本主要由3种基本营养型及3类交叉营养型组成,包括共生营养型、腐生营养型、病理营养型、腐生-共生营养型、病理-共生营养型、病理-腐生-共生营养型。根据Guilds小类,在波尼和马罕根际样本中主要由外生菌根真菌(ectomycorrhizal)、粪生-外生菌根-土壤腐生-木质腐生真菌(dung saprotroph-ectomycorrhizal-soil saprotroph-wood saprotroph)、外生菌根-未定义腐生真菌(ectomycorrhizal-undefined saprotroph)等功能真菌群组成。其中,外生菌根真菌(ectomycorrhizal)在波尼根际样本中占比最高为27.69%,外生菌根-未定义腐生真菌(ectomycorrhizal-undefined saprotroph)在马罕根际样本中占比最高为26.73%;而金华根际样本主要由外生菌根真菌(ectomycorrhizal)和外生菌根-未定义腐生真菌(ectomycorrhizal-undefined saprotroph)2类功能真菌群组成,累积占比达92%以上。
由此可以看出,薄壳山核桃根际样本功能真菌以腐生-共生营养型、共生营养型为主,平均相对丰度分别为42.90%、38.16%,其次为病理-共生营养型(12.52%)、病理-腐生-共生营养型(4.22%)、腐生营养型(3.17%),而病理营养型的平均相对丰度较低,仅为0.57%。
3 结论与讨论
根际微生物以共生、寄生或互生等方式附着在根际土壤中[24],形成数量丰富的活跃区系,其多样性特征可以作为反映整个根际结构稳定性及植物生长状况的重要指标。在本研究中,金华根际土壤真菌的多样性显著低于马罕、波尼。这可能与品种间的性状差异有关。研究表明,根系分泌物是影响根际微生物多样性的重要因素,在一定程度上决定根际微生物的分布数量及种类[25]。马罕和波尼作为薄壳山核桃树种中的优良品种,具有较强的适应能力和推广价值[26-27],而金华在生长及适应性上处于劣势,根系发育能力较低,影响了根系分泌物的释放,根际微生物的繁殖受到抑制[28],最终导致多样性水平低于其他2个品种。另一方面,植物根系在向土壤中分泌相关物质,诱导微生物向根际聚集的同时,也会影响土壤pH值、矿质元素形态等来改变根际环境,形成明显的根际效应[29]。在本研究中,pH值、铵态氮及有效磷是影响根际土壤真菌群落结构的主要环境因子。研究表明,土壤pH值和养分状况都会对微生物群落组成产生一定的影响[30],其中由于微生物存在生长最适pH值和一定的耐受范围,所以当pH值出现变化时,其作用会逐渐增强成为首要影响因子[31]。SHEN等[32]和李德会等[33]的研究也证明了土壤pH值对真菌群落的影响。这与本研究结果一致。
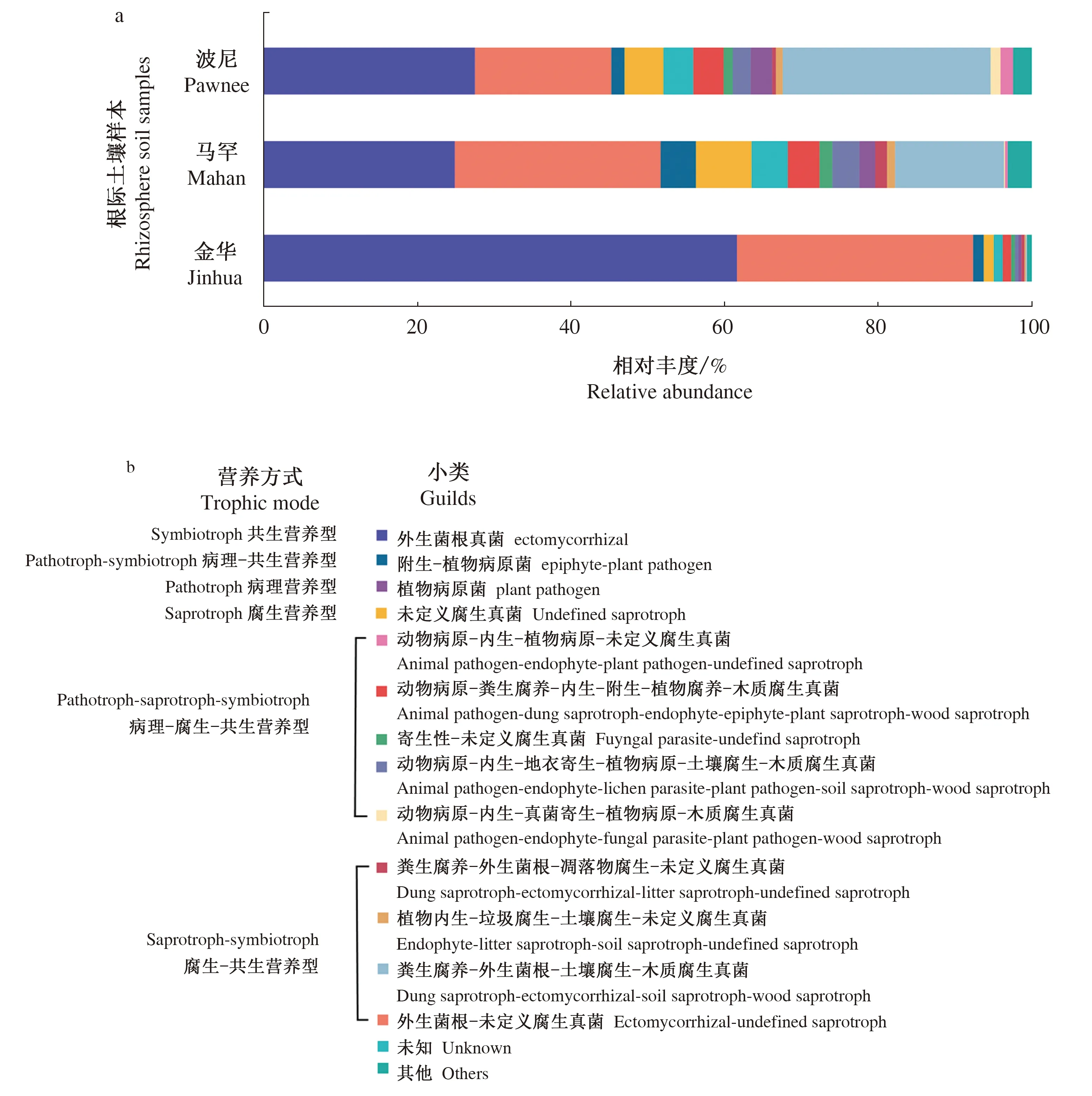
图6 不同薄壳山核桃品种的根际土壤真菌FUNGuild功能分析图Fig.6 Functional prediction based on FUNGuild of rhizosphere soil fungi under different varieties of pecan

根际微生物组与宿主植物间存在明显的有益交互机制,包括提高养分的吸收利用、诱导产生抗性和促进生长发育等,从而支撑植物体形成健康的繁殖体系[39],其中根际微生物组的生态功能在一定程度上反映了宿主植物生长需求和健康状况。本研究中,基于FUNGuild注释下薄壳山核桃的根际土壤真菌功能包括共生、腐生、病理、腐生-共生、病理-共生、病理-腐生-共生等3种基本营养型及3类交叉营养型,不同品种间的功能类型基本一致,主要以腐生-共生营养型和共生营养型为主,表明根际土壤真菌主要介导薄壳山核桃土壤养分循环过程,这与肖方南等[40]的研究一致。而病理营养型的平均相对丰度较低,说明其根际土壤真菌群落结构比较健康,生长环境条件适宜。另外,FUNGuild是基于已有文献对真菌功能进行判别分析,划分类别不够全面和完善,还存在未知的功能注释,因此仍需进一步研究。
综上所述,本研究中不同薄壳山核桃品种根际土壤真菌的群落组成及多样性存在显著差异,pH值是影响其群落结构的首要因子。在属水平上,不同品种根际土壤中存在着具有富集效应的标志真菌群,多为外生菌根真菌,在功能上以腐生-共生和共生两大营养型为主,对薄壳山核桃的养分循环及抗逆能力具有重要意义。因此,未来应该密切关注外生菌根群落与薄壳山核桃之间的共生作用机制及其对环境变化的响应情况。另外,本研究为薄壳山核桃根际有益微生物资源的筛选提供了相关的理论基础,但由于试验仅考虑了品种因素对于薄壳山核桃根际土壤微生物的影响,存在一定的局限性,在后续工作中将继续开展有关土壤类型、林分年龄及林木生长等因素影响的研究。

