响应面分析法优化刺梨果多糖的脱色工艺
李倩倩,李淑芳,陈贵元,2*
(1.大理大学基础医学院,云南 大理 671000;2.云南省昆虫生物医药研发重点实验室,云南 大理 671000)
刺梨中丰富的维生素C含量可促使机体干扰素的合成,当干扰素进入人体后,主要通过细胞表面的受体作用激发细胞产生抗病毒的蛋白,阻止病毒在人体细胞中粘附、聚集、定植和过度繁殖,从而达到抗病毒的目的[1-2]。根据《中国食品成分标准版》,新鲜成熟的刺梨中维生素C含量为2585.0mg/100g,是苹果的861.67倍,柠檬的117.5倍,中华猕猴桃的41.69倍[3]。刺梨中富含多糖[4]、多酚[5]、黄酮[6]、超氧化物歧化酶[7]等重要的生化分子。至此,越来越多的相关产品并非简单地将刺梨果原材料进行初步加工,而是趋向于以刺梨果水提物为原料进行深度加工[8]。众所周知,采用水提醇沉法[9]浸提的刺梨多糖色泽呈黑褐色、浑浊、黏稠度增加,大量色素的存在会干扰后续的分离纯化、质量分析、结构剖析以及生物活性的研发[10-11]。鉴于此,对刺梨果水提物进行脱色的研究势在必行。
针对植物多糖的脱色方式有活性炭[12]、树脂[13]、过氧化氢[14]、反胶束[15]等主要的脱色方式,其中活性炭[16]具有吸附强、过滤快、比表面积大、内部空隙发达、理化性质稳定、耐热、耐酸、耐碱等天然优势[17]。综上所述,利用活性炭吸附法对刺梨果多糖进行脱色。
1 材料与方法
1.1 材料与试剂
刺梨果:购自贵州省遵义市产品。活性炭:上海琪特分析仪器有限公司。98%浓硫酸溶液、蒽酮、无水葡萄糖、葡萄糖:以上为分析纯,均来自国药集团化学试剂有限公司。
1.2 仪器与设备
TGL-16B高速台式离心机:上海安亭科学仪器厂;RE-3000型旋转蒸发仪:上海亚荣生化仪器有限公司;UV-8000紫外可见光分光光度计:上海元析仪器有限公司。
1.3 方法
1.3.1 刺梨果多糖的制备 挑选新鲜刺梨鲜果,50℃烘干粉碎后过80目筛,制得刺梨果粉末。称取刺梨果粉末采用石油醚回流脱脂,过滤收集残渣烘干备用。采取热水浸提刺梨果多糖水溶液,收集提取液用离心机在4000r/min条件下离心15min,收集所有上清液,利用真空浓缩的方式减压浓缩至适量体积,然后加入4倍体积的无水乙醇静置过夜。之后使用丙酮洗脱残留的有机小分子,保留沉淀,冷冻干燥制成刺梨粗多糖[18]。准确称取适量刺梨粗多糖,配置成0.5mg/ml的刺梨果多糖水溶液,保存备用。
1.3.2 活性炭的预处理 将活性炭用去离子水洗涤多次,洗至中性,烘干后研磨成粉末型活性炭,保存备用[19]。
1.4 测定方法
1.4.1 葡萄糖标准曲线的绘制 现配置蒽酮-浓硫酸试剂。葡萄糖对照品溶液的配制:配制得1mg/ml的标准葡萄糖储备液。精密吸取标准葡萄糖储备液0ml、0.2ml、0.4ml、0.6ml、0.8ml、1.0ml、1.2ml置于7个2.0ml容量瓶中,加水稀释定容,振荡摇匀。标准曲线绘制:准确吸取上述葡萄糖对照品溶液依次各2.0ml于锥形瓶中,然后缓慢依次加入蒽酮-浓硫酸试剂4ml,轻轻振荡混匀,每支试管加完后同时置于沸水浴中加热10min,取出后冷却到室温。以去离子水作参比,于波长620nm处检测吸光度。以标准葡萄糖储备液的质量浓度(mg/ml)为X轴;各样品的吸光值(A620)为Y轴,绘制标准曲线。葡萄糖线性回归方程:Y=1.6579X+0.0141(R2=0.9994),表明葡萄糖标准溶液质量浓度在0~0.6(mg/ml)范围内与吸光度值呈现良好的线性关系[20]。
1.4.2 脱色率的测定与计算 如图1所示,将刺梨果多糖在200~800nm波长范围内进行双束紫外可见光全波长扫描,故无法测定其吸收值。由于刺梨果多糖溶液脱色前后稀释均为橙褐色或者橙黄色,依据互补色原理,刺梨果多糖溶液主要吸收蓝色波段(446~464nm)可见光[21]。因此,选择处于蓝色波段中心的450nm波长作为检测波长,进而测定其吸光度值(A450),其脱色率计算公式如下:

图1 刺梨粗多糖的全波长扫描

式(1)中,A表示脱色率,%;A0代表刺梨果多糖溶液通过活性炭脱色前于450nm处的吸光度值;A1代表刺梨果多糖溶液通过活性炭脱色后于450nm处的吸光度值。
1.4.3 多糖保留率的测定及计算 本试验采用蒽酮-浓硫酸法来测刺梨果多糖的含量,其多糖保留率计算公式如下:
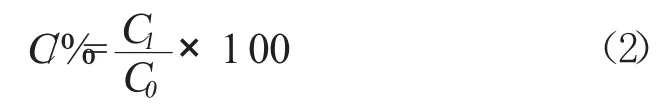
式(2)中,C表示多糖保留率的综合评分,分;C0代表刺梨果多糖溶液脱色前多糖色素质量浓度,mg/ml;C1代表刺梨果多糖溶液脱色后多糖色素质量浓度,mg/ml。
1.4.4 综合评分 根据采用数据加权平均法,将刺梨果多糖的脱色率和多糖保留率两者的权重值均设为50,总分计算为100分,其综合评分计算公式如下[22]:

式(3)中,B表示脱色率的综合评分,分;A表示脱色率,%;Amax表示脱色率的最大值,%;C表示多糖保留率,%;Cmax表示多糖保留率的最大值,%。
1.5 工艺优化
1.5.1 单因素试验
1.5.1.1 在固定活性炭添加量1.5%、脱色温度60℃的条件下,评价不同脱色时间(10min、20min、30min、40min、50min)对刺梨果多糖脱色率的影响。
1.5.1.2 在设定反应条件为活性炭添加量1.5%、脱色时间30min的情况下,分析不同脱色温度(30℃、40℃、50℃、60℃、70℃)对刺梨果多糖脱色率的影响。
1.5.1.3 在控制反应条件为脱色时间30min、脱色温度60℃的情况下,比较不同活性炭添加量(0.5%、1%、1.5%、2%、2.5%)对刺梨果多糖脱色率的影响。
以上3组单因素试验均进行3次重复试验,以考察各种因素对刺梨果多糖脱色率和多糖保留率的影响。
1.5.2 Box-Behnken试验设计 在上述3组单因素试验基础上,进一步研究脱色时间(A)、脱色温度(B)和活性炭添加量(C)3个自变量之间的交互作用,以脱色率和多糖保留率组成的脱色效果综合评分(Y)为指标,应用Box-Behnken试验原理,采用3因素3水平响应面分析法进行试验设计(共17组),响应面因素水平编码如表1所示。

表1 响应面设计试验因素与水平
1.6 数据统计与分析
采 用Design-Expert10.0、Excel、Origin9.0等分析软件对数据进行统计分析和绘图。
2 结果与分析
2.1 单因素试验结果
2.1.1 脱色时间对脱色工艺的影响 如图2所示,随着脱色时间的延长,脱色率大致呈直线上升趋势,但是多糖保留率在20min时出现最高峰,之后呈逐步下降趋势。这可能是由于活性炭脱色是一个动态的吸附与解吸过程,吸附平衡的时间刚好为40min左右,40min之后,脱色效果随时间的增加只是略微增加,基本趋于饱和吸附状态[23]。

图2 脱色时间对刺梨果水提取物脱色率与多糖保留率的影响
如图3所示,综合考虑选取脱色时间20min、30min和40min作为响应面优化的3个水平。

图3 脱色时间对刺梨果水提取物综合评分的影响
2.1.2 脱色温度对脱色工艺的影响 如图4所示,当脱色温度小于40℃时,脱色率曲线呈现直线上升趋势。可能由于温度增高则势能提高,势能转变成动能,分子扩散速度加快,加强了色素颗粒与活性炭之间的互相碰撞机会,使脱色率不断上升[24]。当脱色时间到达40℃时,活性炭对色素颗粒的吸附能力达到平衡;40℃之后,活性炭可以将已经吸附的组分脱附下来,简称为“升温脱附[25]”,致使脱色率呈现缓慢下降趋势。多糖保留率随脱色温度的升高呈下降的趋势,可能是由于在较低温度时多糖提取液黏度降低,有利于糖液中色素的扩散,活性炭吸附色素的同时也会对刺梨果多糖分子吸附,同时温度的升高多糖提取液发生焦糖化,致使多糖保留率呈现下降趋势[26]。
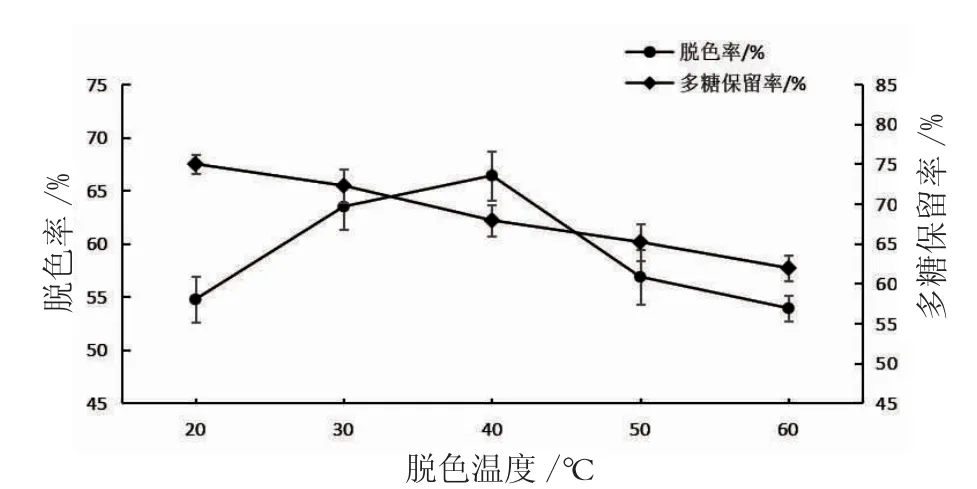
图4 脱色温度对刺梨果水提取物脱色率与多糖保留率的影响
如图5所示,综合考虑将脱色温度20℃、30℃和40℃作为响应面优化的3个水平。

图5 脱色温度对刺梨果水提取物综合评分的影响
2.1.3 活性炭添加量对脱色工艺的影响 如图6所示,活性炭添加量在0.5%~1.5%范围内,脱色率与活性炭添加量成正比,但是多糖保留率与活性炭添加量成反比。可能是由于活性炭添加量的增加会增大分子之间相互吸附的能力,即“凡德瓦引力[27]”,相应的吸附量也逐渐升高,致使溶液中的色素分子及多糖类物质越来越多地被吸附,从而出现脱色率不断增加、多糖保留率持续降低的现象,但是当活性炭内孔径被填满时,则会出现脱色率下降的现象。

图6 活性炭添加量对刺梨果水提取物脱色率与多糖保留率的影响
如图7所示,综合考虑选取活性炭添加量1%、1.5%和2%作为响应面优化的3个水平。

图7 活性炭添加量对刺梨果水提取物综合评分的影响
2.2 脱色工艺的响应面优化
2.2.1 响应面试验的结果与方差分析 响应面试验设计结果如表2所示,刺梨果多糖脱色率与多糖保留率构成的脱色效果综合评分(Y)与各因素的二次方程模型:


表2 Box-Behnken试验设计与结果
由表3的回归模型方差分析可知,回归模型达到极显著水平(p<0.0001),表明该模型具有极显著意义;失拟项不显著(p>0.05),则回归模型与实际地试验值无明显差异。模型的一次项A、B、C,交互项AC以及二次项A2、B2、C2对脱色效果有极显著的影响(p<0.0001)。F值为方差检验,各因素对响应值影响强弱的顺序:B>A>C,说明脱色温度(B)对响应值的影响最显著。模型的校正决定系数R2Adj=0.994 7,说明该拟合模型所解释的因变量变化百分比为99.47%。模型的复相关系R2=0.9977,表明该模型拟合程度较高。

表3 Box-Behnken试验方差分析
2.2.2 各因素对刺梨果多糖脱色素交互影响的等高线图和响应面图 等高线(图8a、图9a、图10a)的形状及疏密程度可以反映2因素交互效应的强弱大小,等高线呈椭圆形且曲线密集表示2因素之间相互作用显著,若为圆形且曲线稀疏表示2因素对响应面的影响不显著[28]。如图9a所示,脱色时间和活性炭添加量的等高线呈椭圆形,说明两者交互作用显著;图8a的等高线呈圆形,说明脱色时间和脱色温度2因素之间的交互作用不明显,此结果与方差分析结果一致。
通过响应面(图8b、图9b、图10b)可更直观分析各因素对响应值的影响以及各因素间的交互效应。响应面的坡度反映各因素变化对响应值的影响,坡度相对较陡峭,则响应值对2因素的交互作用越敏感;坡度相对平缓,说明该因素对响应值的影响越小[29]。如图9b所示,脱色时间和活性炭添加量2因素构成的响应面坡度较陡,表明脱色时间和活性炭添加量作用较为敏感。

图8 脱色时间和脱色温度对刺梨果多糖水溶液综合评分的效果图
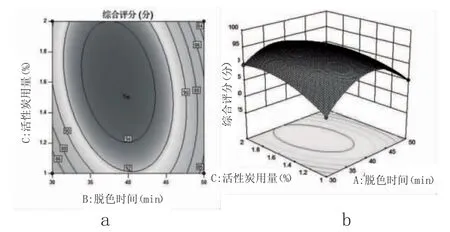
图9 脱色时间和活性炭用量对刺梨果多糖水溶液综合评分的效果图
2.2.3 最佳工艺参数的确定及验证性试验 根据二次多元回归方程的拟合,得到最佳脱色工艺的预测值:脱色时间38.573min、脱色温度32.092℃、活性炭添加量1.573%。此时最佳综合评分为96.080分。
根据最佳工艺预测值将试验条件调整为脱色时间40min、脱色温度30℃、活性炭添加量1.5%对刺梨果多糖脱色率进行验证性实验,平行试验3次,计算平均值,在此条件下脱色率为72.16%,多糖保留率为74.25%,综合评分为95.49分,接近预测值(96.080分),证明该回归模型提供参数的可靠性具有实际意义。
3 结论
本试验首次采用响应面法优化刺梨果多糖提取液活性炭脱色工艺,利用多元二次方程拟合因素与响应值之间的函数关系得到活性炭脱色的最优工艺参数:脱色时间40min、脱色温度30℃、活性炭添加量1.5%,在此条件下脱色率为72.16%,多糖保留率为74.25%,综合评分为95.49分,接近预测值(96.080分),可见该模型能较好地预测活性炭对刺梨果多糖脱色的效应。本试验运用响应面分析法求得的各参数组合范围全面,工艺参数具有精确性和可靠性,可以避免资源在实践生产过程中的过度浪费。
活性炭脱色因其成本较低,脱色效果较好,同时因活性炭脱色是物理吸附过程,不会破坏多糖结构,也不会引入新的杂质,适合工业化生产的需要,但是活性炭吸附属于非选择性、不定项的物理吸附,在吸附色素的同时会吸附多糖,造成多糖含量的损失,同时活性炭为黑色细微粉末状,本身颜色为黑色,也会对脱色过程带来一定的色值影响,如何去除活性炭本身的影响将成为下一个研究方向。

