《盐类的水解》系列疑难问题诊断、解决策略及价值
北京 谭德山 姜 成
《盐类的水解》一节是高中化学中的教学重点和难点,在高考中也多次考查,本节内容位于人教版教材选择性必修1的第三章第三节,可以认为是学生已经学习过的弱电解质的电离平衡、水的电离平衡以及化学平衡移动原理等知识的综合应用。笔者将《盐类的水解》一节中存在的疑难问题进行收集、归纳、梳理和整合,选择具有典型性和代表性的5个问题进行诊断,选择最佳的解决策略,供教师和学生参考,以减轻教师的备课压力和学生的学习负担,达到《盐类的水解》的教学难点突破和促进学生核心素养提高的初步效果。
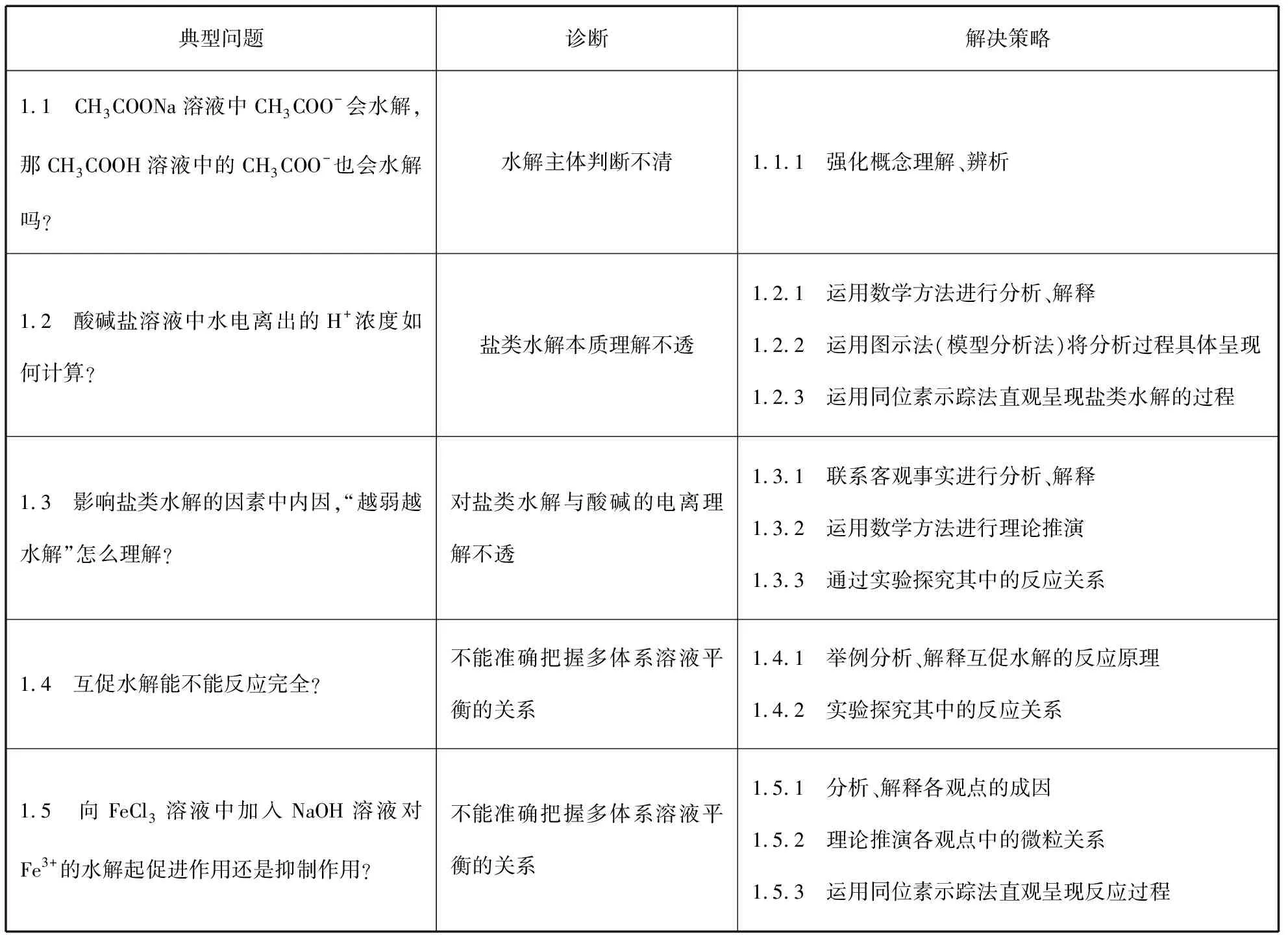
表1
一、疑难问题梳理、诊断与解决策略
1.“盐类的水解”就是指在盐溶液中,盐电离出的离子和水电离出的H+或OH-结合生成弱酸或弱碱,从而使水的电离平衡正向移动的过程。要注意这里的溶液中的主要溶质是盐,CH3COOH溶液中的CH3COO-也会结合H+,但是CH3COOH溶液中的主要溶质是酸,不是盐,CH3COO-结合H+是CH3COOH电离的逆过程,CH3COOH溶液中溶质主要发生电离而不是水解。

以Na2CO3溶液为例,绘制出水电离出的图1所示的H+和OH-在复杂体系中的来龙去脉,可以直观地反映出水电离产生的H+浓度数值上等于水中积累的OH-浓度。
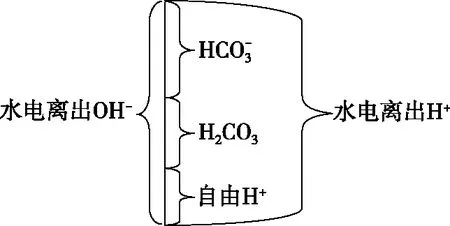
图1
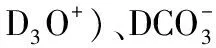
3.影响盐类水解的因素——物质的性质,可总结归纳为“越弱越水解”。首先可以列举事实进行说明,常见弱酸的电离程度与其对应弱酸根离子的水解程度如表2所示。
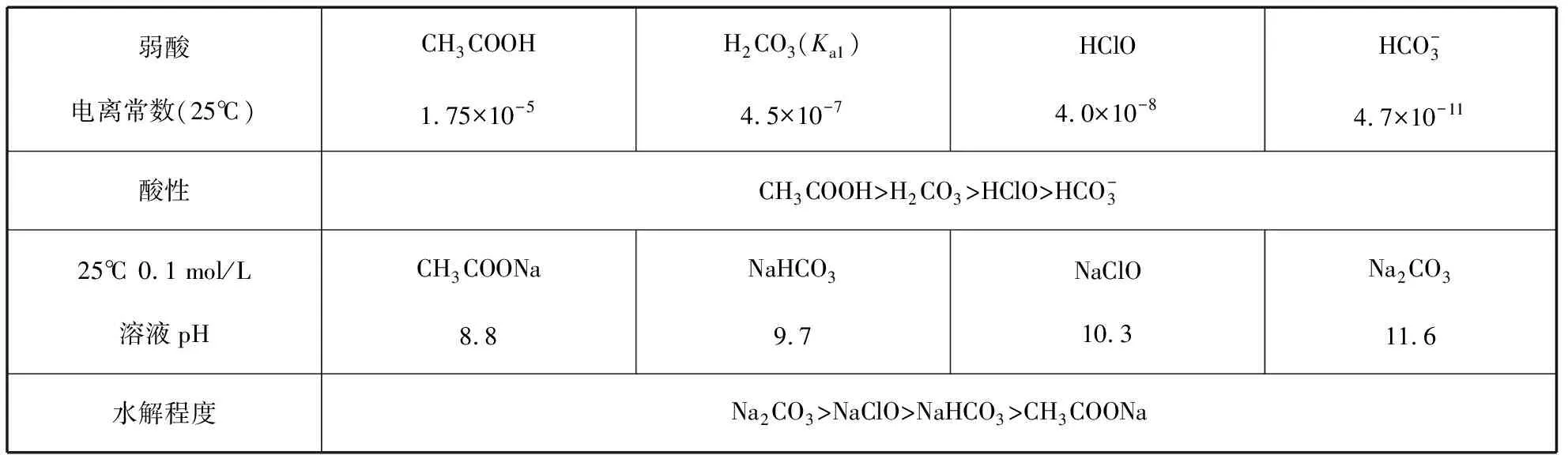
表2
此外,盐的水解程度可以用水解常数大小来衡量,下面以某弱酸强碱盐NaA溶液为例进行推演物质的性质与其水解常数的关系:
已知在NaA溶液中,存在以下平衡:

当水解达到平衡时,溶液中还存在关系:
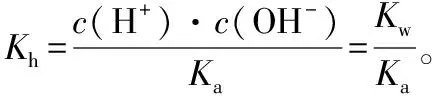
通过实验,可直观得出物质的性质对其水解常数的影响。配制两份温度和浓度均相等的CH3COONa、NaClO溶液,利用手持设备分别测定两种溶液的pH,pH越大,水解程度越大。


5.向FeCl3溶液中加入NaOH溶液对溶液中离子平衡的影响,主流的解释有如下三种。
【观点一】向FeCl3溶液中加入NaOH溶液,因为FeCl3溶液水解呈酸性,加入碱性物质,水解平衡受到促进,原因就是水解产生的H+和OH-反应,降低H+浓度,水解平衡正向移动,当然这种观点忽略了一个重要的因素,Fe3+也可以和OH-直接反应,所以这种观点经不起推敲。
【观点二】FeCl3溶液中Fe3+的浓度远大于H+的浓度,所以Fe3+最终都转化为Fe(OH)3,为此反应提供OH-的可以是NaOH溶液,也可以是水,NaOH溶液电离程度更大,提供的OH-浓度大,NaOH溶液电离出的OH-和Fe3+直接结合产生Fe(OH)3沉淀,反应速率更快,由此造成Fe3+的浓度降低,从而使水解平衡逆向移动,因而抑制水解。但这种观点也有两个问题值得质疑,一是速率和平衡是描述化学反应的两个维度,二是OH-和H+结合,与OH-和Fe3+相比,其速率与限度都是很大的,没有证据表明哪个反应更快、更彻底。
【观点三】Fe3+在水溶液中是以水合离子[Fe(H2O)6]3+的形式存在的,而且水解也是分步进行的。



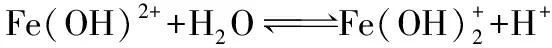


向FeCl3溶液中加入NaOH溶液,对离子反应的影响,也可进行理论推演:


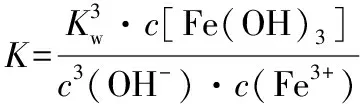
因为加入氢氧化钠溶液,c(OH-)增大,平衡常数K和Kw只受温度影响,Fe(OH)3溶解度很小,很容易饱和,浓度变化可忽略,故Fe3+浓度只有降低一种可能,表明平衡要向正向移动,水解程度增大。
还可以设计同位素示踪法探究“向FeCl3溶液中加入NaOH溶液对其离子平衡的影响”。向0.01 mol·L-1的FeCl3溶液中滴加0.01 mol·L-1NaOD溶液,待生成大量红褐色沉淀后停止滴加,过滤混合溶液,检验沉淀的放射性和滤液的放射性。若沉淀有放射性,则说明生成Fe(OD)3,FeCl3水解被抑制;再将滤液用半透膜进行渗析分离,取渗析液检验放射性,若无放射性,前述观点得到进一步验证;若仍有放射性,则说明也存在NaOD溶液与水解产生的H+的反应,需要进一步进行定量实验,判定两种趋势所占比例。
二、各种不同的教学策略,在核心素养养成和“双减”工作中的价值
《盐类的水解》教学中采取的教学策略主要有概念、原理的分析和理解、解释、理论推演、同位素跟踪和实验探究,表3是对这些教学策略在核心素养养成和“双减”工作中的价值反思。
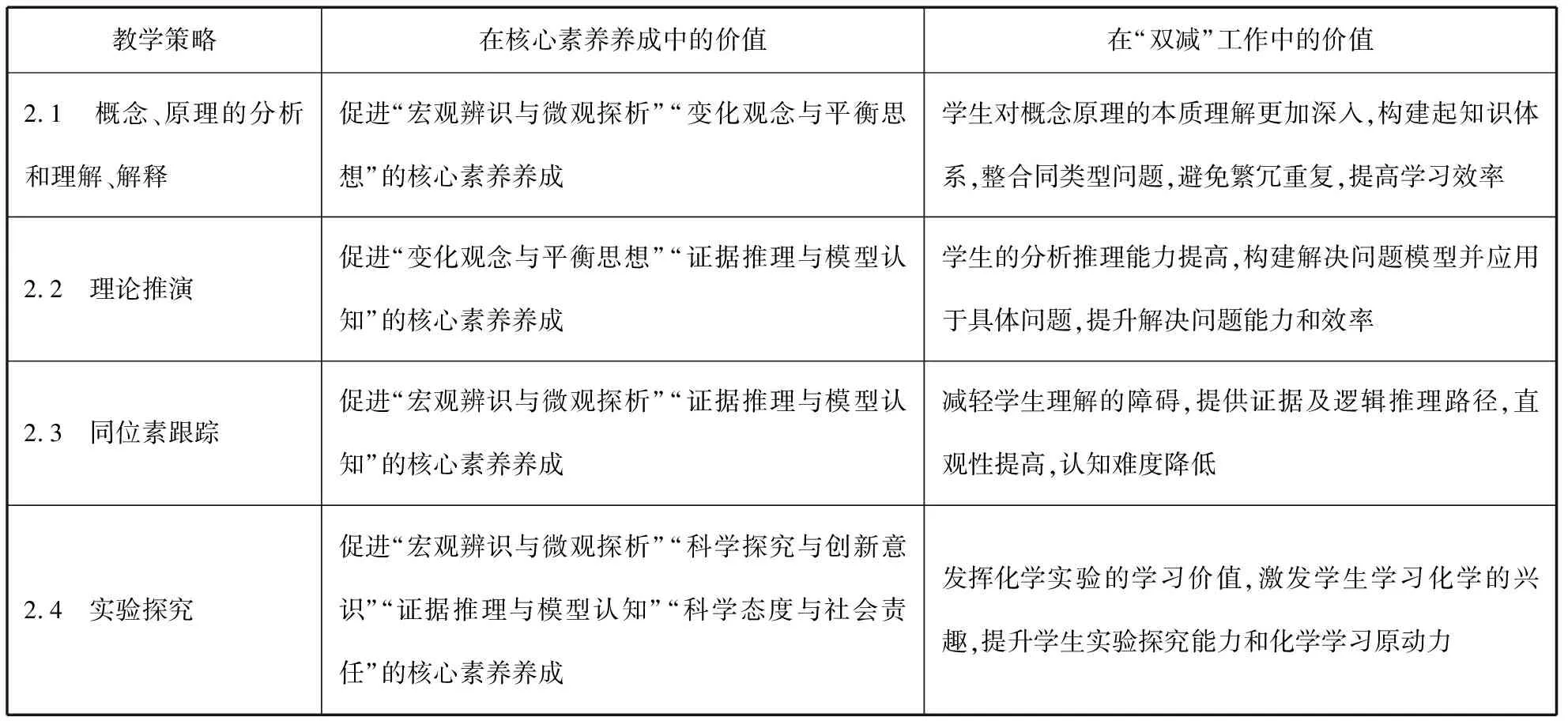
表3
1.通过对盐类水解的概念中盐类水解主体的界定,学生有种“豁然开朗”的感觉,只有盐类才能谈水解,而其他弱酸及弱碱不涉及水解,学生理解难度大幅度降低;图示法分析不同类型溶液中水电离出的H+浓度,直观性极强,学生认识效率提高,学习兴趣提高。学生学得明白、学得容易、学得有趣,还掌握了问题的本质,也利于后续学习内容的推进,减少了学困的产生,从根本上减轻了学生的学习负担。
2.分别从平衡常数和水解常数的角度进行数学推演“物质性质对水解程度的影响”和“向FeCl3溶液中加入NaOH溶液”的问题,依据化学平衡常数及反应方程式的内容,均是学生已经习得的知识,同时也符合最近发展区理论要求,有利于学生巩固旧知识,解决新问题,在促进学生“变化观念与平衡思想”“证据推理与模型认知”的核心素养发展的同时,提高学生的学习效率。
3.在分析水电离出的氢离子浓度的计算中,采用“向重水D2O中加入少量Na2CO3固体”的实验,通过检验溶液中含有重氢元素的组分,分析水电离出的氢离子的成分,很好地发展了学生“宏观辨识与微观探析”“科学探究与创新意识”“证据推理与模型认知”的核心素养;方案明确、思路清晰,化难为易,学生的学习负担减少。“向FeCl3溶液中加入NaOH溶液对水解的影响”问题采用“向0.01 mol·L-1的FeCl3溶液中滴加0.01 mol·L-1NaOD溶液”的实验方案,可以发展学生“宏观辨识与微观探析”“证据推理与模型认知”的核心素养,同时减轻学生理解的障碍,获得可靠证据,进行合理推理,提高学生解决问题的能力和学习效率。


