二甲双胍抑制破骨分化改善糖尿病模型鼠骨量的研究
田峰 胡铜 吴昊天 祖力卡尔·阿地力 赵疆 涂来勇*
1.新疆维吾尔自治区中医医院,新疆 乌鲁木齐 830000
2.新疆医科大学,新疆 乌鲁木齐 830000
3.新疆维吾尔自治区中医药研究院,新疆 乌鲁木齐 830000
糖尿病可导致患者体内代谢障碍,长期高血糖会造成多器官、多系统损害,在诸多靶器官中,“高血糖水平”与“骨稳态”关系密切。长期高血糖状态直接影响成骨分化与破骨分化的动态平衡,平衡一旦被打破,会造成骨质疏松、骨折愈合延迟或不愈合。糖尿病患者的高血糖水平、晚期糖基化终末产物形成、胰岛细胞的分泌功能、炎症因子的释放、氧化应激反应的上调、生长因子的代谢、成脂分化的激活、降糖药物的干预等均可对骨微细结构、骨皮质的强度、成破骨分化的平衡产生影响[1-2]。二甲双胍是目前临床上治疗糖尿病的一线治疗药物[3]。一项多中心研究[4]显示,二甲双胍治疗可降低代表骨吸收的空腹骨转换标志物,抑制骨吸收的活性,提示二甲双胍可能对糖尿病患者骨骼的修复与重建起到有益的影响。二甲双胍还可降低患者长骨与中轴骨的骨折率。前期研究显示对于确诊为糖尿病或前驱糖尿病的患者,二甲双胍可以维持成破骨动态平衡,因此对骨稳态具有保护作用[5-6]。有研究[7]报道二甲双胍可以促进前成骨细胞和间充质干细胞的分化,具有潜在的增强成骨分化作用。但二甲双胍对骨髓源性巨噬细胞破骨分化的影响尚无定论。研究表明[8],高糖环境可激活cAMP/PKA通路,直接调控核因子-KB受体活化因子配体(receptor activator of nuclear factor kappa-B ligand,RANKL)的表达增加,通过RANKL/RANK/OPG通路刺激破骨细胞生成[9]。也有研究[10]得出完全不同的结论,即高糖环境上调Wnt通路激活cAMP/PKA通路从而抑制破骨分化。本研究拟通过体外实验明确二甲双胍对大鼠骨髓源性巨噬细胞(BMDM)破骨分化的影响,进而通过体内实验观察二甲双胍对糖尿病模型鼠骨量的改善作用。
1 材料和方法
1.1 实验材料
盐酸二甲双胍片(格华止,0.85 g,中美上海施贵宝制药有限公司),STZ(链脲菌素,S0130,sigma),血糖仪(580,鱼跃),血糖试纸(580,鱼跃)。引物购自上海生工生物有限公司,引物序列见表1。一抗来源:CTSK(碧云天,AF6597),C-FOS(碧云天,AF6489),NFATC1(Abcam,ab155986),TRAF6(碧云天,AF8223),GAPDH(Abcam,ab8245)。一抗及二抗的浓度参照说明书使用。大鼠RANKL(Recombinant Rat TRANCE/RANK L/TNFSF11 Protein,9366-TN-025,R&D),大鼠巨噬细胞集落刺激因子(Rat MCSF,96-400-28-2,Peprotech)。

表1 引物序列
1.2 方法
1.2.1构建动物模型:选取24只8周龄健康雄性SPF级SD大鼠,体重(230±10)g,将大鼠随机分笼,自由饮水,高脂饲料喂养,并保持饲养室环境良好,温度24 ℃,湿度45 %~55 %,每天12 h光照、12 h黑暗交替,噪音不超过55分贝。适应性饲养一周后随机分为3组,每组8只,分别为对照组、糖尿病模型组(模型鼠)、糖尿病模型+二甲双胍(治疗组)。一周后,所有大鼠在前一日晚8点禁食,保留足够饮水,于次日晨8点开始构建糖尿病模型。具体方法为:模型组一次性自左下腹腔注射STZ 60 mg /kg(STZ溶解于预冷的柠檬酸-柠檬酸钠缓冲液,浓度调整为2 %)[11],建立胰岛功能损伤模型,正常组给予等体重剂量的柠檬酸-柠檬酸钠缓冲液。造模72 h后,禁食不禁水12 h,取大鼠尾静脉血测血糖。具体方法为:用酒精棉擦净大鼠鼠尾,用无菌剪刀剪断鼠尾,去第一滴静脉血,血糖试纸采集第二滴静脉血,检测血糖。当血糖≥16. 7 mmol /L,并出现饮水量、饲料消耗量明显增多、尿量明显增多等症状时,符合糖尿病诊断标准[12],判定为糖尿病模型大鼠。伦理编号为TCMF1-20210521。
1.2.2动态指标监测:造模成功后,每日早晨观察大鼠状态变化,包括毛发疏密、色泽、腹腔是否积液、耳钉是否脱落、鼠尾伤口是否清洁,每周测量体重。为监测血糖水平,同时避免过多有创操作增加感染概率,每周测定血糖一次(断尾取血法)。测血糖前禁食不禁水12 h。测完血糖后用酒精棉球擦净鼠尾。每天保证充足的饲料及饮水,每天更换大鼠垫料及托盘,每周清洗饲养笼。
1.2.3给药方式及药物剂量:根据人和动物间按体表面积折算的等效剂量比值,换算得出治疗组SD大鼠每日二甲双胍灌胃剂量为20 mg/只,对照组及模型组均给予等体积生理盐水灌胃。连续给药2个月。
1.2.4收集标本:行过量麻醉处死大鼠,取背部正中切口,剥离毛发及皮肤,完整收集下肢骨;取腹部正中切口,用纱布去除腹腔内脏器,暴露椎体前缘,并擦拭干净,完整收集L4椎体。剔除椎体及胫腓骨周围肌肉及脂肪组织,浸没在4 %多聚甲醛中,固定24 h。脱钙处理14 d,制备石蜡切片,并严格按照操作流程制备HE染色、TRAP染色骨组织切片。
1.2.5大鼠BMDM的获取:将8周龄SD大鼠过量麻醉处死后,完整收集股骨与胫骨,在乙醇中浸泡5 min,转移至超净台。用无菌刀片彻底刮除软组织后,无菌剪刀剪开股骨与胫骨的两端,用5 mL无菌注射器冲出骨髓,离心获得细胞沉淀,含rMCSF的培养基(50 ng/mL)重悬成单细胞悬液,种T75培养瓶,2 d后即可获得大鼠BMDM。本研究采用P2代BMDM完成实验[13]。
1.2.6RT-qPCR检测mRNA的表达:按照每孔2×105的密度将BMDM种于六孔板,待长满底面70 %~80 %时开始药物干预。完成药物干预后,去培养基,PBS洗三遍后,每孔加入1 mL TRIZOL,收集于EP管中。完成总RNA的提取,测浓度,按实际用量稀释后反转录成cDNA。按照说明书的步骤,采用2-△△Ct法计算目标基因的相对表达量。
1.2.7Western blot检测蛋白的表达:按照每孔2×105的密度将BMDM种于100 mm的皿中,待细胞贴壁并增殖至铺满培养皿底面70 %~80 %时,开始药物干预,并隔日换液。完成药物干预后,去培养基,PBS轻轻的冲洗三遍,每皿加入250 μL RIPA裂解液,冰上静置5 min,后用刮刀刮下贴壁细胞,收集至1.5 mL EP管,离心取上清。按照说明书步骤,测蛋白浓度并完成蛋白表达量的检测。使用Image J定量。
1.3 统计学分析
采用Graphpad 7.0完成统计分析及作图。两独立样本采用t检验,多组间比较采用单因素方差分析,多组间比较存在两变量时采用双因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 二甲双胍对大鼠骨髓源性巨噬细胞破骨分化的影响
体外实验表明,与对照组相比,二甲双胍抑制RANKL诱导的大鼠BMDMs成熟破骨细胞的形成,并减少破骨细胞的面积,且呈浓度依赖性,差异有统计学意义(图1)。
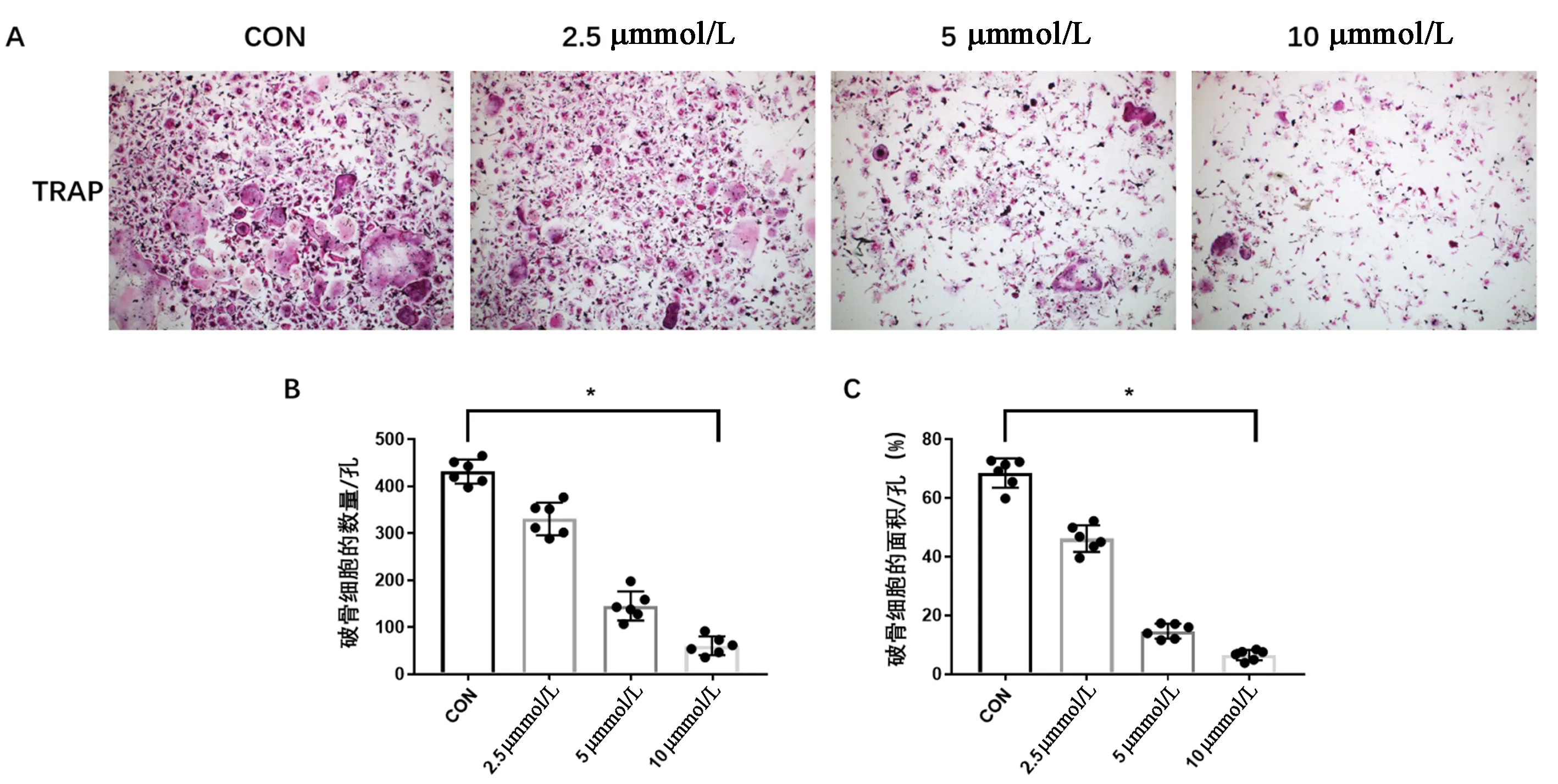
图1 二甲双胍抑制大鼠BMDMs的破骨分化
2.2 二甲双胍对破骨分化标志基因的影响
RT-qPCR结果显示,与对照组相比,二甲双胍(10 μmmol/L)显著抑制了破骨分化相关标志基因的表达(图2),包括:Ctsk、Nfatc1、C-fos、Traf6,差异有统计学意义。

图2 二甲双胍下调Ctsk、Nfatc1、C-fos、Traf6的表达
2.3 二甲双胍对破骨分化标志蛋白的影响
Western blot结果显示,与对照组相比,RANKL显著促进破骨分化标志蛋白的表达,二甲双胍(10 μmmol/L)显著抑制了C-FOS,NFATC1,TRAF6,CTSK破骨分化标志物的表达,差异有统计学意义。见图3。

图3 二甲双胍抑制C-FOS、NFATC1、TRAF6、CTSK的表达
2.4 二甲双胍对糖尿病模型鼠体重及空腹血糖的影响
体内实验结果显示,与对照组相比,糖尿病模型组空腹血糖显著升高,体重明显降低;二甲双胍灌胃治疗后,可以显著降低糖尿病模型鼠的空腹血糖,并增加大鼠体重,差异均有统计学意义。见图4。
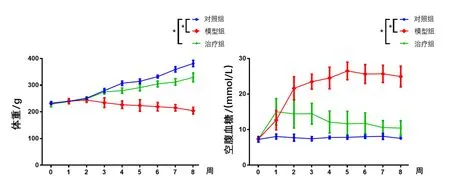
图4 对照组、模型组、治疗组的体重、空腹血糖变化曲线
2.5 二甲双胍对糖尿病模型鼠骨质量的影响
病理切片显示,与对照组相比,模型组骨量下降,骨组织表面的破骨细胞数量、面积均增加,差异有统计学意义;与模型组相比,治疗组相对骨小梁体积上升,骨组织表面的破骨细胞数量、面积均减少,差异有统计学意义。见图5。
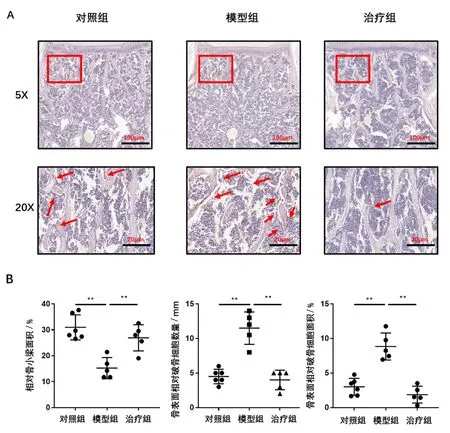
图5 对照组、模型组、治疗组椎体骨组织TRAP染色切片
3 讨论
二甲双胍是一种经过临床验证的、有效、安全的降糖药[14],1957年作为治疗糖尿病的药物被引入。此后,二甲双胍作为一线口服降糖药物,无论是单药治疗还是与其他口服降糖药物和胰岛素联合治疗,在糖尿病的各个阶段均推荐使用[15-16]。研究表明对于确诊为糖尿病或前驱糖尿病患者,二甲双胍能够稳定骨转换标志因子,维持骨形成与骨吸收的动态平衡,对骨稳态具有长期的保护作用[17]。数据显示二甲双胍有益于糖尿病患者血糖的控制及高血糖环境下的相关疾病,如改善炎症环境。炎症的激活已经被认为是破骨分化活跃的主要因素。因此本研究聚焦于探讨二甲双胍对糖尿病模型鼠骨表面破骨细胞形成的抑制作用。
既往研究[18]证实,二甲双胍可通过阻断NF-κB信号通路的激活抑制RANKL诱导Raw264.7巨噬细胞破骨分化。鉴于细胞系的局限性,本研究进一步研究了原代骨髓源性巨噬细胞,得出一致的表型。二甲双胍可以抑制RANKL诱导的BMDM破骨分化,本研究中稳定的表型包括减少成熟破骨细胞的数量和破骨细胞的面积,并下调破骨分化标志基因的表达,包括:Nfatc1、Ctsk、C-fos、Traf6。这些标志基因可以调控巨噬细胞分化为破骨细胞前体、破骨细胞前体相互接触并融合为成熟破骨细胞、成熟的破骨细胞吸收骨基质等多个重要的生命过程[19],这也决定了破骨细胞的数量和面积以及形成骨陷窝的大小,抑制这些生命过程,直接导致破骨分化受阻,不能形成成熟的破骨细胞。
越来越多的证据[20-21]表明,糖尿病患者的骨折风险会更高,使用二甲双胍至少不会增加骨折的风险。在体外实验阳性结论的支持下,本研究开展了基于二甲双胍与糖尿病模型鼠的体内研究,发现二甲双胍在降低模型组大鼠空腹血糖、增加体重的同时,可以挽救骨丢失,抑制骨小梁表面的破骨细胞的成熟,减少破骨细胞的数量和面积。骨组织中成骨细胞的骨形成,与破骨细胞的骨吸收,是同时存在的,并且始终保持动态变化。当破骨细胞过度活跃,骨吸收能力增强,不可避免的会造成骨质量下降。Aurigena等[22]认为,低浓度二甲双胍[50 mg/(kg·day)]可降低去势牙周炎大鼠的炎症反应、氧化应激,由于炎症反应和氧化应激是巨噬细胞破骨分化的上游刺激因素,因此低浓度的二甲双胍可以抑制破骨分化,与本研究结论一致。此外,极低剂量的二甲双胍[10 mg/(kg·day)]可通过增加成骨细胞分化来防止牙周炎引起的骨丢失。炎症反应、氧化应激被认为是破骨分化的关键上游信号通路,激活炎症反应、过度的氧化应激反应将会显著促进破骨分化和骨吸收能力。相反,抑制炎症环境的形成,可以减少成熟的破骨细胞数量。基于这些研究,笔者认为,二甲双胍能够降低炎症因子的释放水平,阻止炎症微环境的形成,促进干细胞的成骨分化,抑制巨噬细胞的破骨分化,促进骨形成,抑制骨吸收,最终达到挽救骨丢失,提高骨质量的效果。这也提示二甲双胍具有双向调节骨稳态的能力,在控制血糖的同时,具有治疗长期高血糖引起骨代谢疾病的潜力。
开发新药既昂贵又费时。近年来,有学者提出了药物重新定位(drug repositioning or repurpose)的新概念来寻找和开发“新药”,也就是老药新用[23]。该方法通过阐明新的蛋白功能和靶向分子,将已经在临床推广使用的药物用于治疗一种新的疾病。这种方法的优点显而易见,如不需要测试毒性或评价药代动力学[24]。同时,这些优点可以带来更多的益处,如大大减少开发新药的成本和时间,提高成功率。
本研究选用治疗糖尿病的一线用药二甲双胍,治疗一种糖尿病继发性骨稳态失衡疾病即糖尿病性骨质疏松症,并证实二甲双胍在体外实验中能够抑制BMDM破骨分化,在体内实验中抑制了骨表面破骨细胞的形成,挽救了骨丢失。本研究证实,二甲双胍在有效控制血糖的同时,可以双向调节骨稳态,为扩大二甲双胍的适应症提供研究基础,为糖尿病性骨质疏松症患者的治疗提供更丰富的选择。

