女性系统性红斑狼疮患者骨代谢异常的危险因素分析
李朝霞 黎晓萱 周毅* 尚靖杰 徐浩
1.暨南大学附属第一医院风湿免疫科,广东 广州 510360
2.暨南大学附属第一医院核医学科, 广东 广州 510360
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种慢性系统性自身免疫性疾病,它可累及各器官系统,常伴有多个并发症。骨代谢异常是其常见合并症之一,可表现为骨量减少、骨质疏松(osteoporosis,OP)以及骨梗死。骨代谢异常不单会增加患者跌倒及骨折的风险,还会给患者和社会带来沉重的经济负担,它是影响SLE患者长期生存质量的重要危险因素[1]。然而SLE导致骨代谢异常的具体机制尚不十分明确,其与多种因素相关,例如全身炎症反应、糖皮质激素及免疫抑制剂的应用是独立的危险因素[2-3]。
近年来,有学者认为骨质疏松症的发病亦与免疫系统密切相关,并提出“骨免疫”的概念[4],骨代谢的关键分子途径是核因子(NF)-κB受体活化因子配体(RANKL)/NF-κB受体激活蛋白(RANK)/骨保护素(OPG),这些关键细胞因子可在淋巴细胞中表达,因此可推测淋巴细胞与骨质疏松症的发生密切相关。
综上,SLE作为自身免疫性疾病,淋巴细胞的表达及分布异常在其发病中起着重要作用,然而SLE患者淋巴细胞亚群分布与骨代谢异常的关系尚不明确。本研究拟探讨SLE患者骨密度与外周血淋巴细胞亚群的关系,并初步探索免疫细胞在SLE骨代谢异常中的作用,为进一步研究SLE患者骨代谢异常的分子机制奠定基础。
1 对象及方法
1.1 研究对象
研究对象为2017年1月至2021年6月在暨南大学附属第一医院风湿免疫科就诊的因SLE住院的成年女性患者。本研究经由暨南大学附属第一医院伦理委员会审核批准,所有入组研究对象本人或其法定监护人均签署知情同意书。
SLE 的诊断依据 1997 年美国风湿病协会制定的 SLE 分类标准[5]。OP 则根据中华医学会骨质疏松和骨矿盐疾病分会 2011 年发布的骨质疏松症诊治指南中制定的骨质疏松诊断标准[6]。排除合并严重心血管疾病、甲状旁腺及甲状腺等内分泌疾病患者、近期有严重感染或使用雌激素、雄激素或其他影响骨代谢药物的患者。
1.2 方法
1.2.1人口学及临床资料的收集:本研究设计了一份调查问卷收集所有受试者的人口学及临床资料,通过系统性红斑狼疮疾病活动性指数2000(SLEDAI-2K)[7]和系统性狼疮国际合作组织/美国风湿病学会损伤指数(SLICC/ACR-DI)[8]分别评估SLE的活动度和严重程度。收集受试者的实验室检查指标,包括外周血细胞计数、血脂、生化及骨转换标志物等。
1.2.2DEXA测定骨密度:采用Lunar iDXA双能X线骨密度仪检测患者的骨密度,分析软件为enCORE(版本16)。骨矿盐含量(BMC)的测量精密度为0.45 %。
1.2.3流式细胞仪分析淋巴细胞亚群的分布:通过流式细胞术检测SLE患者外周血淋巴细胞亚群,所有试剂均为美国BD 公司产品,由6色TBNK试剂盒试剂组成。具体标记如下:CD3+T细胞、CD4+T细胞、CD8+ T细胞、CD16+CD56+NK细胞、CD19+B细胞、CD45+T细胞分别采用FITC-CD3、PE-Cy7-CD4、APC-Cy7-CD8、PE-CD16&CD56、APC- CD19及PerCP-Cy5.5-CD45。
1.3 统计学
研究对象的均衡性检验采用单因素方差分析(one-way ANOVA)、非参数检验、独立样本t检验、配对t检验和χ2检验,组间差异采用单因素方差分析和非参数检验,两两比较采用Scheffe检验。相关分析采用Spearman,回归分析采用Logistic。以P<0.05为差异有统计学意义。所有数据分析均由STATA 12.0执行。
2 结果
2.1 受试者的一般情况及临床特征
本研究共纳入92例女性SLE患者,绝经后女性为36例(39.1 %)。SLE患者的临床特征见表1。所有患者的平均年龄、病程及SLEDAI-2K得分分别为(42.1±14.1)岁、(84.4±73.0)个月及2.0±2.7。SLICC/ACR-DI评分中位数为0(0~4)。
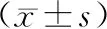
表1 SLE患者的临床学特征
2.2 实验室检查结果
表2显示了SLE患者的主要实验室检查结果。22.8 %患者(n=21)存在低补体血症,31.2 %患者(n=24)存在维生素D缺乏,55.8 %患者(n=43)存在维生素D不足。
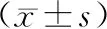
表2 SLE患者的实验室检测结果
2.3 骨代谢异常的现患率
92名患者中,62.0 %患者(n=57)存在骨代谢异常,其中44.6%患者(n=41)现患骨量减少,而17.4%患者(n=16)现患骨质疏松症,其中有9.8%患者(n=9)的合并脆性骨折。
2.4 SLE患者淋巴细胞亚群的分布
SLE患者外周血CD3+T细胞、CD4+ T细胞、CD8+ T细胞、CD4+CD8+ T细胞、CD16+CD56+NK细胞、CD19+B细胞及CD45+T淋巴细胞的比例及CD4/CD8比值的平均分布水平分别为(75.4±9.8)%、(35.3±8.6)%、(36.5±10.3)%、(0.8±0.9)%、(11.6±7.7)%、(11.9±8.8)%及1.1±0.6。
2.5 不同亚组的比较
骨量正常、骨量减少及骨质疏松三个亚组人口学及临床资料的比较见表3。三个亚组在年龄分布及月经状态方面存在显著差异,骨质疏松/骨量减少组的年龄显著高于骨量正常组,且绝经患者所占比显著高于骨量正常组。骨质疏松组患者合并高血压及脑卒中的比例高于其他两组,碱性磷酸酶及LDL-C的水平显著高于骨量正常组。骨质疏松组患者的NK细胞水平显著高于其他两组,而CD4/CD8比值显著高于骨量正常组。
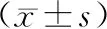
表3 不同亚组人口学及临床资料的比较
2.6 骨密度与其他指标的相关性
全身骨密度最低值与年龄(r=-0.291,P=0.005)、病程(r= -0.239,P= 0.022)、绝经状态(r= -0.288,P=0.005)及碱性磷酸酶(r= -0.221,P=0.033)均呈负相关。腰椎骨密度与年龄(r=-0.260,P=0.013)、皮肤黏膜受累(r= -0.265,P=0.011)、绝经状态(r=-0.355,P<0.001)、外周血淋巴细胞绝对值(r= -0.258,P=0.014)、碱性磷酸酶(r= -0.363,P<0.001)、补体C3(r= -0.240,P=0.025)及高密度脂蛋白(r= -0.234,P= 0.026)呈负相关。
2.7 骨代谢异常的预测因素
将人口统计学(年龄、性别等)、临床特征(病程、激素用量、合并症、疾病活动度及损伤指数等)及实验室指标(外周血细胞计数、生化、补体及各淋巴细胞亚群百分比等)作为自变量、骨代谢异常(骨量减少和骨质疏松)作为因变量进行Logistic回归分析。单因素Logistic回归分析显示年龄、绝经状态、外周血淋巴细胞绝对值、碱性磷酸酶、LDL-C、外周血CD4+T细胞及CD4/CD8比值是骨代谢异常的危险因素(表4),当前日激素用量、并发症及合并症等均不是危险因素。将上述危险因素纳入多变量Logistics分析模型中,结果提示绝经状态(OR=13.0,P<0.001,95%CI3.43~49.5)、LDL-C(OR=5.74,P=0.002,95%CI1.93~17.0)及外周血CD4+T细胞(OR=1.08,P= 0.025,95%CI1.01~1.16)是骨代谢异常的影响因素(表5)。
将人口统计学、临床特征及实验室指标作为自变量和骨质疏松症作为因变量进行Logistic回归分析。单因素Logistic回归分析显示年龄、SLICC/ACR-DI、绝经状态、高血压、脑卒中、碱性磷酸酶、补体C4、LDL-C及外周血CD16+CD56+T细胞数是骨质疏松的危险因素(表4)。将上述危险因素纳入多变量Logistics分析模型中,结果提示年龄(OR=1.12,P<0.001,95%CI1.06~1.19)是骨质疏松的影响因素(表6)。

表4 骨代谢异常及骨质疏松的单因素Logistic回归分析结果
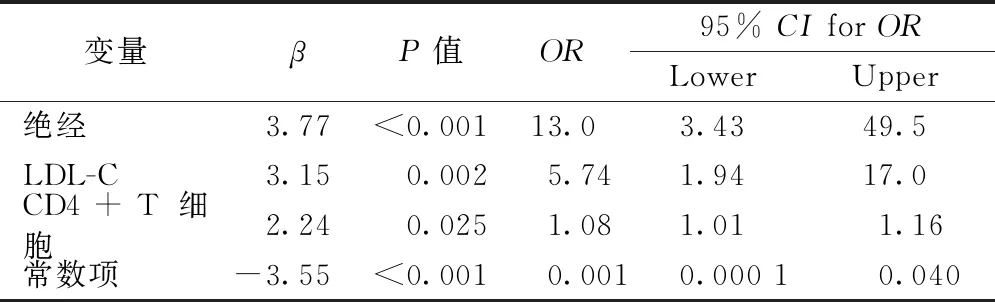
表5 骨代谢异常的多因素Logistic回归分析

表6 骨质疏松的多因素Logistic回归分析
3 讨论
本研究通过DXA评估SLE患者的骨密度,发现高达62.0 %的患者存在骨代谢异常,44.6 %的患者患有骨量减少,而17.4 %患者现患骨质疏松症。本组患者中维生素D不足/缺乏的患者所占比例较高,此外,本研究显示骨代谢异常与传统危险因素(如年龄、绝经状态)密切相关,进一步研究显示骨代谢异常患者的淋巴细胞亚群分布与骨代谢正常的患者存在一定差异,多因素回归分析显示CD4+T淋巴细胞是骨代谢异常的预测因素。
既往研究显示SLE 患者骨质疏松以及脆性骨折的发生率较健康人群明显增加。因样本量大小、研究设计、研究对象的种族、年龄、性别、疾病活动度及药物使用等背景不同,结果变异较大。韩国近期一项多中心大规模研究显示,在女性 SLE 患者中FRAX 工具评估有骨折高风险的比例为 15.5 % ~ 16.1 %,根据WHO标准诊断为骨质疏松症的患者比例为 32.9 %[9]。2019年的一项荟萃分析共纳入71项研究共33 527 例SLE患者,其中低BMD、骨量减少和骨质疏松症的患病率分别为4%、38 %和13 %[2]。本次研究结果与上述结果基本相符。
本研究患者中维生素D不足/缺乏发生率高,与既往的研究相符。国内外研究均显示SLE患者中普遍存在维生素D缺乏,维生素D缺乏不单与疾病活动有关,且与骨质疏松的发生密切相关[10-12]。维生素D作为钙剂吸收的重要调节激素,在骨代谢中起到至关重要的作用。在临床工作中,很多患者会接受活性维生素D的治疗,但常规补充普通维生素D的患者比例不高。因此如果检测到患者维生素D存在不足时,临床医生应该首选普通维生素D作为替代治疗,而并非单纯使用活性药物进行治疗。
本研究相关性分析结果提示年龄、绝经状态及部分病情相关指标与骨代谢异常呈负相关,这与既往研究相符[3]。在SLE患者中,病情活动及药物应用与骨质疏松的发生密切相关。既往研究显示,全身炎症状态、各种致炎细胞因子的分泌可直接影响骨代谢过程,导致骨质疏松的发生。药物应用,尤其是糖皮质激素的长期应用是导致骨质疏松发生的最重要医源性因素,因此尽量减少糖皮质激素的用量及疗程是临床预防骨质疏松症的重要举措[13]。
本研究发现CD4+T细胞是骨代谢异常的危险因素。研究显示T淋巴细胞对成骨细胞和破骨细胞的刺激/抑制作用与T细胞亚群及细胞因子密切相关[14]。T细胞可调节破骨细胞生成RANKL,如在类风湿关节炎中活化T细胞表达RANKL直接诱导破骨细胞形成从而导致骨破坏,还可产生多种促炎性细胞因子,促进骨髓基质细胞及成骨细胞中RANKL的表达从而间接诱导破骨细胞生成引起骨丢失[15]。体外研究证实,将活化CD4+ T淋巴细胞与破骨细胞前体在单独存在M-CSF或MCSF+可溶性RANKL的情况下共培养后发现,CD4+T细胞可诱导破骨细胞分化[16]。此外, T细胞也可通过细胞表面受体如CD40 L来调节成骨细胞[17]。由此可推断CD4+T细胞在SLE患者发生骨代谢异常中同样起到重要作用,具体机制有待一下研究。
本研究初步发现,骨代谢的发生与多重传统危险因素相关,同时也发现它与外周血淋巴细胞的分布存在一定的相关性,尤其是T细胞及NK细胞。该发现可能为今后进一步研究SLE患者发生骨质疏松的分子基础提供依据。

