Th1/Th2亚群细胞因子联合中性粒细胞CD64和人白细胞DR抗原评估慢性阻塞性肺疾病急性加重的价值
朱彩平,周世新,贺小红
(东莞康华医院呼吸与危重症医学科,广东东莞 523000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是呼吸科常见的肺部气道慢性炎症性疾病,患者支气管细胞坏死,形成溃疡,导致正常支气管组织细胞结构被破坏,气道壁代偿性修复,引发气道管壁厚度增加,气道管壁阻力上升,出现不可逆气流受限,肺功能减退[1]。由于大气污染、吸烟、细菌感染及病毒感染等不良因素的影响,诱发慢性阻塞性肺疾病急性加重(acute exacerbation of chronic obstructive pulmonary disease,AECOPD),患者短期内出现剧烈咳嗽、呼吸困难加重、痰量增多呈脓性,且常伴发热等炎症反应,对患者健康造成严重威胁,病死率、致残率较高[2]。临床多采用外周血白细胞、C反应蛋白(CRP)对AECOPD进行鉴别,但其敏感度及特异度较低、局限性较大。Th1/Th2亚群细胞因子含量与机体免疫功能相关,有助于反映患者是否感染[3]。中性粒细胞CD64是新发现的穿膜糖蛋白,在机体发生感染时会急剧上升,是有效的炎症标记物[4]。人白细胞DR抗原(HLA-DR)是单核巨噬细胞抗原重要分子,在免疫应答中起到关键作用[5-6]。基于此,本研究分析Th1/Th2亚群细胞因子联合中性粒细胞CD64和HLA-DR对AECOPD的评估价值,以期为此类患者的诊断提供帮助,现报道如下。
1 资料与方法
1.1 一般资料选取2020年7月至2021年12月东莞康华医院收治的296例AECOPD患者设为观察组,另选取同期院内322例COPD稳定期复诊患者设为对照组进行回顾性分析。观察组患者中男性194例,女性102例;年龄41~65岁,平均年龄(55.64±7.18)岁;病程1.5~12年,平均病程(7.28±2.14)年。对照组患者中男性201例,女性121例;年龄42~68岁,平均年龄(56.27±7.61)岁;病程2~10年,平均病程(7.45 ±2.03)年。两组患者性别、年龄、病程等一般资料比较,差异均无统计学意义(均P>0.05),组间具有可比性。本研究经东莞康华医院医学伦理委员会批准。纳入标准:①均符合《慢性阻塞性肺疾病基层诊疗指南(2018年)》[7]中COPD和AECOPD的诊断标准;②年龄>40岁。排除标准:①近期使用过激素、免疫抑制剂治疗者;②患恶性肿瘤、癌症等疾病者;③合并自身免疫系统疾病者;④合并心、肝、肾功能严重异常者。
1.2 检验方法①Th1/Th2亚群细胞因子检测方法:观察组患者于入院时及治疗7 d后,对照组患者于复诊时抽取其清晨空腹静脉血5 mL,采用流式细胞仪(美国Becton Dickinson公司,型号:FACS Canto II)检测白细胞介素-6(IL-6)、γ干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)水平,试剂盒均购于R&D公司。②CRP、降钙素原(PCT)测定:采用电化学发光全自动免疫分析仪(德国罗氏公司,型号:ELecsys 2010)及其配套试剂盒测定血清PCT、CRP水平。③CD64指数、HLA-DR表达率测定:采用流式细胞仪检测中性粒细胞CD64、HLA-DR水平,并计算CD64指数、HLA-DR表达率。
1.3 观察指标①比较观察组患者入院时及治疗7 d后,对照组患者复诊时Th1/Th2亚群细胞因子、炎症因子及CD64指数、HLA-DR表达率。②分析入院时IL-6、 IFN-γ、TNF-α水平及CD64指数、HLA-DR表达率对AECOPD发生的预测价值。③进行一致性分析。IL-6、IFN-γ、TNF-α水平及CD64指数、HLA-DR表达率中任意一项指标预测AECOPD为阳性则结果判定为阳性。
1.4 统计学分析采用SPSS 22.0统计学软件进行数据处理。计量资料以(±s)表示,两组间比较行独立样本t检验;多组间比较行方差分析,其两两比较行LSD-t检验。计数资料以[例(%)]表示,组间比较行χ2检验。采用受试者工作曲线(ROC)分析入院时IL-6、IFN-γ、TNF-α水平及CD64指数、HLA-DR表达率对AECOPD发生的预测价值。一致性分析采用Kappa检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者检测指标比较观察组患者入院时CRP、PCT、IL-6、IFN-γ、TNF-α水 平 及CD64指数显著高于观察组治疗7 d后及对照组复诊时,HLADR表达率显著低于观察组治疗7 d后及对照组复诊时,差异有统计学意义(P<0.05);观察组患者治疗7 d后IL-6、IFN-γ、TNF-α水平及CD64指数显著高于对照组复诊时,HLA-DR表达率显著低于对照组复诊时,差异有统计学意义(P<0.05),见表1。
表1 两组患者检测指标比较(±s)
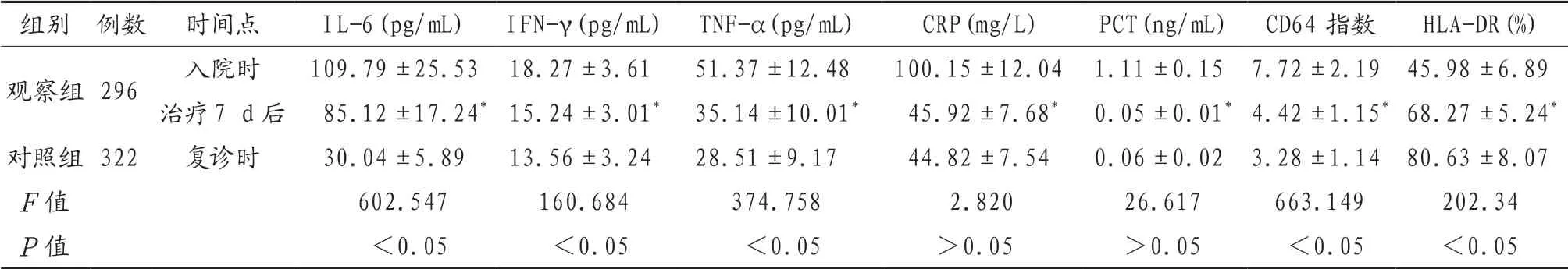
表1 两组患者检测指标比较(±s)
注:与同组入院时比较,*P<0.05。IL-6:白细胞介素-6;IFN-γ:γ干扰素;TNF-α:肿瘤坏死因子-α;CRP:C反应蛋白;PCT:降钙素原;HLA-DR:人白细胞 DR 抗原。
组别 例数 时间点 IL-6(pg/mL) IFN-γ(pg/mL) TNF-α(pg/mL) CRP(mg/L) PCT(ng/mL) CD64指数 HLA-DR(%)观察组296 入院时 109.79±25.53 18.27±3.61 51.37±12.48 100.15±12.04 1.11±0.15 7.72±2.19 45.98±6.89治疗7 d后 85.12±17.24*15.24±3.01* 35.14±10.01* 45.92±7.68* 0.05±0.01*4.42±1.15*68.27±5.24*对照组322 复诊时 30.04±5.89 13.56±3.24 28.51±9.17 44.82±7.54 0.06±0.02 3.28±1.14 80.63±8.07 F值 602.547 160.684 374.758 2.820 26.617 663.149 202.34 P值 <0.05 <0.05 <0.05 >0.05 >0.05 <0.05 <0.05
2.2 入院时相关指标预测AECOPD的ROC分析经ROC分析,入院时IL-6、 IFN-γ、TNF-α水平及CD64指数、HLA-DR表达率预测AECOPD的ROC的曲线下面积分别为0.950、0.935、0.948、0.918、0.811,差异均有统计学意义(均P<0.05),见表2。入院时IL-6、 IFN-γ、TNF-α水平及CD64指数、HLA-DR表达率预测AECOPD的ROC曲线,见图1。
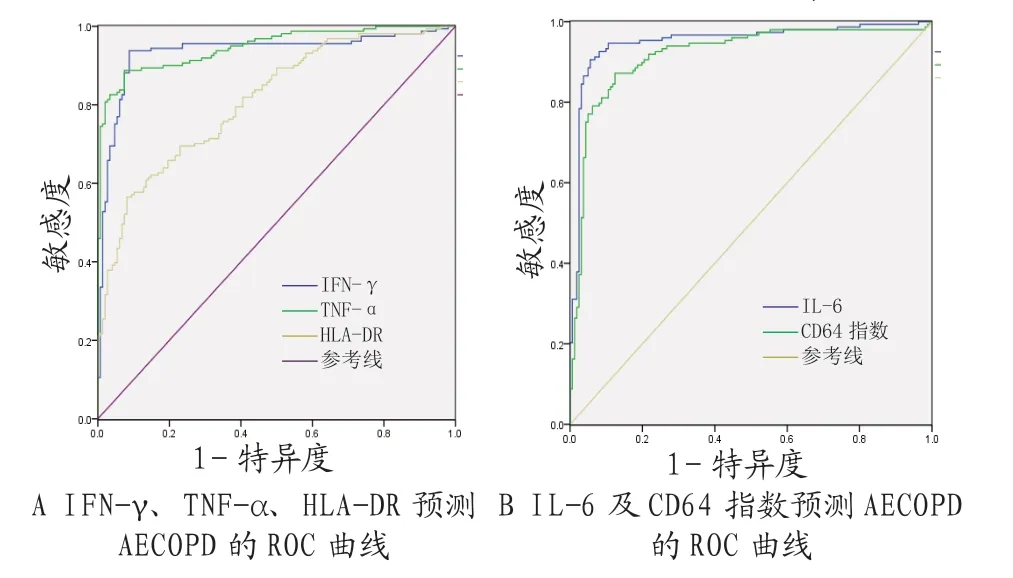
图1 入院时相关指标预测AECOPD的ROC曲线
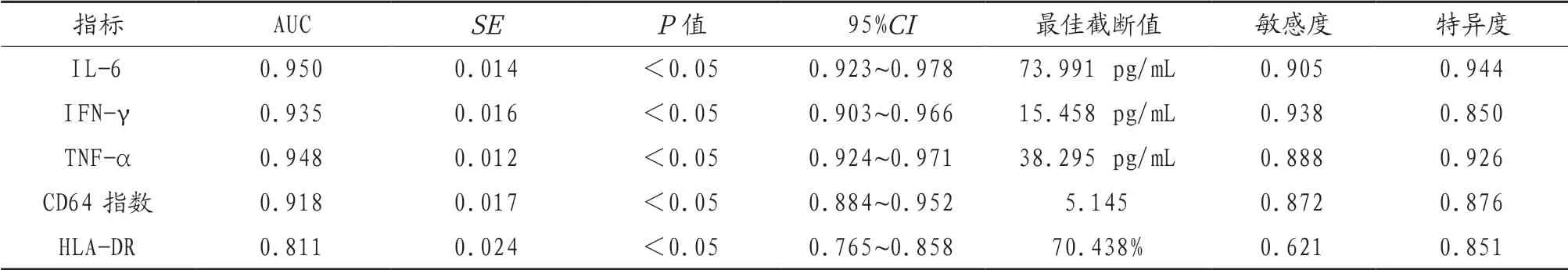
表2 入院时相关指标预测AECOPD的ROC分析
2.3 联合检测的一致性分析入院时IL-6≥73.991 pg/mL、IFN-γ≥15.458 pg/mL、TNF-α≥38.295 pg/mL、CD64指 数≥5.145、HLA-DR表达率≤70.438%判定为阳性,联合预测中任一指标为阳性则结果判定为阳性。经一致性分析,296例纳入对象中联合预测阳性268例,敏感度0.905,特异度为0.894,准确率为0.900,Kappa为0.799,见表3。

表3 联合检测的一致性分析
3 讨论
COPD是危害人类健康的常见疾病之一,多与大气污染、粉尘、遗传、病原菌感染等因素相关。随着人类生活方式的改变及环境因素的影响,患者疾病程度加重,发病率上升,导致患者上呼吸道病菌感染、气道细菌负荷增加及气道新菌株产生,出现AECOPD,且发病率增加,病死率上升[8]。另外,临床对AECOPD多使用抗生素治疗,导致抗生素滥用,影响细菌耐药性,导致病情加重,治疗难度增加。因此,寻找合适的生物标记物及早预测AECOPD,对病情的诊断及指导抗生素的使用具有十分重要的意义。
本研究结果显示,AECOPD患者Th1/Th2亚群细胞因子及CD64指数、HLA-DR表达率均处于异常状态,提示Th1/Th2亚群细胞因子及CD64指数、HLA-DR表达率的敏感性高于常规炎症因子指标。其原因分析如下:Th1细胞分泌 TNF-α、IFN-γ等因子,在细胞免疫、抗感染方面发挥重要作用,Th2细胞通过分泌IL-6抑制机体免疫,降低免疫功能[9]。CD64具有较高的特异度、敏感度,在细胞吞噬、呈递抗原、炎症释放等过程发挥重要作用[10]。HLA-DR是MHC-Ⅱ类分子,具有传递抗原肽给淋巴细胞、增强免疫应答的功能[11]。COPD患者机体受细菌组织、集落刺激因子、INF-γ等促炎因子的影响,CD64表达迅速上升,通过细胞毒性作用,加重炎症反应[12]。AECOPD期间受到细菌、病毒感染,机体细胞交叉调节功能异常,Th1 /Th2动态平衡被破坏,免疫功能受损,HLA-DR表达率下降,可及时反映患者病情进展程度[13]。同时,CD64指标及HLA-DR表达率受药物、种族等因素的干扰较小,作为实验室检测指标预测AECOPD具有一定的参考价值[14]。
经ROC分析,入院时IL-6、IFN-γ、TNF-α水平及CD64指数、HLA-DR表达率预测AECOPD的ROC的AUC分 别 为0.950、0.935、0.948、0.918、0.811,最 佳 截 断 值 为73.991 pg/mL、15.458 pg/mL、38.295 pg/mL、5.145、70.438%。经一致性分析,Kappa值为0.799。上述结果提示Th1/Th2亚群细胞因子及CD64指数、HLA-DR表达率可作为AECOPD的生物标记物。
综上,Th1/Th2亚群细胞因子及CD64指数、HLA-DR表达率联合可及时反映AECOPD病情的严重程度,对预测AECOPD具有一定的参考作用,值得临床应用。

