脑室-腹壁皮下隧道长时程外引流治疗感染性脑积水的回顾性分析
潘栋超,刘东升,傅继弟
继发性脑积水常见于颅脑外伤、动脉瘤破裂出血、脑肿瘤术后、颅内感染后等,其中感染性脑积水的治疗相对复杂,颅内感染的复发以及感染后脑脊液成分的异常都影响着脑积水的治疗[1-2]。感染性脑积水常伴有蛛网膜广泛增厚粘连、脑脊液吸收障碍,因此三脑室底造瘘并不是首选,大多数患者需要分流[3-4]。但分流手术时机的选择是个难题,因感染性脑积水脑脊液指标的改善需要的时间通常较长,如果提前分流增加了感染复发和分流管堵塞的风险,长时间腰大池或头部外引流则极大地增加了感染的风险,即使定期更换穿刺部位也难以避免,并增加了出血的风险及脑组织的创伤[5]。而如果仅仅保守治疗等待脑脊液指标改善,脑积水持续加重将损伤脑组织甚至导致严重脑软化、脑疝[6]。因此,对于感染性脑积水在分流前既要等待脑脊液成分恢复正常,也需要停药观察感染是否复发,而这个观察期内为避免脑积水损伤脑组织也需要持续引流。本研究通过回顾分析航空总医院神经外科2013年1月—2019年12月间收治的384例脑脊液理化指标不合格的感染性脑积水患者,均通过脑室-腹壁长程、长时段体外引流进行分流前的脑脊液净化治疗、强化静脉抗感染治疗并观察颅内感染是否复发,在脑脊液生化、常规、外观基本达标后行改良分流手术,探讨该方式治疗感染性脑积水的优势及存在的问题。
1 资料与方法
1.1 一般资料 共纳入384例患者,其中男264例,女120例;年龄3个月~74岁,平均年龄(40.39±18.39)岁。原发病有颅脑外伤、脑出血、颅内占位、脑积水、中枢神经系统感染、动脉瘤、小脑扁桃体下疝、癫痫、脑血管畸形、脑梗塞等。纳入标准:(1)符合《中国神经外科重症患者感染诊治专家共识(2017版)》颅内感染诊断标准,如脑脊液、手术切口分泌物、手术标本细菌学检查阳性,且除外标本污染则同样为确诊病例,按照静脉抗感染联合脑室/腰大池外引流冲洗等方法治疗颅内感染后,脑脊液病原微生物血培养皿培养至少两周内连续三次阴性;(2)入院后确诊继发性脑积水,脑室扩张伴室旁水肿,意识减退,肌张力增高、呕吐等,给予释放脑脊液后症状减轻;(3)脑脊液理化指标异常,外观色黄浑浊,红细胞、白细胞计数偏高,蛋白升高,葡萄糖偏低或正常;(4)头颅CT、MRI增强扫描显示仍存在硬脑膜、室管膜或脑实质内的强化病灶。排除标准:(1)非感染性脑积水、孤立颅内脓肿、单纯化脓性脑膜炎;(2)严重心力衰竭、急性心肌梗死;(3)严重肝肾功能异常、恶性肿瘤;(4)胸壁、腹壁皮肤大面积感染、破溃。
1.2 方法
1.2.1 临床资料及检测指标 采集包括性别、年龄、既往病史和疾病诊断等临床资料。颅内感染患者入院后,常规行侧脑室或腰大池外引流术,术中留取脑脊液标本行细菌培养、常规、生化检验,术后进行脑脊液引流及抗生素冲洗治疗,并每周留取两次脑脊液行细菌培养、常规、生化检验。脑脊液细菌培养至少两周内连续三次阴性后,在持续静脉抗感染的过程中行脑室-腹壁外引流术。选取额角或枕角进行脑室穿刺,置入分流管脑室段,脑室段及腹腔段之间以双通接头连接,引流管腹腔段自对侧的脐旁水平10 cm外穿出,连接体外引流装置。继续抗感染至少两周,如为革兰氏染色阴性杆菌(G-)化脓性脑室炎,则继续抗感染至少三周。所有患者治疗期间常规每周复查脑脊液生化、常规及细菌培养,监测脑脊液指标。体外引流袋每3 d更换一次,三通接头以及引流袋排水口碘伏消毒后以无菌纱布包扎。在临床判断颅内感染治愈并且抗生素延长抗感染周期达标后,停止抗感染治疗并观察最少两周,复查脑脊液生化、常规指标无明显波动,脑脊液外观基本清亮,无絮状物等杂质,细菌培养阴性。满足以上条件后行改良的脑室-腹腔分流手术。
1.2.2 改良的脑室-腹腔分流手术 取胸骨角下方平坦骨面做2 cm横形切口,游离皮下分流管,截断后连接分流泵及新的分流管腹腔段,将新的腹腔段置入腹腔内,而胸部切口以上包括头部内的分流管保留。
1.2.3 分流后患者评估 术后脑积水症状是否复发或加重,分流1周后行头CT或MRI检查,明确是否有硬膜下血肿/积液、颅内出血。对出院患者每3~6个月进行门诊随访或电话/网络随访并复查头部CT。
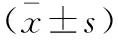
2 结 果
2.1 术前评估及治疗 按照标准入选患者共384例,各年龄段分布及其百分比(图1),提示选取的样本发生在各年龄段。转入本科室后复查脑脊液内细菌仍阳性者244例(63.54%),脑脊液细菌阴性但脑脊液常规和生化指标异常者140例(36.46%)。入选患者的原发病以脑外伤(29.4%)、脑出血(18.5%)、颅内占位(15.4%)、脑积水(13%)、中枢神经系统感染(11.2%)为主(图2),均经常规抗感染治疗并满足以下条件后行脑室-腹壁外引流术:脑脊液两周连续三次细菌培养阴性,脑脊液化验显示白细胞<100×106/L,蛋白偏高,葡萄糖偏低或正常,无明显脓性物引出,头CT或增强MRI显示颅内无未处理的脓肿。脑室-腹壁外引流时间最短14 d,最长387 d,脑室腹壁外引流时间中位数是69 d,与外院脑室外引流时间(中位数13 d)相比,临床治疗效果明显好转。

图1 颅内感染后继发脑积水患者的年龄段分布及其百分比
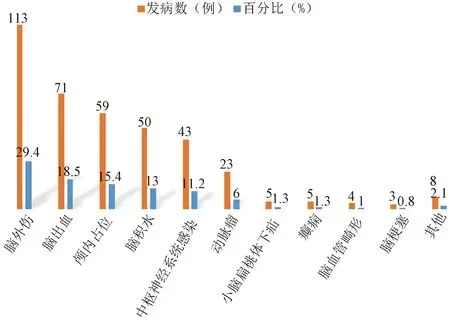
图2 颅内感染后继发脑积水的原发病及百分比汇总
2.2 手术方式及并发症 脑室-腹壁外引流384例(脑室-腹壁外引流联合孤立四脑室-腹壁外引流9例,脑室-腹壁外引流联合孤立颞角腹壁外引流26例,单独颞角腹壁外引流2例)。引流期间感染7例(1.82%),其中皮下隧道感染2例,既往颅内感染复发4例,新发颅内感染1例,新发和复发的感染主要通过病原菌种类是否与原来不同来区分。脑室-腹壁外引流期间死亡6例,其中感染3例,高血压脑出血1例,1例放弃出院后死亡,脑干功能衰竭1例。
2.3 手术疗效 384例患者在行脑室-腹壁外引流术治疗期间,感染7例(治愈4例),死亡6例(其中感染3例,高血压脑出血1例,1例出院后死亡,脑干功能衰竭1例)。最终378例行脑室-腹腔分流手术,随访1~5年,治愈369例(97.62%),失败9例(2.38%),其中分流手术后感染5例,单纯机械性堵塞4例,再次治疗后3例治愈出院,死亡 6例。
在院治疗以及出院随访期间死亡共12例,其中感染5例,1例出院后4个月因癫痫持续发作死亡,1例出院后7个月不明原因死亡,高血压脑出血死亡1例,分流管堵塞死亡1例,脑干功能衰竭死亡2例,放弃1例。
3 讨 论
入选患者中,脑外伤、脑出血、颅内占位、脑积水等原发病所占比例较高。脑外伤、脑出血因急诊手术比例较大,且术后常需在ICU或监护室内留置外引流管,感染风险较大。颅内占位手术时间较长,部分患者携带脑室外引流管,增加了感染的风险[7]。脑积水手术为异物植入,其面临的主要风险为感染、分流管堵塞。
针对颅内感染的治疗,目前主要的方式为静脉抗生素联合腰大池、侧脑室外引流,必要时可局部给药,且通常会在感染控制后延长抗生素使用时间防止复发。延长的时间需要参考中枢神经系统感染(central nervous system infections,CNSIs)的程度:(1)轻度:体温>38 ℃,格拉斯哥昏迷评分(Glasgow coma score,GCS)为13~15分,脑脊液白细胞计数为(50~500)×106/L。(2)中度:体温>39 ℃,GCS为9~12分或较之前下降2分,颈项强直,脑脊液白细胞计数为(500~1 000)×106/L。(3)重度:体温>39 ℃或<36.0 ℃,昏迷,GCS≤8分或较前下降2分,颈项强直,脑脊液为脓性且白细胞计数>1 000×106/L及脑脊液葡萄糖<1 mmol/L,头颅CT或MRI可见脑室内积脓、分隔或孤立脑室形成。本研究建议对轻、中度CNSIs革兰阴性杆菌建议至少治疗 21 d,对金黄色葡萄球菌至少治疗10~14 d[8];对重度CNSIs推荐长时程治疗,治疗时程为4~8周[9],符合临床治愈标准后继续应用抗菌药治疗10~14 d,以防止复发[10]。当患者合并脑积水时,在抗感染期间均不适合分流,需要持续体外引流,即使在脑脊液内活动性感染控制后也面临两个问题:(1)感染是否已经治愈或仅是暂时被压制,因为脑脊液仅仅是感染的介质,并不是唯一的感染灶,单纯脑脊液指标正常并不代表颅内感染彻底治愈;(2)脑脊液指标长时间异常,不适合分流,拔除外引流管存在高颅压风险,提前分流增加了分流管堵塞、感染复发的几率。虽然有研究认为感染性脑积水可在细菌培养阴性7~10 d再行分流术[11],但脑脊液成分难以在感染控制后快速恢复正常,因此需要在分流前尽量做到三点:(1)细菌至少两周内培养三次阴性后根据影像学感染灶的吸收及脑脊液化验指标情况继续适当延长抗感染时间;(2)分流前停止抗感染治疗两周,观察感染是否复发、脑脊液生化常规指标是否反弹;(3)脑室内脑脊液指标基本恢复正常且外观基本清亮。
常规脑脊液体外引流时间一般不超过7~10 d,最长建议不超过2~3周[12],但临床经常面临脑脊液在2~3周引流后仍然指标异常不适合分流的患者,比如严重的化脓性颅内感染、复杂孤立脑室、多发颅内脓肿、重度中枢神经系统结核等,引流至脑脊液完全正常通常需要2~4个月,且国外指南也认为脑室炎、脑膜炎患者可在出院后甚至更长时间以后复发[13]。以往部分医生选择每超过两周更换引流部位,频繁地脑穿刺也增加了颅内出血的风险以及脑组织损伤[14]。因此2021年新版指南认为,脑室外引流(extraventricular drainage,EVD)使用长程皮下隧道经胸或腹部皮肤穿出时引流管引流时间可更长[15]。一般认为延长体外引流时间增加了颅内感染风险[16-17],但是从治疗的角度考虑,在合并脑积水且脑脊液指标明显异常的情况下,提前分流的高失败率让后续治疗变得更加困难,且国外并未对感染性脑积水的外引流时间做具体限制[9]。
分流手术失败的主要因素有机械性堵塞及感染、出血、腹腔包裹性积液等[18]。文献报道,成人分流术后感染性并发症发生率为6.5%~23.5%[19],这个几率是指一般脑积水患者。有研究报道,感染性并发症60%发生在术后1个月内,70%发生在术后2个月内,仅10%发生于术后1 年以上[20]。有研究报道,约26.4%(135/512)的患者分流后出现了至少一种并发症,包括穿刺出血、分流管堵塞、颅内感染、引流过度致硬膜下积液或硬膜下血肿;其中穿刺出血或硬膜下血肿可造成分流泵部分或完全堵塞,而分流装置部分堵塞因为临床表现可能不典型,确诊困难,常延误治疗[11]。以上是一般继发性脑积水的分流失败风险,感染性脑积水患者分流手术失败风险可能更高[21],即使经过前期治疗后认为感染治愈,再次手术后仍有复发的风险[22]。本研究认为额外增加的风险来自于颅内感染治疗不彻底导致的复发、颅内感染后造成的脑脊液成分异常,以及长时间颅内感染后再次手术出血风险的增加。由于颅内感染导致的蛛网膜颗粒吸收障碍以及广泛的蛛网膜、室管膜粘连,单纯脑室镜手术效果不佳,分流仍是首选[3-4],而如何提高分流手术的成功率应是临床研究的重点。
为了解决分流前脑脊液成分异常及颅内感染是否会复发这个问题,本研究选择延长体外引流的时间[23]。而针对延长体外引流时间后颅内感染风险增加的情况,选择以脑室-腹壁外引流术这种长程皮下隧道方式作为分流前的过渡治疗[24]。本研究认为EVD采用走皮下隧道技术,能减少引流管移位、脱管、脑脊液漏及感染的发生率[10]。该术式的优势:(1)长程潜行,从腹部伤口逆行感染颅内的风险降低;(2)腹部皮肤毛囊稀少,减少了头皮油脂以及头发生长带来的感染风险;(3)不影响患者在治疗期间的康复锻炼,引流管易固定不易脱出;(4)在行脑室-腹壁外引流过程中,因脑室穿刺、头皮出血进入脑室造成的血性脑脊液通过体外引流排出,此时未放置分流泵,避免了分流泵的堵塞,即使因出血较多造成引流管堵塞,也可通过尿激酶疏通[25],且可进行必要的冲洗治疗;(5)体外引流期间即可观察患者能够适应的最佳颅压,并以此为参考设置分流泵的压力。
体外引流期间感染的途径主要有:(1)引流管出口处头皮伤口感染;(2)反复倾倒脑脊液逆行感染;(3)进行冲洗等操作污染[26]。针对感染的途径,本研究对引流系统的更换、伤口换药做了相应的改良:(1)引流管出口处的伤口每2 d进行一次消毒、更换敷料,同时以碘伏纱条缠绕引流管根部;(2)引流袋每2~3 d更换一次,避免人为倾倒操作感染;(3)在头部引流期间,需要每周碘伏消毒后由专业医生进行备皮。本研究通过以上方式进行操作,体外引流期间感染7例(1.82%),体外引流时间14~387 d,平均95.7 d;引流时间短于21 d的患者占5.5%,22~100 d的患者占61%,100~200 d的患者占24.4%,引流超过200 d的患者占9.1%。体外引流时间偏长可能与收治的患者多数为难治性颅内感染有关,病程较长,慢性感染造成的损伤较重且恢复缓慢。引流时间短于21 d者仅占5.5%,显示多数感染性脑积水患者,在颅内感染控制后其脑脊液成分恢复正常所需的时间仍然长于3周。引流时间在22~50 d之间的病例密度最高,显示大部分颅内感染控制后脑脊液成分恢复正常所需的时间基本在1~2个月之间。体外引流时间超过100 d者,多数为蛋白水平长期偏高或者合并孤立脑室形成、反复多次手术的患者,尤其是同时合并孤立颞角、孤立第四脑室的患者,多见于鲍曼不动杆菌、肺炎克雷伯菌等感染。
颅内感染后脑脊液成分异常通常与感染导致的慢性炎症有关[27],脑脊液成分异常并不一定导致分流失败,但会增加分流失败的风险。在有效控制体外引流继发感染的情况下,充分地引流等待脑脊液成分恢复正常再行分流手术可降低分流手术失败的风险。等待患者完成足疗程的颅内感染治疗及停药观察,脑脊液指标恢复正常、杂质消失后,行改良的分流手术,该术式不涉及新的颅骨钻孔、脑穿刺,避免了颅内渗血、止血材料排异反应等造成的分流泵堵塞[28]。
此外,在行长时间体外引流过程中,可使脑组织逐渐适应新的压力,脑室形态趋于稳定,而巨大脑室在缩小过程中可见引流管内反复出现血丝,考虑与形态改变后内部毛细血管撕裂或蛛网膜下腔渗血有关。在患者感到不适时可随时关闭引流管控制引流量,减少了硬膜下血肿的发生,并避免了渗血增加分流泵阻力的情况[29]。结果显示,经长时间脑室-腹壁外引流后行分流手术的失败率较低(2.38%),在脑室-腹壁外引流期间出现颅内感染的病例中,1例为新发颅内感染(1/384,0.26%),4例为原有颅内感染复发(4/384,1.04%),2例为皮下隧道感染(2/384,0.52%)。原有颅内感染复发为体外引流期间感染的主要因素,且均为2018年前病例,考虑与2018年前对此类患者行增强核磁检查比例较少有关,在脑室-腹壁外引流前可能有遗漏未处理的感染灶,2018年后对于颅内感染患者均行常规增强头部MRI检查,未再出现脑室-腹壁外引流期间感染复发的情况。皮下隧道感染均合并引流管腹壁出口伤口感染,与伤口换药不到位有关,而新发颅内感染比例极低(0.26%)。因此,脑室-腹壁外引流这一新的手术方式降低了感染性脑积水因为脑脊液成分异常或感染复发导致的分流失败及死亡率增加的风险,且并未因为延长体外引流时间而造成继发性颅内感染风险的显著增加。
孤立脑室通常继发于化脓性颅内感染后,少部分继发于脑室内积血、脑室系统肿瘤术后[30]。脑室炎相关性孤立脑室的形成可能与室管膜及脉络丛炎症增生粘连、脓性物机化堵塞有关,提示颅内感染程度较重并已产生不可逆损伤,因该部位室管膜表面覆盖脓苔并硬化,单纯静脉和鞘内注射药物都难以有效进入病灶[31],这也是化脓性脑室炎死亡率、复发率高,治疗周期长的原因之一。本研究感染性脑积水死亡病例中,8例存在孤立脑室,占全部死亡患者的8/12(66.67%),而根据经验,在颅内感染活动期头部外引流期间死亡的患者中,存在孤立脑室的比例更高;因此,孤立脑室是导致颅内感染后死亡的主要因素。
综上所述,感染性脑积水在颅内感染治愈后,通过脑室-腹壁长程、长时段体外引流的方式可以显著提高分流手术的治愈率,降低感染、分流管堵塞等并发症。而严格的伤口、引流系统管理则可有效地降低引流相关性感染。
利益冲突:所有作者均声明不存在利益冲突。

