换热壁面碳酸钙吸附与脱水行为的分子动力学
肖毅,王兵兵,于旭亮,王鑫,蔡汉友
(东北电力大学能源与动力工程学院,吉林吉林 132012)
对于采用硬水作为冷却介质的工业换热器,由于换热壁面附近存在温度梯度,溶解于硬水中具有逆溶解度的难溶盐离子会在壁面区域析出,并沉积在换热壁面,从而形成一层难以去除的污垢。碳酸钙作为常见的析晶污垢,其形成后不仅增加热阻和流动阻力,造成额外损失,更为严重时会损坏换热元件。因此,抑制碳酸钙污垢已成为换热器研究的重要方向。
通过向工质中加入化学阻垢剂,可以阻止碳酸钙在壁面的形成。然而,传统的无机化合物中含有无机氮和磷,这些元素易导致水体富营养化,造成环境污染。因此,目前阻垢剂的研究开始向绿色、无污染的方向转变。此外,物理抑垢法受到广泛关注,有研究表明,外加电场或磁场具有较好的抑垢作用,但其抑垢机理不明晰。为更好地解决碳酸钙污垢沉积问题,需要明确换热壁面碳酸钙污垢的形成机理。
已有研究分析了过饱和碳酸钙溶液中碳酸钙成核过程。越来越多的证据表明碳酸钙溶液中存在稳定的预成核团簇,而在成核前后,团簇粒径的突变也为预成核团簇的团聚诱导晶核产生提供了依据。同时,研究表明无定形碳酸钙(ACC)作为前体存在于结晶过程中,ACC 为水化结构,对无水碳酸钙晶体的形成十分重要,ACC 结晶过程中会经历脱水进而向无水结晶态转化。Saharay等利用分子动力学的方法建立不同ACC 模型,模拟发现水合度较低的ACC 内部结构更加有序,并且无水ACC 的密度与方解石相近。换热壁面碳酸钙晶体的形成不仅与成核过程有关,同时与碳酸钙在壁面上的吸附与脱水行为紧密联系。
实验很难观测壁面碳酸钙的吸附与脱水过程,分子动力学模拟方法可以获得体系演化过程中分子的运动与受力,是揭示物理现象发生的重要手段。本文采用分子动力学方法从微观角度模拟金属壁面碳酸钙的吸附与脱水行为,通过观测模拟体系演化过程中碳酸钙扩散系数、配位结构、水化数以及离子径向分布函数等参量,揭示换热壁面碳酸钙污垢的形成物理过程。此外,通过向壁面施加高温,模拟分析含水碳酸钙团簇从无水向结晶的转化。换热表面碳酸钙晶体污垢的形成初期为诱导期,析晶污垢诱导期对污垢层的继续生长至关重要。从分子角度揭示换热表面碳酸钙的吸附与脱水行为有利于明晰碳酸钙污垢形成初期的诱导期,为抑制换热表面碳酸钙污垢的形成提供更明确的思路。
1 模型和方法
本文利用LAMMPS 软件模拟金属壁面碳酸钙的吸附与脱水行为。如图1 所示,初始模型为长方体盒子,盒子尺寸为50.54Å×50.54Å×115Å(1Å=0.1nm),由下到上依次为平板区域、溶液区域和蒸发区域。其中,平板区域含有3136 个铜原子,厚度为12.635Å,晶格结构为面心立方,晶格常数为3.61Å。溶液区域含有5000个水分子,液膜的初始厚度为60Å,通过改变钙离子和碳酸根离子的加入量实现不同浓度的模拟,在已发表的结晶实验中选取的碳酸钙浓度范围为0.002~0.8mol/L,温度选取为0~96℃。本文模拟参考实验工况,选择0.2mol/L、0.4mol/L、0.6mol/L和0.8mol/L四种浓度,模拟温度设置为360K。此外,模拟高温壁面碳酸钙的脱水行为时,壁面温度分别设置为500K、600K、700K和800K。由于高温下水分子的蒸发导致体系压力增加,为避免压力的影响,本文模拟盒子上方设置蒸发区域,并将进入最上方10Å区域的水分子删除。
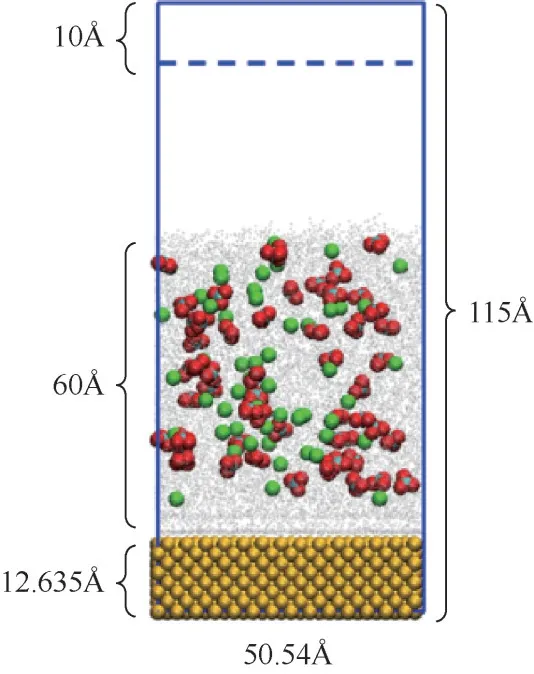
图1 金属壁面碳酸钙吸附过程物理模型
模拟中水分子选取适用于热力学研究的SPC/Fw 模型,氢氧键长为1.012Å、键角为113.24°。碳酸根中原子间相互作用势能则参考Demichelis等修正参数,这些参数可以准确描述碳酸根振动光谱,碳氧键长为1.3042Å、键角为120°。水和碳酸根之间的相互作用势能参数如表1和表2所示。

表1 水分子内原子相互作用势能参数

表2 碳酸根分子内相互作用势能参数
本文采用Lennard-Jones 和Buckingham 两种势能模型描述分子间范德华相互作用。另外,对带电粒子间也引入长程库仑力进行约束。各原子电荷量与原子量如表3所示。

表3 各原子电荷量与原子量
Lennard-Jones势能函数的表达式见式(1)。
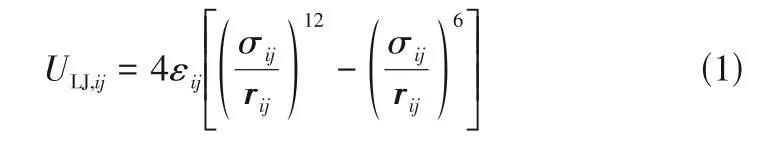
式中,r、σ和ε分别表示第个和第个粒子间的距离、势能阱的深度以及当L-J势能函数等于零时粒子间的距离。其中,对于溶液与铜壁面的相互作用,在分别参考水分子、离子和铜原子的L-J势的同时,利用Geometric 混合规则,将分子间的作用势能耦合。Geometric 混合规则表达式见式(2)和式(3)。

Buckingham势能函数的表达式见式(4)。

式中,r代表粒子之间的距离;A、ρ和C代表三个特征参数。分子间相互作用势能参数详见表4。

表4 分子间势能参数
所有模拟均采用Velocity-Verlet 算法对运动方程的时间积分,时间步长选用1fs。在计算长程库仑力过程中PPPM 算法的精度为10。为使初始体系趋于稳定,首先采用NVT 对过饱和碳酸钙溶液和金属壁面控温0.2ns,此时整个体系温度维持在360K。在讨论高温壁面碳酸钙的脱水行为时,对壁面进行高温控制。
2 结果与讨论
2.1 壁面水分子吸附层
壁面附近的水分子受壁面铜原子的强范德华力作用,一部分水分子会吸附在壁面并形成致密的水分子层。图2展示了溶液中水分子数密度沿垂直于壁面方向的分布,其中在距离壁面2.85Å 和5.85Å附近存在两个峰值,分别代表分布于近壁面处的两个水分子层(图2 中分别用红色和蓝色标出)。近壁面区域水分子的分布情况反映了铜原子对溶液中分子的范德华吸引力的影响范围,因此,在接下来碳酸钙吸附过程的讨论中,以水分子吸附层为界限,当碳酸钙运动到吸附层内时,判定碳酸钙吸附到壁面。

图2 水分子沿垂直于壁面方向的数密度分布
2.2 金属壁面碳酸钙吸附行为


图3 0.6mol/L溶液中碳酸钙向金属壁面吸附过程演化
当溶液中做无规则布朗运动的碳酸钙团簇接近壁面时(图3中6ns时刻),团簇与铜原子间的范德华吸引力随团簇与壁面间距的减小而增加,团簇逐渐吸附在壁面(图3 中15ns 时刻)。随后,由于壁面对碳酸钙的吸引,吸附的碳酸钙团簇向壁面铺展,当=70ns时,吸附层内碳酸钙的分布如图4(b)所示,此时壁面上吸附着碳酸钙团簇。图5统计了演化过程中溶液中钙离子与铜原子的平均相互作用势能,随着吸附行为的进行(0~55ns),钙离子与铜原子的平均相互作用势能绝对值增加;当>55ns时,势能值维持在-3.5eV 左右波动,表明所有钙离子吸附在壁面上。

图4 0.6mol/L碳酸钙溶液5ns和70ns时刻壁面的吸附情况
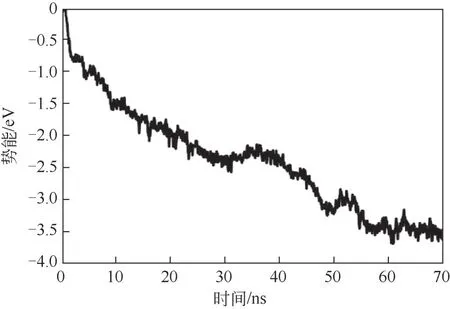
图5 溶液中钙离子与铜原子相互作用势能



图6 0.6mol/L碳酸钙溶液吸附层内不同种类离子数随时间演化
碳酸钙向壁面扩散的同时,溶液中的离子也会缔合形成尺寸更大的碳酸钙纳米团簇。图7(a)展示了溶液中不同团簇离子数和溶液中团簇总数随时间的演化。如图7(a)所示,在初始时刻(前6ns),溶液中团簇尺寸的变化比较明显,同时如图7(b)所示,初始时刻团簇总量急剧下降,此时,溶液中由于离子之间的缔合而形成一个尺寸较大的团簇,但其余的团簇尺寸小,以离子对或链状碳酸钙分子的形式分布于壁面上。而之后团簇包含的离子数和溶液中的团簇数量基本在一定范围内波动,说明此后溶液体系基本趋于稳定。在壁面附近的离子均已扩散到吸附层内,溶液中做布朗运动的团簇未抵达吸附层之前,吸附层内离子的总数也近似恒定[图6(b)中1.2~6ns]。在6ns 时刻,溶液中的团簇运动到壁面附近,受壁面吸引力的影响,团簇开始缓慢向壁面吸附,并在55ns后整个吸附过程趋于平衡。

图7 溶液中不同团簇离子数及溶液中团簇总数随时间的演化(包括离子和离子对)
本文同时对0.2mol/L、0.4mol/L 和0.8mol/L 过饱和碳酸钙溶液进行了模拟,各浓度下的演化如图8 所示。除0.2mol/L 没有在溶液中观察到碳酸钙团簇,其余浓度均存在两种碳酸钙附着途径,既有离子、离子对或短链向壁面的扩散,也存在溶液体相中形成的碳酸钙团簇向壁面的附着。而对于0.2mol/L的过饱和碳酸钙溶液,由于溶液的浓度较低,且对于当前的模拟尺寸,存在于只有几纳米液膜中的离子数量很少,很难缔合成较大尺寸的碳酸钙团簇,而在离子自由运动的过程中,阴阳离子会率先结合形成离子对。此后,如图8(a)所示,在1ns 时刻当离子对扩散到壁面附近后会被吸附在壁面,随着溶液中的离子持续向壁面扩散,各离子或离子对之间会继续缔合形成链状碳酸钙(2.5ns)。溶液体系中钙离子与碳酸根离子存在强吸引作用,因此,换热表面发生钙离子与碳酸根离子的吸附行为的同时,溶液中离子会形成碳酸钙水合团簇结构。随着碳酸钙浓度的增加,溶液中钙离子与碳酸根离子形成水合团簇结构的概率与尺寸更大。形成的碳酸钙团簇尺寸越大,扩散系数越小,导致其在换热表面的吸附速率越小。

图8 不同浓度下碳酸钙吸附过程演化图像
根据0.6mol/L 过饱和碳酸钙溶液的模拟结果,对吸附过程中离子的动力学特性和碳酸钙的结构变化进行讨论。图9 展示了Ca扩散系数与吸附层内水分子数随时间的演化。初始阶段,离子、离子对或链状碳酸钙分子由于尺寸较小而具有较高的扩散系数,当近壁面处的离子、离子对或链状碳酸钙分子已经吸附到铜壁面且溶液中的离子已缔合成尺寸较大的团簇后,这些离子的运动受限,因而扩散系数急剧下降。同时,伴随溶液中的团簇向壁面的附着,离子的扩散系数继续缓慢降低,最终保持在较低水平。在碳酸钙吸附过程中吸附层内的水分子数不断降低[图9(b)],这是因为碳酸钙向壁面吸附的过程中排挤出水分子,从而与铜壁面紧密结合。当整个吸附过程趋于平衡时(55ns 后),吸附层内的水分子数量保持恒定,整个体系也趋于稳定。
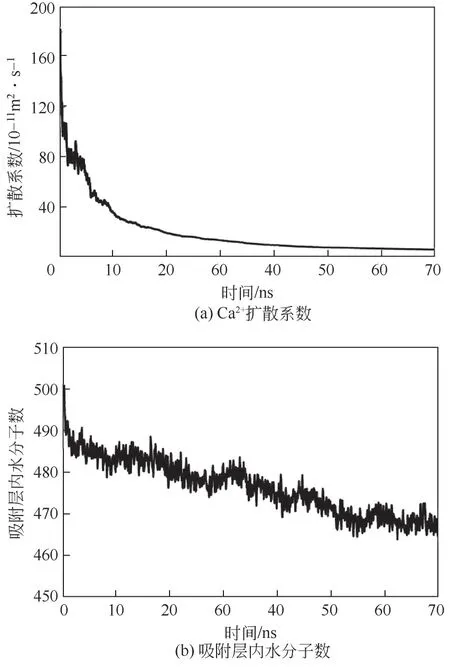
图9 Ca2+扩散系数和吸附层内水分子数随时间的演化

图10 Ca—C配位数与水合数随时间的演化(a)和初始时刻(1ns)与最终时刻(70ns)Ca—Ca径向分布函数(b)
2.3 高温下碳酸钙团簇的脱水行为
实验中常常将从溶液中分离出来的非晶碳酸钙置于高温环境中进行脱水处理以达到干燥的目的,观察脱水后碳酸钙结构的改变。为探究碳酸钙晶体的形成过程,本文通过给壁面施加高温强制水分的蒸发,促进吸附于金属壁面的碳酸钙脱水,以便观察在脱水过程中碳酸钙结构的变化。以0.6mol/L的模拟结果为基础,移除液相体系上部水分子,对平板分别施加360K、500K、600K、700K和800K 的高温,观察壁面上碳酸钙的脱水过程。其中,平板温度为800K 的模拟结果如图11 所示,可以看出,吸附于壁面上的碳酸钙最终聚合形成一个团簇,并且随着水分子的蒸发,团簇中包含的水分子数也骤然下降。
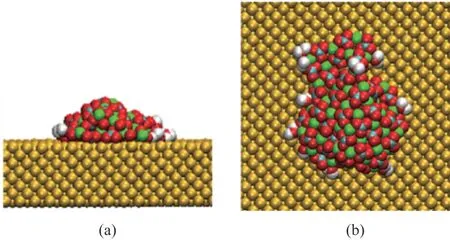
图11 800K壁温时最终时刻壁面碳酸钙吸附形态
图12 展示了不同壁面温度时模拟体系Ca—C配位数、钙离子水合数及Ca—O配位数随时间的演化。对于壁面温度为360K 工况,配位数数值基本保持恒定,这是因为360K 时整个体系就已达到稳定。高温下碳酸钙的脱水过程中Ca—C 配位数和Ca—O配位数单调增加并趋于恒定,而钙离子水合数单调降低并趋于恒定。随壁面温度的升高,Ca—C配位数和Ca—O配位数的渐进值单调递增而水合数单调递减。在800K 的温度下,团簇中的水分子基本蒸发完全,最终的水合数约为0.3,同时Ca—O 配位数约为6,而对于碳酸钙晶体,如方解石和球霰石,钙离子与碳酸根中氧的配位数也为6。上述结果表明,壁面高温促使碳酸钙内部水分子脱离,非晶碳酸钙向结晶态转化。

图12 不同壁面温度工况下Ca—C配位数、水合数和Ca—O配位数随时间的演化
图13 统计了不同壁面温度时碳酸钙脱水最终时刻Ca—Ca径向分布函数。不同温度下Ca—Ca径向分布函数均在4Å 和6Å 附近存在两个明显的波峰,且随温度的升高,峰值逐渐增加。这可能是由于高温在迫使水分子脱离的同时也加速了离子的运动,从而发生重新排列,并通过配位数和径向分布函数的变化得以体现。另外,不同温度下的脱水过程并未造成波峰的大幅度偏移,两个波峰出现在4Å 和6Å 附近,这说明Ca—Ca 的两种基本配合形式未发生明显改变,而不同温度下脱水过程造成的峰值的差异,表明脱水的发生导致碳酸钙中特定配合形式的钙离子的数量有所提高。本文选取的是铜换热表面,当将表面改为其他金属材质时,碳酸钙的吸附与脱水行为同样会发生,但由于不同表面对碳酸钙的作用力不同,会导致不同换热表面上碳酸钙团簇结构中配位数、水合数以及镜像分布函数等参数在量值上存在差异。

图13 不同壁面温度时碳酸钙脱水最终时刻Ca—Ca径向分布函数
3 结论
本文从分子角度模拟分析近铜壁面处碳酸钙的吸附行为,结果表明,过饱和碳酸钙溶液的吸附过程既包括离子、离子对或链状碳酸钙分子向壁面的扩散,也存在溶液中已形成的团簇向壁面的附着。通过这两种途径吸附于壁面的碳酸钙,为之后溶液中的离子或分子继续向壁面吸附提供位点。在碳酸钙向壁面吸附过程中钙离子的扩散系数逐渐减小并趋于恒定,Ca—C配位数先增加后趋近于定值,而水合数先减小后趋近于定值。上述结果表明,随着碳酸钙与壁面的结合,钙离子的运动受到限制,并且在有限的模拟时间和没有离子继续补充的条件下,吸附于铜壁面碳酸钙内部结构不发生改变。此外,径向分布函数表明最终形成的碳酸钙属于具有一定水合数的非晶结构。
提高壁面温度,碳酸钙脱水的驱动力增大,脱水越完全,Ca—C和Ca—O配位数越高。当壁面温度为800K时离子水合数接近于0,Ca—O配位数约为6,而宏观尺度方解石和球霰石两种无水碳酸钙晶体的Ca—O配位数也等于6,对比结果表明,碳酸钙在脱水过程中向晶体转化。

