贝莱斯芽孢杆菌处理对厚皮甜瓜保鲜效果及保护酶活性的影响
王静怡,佐长赓,牛新湘,管力慧,杨红梅,楚 敏,王 宁,林 青,娄 恺,史应武,5,
(1.新疆大学生命科学与技术学院,新疆乌鲁木齐 830052;2.新疆农业科学院微生物应用研究所,新疆乌鲁木齐 830091;3.新疆特殊环境微生物实验室,新疆乌鲁木齐 830091;4.新疆农业科学院土壤肥料与农业节水研究所,新疆乌鲁木齐 830091;5.农业农村部西北绿洲农业环境重点实验室,新疆乌鲁木齐 830091)
新疆由于其独特的气候条件,是重要的瓜果产区。其中,厚皮甜瓜是新疆主要的特色瓜果之一。厚皮甜瓜为葫芦科(Cuculacere),黄瓜属(CucumisL.),一年生草本植物,对比其他甜瓜,厚皮甜瓜具有果肉甜度高、口感好、贮藏期长等优点[1]。然而由于其含糖量高,水分足,因此在气温高的夏季采摘容易使其受到病原菌的侵染,缩短其贮藏期,给生产者带来经济损失[2]。在厚皮甜瓜的贮藏过程中,自身对病原菌的防御会导致自由基的积累,自由基的积累会加速其腐败进程[3],厚皮甜瓜体内的保护酶在清除自由基中发挥了重要作用[4-5]。但在采后贮藏期间,保护酶的活性会由于外界因素的变化而降低,因此,减缓保护酶的活性降低及生防菌在厚皮甜瓜表面稳定定殖对延长厚皮甜瓜贮藏期具有积极意义。
果蔬保鲜的研究多使用物理和化学方式[6],其中物理保鲜方式主要有低温保鲜、气调保鲜、辐照保鲜、光照处理保鲜、臭氧保鲜和热处理保鲜等,杜红凤等[7]通过研究常温、0.5 ℃和3 ℃贮藏条件下哈密瓜保护酶SOD、POD、CAT 活性的变化,得出0.5 ℃的贮藏条件对哈密瓜保护酶活性下降的抑制作用最为明显;化学保鲜方式主要是利用植物生长调节剂和化学保鲜剂,其中,姚军等[8]使用0.5%、1.0%和1.5%浓度的水杨酸对采后哈密瓜进行浸泡处理,得出不同浓度的水杨酸均可增强PAL、PPO 和POD的活性,抑制哈密瓜果实腐烂的结论。现今生物保鲜技术以其无污染,成本低,效率高等优点成为研究热门[9]。生物保鲜技术主要有微生物拮抗保鲜、天然提取物保鲜和基因工程保鲜,其中,微生物拮抗保鲜的主要机理为抑制孢子萌发菌丝生长及诱导植物产生系统抗性[10-11],刘奎等[12]探究猕猴桃接种枯草芽孢杆菌BS-1 对猕猴桃软腐病的抑制效果及保鲜效果,发现接种BS-1 可显著降低猕猴桃果实的腐烂率。目前,对于厚皮甜瓜保鲜效果及采后保护酶活性的变化研究,化学物理方式仍占据研究的主流[7],近几年生防菌由于其高效环保的特点逐渐成为研究热点[13],但把生防菌与温度结合用在厚皮甜瓜贮藏期的研究鲜见报道。
本研究选用西州蜜25 号厚皮甜瓜,通过在4 ℃和25 ℃条件下在厚皮甜瓜表面接种贝莱斯芽孢杆菌BG-2,测定贮藏期间拮抗菌在厚皮甜瓜表面定殖特性、保鲜效果和厚皮甜瓜POD、PPO 和PAL 酶活性的变化趋势,探究2 种温度下贝莱斯芽孢杆菌BG-2 在厚皮甜瓜表面定殖特性、保鲜效果和对厚皮甜瓜贮藏期保护酶活性变化的影响。探讨生物保鲜技术在厚皮甜瓜保鲜领域应用的可能性,为延长新疆厚皮甜瓜贮藏期的研究提供理论依据。
1 材料与方法
1.1 材料与仪器
病原菌 来自实验室从腐烂厚皮甜瓜中筛选出的尖孢镰刀菌(Fusarium oxysporum)CH-3;拮抗菌贝莱斯芽孢杆菌(Bacillus velezensis)BG-2 筛选自厚皮甜瓜种植土地;厚皮甜瓜 选自市场(经新疆农业科学院园艺作物研究所鉴定为西州蜜25 号),购买大小相近、重量3 kg 左右,成熟度基本一致,表皮无损伤,无病害虫害的西州蜜25 号;营养琼脂(NA)培养基、营养肉汤(NB)培养基、马铃薯葡萄糖水培养基(PDB)、马铃薯葡萄糖琼脂培养基(PDA)、LB 培养基 青岛高科技工业园海博生物技术有限公司;NaCl 天津市登峰化学试剂厂;75%乙醇 天津市广成化学试剂有限公司;过氧化氢酶试剂盒、多酚氧化酶试剂盒、苯丙氨酸解氨酶试剂盒 苏州科铭生物技术有限公司。
UVZ255 型紫外分光光度计 日本岛津自动化设备有限公司;CENTRIFUGE 型高速冷冻离心机EPPENDORF;GMSX-280 型高压蒸汽灭菌锅 北京市永光明医疗仪器厂;ZWY-2102C 型恒温培养震荡器 上海智城仪器制造有限公司;WY 型手持折射仪成都豪创光电仪器有限公司;Five Easy Plus 型pH计 北京东南仪诚实验室设备有限公司。
1.2 实验方法
1.2.1 拮抗菌处理液的制备 将筛选出的拮抗菌在NA 板上划线,32 ℃培养24 h,挑取单菌落接种于500 mL 有100 mL LB 培养基的锥形瓶中,32 ℃,180 r/min 摇瓶培养12 h,得到种子液。按2%的接种量接种至500 mL 装有250 mL NB 培养基的锥形瓶中,32 ℃,180 r/min 摇瓶发酵3 d,8000 r/min 4 ℃离心5 min,取下层菌体沉淀,用0.85%的NaCl 溶液洗涤3 次,加入250 mL 相同浓度NaCl 溶液重悬菌体得到拮抗菌处理液。
1.2.2 病原菌处理液的制备 在PDA 平板中心接种一个病原菌菌饼,用6 mm 打孔器(1×105Pa 灭菌)在长满病原菌的平板上打取15 个菌饼,接种至含有100 mL PDB 培养基的500 mL 锥形瓶中,25 ℃,160 r/min 摇瓶培养2 d 获得种子液,以1%的接种量接种至含有250 mL 培养基的500 mL 锥形瓶中,25 ℃,160 r/min 摇瓶发酵5 d,8000 r/min 4 ℃离心5 min,取下层菌体沉淀,用0.85%的NaCl 溶液洗涤3 次沉淀,加入250 mL 相同浓度NaCl 溶液得到病原菌处理液。
1.2.3 厚皮甜瓜果实损伤后接种处理液 根据汪志浩等[14]的方法进行改进:将厚皮甜瓜表面用自来水冲洗干净并晾干,用75%的乙醇对其进行表面消毒后用无菌水洗3 遍并晾干,选取厚皮甜瓜一侧16 cm2的瓜面,用无菌针均匀的刺约2 mm 深的伤口30 个。
对照(CK):将消毒处理后的厚皮甜瓜于生理盐水中浸泡2 min。实验设置3 个处理,处理1(T1):用拮抗菌处理液(1×107CFU/mL)浸泡表面已消毒损伤厚皮甜瓜2 min;处理2(T2):将表面消毒处理后的厚皮甜瓜用无菌棉签蘸取病原菌处理液(1×105CFU/mL)涂抹伤口部位并晾干;处理3(T3):将表面消毒处理后的厚皮甜瓜用无菌棉签蘸取病原菌处理液(1×105CFU/mL)涂抹伤口部位,晾干后于拮抗菌处理液中浸泡2 min。。每种处理选取360 个厚皮甜瓜,180 个置于25 ℃,相对湿度55%的人工气候箱中,180 个置于温度4 ℃,相对湿度85%的冷库中。常温下每隔5 d 测定,低温下每隔10 d 测定,每次测定每种处理选取9 个瓜。
1.2.4 厚皮甜瓜腐烂率的测定 根据汪志浩等[14]的方法进行改进,常温下每隔5 d,低温下每隔10 d,将病斑半径大于10 mm 的厚皮甜瓜记为腐烂,记录各组厚皮甜瓜腐烂数量,为方便统计,定义厚皮甜瓜腐烂率计算公式如下:
厚皮甜瓜腐烂率(%)=(腐烂果实数量/果实总数量)×100
1.2.5 厚皮甜瓜酶活测定 将待测厚皮甜瓜切开后称取5 g 损伤部位果肉,匀浆后吸取1 mL,采用POD、PPO、PAL 测试盒进行提取测定,每次测定重复3 次。
1.2.6 厚皮甜瓜可溶性固形物(TSS)的测定 根据曹建康[15]的方法进行改进,取伤口部位随机5 g 厚皮甜瓜果肉于研钵中匀浆,4 层纱布过滤得到汁液,用胶头滴管滴取3 滴瓜液至手持折射仪检测镜上,读取数值(%),即为厚皮甜瓜可溶性固形物含量。每个处理重复3 次。
1.2.7 厚皮甜瓜pH 的测定 根据陈存坤等[16]的方法进行改进,取伤口部位随机10 g 厚皮甜瓜果肉于研钵中匀浆,4 层纱布过滤得到汁液,用pH 计测量pH,每个处理重复3 次。
1.2.8 拮抗菌在厚皮甜瓜表面定殖特性的测定 参照李建等[17]的方法进行改进,常温贮藏厚皮甜瓜每隔5 d 取样,低温贮藏每隔10 d 取样。取伤口处5 g厚皮甜瓜于无菌研钵中研磨,0.85%无菌生理盐水稀释104倍,取100 μL 稀释液涂布于NA 板,32 ℃恒温培养16 h 后平板计数拮抗菌BG-2。每个处理取3 个重复。
定殖量(CFU/g)=平板菌落数×104
1.3 数据处理
本研究每个处理做3 组平行,每组平行重复3 次,数据结果以平均值±标准差表示,采用Excel 2019 进行作图,SPSS26 对实验数据进行整理和分析,用方差分析的最小显著性差异(LSD)进行差异显著性比较,P<0.05 表示差异显著。
2 结果与分析
2.1 不同贮藏温度下拮抗菌BG-2 对厚皮甜瓜腐烂率的影响
腐烂率是直观表现厚皮甜瓜腐烂情况的指标,由图1 可知,在25 ℃和4 ℃条件下,T2 处理最早腐烂,分别从第10 d 和第20 d 开始,T1 处理腐烂时间最晚且腐烂率显著低于其他处理(P<0.05)。这可能是由于拮抗菌BG-2 具有广谱抗菌性,而对厚皮甜瓜消毒处理并不能杀灭所有病原菌,另一方面拮抗菌可以诱导厚皮甜瓜保护酶活性增强,提高抗病能力,延缓腐烂。井敏敏等[18]也通过将拮抗菌接种到贮藏期“台农”芒果上得出拮抗菌可以抑制芒果果实软化的结论。25 ℃条件下,第25 d 时,T2 的腐烂率为100%,显著高于其他处理(P<0.05),T1 的腐烂率为33.33%,T3 的腐烂率为55.56%,均低于CK,说明拮抗菌BG-2 可以有效控制病原菌的生长。4 ℃条件下,第50 d 时,T2 的腐烂率为100%,此时CK 和T3 的腐烂率均为56.00%,T1 的腐烂率为22.22%,显著低于其他处理(P<0.05),T1 处理的保鲜效果最好,且相同天数低温4 种处理腐烂率均低于常温,说明低温可以延缓厚皮甜瓜腐烂,这与王红林等[19]的研究结果相符。综上表明拮抗菌BG-2 与低温结合对延缓厚皮甜瓜腐烂效果最好。

图1 拮抗菌对新疆厚皮甜瓜腐烂率的影响Fig.1 Effect of decay rate of antagonistic bacteria on Xinjiang muskmelon
2.2 不同贮藏温度下拮抗菌BG-2 对厚皮甜瓜过氧化物酶活性的影响
植物保护酶在植物防御系统中发挥了重要作用[20-21],其与某些病原菌的抗病性密切相关,在抵御病原菌入侵中发挥积极作用[22]。研究表明贮藏期水果体内H2O2含量随贮藏时间延长而增加,过量H2O2会对植物细胞造成损伤,缩短贮藏期[19]。而POD 可以抑制果实体内H2O2的生成[23-26],平衡活性氧的代谢,延缓果实的衰老[27-28]。由图2 可知,在25 ℃和4 ℃条件下,4 种处理的过氧化物酶都呈现先上升后下降的趋势。25 ℃和4 ℃下4 种处理均在第20 d 时酶活达到最高,且T3 处理显著高于其他处理(P<0.05),25 ℃下为5.45×103U/g,4 ℃下为3.06×103U/g。整个贮藏期间,T1 和T3 处理酶活始终高于CK 处理,这与寇莉萍等[29]的研究结果相似,这可能是由于厚皮甜瓜受到胁迫后体内POD 活性上升从而抵御病原菌的侵染,T1 处理酶活上升说明拮抗菌能诱导厚皮甜瓜中POD 的活性增高[30],延长厚皮甜瓜贮藏期。
2.3 不同贮藏温度下拮抗菌BG-2 对厚皮甜瓜多酚氧化酶活性的影响
PPO 在植物体活性氧系统调控中起着关键作用,能有效维持细胞内自由基的正常水平,同时PPO 可催化植物体内的酚类物质转变为有毒的醌类物质和单宁,抑制病原菌的生长[31-32]。由图3 可知,在25 ℃条件下,多酚氧化物酶呈现先上升后下降的趋势,在4 ℃条件下,多酚氧化物酶呈现缓慢上升的趋势。在25 ℃贮藏期间,T1 处理在第10 d 时酶活显著高于其他处理(P<0.05),为63.2 U/g。其余3 种处理在第15 d 时酶活达到最高,此时T3 处理酶活显著高于其他处理(P<0.05),为65.8 U/g,这可能是由于病原菌和拮抗菌结合具有协同作用[18]。在4 ℃贮藏期间,4 种处理中在第40 d 时酶活达到最高,T3 处理显著高于其他处理(P<0.05),为69 U/g,说明低温能有效延长PPO 活性的上升期,与袁启凤等[33]研究结论相似。2 种贮藏温度下拮抗菌处理酶活始终高于CK 处理,表明拮抗菌BG-2 和低温结合处理厚皮甜瓜能有效减缓PPO 活性的降低,延长厚皮甜瓜贮藏期。
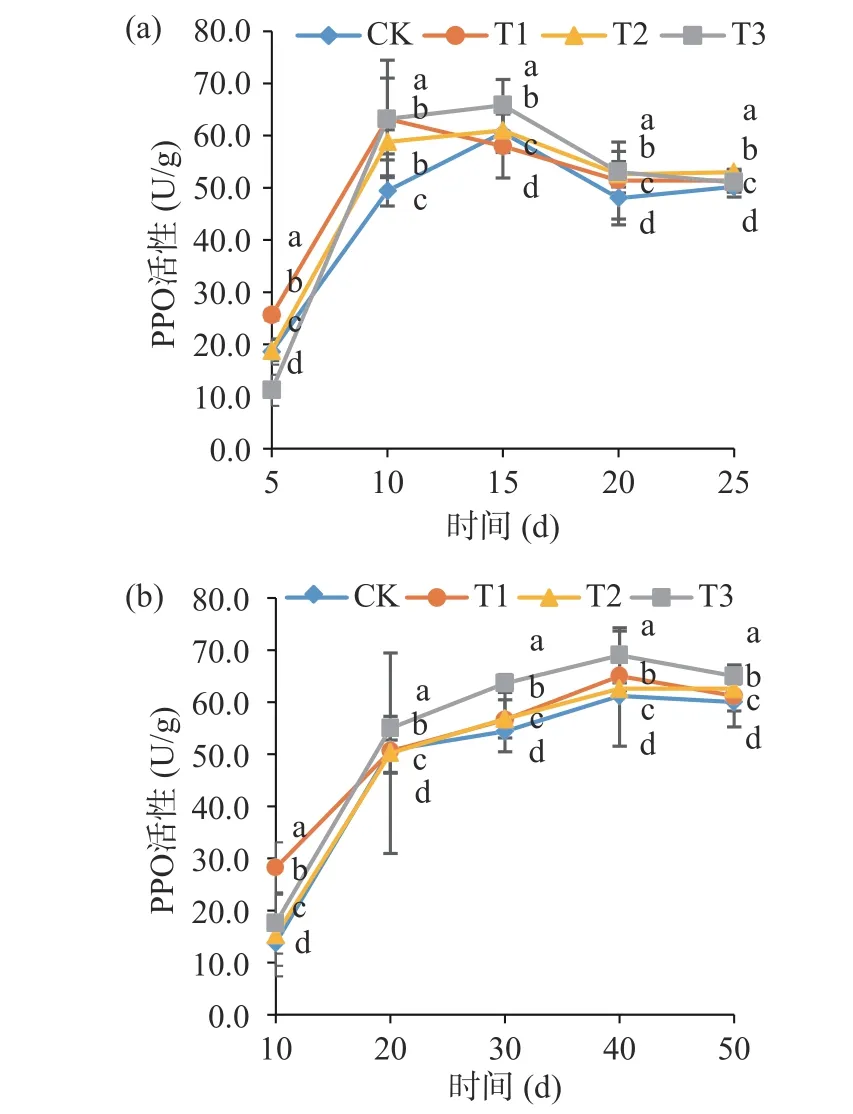
图3 拮抗菌对新疆厚皮甜瓜多酚氧化酶活性的影响Fig.3 Effect of antagonistic bacteria on PPO activity of Xinjiang muskmelon
2.4 不同贮藏温度下拮抗菌BG-2 对厚皮甜瓜苯丙氨酸解氨酶活性的影响
PAL 是苯丙烷类代谢途径的关键酶[34],合成的酚类、植保素、木质素和异黄酮类物质在抵御病原菌侵染植物体中起着重要作用[35]。由图4 可知,在25 ℃和4 ℃条件下,苯丙氨酸解氨酶呈现先上升后下降的趋势。在25 ℃贮藏期间,在第10 d 时酶活达到最高,4 种处理中T1 处理显著高于其他处理(P<0.05),为5.55 U/g,是初始值的1.60 倍,增长较明显。在4 ℃贮藏期间,CK、T1、T3 在第20 d 时酶活达到最高,其中,T1 处理显著高于其他2 个处理(P<0.05),为5.72 U/g,是初始值的2.31 倍,增长明显。40 d后T3 处理PAL 活性高于其他,可能是由于病原菌与拮抗菌结合在诱导PAL 酶活性中具有协同作用,T2 处理在整个贮藏期间虽然整体呈上升趋势但增长较为平缓,且对比T1 和T3 处理始终处于较低水平。表明拮抗菌BG-2 处理厚皮甜瓜能有效减缓PAL 活性的降低从而延长厚皮甜瓜贮藏期。

图4 拮抗菌对新疆厚皮甜瓜苯丙氨酸解氨酶活性的影响Fig.4 Effect of antagonistic bacteria on PAL activity of Xinjiang muskmelon
2.5 不同贮藏温度下拮抗菌BG-2 对厚皮甜瓜可溶性固形物的影响
可溶性固形物是判断果实是否成熟及影响果实风味的重要指标[36]。由图5 可知,在25 ℃和4 ℃条件下,厚皮甜瓜的可溶性固形物含量呈现下降的趋势。在整个贮藏期间,T1 处理和T3 处理可溶性固形物含量均显著高于T2 处理(P<0.05)。在25 ℃下,贮藏第25 d 时,T1 和T3 处理的可溶性固形物分别下降了17.25%和14.19%,T2 处理下降了60.59%。在4 ℃下,贮藏第50 d 时,各处理可溶性固形物含量达到最低,T1 和T3 处理显著高于CK 和T2 处理(P<0.05)。整个4 ℃贮藏过程T1 和T3 处理的可溶性固形物含量分别下降了15.72%和14.43%,这与赵鲁宁等[37]的研究结果一致。果实中可溶性固形物中主要成分是糖类物质,而糖类物质是果实重要的风味物质和能量来源[38]。低温贮藏能有效减缓果实可溶性固形物的下降,延长贮藏期[39],与本研究中4 ℃下4 种处理可溶性固形物含量高于25 ℃相符。说明拮抗菌BG-2 与低温结合能有效抑制厚皮甜瓜贮藏过程中可溶性固形物的下降,降低厚皮甜瓜风味和营养物质的损失。
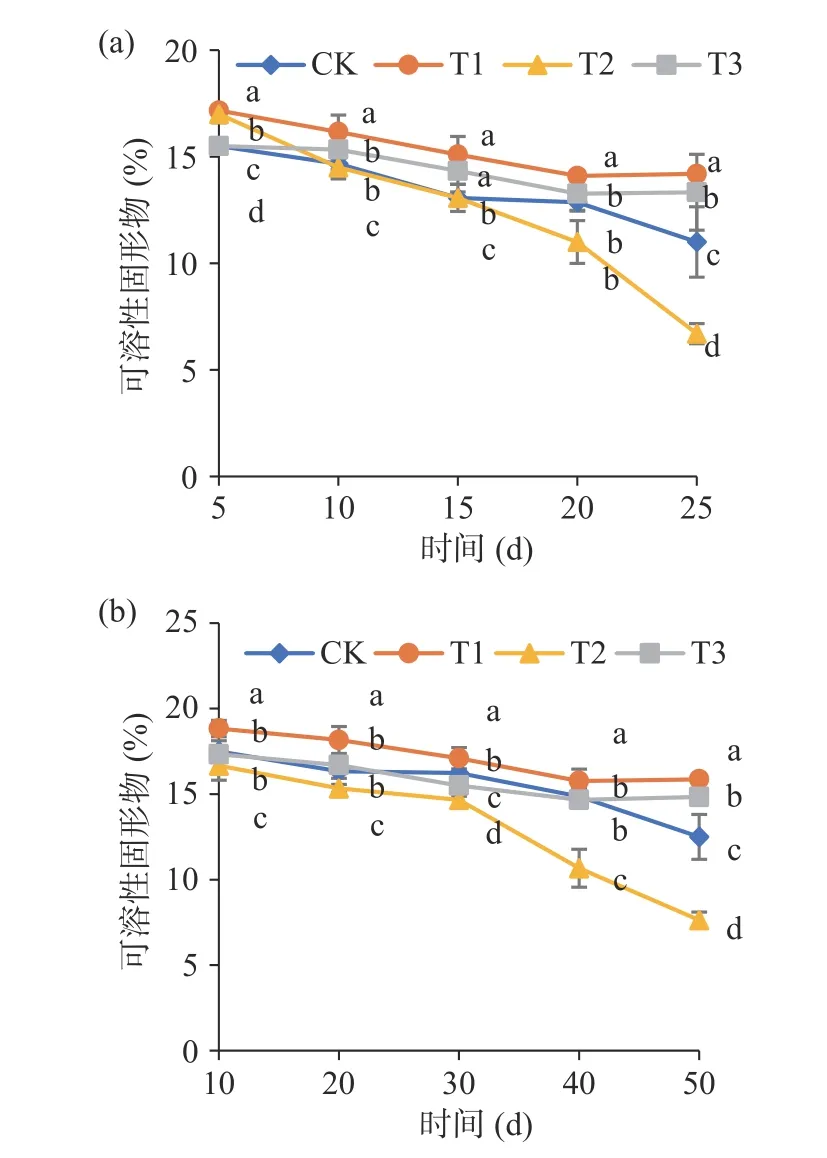
图5 拮抗菌对新疆厚皮甜瓜可溶性固形物的影响Fig.5 Effect of antagonistic bacteria on TSS content of Xinjiang muskmelon
2.6 不同贮藏温度下拮抗菌BG-2 对厚皮甜瓜pH 的影响
由图6 可知,在25 ℃和4 ℃条件下,厚皮甜瓜的pH 呈现下降的趋势,这是由于在贮藏过程中厚皮甜瓜腐败产生有机酸,导致pH 降低,CK 处理在第2 次取样升高的趋势可能是由于厚皮甜瓜的后熟消耗了有机酸[16]。在整个贮藏期间,T1 和T3 处理抑制pH 下降的能力优于其他2 种处理。在25 ℃下,贮藏第25 d 时,T1 和T3 处理pH 显著高于CK 和T2处理(P<0.05),整个贮藏过程T1 和T3 处理pH 分别下降了8.26%和15.09%,T2 处理下降了30.07%。在4 ℃下,贮藏第50 d 时,各处理pH 达到最低,T1和T3 处理显著高于CK 和T2 处理(P<0.05)。整个贮藏过程中,T1 和T3 处理pH 分别下降了5.28%和7.63%,T2 处理下降了21.93%。说明低温对抑制厚皮甜瓜pH 下降效果更好,T1 和T3 处理不仅能抑制厚皮甜瓜前期贮藏过程中pH 的上升,还能延缓后期pH 的下降,且与低温结合效果更好。

图6 拮抗菌对新疆厚皮甜瓜pH 的影响Fig.6 Effect of antagonistic bacteria on pH of Xinjiang muskmelon
2.7 不同贮藏温度下拮抗菌BG-2 在厚皮甜瓜表面的定殖特征
由图7 可知,在25 ℃和4 ℃条件下,CK 和T2 处理拮抗菌为0,T1 和T3 处理拮抗菌在厚皮甜瓜表面的定殖规律都呈现了先上升后下降的趋势。在25 ℃贮藏条件下,T1 和T3 处理拮抗菌定殖量在前20 d 呈现匀速上升的趋势,在第20 d 达到最高,T1 为5.68×106CFU/g,T3 为4.63×106CFU/g。之后拮抗菌定殖量开始下降,在第25 d 时T1 保持在3.54×106CFU/g,T3 保持在3.45×106CFU/g。在4 ℃贮藏条件下,T1 和T3 处理拮抗菌定殖量在前30 d呈现上升趋势,在第30 d 达到最高,T1 为1.41×106CFU/g,T3 为1.06×106CFU/g。之后拮抗菌定殖量开始下降,在第50 d 时T1 保持在1.06×106CFU/g,T3 保持在5.50×105CFU/g。说明拮抗菌BG-2 能在厚皮甜瓜表面稳定定殖且保持有效的定殖量。
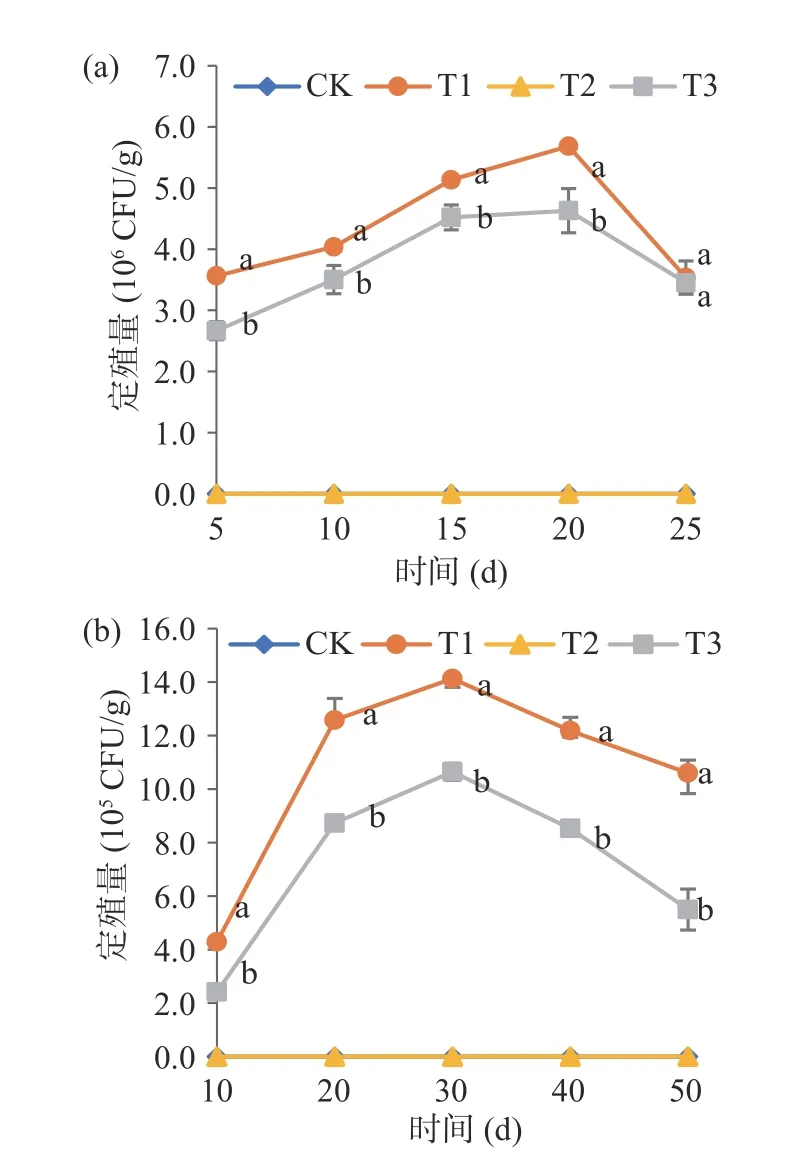
图7 拮抗菌在新疆厚皮甜瓜表面的定殖特性Fig.7 Colonization characteristics of antagonistic bacteria on the surface of Xinjiang muskmelon
3 结论
本研究初步探明了25 ℃和4 ℃下拮抗菌BG-2 对新疆厚皮甜瓜贮藏期保鲜效果和保护酶活性的影响。结果表明,2 种温度贮藏期贮藏结束时,接种拮抗菌BG-2 的厚皮甜瓜T1 处理腐烂率显著低于T2 处理(P<0.05),对抑制厚皮甜瓜pH 和可溶性固形物含量的下降也显著优于CK 和T2 处理(P<0.05)。厚皮甜瓜保护酶POD 和PAL 活性均呈现先上升后下降的趋势,PPO 活性在25 ℃下呈现先上升后下降的趋势,在4 ℃下呈现缓慢上升的趋势。接种拮抗菌BG-2 的厚皮甜瓜3 种酶活性显著高于CK 和T2 处理(P<0.05)。在25 ℃和4 ℃下贝莱斯芽孢杆菌BG-2 均能在厚皮甜瓜表面定殖,降低厚皮甜瓜腐烂率,延缓pH 和可溶性固形物的下降,延缓贮藏期厚皮甜瓜果实内POD、PPO 和PAL 活性下降,尤其与低温相结合效果更好。
——栽培注意事项

