饮用金花香橼茶3个月对小样本高脂血症人群糖脂代谢的改善效果研究
孙颖,陈鑫,杨华,应剑,邵丹青*,吕晓华*,肖杰,陈志雄,李颂,覃俊杰,郑斌,高建设
饮用金花香橼茶3个月对小样本高脂血症人群糖脂代谢的改善效果研究
孙颖1,3,4,陈鑫1,3,4,杨华2,应剑1,3,4,邵丹青1,3,4*,吕晓华2*,肖杰1,3,4,陈志雄5,李颂6,覃俊杰7,郑斌5,高建设5
1. 中粮营养健康研究院有限公司,北京 102209;2. 四川大学华西公共卫生学院/四川大学华西第四医院,四川 成都 610041;3. 营养健康与食品安全北京市重点实验室,北京 102209;4. 老年营养食品研究北京市工程实验室,北京 102209;5. 厦门茶叶进出口有限公司,福建 厦门 361013;6. 中茶科技(北京)有限公司,北京 102209;7. 深圳谱元科技有限公司,广东 深圳 518000
探讨一款用黑茶工艺、经冠突散囊菌发花的乌龙茶——金花香橼茶饮用3个月对小样本高脂血症人群糖脂代谢的临床改善效果。招募38名志愿者,试饮金花香橼茶3个月,通过检测和对比试饮前后的体成分(体重、体脂百分比等)、血液生化指标(空腹血糖、血尿酸、血脂四项)、肝脏超声、肠道菌群等,探讨金花香橼茶的健康功效。结果表明,试饮金花香橼茶3个月后,志愿者体重、体质指数、体脂百分比、内脏脂肪等级、血清总胆固醇、低密度脂蛋白胆固醇、空腹血糖显著降低(<0.05),脂肪肝严重程度减轻,肠道菌群均匀性和多样性增加,考拉杆菌属()、瘤胃球菌属()、嗜血杆菌属()、韦荣球菌属()等丰度升高,戴阿利斯特杆菌属()、丁酸蓖麻单胞菌属()丰度降低。提示金花香橼茶具有辅助降血糖、降血脂、改善非酒精性脂肪肝的作用,可能通过增加产短链脂肪酸菌属的丰度,增加短链脂肪酸,改善胰岛素抵抗,进而改善糖脂代谢。本研究所得结果仍需更加严谨的长期试验进一步加以确证。
金花香橼茶;糖脂代谢;肠道菌群;短链脂肪酸
随着我国居民的收入水平提高,人们的膳食模式在悄然发生变化,由传统的高碳水化合物、低脂肪的膳食结构逐步向高脂肪、低碳水化合物转变[1]。随之而来,糖脂代谢紊乱相关疾病患病率迅速增长,情况不容乐观,2019年全国18岁以上居民超重率和肥胖率分别达34.3%和16.4%,血脂异常总体患病率高达35.6%[2],糖尿病患病率达11.2%[3],发达城市的成人非酒精性脂肪性肝病的患病率高达15.0%[4]。超重、肥胖、糖尿病、血脂异常、非酒精性脂肪肝病是典型的糖脂代谢紊乱性疾病,这类疾病的危害在于长期糖脂异常会损害全身脏器进而导致其功能减退,且几种糖脂代谢紊乱性疾病常合并出现,进一步增加血管疾病的发生风险,微血管和大血管损伤是造成患者致残、致死的重要原因[5]。糖脂代谢紊乱性疾病严重威胁我国居民的健康,成为国家的重大公共卫生问题[5],这一系列疾病的核心病理表现之一即胰岛素抵抗[6]。近年来的研究发现,肠道菌群可能在胰岛素抵抗的发生发展机制上扮演着重要角色。健康的膳食和生活方式可有效改善胰岛素抵抗[7],进而改善糖脂代谢紊乱性疾病的发生发展,为此,我国先后发布了《“健康中国2030”规划纲要》《国民营养计划(2017—2030年)》和《健康中国行动(2019—2030年)》等重要文件,均指出要推动营养型农业和食品加工业的转型升级,引导人民提高健康素养,建立健康的生活方式,丰富营养健康产品的供给,帮助人民吃出健康[8-10]。
茶叶作为世界三大饮料之一,是我国传统的营养健康食物资源,其功能成分主要包括多酚、黄酮、多糖类、生物碱等,具有显著的抗氧化、抗炎、改善糖脂代谢等作用[11-12]。已有研究显示,在高脂饮食诱导肥胖小鼠模型中,乌龙茶干预可以有效减缓小鼠肥胖以及脂肪肝的发生发展[13];在高脂大鼠模型中,高剂量乌龙茶水浸提物干预可以有效抑制大鼠体重增加,改善腹膜后脂肪、性腺周围脂肪的组织重量及脏器指数,且可以有效改善血脂水平[14];而以冠突散囊菌()为优势菌发酵的茯砖茶的提取物能够显著抑制高脂诱导大鼠的体重增加及脂肪积累,显著降低血清中总胆固醇(Total cholesterol,TC)、甘油三酯(Triglycerides,TG)以及低密度脂蛋白胆固醇(Low density lipoprotein cholesterol,LDL-C)的水平[15]。金花香橼茶,是采用福建永春佛手(香橼茶)的新鲜叶片,结合海堤焙酵工艺,经过原料精制、渥堆发酵、气蒸压砖和干燥发花而制得的新工艺茶[16]。“发花”是形成茯砖茶独特品质的关键工艺,其实质是通过控制一定的外界条件,促使优势菌——冠突散囊菌生长繁殖,产生金黄色闭囊壳,俗称“金花”[16]。课题组前期对金花香橼茶的物质成分进行鉴定,共鉴定出41种关键成分,主要包括茶多酚、黄酮和多糖等[17],这些成分可能是金花香橼茶健康功效的物质基础。前期动物实验发现,金花香橼茶茶汤可以显著降低肥胖大鼠的体重增长、血脂和肝脏脂肪蓄积[18]。基于前期研究,初步认为金花香橼茶具有改善糖脂代谢的潜力。本研究将通过人群研究对金花香橼茶的功效进一步验证,采用自身前后对照,观察志愿者试饮金花香橼茶前后身体指标(包括体成分、生化指标、脂肪肝、肠道菌群等)的改善情况,探讨金花香橼茶的健康功效,从而为糖脂代谢紊乱性疾病的防控提供思路。
1 材料与方法
1.1 样品
本研究干预所用的金花香橼茶(货号:XTJ2902)是中茶厦门茶叶进出口有限公司生产的同批次产品,于阴凉避光通风处存放。开展人群临床研究前,金花香橼茶样品委托谱尼测试集团股份有限公司和国家副食品质量监督检验中心进行安全性评价(表1),样品经急性经口毒性试验验证属于实际无毒级,氟含量为0.16 mg·kg-1,低于《茶叶中铬、镉、汞、砷及氟化物限量》中氟的限量标准,有毒金属和霉菌毒素均未检出。
1.2 主要仪器和试剂
InBody370人体成分分析仪,拜斯倍斯医疗器械贸易(上海)有限公司;AU400全自动生化仪,奥林巴斯(日本);NemioMX超声诊断仪,东芝集团(日本)。
试验所用TC、TG、高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-C)、LDL-C、葡萄糖、尿酸(Uric acid,UA)等试剂盒,均购于四川新健康成生物股份有限公司。
1.3 研究对象
本研究获得四川大学华西公共卫生学院(华西第四医院)医学伦理委员会批准并全程跟踪。由四川大学华西公共卫生学院负责招募志愿者,对符合纳入标准的高脂血症和/或合并非酒精性脂肪肝人群进行招募入组并签署知情同意书。
1.3.1 纳入标准
(1)年龄18~80岁;(2)血脂异常(TC≥6.4 mmol·L-1或TG≥2.0 mmol·L-1或LDL-C≥3.1 mmol·L-1)患者或非酒精性脂肪肝患者;(3)具有一定的阅读能力,自愿且知情同意参加本研究者;(4)能遵从研究方案,研究期间能坚持饮茶。

表1 金花香橼茶样品安全性评价指标及结果
1.3.2 排除标准
(1)年龄在18岁以下或80岁以上,妊娠或哺乳期妇女或过敏体质者;(2)使用二甲双胍药物治疗和胰岛素治疗的糖尿病患者;(3)合并有心血管、脑血管、肝、肾和造血系统等严重疾病、精神病患者;(4)合并其他传染性疾病,如甲肝、乙肝、丙肝和获得性免疫缺陷综合征者;(5)规律或计划服用可能影响脂代谢药物者;(6)规律或计划服用保肝药物者;(7)有饮用乌龙茶习惯者;(8)近3个月服用益生菌、益生元、抗生素者;(9)因其他原因不能配合本研究者。
1.4 研究方法
采用自身干预前后对照研究设计,观察饮用3个月金花香橼茶对高脂血症和/或合并非酒精性脂肪肝人群的糖脂代谢改善效果。依据纳入和排除标准,募集合适的试饮志愿者,采取金花香橼茶试饮干预,在干预前(干预0 d)和干预后(干预90 d)分别测量志愿者身高、体重、体脂、体脂比、腰围、臀围、内脏脂肪等级、血脂四项(TC、TG、HDL-C和LDL-C)、空腹血糖(Fasting blood glucose,FBG)、血UA、脂肪肝程度以及肠道菌群健康状态,比较上述指标在干预前后的差异,进而判断干预措施对健康状况有无改善作用。要求所有志愿者干预过程中保持其他因素(如饮食、运动习惯)不变,同时于检查前一天正常饮食,避免吸烟、饮酒和摄入咖啡因,避免异常剧烈运动,晚饭后禁食10~14 h。
金花香橼茶饮用方法:每日实际用量6 g,使用300 mL飘逸杯;每次200 mL沸水冲泡60~90 s,待不烫口时尽快饮用;可反复冲泡,以饮茶代替饮水;第一泡建议在30 min内喝完;对于没有饮用茶和咖啡习惯的人,建议饮用时间最迟不晚于下午3点;推荐早饭或午饭后1 h开始饮用。
1.5 指标检测
1.5.1 身体测量及体成分指标测定
使用皮尺测量志愿者的腰围、臀围。使用InBody370型人体成分分析仪通过生物电阻抗测量法进行体质量(kg)、体脂(kg)、体脂百分比(%)和内脏脂肪等级的测定。通过腰围/臀围计算腰臀比,通过体质量÷身高2计算体质指数(Body mass index,BMI),体质量和身高的单位分别为kg和m。检测由受过专业训练的专业人员完成。
1.5.2 血清生化指标检测及脂肪肝评估
在调查当天采集志愿者的空腹静脉血,使用TC、TG、HDL-C、LDL-C、葡萄糖和UA的检测试剂盒,通过全自动生化仪进行血清TC、TG、HDL-C、LDL-C、FBG和UA检测,严格按照试剂盒说明书进行测定。使用超声诊断仪进行脂肪肝的诊断及严重性评估。采血、指标检测及肝脏超声均由专业护士和医生完成。
1.5.3 肠道菌群检测
按照正规采样规程,采集志愿者的粪便,加冰冷藏运输,由深圳谱元科技有限公司完成肠道微生物16 S基因靶向测序分析。使用MOBIO PowerSoil DNA Isolation Kit(12888-100)从志愿者粪便样本中提取细菌DNA,并在–80℃下储存在Tris-EDTA缓冲溶液中备用。使用通用引物(515F-806R)对16 S rRNA基因的V4区进行聚合酶链反应(PCR)扩增,并使用Illumina MiniSeq平台进行测序。使用QIIME2处理16 S rRNA扩增子序列。代表性序列(即特征)被定义为100%相似的合并序列,即操作分类单元(Operational taxonomic units,OTU)。使用Greengenes 13.8数据库对基因序列进行分析和注释。
1.6 统计分析
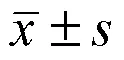
2 结果与分析
2.1 试饮志愿者基本信息
本次研究共纳入符合招募要求的试饮志愿者38人,其中男性29人,女性9人,志愿者基本信息见表2。入选的试饮志愿者中,血脂异常(TC≥6.4 mmol·L-1或TG≥2.0 mmol·L-1或LDL-C≥3.1 mmol·L-1)合并非酒精性脂肪肝者19人,单纯血脂异常者9人,单纯性非酒精性脂肪肝者10人。
2.2 试饮前后志愿者体重和体成分的变化
试饮金花香橼茶3个月后,试饮志愿者的体重、BMI、体脂、体脂百分比及内脏脂肪等级均显著下降(<0.05)。其中,男性志愿者试饮后体重、BMI、体脂及体脂百分比均显著下降(<0.05),体质量下降0.87 kg,BMI下降0.26,体脂下降0.99 kg,体脂百分比下降1.1个百分点;女性志愿者试饮后体重、BMI、体脂、体脂百分比、臀围、腰臀比及内脏脂肪等级显著下降(<0.05),体质量下降0.71 kg,BMI下降0.53,体脂下降1.37 kg,体脂百分比下降2.04个百分点,臀围下降2.99 cm,腰臀比下降0.01,内脏脂肪等级下降0.78(表3)。
2.3 试饮前后志愿者血液生化指标的变化
试饮金花香橼茶3个月后,试饮志愿者血清TC、LDL-C和FBG水平显著下降(<0.05)。其中,男性志愿者试饮后血清TC和FBG水平显著下降(<0.05),分别下降9.6%和14.0%;女性志愿者试饮后血清TC、LDL-C和FBG水平显著下降(<0.05),下降比例分别达14.5%、20.8%和13.6%(表4)。
2.4 试饮前后志愿者非酒精性脂肪肝情况的变化
试饮金花香橼茶3个月后,志愿者总体脂肪肝患病数从29人下降到28人,中度脂肪肝人数从9人减少到3人,脂肪肝总体患病数减少,脂肪肝严重程度减轻(表5)。
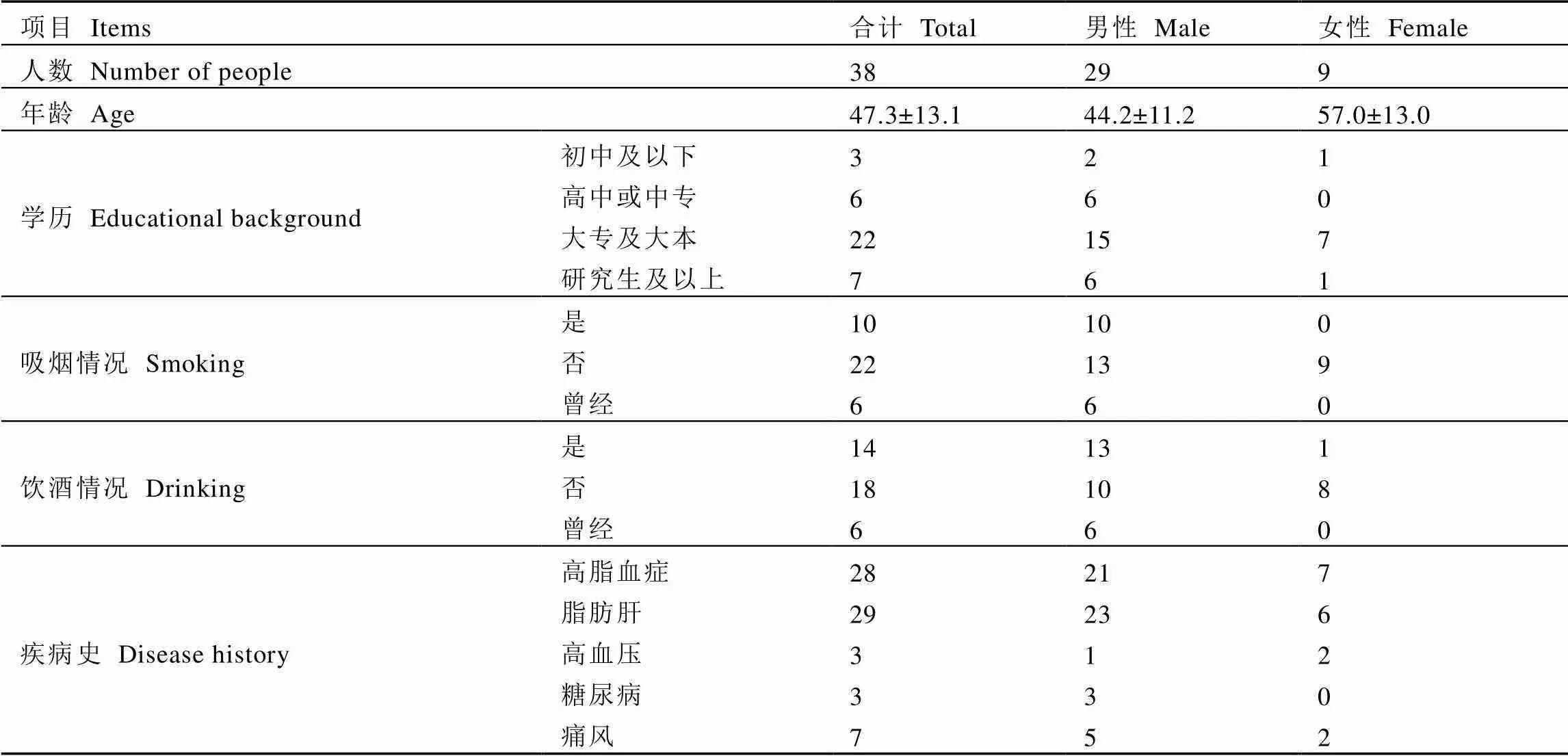
表2 试饮志愿者基本信息
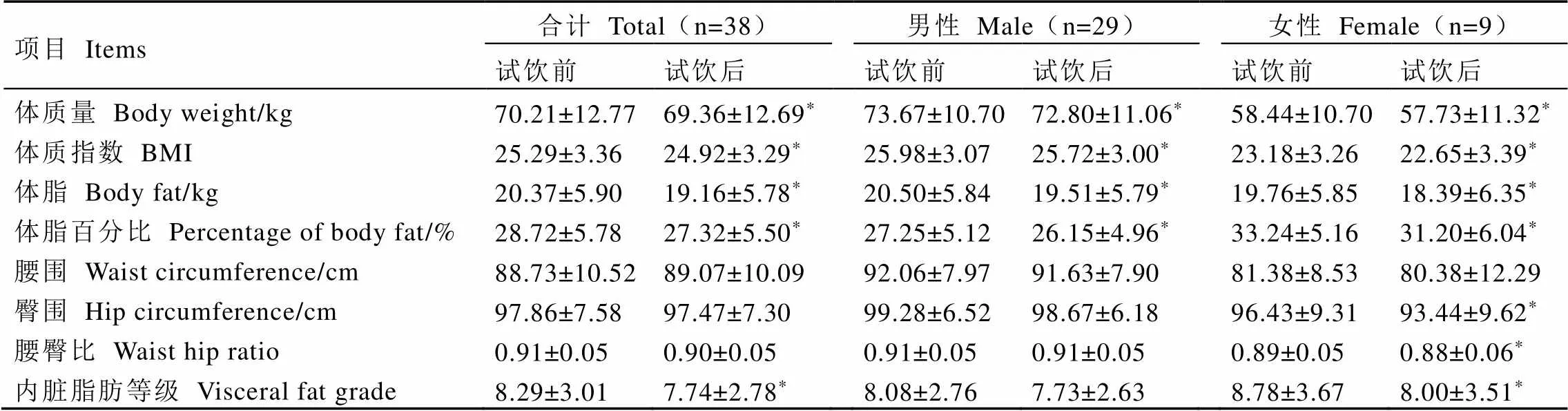
表3 试饮前后志愿者体质量和体成分的变化
注:*表示与试饮前比较,<0.05。下同
Note:*represents a significant difference compared to the group of before drinking,<0.05. The same below
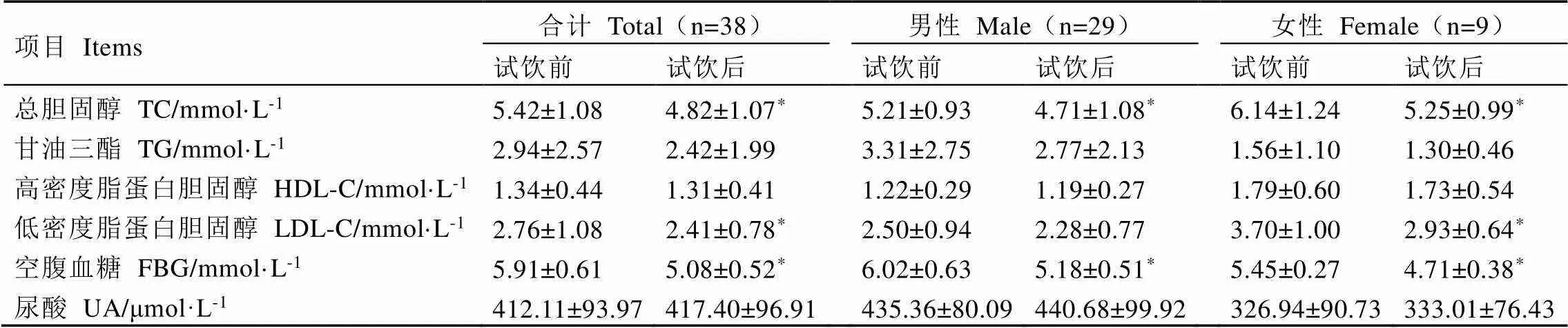
表4 试饮前后志愿者血液生化指标的变化

表5 试饮前后志愿者非酒精性脂肪肝情况的变化
2.5 试饮前后志愿者肠道菌群的变化
纳入研究的38名志愿者中有29名完成试饮前后的粪便采集及测序,其中男性志愿者22名,女性志愿者7名,对29人的肠道菌群进行分析。
多样性通常表征肠道菌群的丰富度和物种的均匀度,常用Evenness、PD、Observed OTUs和Shannon指数等指标进行表征,指数越大,则微生物群落多样性越好。本研究结果显示(图1),与试饮前相比,试饮金花香橼茶3个月后志愿者的肠道菌群丰富度和物种均匀度均有所提高,但各组间差异不显著(>0.05)。
多样性是以矩阵的数据形式,逐一比较每个物种在不同样本群落中的数量和分布的差异,主成分分析(PCA)可以直观反映样本群落间的差异。对试饮前后的肠道菌群进行PCA分析,发现试饮前后志愿者肠道菌群群落间无显著差异(图2)。
对门水平的组成进行分析,发现试饮志愿者的肠道菌群主要由拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和梭杆菌门(Fusobacteria)构成,饮茶后志愿者的肠道菌群中厚壁菌门、变形菌门和放线菌门(=0.007)相对丰度上升,拟杆菌门(=0.039)和梭杆菌门相对丰度下降,厚壁菌门/拟杆菌门(F/B)从饮茶前的0.70升高到饮茶后的0.98。分析不同性别志愿者的肠道菌群,未发现门水平存在显著的性别差异(图3)。
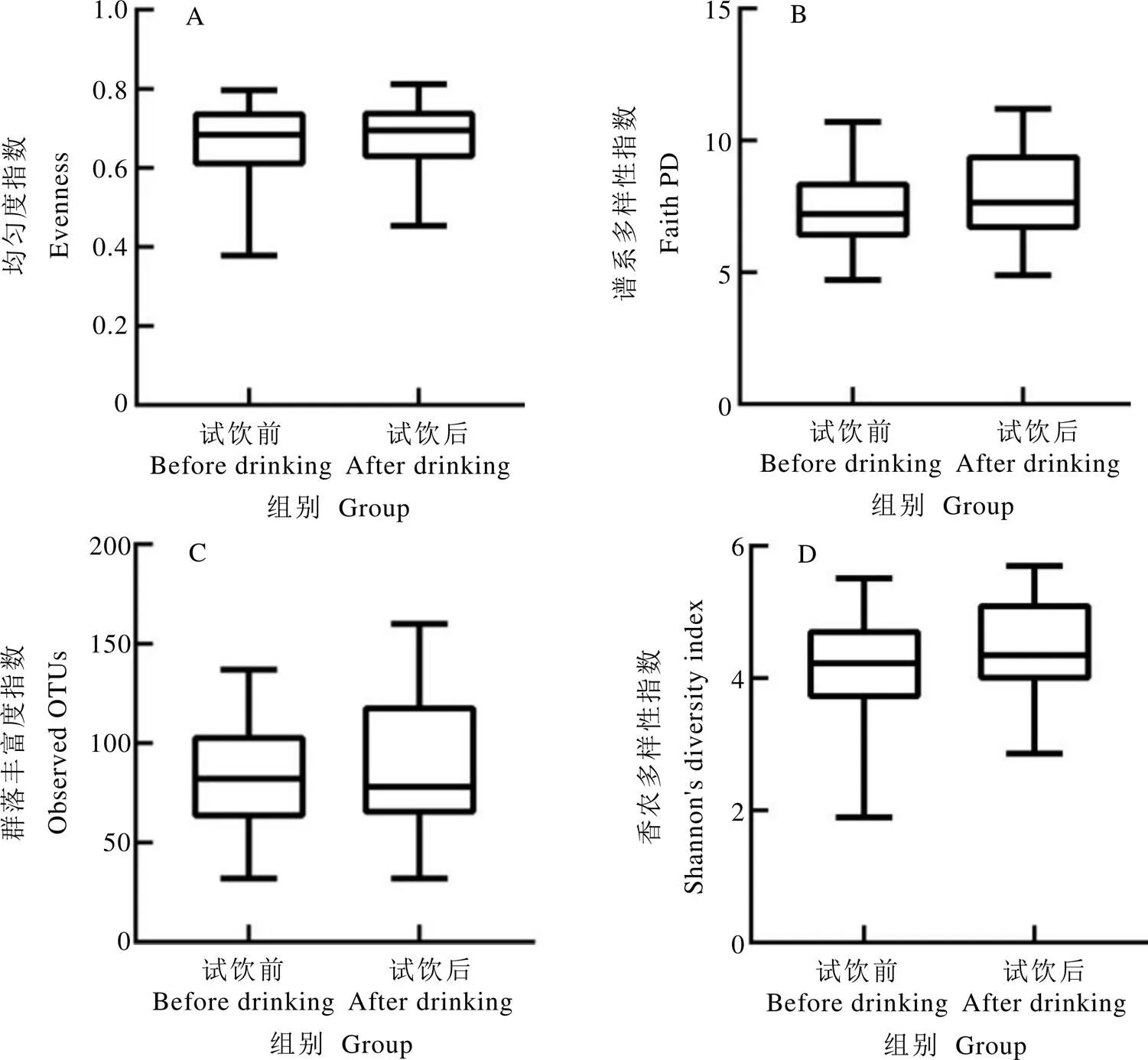
图1 试饮前后志愿者肠道菌群α多样性的变化
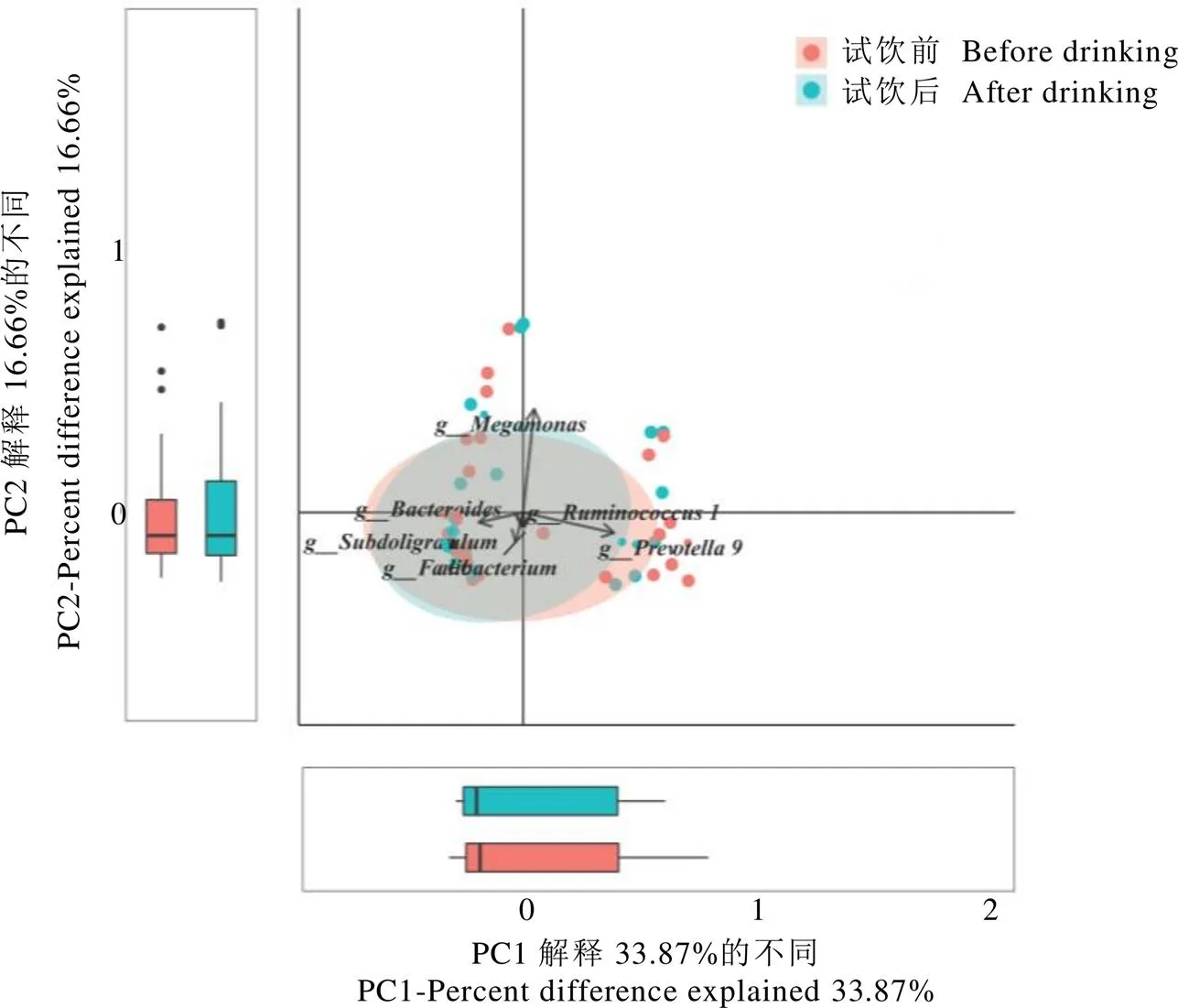
注:PC1为主成分分析的第一主成分,PC2为主成分分析的第二主成分
对属水平的组成进行分析,与试饮前相比,试饮后志愿者肠道菌群中的巨单胞菌属()、罗斯氏菌属()、布劳特氏菌属(,=0.008)、柯林斯氏菌属()等相对丰度上升,拟杆菌属()、普雷沃氏菌属()、粪杆菌属()、毛螺菌属()等相对丰度下降。分析不同性别志愿者的肠道菌群,未发现属水平存在显著的性别差异(图4)。
对志愿者的体成分指标(包括体重、体脂比、腰臀比和内脏脂肪等级)和生化指标(包括TC、TG、HDL-C、LDL-C、FBG、UA)同肠道菌群属水平进行相关性分析。结果显示(图5),戴阿利斯特杆菌属()与体重、体脂比、腰臀比、内脏脂肪等级指标正相关;考拉杆菌属()与体重、腰臀比、内脏脂肪等级成负相关;瘤胃球菌属()与FBG成负相关;与FBG成负相关,与HDL-C成正相关;与体重、TG成负相关,与HDL-C和LDL-C正相关。将上述菌属相对丰度进行试饮前后对比,戴阿利斯特杆菌属试饮后丰度降低,而考拉杆菌属、瘤胃球菌属、试饮后丰度升高。
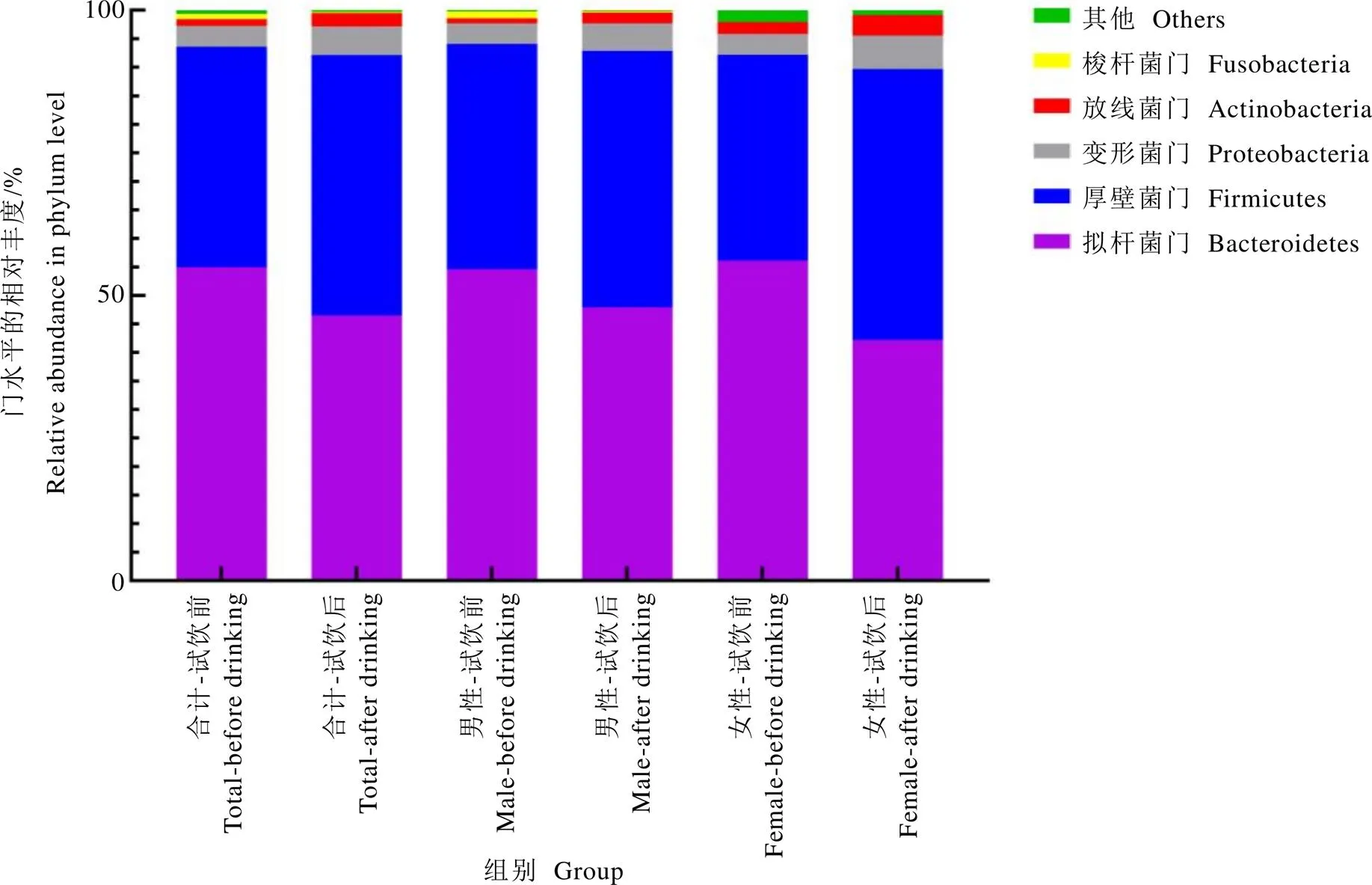
图3 试饮前后志愿者肠道菌群门水平组成的变化
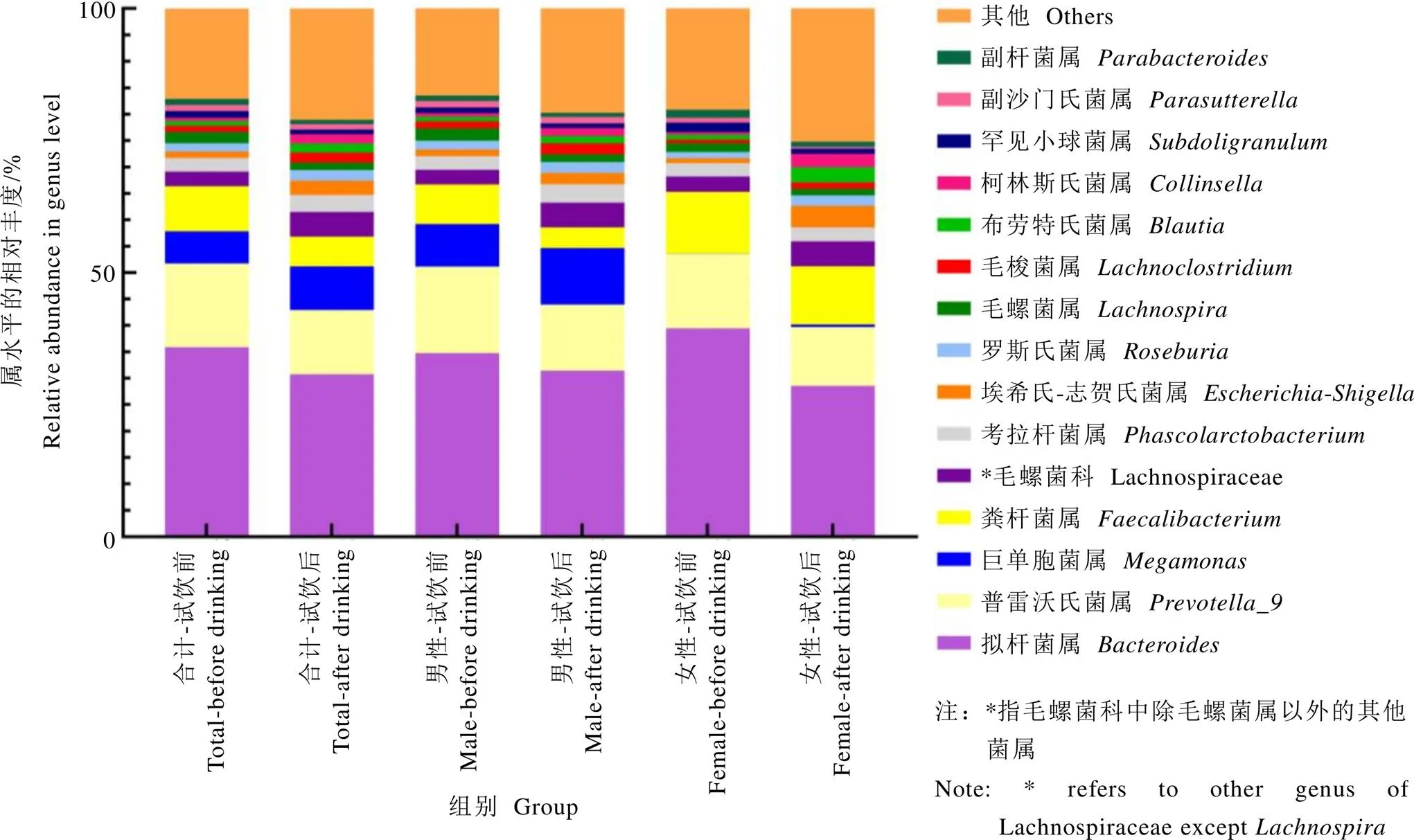
图4 试饮前后志愿者肠道菌群属水平组成的变化
2.6 试饮志愿者个体化差异分析
评估试饮志愿者的体成分指标、血液生化指标和非酒精性脂肪肝转化情况,对志愿者进行个体分析,将饮茶干预的效果进行定量细分,分为干预效果明显和不明显2个水平(表6),分析这两部分试饮志愿者肠道菌群的菌属变化情况。
结果显示,29名试饮志愿者中,有22名志愿者干预效果明显,7名干预效果不明显,将干预效果明显与不明显的志愿者试饮前后的肠道菌群变化情况进行对比,发现戴阿利斯特杆菌属、嗜血杆菌属()、韦荣球菌属()和丁酸蓖麻单胞菌属()的变化在两组存在统计学差异。干预效果明显的志愿者肠道菌群中戴阿利斯特杆菌属升高值低于在干预效果不明显者的升高值(=0.01);嗜血杆菌属和韦荣球菌属在干预效果明显者肠道中升高,在干预效果不明显者肠道中降低(分别为0.14和0.003);丁酸蓖麻单胞菌属在干预效果明显者肠道中降低,在干预效果不明显者肠道中升高(=0.003),具体如图6所示。将上述菌属相对丰度进行试饮前后对比,戴阿利斯特杆菌属和丁酸蓖麻单胞菌属试饮茶后丰度降低,而嗜血杆菌属、韦荣球菌属试饮后丰度升高。
3 讨论与结论
金花香橼茶是以乌龙茶为基底,经黑茶的发酵工艺,通过优势菌冠突散囊菌的增殖而得到的新工艺茶。本研究首次在人群中开展金花香橼茶对高脂血症和/或合并非酒精性脂肪肝患者的糖脂代谢功能影响的研究。本研究发现,试饮金花香橼茶3个月后,试饮志愿者体重、BMI、体脂百分比、内脏脂肪等级、血清TC、LDL-C、FBG水平与饮茶前相比显著下降,提示饮用金花香橼茶3个月改善了志愿者的糖脂代谢。
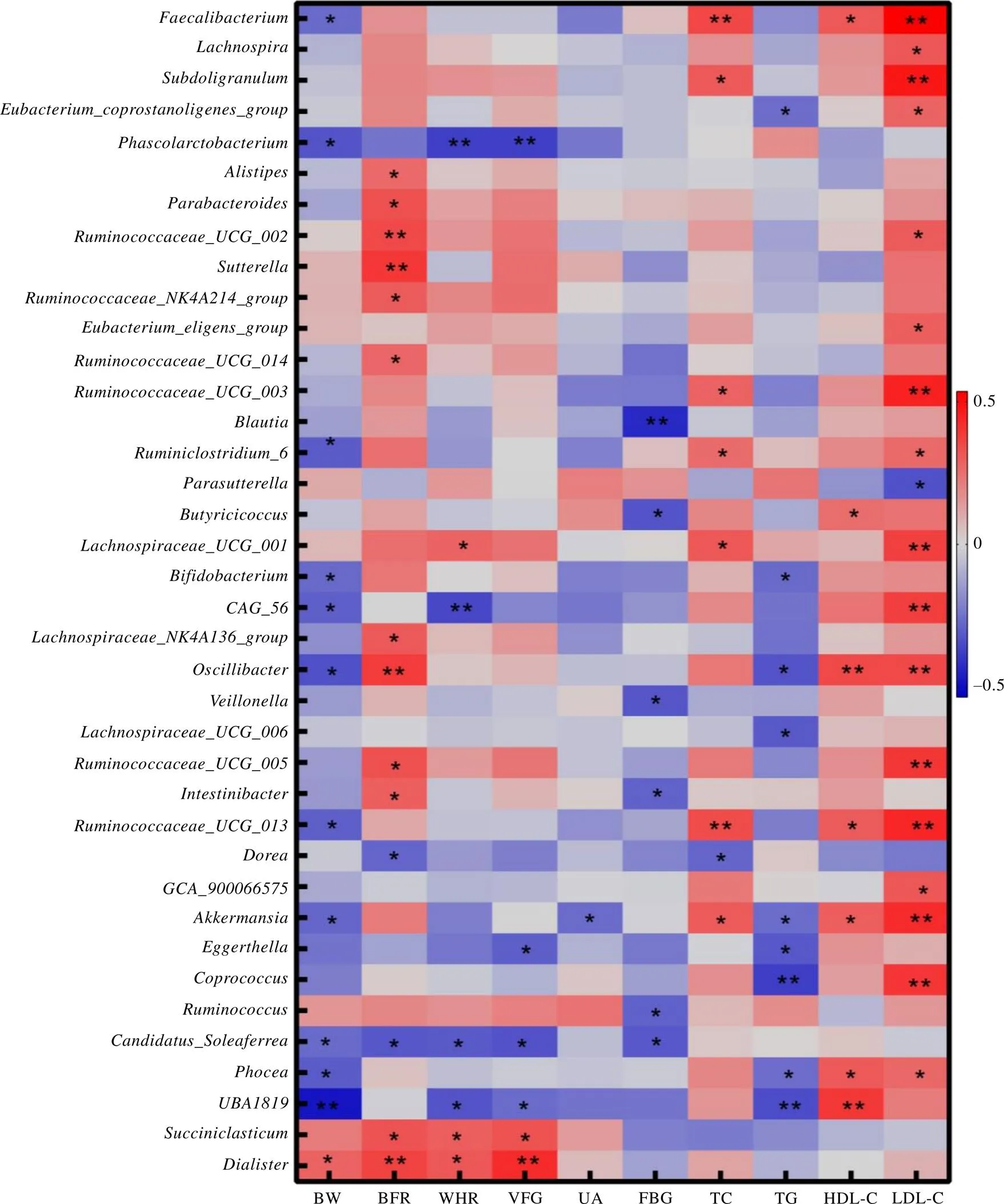
注:BW为体重,BFR为体脂比,WHR为腰臀比,VFG为内脏脂肪等级,UA为尿酸,FBG为空腹血糖,TC为总胆固醇,TG为甘油三酯,HDL-C为高密度脂蛋白胆固醇,LDL-C为低密度脂蛋白胆固醇。*和**表示体成分及生化指标与肠道菌群属水平的相关性存在统计学意义,分别表示P<0.05和P<0.01
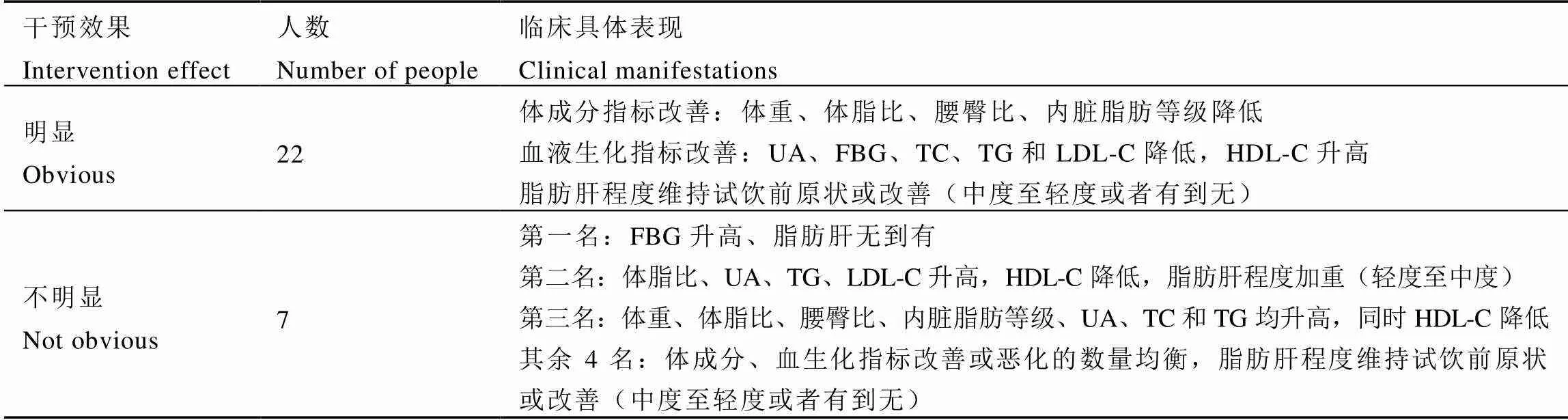
表6 试饮茶干预效果细分
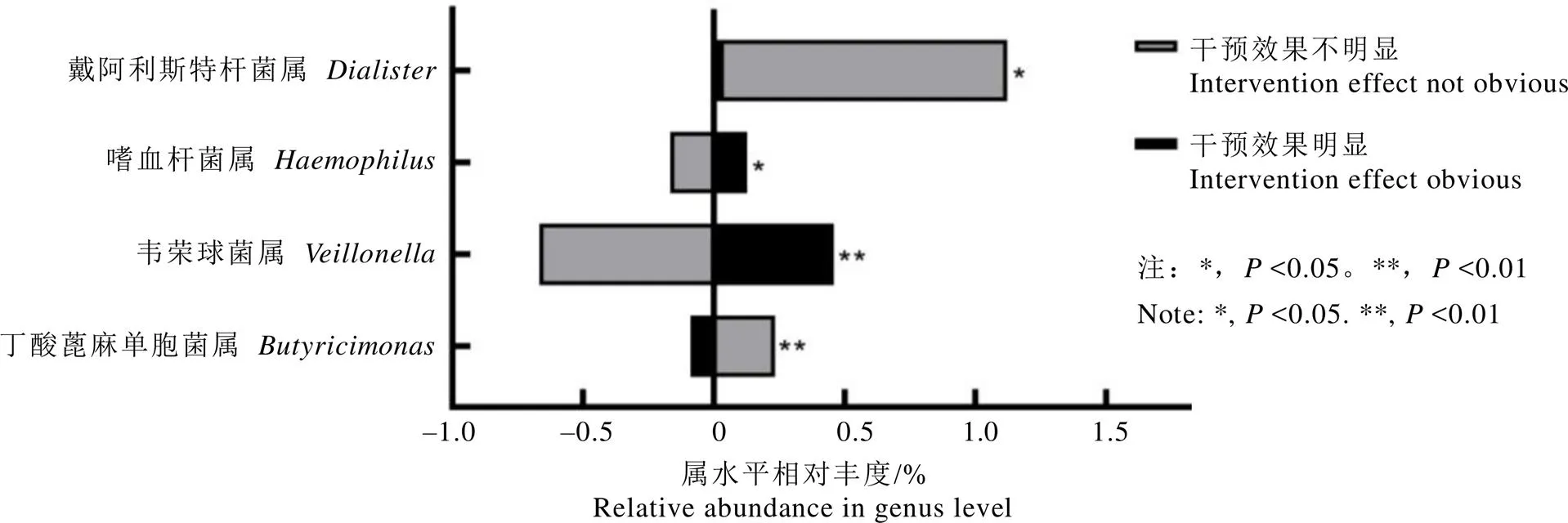
图6 饮茶干预效果明显与不明显志愿者肠道菌群变化情况对比
茶叶是我国传统的营养健康饮料资源,既往研究显示茶叶具有诸多健康功效。Yuan等[13]发现,陈年乌龙茶可以降低高脂饮食诱导的体重增加,脂肪堆积,血清TC、TG和LDL-C升高,同时提高血清HDL-C水平,并明显减轻了脂肪肝,同时可以使附睾脂肪中脂肪细胞减小。He等[19]发现乌龙茶可通过改善脂质代谢降低体脂含量,减轻体重,认为长期饮用乌龙茶可以预防肥胖。Rothenberg等[15]总结发现,发酵茶在增加短链脂肪酸的产生、调节肠道菌群、促进脂质代谢方面优于不发酵茶。本项目组前期利用高脂饮食诱导的大鼠模型[18],研究饮用金花香橼茶对预防肥胖的作用,结果发现,干预45 d后,高剂量干预组的体重增长显著低于高脂模型组,且血脂指标显著改善,TC、TG显著降低,HDL-C升高。HE染色结果显示,高脂模型组中大鼠肝脏存在大小不一的空泡(脂肪滴),肝细胞体积增大、肿胀,而高剂量金花香橼茶茶汤干预组中肝脏空泡较少,且肝索形态较为正常[18],因此认为金花香橼茶能有效改善脂肪肝小鼠的脂代谢功能。在此基础上,本研究在人群中开展了功效研究,发现了与上述研究一致的结果。
研究发现,随着发酵进程的加深,金花香橼茶中茶多糖(Tea polysaccharides,TPS)含量呈现先下降后上升的趋势,成品茶中TPS的含量高达3.9%[17]。TPS是茶叶中活性多糖的总称,具有降血糖、降血脂、抗氧化、增强免疫力等诸多生物活性[20-21],因此TPS很有可能是金花香橼茶降糖、降脂功能的重要物质基础。
茶多酚是茶叶的主要功能成分,Heber等[14]研究发现,绿茶、红茶和乌龙茶多酚可降低肥胖饮食小鼠的内脏脂肪和炎症水平,不同茶类的多酚含量虽然存在显著差异,但均有诱导体重减轻、抗炎等作用。儿茶素是茶多酚中含量最多的成分,具有显著的抗氧化、抗炎等保健功效和药理活性[22]。侯粲等[17]研究发现,金花香橼茶在加工过程中酯型儿茶素含量显著下降,但是成品茶叶的抗氧化活性仍维持在原有水平,可能是因为发酵过程中产生了新型黄酮类化合物,以及从儿茶素结构中脱落的没食子酸,抵消了因儿茶素含量降低发生的抗氧化活性变化,且该研究发现金花香橼茶具有抑制-葡糖糖苷酶和-淀粉酶的能力,可以减缓葡萄糖的生成和吸收,具有降糖的潜力,这在本研究中得到验证,饮茶3个月后,志愿者的空腹血糖从5.9 mmol·L-1降低到5.1 mmol·L-1(<0.05)。
近年来,越来越多的研究表明肠道菌群与神经系统疾病、精神疾病、呼吸系统疾病和代谢性疾病等存在关联,其中,肠道菌群与糖脂代谢的关系越来越受到研究人员的关注[23]。有研究认为,肠道菌群可能通过细菌的脂多糖(LPS)导致慢性炎症或减少循环短链脂肪酸(Short-chain fatty acid,SCFA)或增加衍生代谢产物(如丙酸咪唑、色氨酸衍生代谢产物、吲哚、犬尿氨酸、5-羟色胺、支链氨基酸等)等多种机制,介导胰岛素抵抗的发生发展,进而引起糖脂代谢紊乱,同时越来越多的证据表明,SCFA可以充当肠道上皮特殊营养和能量组分,改善肠道屏障功能,抑制胰岛素介导的脂肪组织中的脂肪积累,表现出抗炎作用,并保护宿主免受结肠疾病的侵害[24-25]。
研究发现,茶叶通过TPS、茶多酚、茶黄酮等物质基础[26],能够显著降低2型糖尿病大鼠的FBG、TC、TG、LDL-C和游离脂肪酸水平,其内在机制是茶叶有助于改善肠道菌群的多样性,有助于肠道有益菌生长并抑制有害菌的生长[27],如茯砖茶可以显著改善高脂饮食诱导的肥胖小鼠的肠道菌群,促进双歧杆菌()的增殖[28];金花黑茶干预使得BALB/c小鼠肠道微生物多样性增加,如双歧杆菌()、乳球菌等有益菌增加,大肠杆菌等有害菌降低[29],进而促进健康;TPS可增加肠道微生物群的多样性,恢复一些因糖尿病而减少的菌属(如、)的相对丰度[21]。与前述研究结果一致,本研究发现饮用金花香橼茶后志愿者的肠道菌群多样性增加。多样性代表样人体内肠道菌群的复杂度,受菌群丰富度和均匀度影响,是反映受检者肠道菌群健康水平的重要指标之一。多样性越高代表受试者肠道菌群越健康,反之则提示肠道菌群可能存在失衡,且肠道菌群多样性与各种代谢疾病的发生以及并发症的发生关系紧密[30-31]。同时,本研究也发现试饮后和丰度增加,与前述研究结果一致。
国内外学者在对肠道菌群影响肥胖的研究上,通常以门水平的组成即厚壁菌门/拟杆菌门(F/B)的比值来反映机体肥胖状况,但仍存在争议。小鼠和人体试验发现肥胖组的F/B较正常组更高,而且经过饮食干预后肥胖组的F/B值随体重的减轻而下降[32]。但也有研究指出,F/B值与肥胖无关[33],肥胖者的厚壁菌门和拟杆菌门丰度均降低[34],肥胖者减肥成功后其肠道菌群中厚壁菌门丰度升高[35],甚至肥胖组F/B的值较体重正常组相对降低[36]。茶叶相关的研究发现,连续饮用两周的绿茶(400 mL·d-1),在促进产SCFA菌属生长、降低粪便中细菌内毒素含量的同时,也增加了F/B的比例[26]。本研究发现,与饮茶前相比,饮茶后志愿者肠道中拟杆菌门降低,厚壁菌门上升,F/B呈现增加的趋势,提示对于F/B与肥胖之间关系还应该再进一步探讨。
在肠道菌群构成的门水平上,厚壁菌门的许多成员都是有益菌,如乙酸盐生产者乳杆菌,产丁酸的粪杆菌、真杆菌、罗氏杆菌等[37-38]。而本研究中发现饮茶后厚壁菌门丰度增加,金花香橼茶可能通过促进厚壁菌门增殖进而使得SCFA增加,促进健康。梭杆菌门也是人类肠道菌群中所占比例很高的菌,主要分为纤毛菌科(Leptotrichiaceae)和梭杆菌科(Fusobacteriaceae),其中梭杆菌科成员中的具核梭杆菌可促进消化道肿瘤的发生和发展,但同时也是人体中的共生菌和机会致病菌[39]。本研究发现志愿者饮用金花香橼茶后,肠道中的梭杆菌门降低。
在肠道菌群构成的属水平上,有学者研究我国9个省市7个民族314名健康年轻人粪便菌群结构,发现所有研究者中均出现包括考拉杆菌属、瘤胃球菌属在内的9个与合成SCFA有关的菌属[40]。考拉杆菌属是丙酸生产者,瘤胃球菌属是丁酸生产者[41],本研究发现考拉杆菌属与体重、腰臀比、内脏脂肪等级成负相关,瘤胃球菌属与FBG成负相关,提示2个菌属为有益菌,且2个菌属在饮茶后均出现丰度的升高,提示金花香橼茶能促进二者的增殖,这可能是金花香橼茶改善糖脂代谢、发挥健康功效路径上的关键环节。对于产丁酸菌属,有研究评估其作为潜在新一代益生菌的安全性,发现其安全性及耐受性良好,有成为二代益生菌的潜力,也有研究者发现,经过益生元干预的小鼠肠道菌群中丰度增加[42]。本研究发现,与HDL-C成正相关,与FBG成负相关,同时经过饮茶干预,该菌的丰度升高,是一个有益菌,与上述研究观点基本一致。此外,本研究还发现、嗜血杆菌属、韦荣球菌属可能是有助于发挥糖脂代谢改善功效的菌属。有研究发现,与焦虑和运动功能显著相关[43],嗜血杆菌属在口腔内较多[44],但关于二者与糖脂代谢的相关性并未检索到相关文献支持,而针对韦荣球菌属,有研究发现其同时具有促炎和抗炎作用,在肠道中韦荣球菌属与唾液链球菌菌株1共培养时可降低炎性细胞因子的产生,而与菌株2共培养时炎性细胞因子的产生比各自单独培养时显著增加[45],产生相互矛盾的结论或许是由于肠道微环境以及菌群构成不同所导致。
有研究表明,戴阿利斯特杆菌属可能通过增加一些代谢产物,使得糖脂代谢恶化[46-47]。本研究发现戴阿利斯特杆菌属与体重、体脂比、腰臀比、内脏脂肪等级指标成正相关,而饮用金花香橼茶后该菌丰度下降。关于,大多数研究认为其是一个产丁酸菌属,具有抗炎并促进结肠细胞功能恢复的作用[45,48-49],但本研究发现其在干预效果好的志愿者肠道中丰度降低,在干预差者肠道中丰度升高,且试饮茶后总体丰度降低,与以往研究不一致。
本研究以小样本量的自身对照试验方案初步探索了规律性饮用金花香橼茶3个月对高脂血症人群糖脂代谢的改善效果,虽然无法证明肠道菌群在金花香橼茶改善糖脂代谢通路上的因果关系,但通过结果可以猜测饮用金花香橼茶可能基于其TPS、茶多酚等功能成分,通过增加产SCFA菌的丰度,增加循环中SCFA的浓度,进而改善胰岛素抵抗程度,从而改善志愿者的糖脂代谢水平。本研究因研究设计在统计效能上低于随机对照试验,后续欲探讨金花香橼茶对糖脂代谢的确切效果、可能机制及糖脂代谢通路上的因果关系等,仍需开展更大规模、更加深入、更加严谨的长期试验,如开展志愿者的肠道菌群代谢通路分析等。
综上所述,金花香橼茶经过毒理学实验和有毒有害物质检测,呈现良好的安全性。小样本高脂血症和/或合并非酒精性脂肪肝人群饮用该茶3个月后,体重、BMI、体脂重量、体脂百分比、内脏脂肪等级显著降低,同时,血清TC、LDL-C、FBG显著下降,脂肪肝严重程度减轻,肠道菌群改善。提示金花香橼茶具有降低体脂肪、辅助降低血清胆固醇和血糖及改善肠道菌群的作用。但是本研究在金花香橼茶改善糖脂代谢的机制方面未做深入探讨,需要未来更加深入的、规模更大的作用机制和因果关系研究。
[1] 林海, 丁钢强, 王志宏, 等. 新营养学展望: 营养、健康与可持续发展[J]. 营养学报, 2019, 41(6): 521-529.
Lin H, Ding G Q, Wang Z H, et al. The prospective in new nutrition science: nutrition, health and sustainable development [J]. Acta Nutrimenta Sinica, 2019, 41(6): 521-529.
[2] 国家卫生健康委疾病预防控制局. 中国居民营养与慢性病状况报告(2020年)[M]. 北京: 人民卫生出版社, 2021: 3-5.
Disease Prevention and Control Bureau of National Health Commission of the People's Republic of China. Report on nutrition and chronic diseases of Chinese residents (2020) [M]. Beijing: People's Medical Publishing House, 2021: 3-5.
[3] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 中华内分泌代谢杂志, 2021, 37(4): 311-398.
Chinese Diabetes Society. Guideline for the prevention and treatment of type 2 diabetes mellitus in China (2020 edition) [J]. Chinese Journal of Endocrinology and Metabolism, 2021, 37(4): 311-398.
[4] 任士萌, 梅璐, 黄煌, 等. 非酒精性脂肪性肝病患者肠道菌群及生物化学指标相关性分析[J]. 中华肝脏病杂志, 2019, 27(5): 369-375.
Ren S M, Mei L, Huang H, et al. Correlation analysis of gut microbiota and biochemical indexes in patients with non-alcoholic fatty liver disease [J]. Chinese Journal of Hepatology, 2019, 27(5): 369-375.
[5] 项磊, 陈羽, 朴胜华, 等. 糖脂代谢紊乱流行病学及糖脂代谢病分期诊治[J]. 广东药科大学学报, 2019, 35(2): 159-163.
Xiang L, Chen Y, Piao S H, et al. Glucolipid Metabolic Disorders: epidemiology, staging and management [J]. Journal of Guangdong Pharmaceutical University, 2019, 35(2): 159-163.
[6] 李强. 中国2型糖尿病合并血脂异常防治专家共识(2017年修订版)[J]. 中华内分泌代谢杂志, 2017, 33(11): 925-936.
Li Q. Expert consensus on prevention and treatment of dyslipidemia in type 2 diabetes mellitus in China (revised 2017) [J]. Chinese Journal of Endocrinology and Metabolism, 2017, 33(11): 925-936.
[7] 洪小瑜, 戴亚丽, 林秋讯, 等. 生活方式的管理对新诊断2型糖尿病患者肠道菌群的影响[J]. 罕少疾病杂志, 2021, 28(2): 99-102.
Hong X Y, Dai Y L, Lin Q X, et al. Effect of lifestyle management on intestinal flora in patients with type 2 diabetes mellitus [J]. Journal of Rare and Uncommon Diseases, 2021, 28(2): 99-102.
[8] 中共中央, 国务院. 《“健康中国2030”规划纲要》[Z/OL]. (2016-10-25)[2022-02-07]. http://www.gov.cn/xinwen/2016-10/
25/content_5124174.htm.
Central Committee of the Communist Party of China, The State Council. ‘Healthy China 2030’ Planning Outline [Z/OL]. (2016-10-25)[2022-02-07]. http://www.gov.cn/ xinwen/
2016-10/25/content_5124174.htm.
[9] 国务院办公厅. 国民营养计划(2017—2030年)[J]. 营养学报, 2017, 39(4): 315-320.
General Office of the State Council of the People's Republic of China. National Nutrition Plan (2017-2030) [J]. Acta Nutrimenta Sinica, 2017, 39(4): 315-320.
[10] 健康中国行动推进委员会. 《健康中国行动(2019—2030年)》[R/OL]. (2019-07-09)[2022-02-07]. http://www. gov.cn/
xinwen/2019-07/15/content_5409694.htm.
Health China Action Promotion Committee. Healthy China Action (2019–2030)[R/OL]. (2019-07-09)[2022-02-07]. http://www.gov.cn/xinwen/2019-07/15/content_5409694.htm.
[11] 陈宗懋, 甄永苏. 茶叶的保健功能[M]. 北京: 科学出版社, 2014.
Chen Z M, Zhen Y S. Health function of tea [M]. Beijing: Science Press, 2014.
[12] Hayat K, Iqbal H, Malik U, et al. Tea and its consumption: benefits and risks [J]. Critical Reviews in Food Science and Nutrition, 2015, 55(7): 939-954.
[13] Yuan E, Duan X, Xiang L, et al. Aged oolong tea reduces high-fat diet-induced fat accumulation and dyslipidemia by regulating the AMPK/ACC signaling pathway [J]. Nutrients, 2018, 10(2): E187. doi: 10.3390/nu10020187.
[14] Heber D, Zhang Y, Yang J, et al. Green tea, black tea, and oolong tea polyphenols reduce visceral fat and inflammation in mice fed high-fat, high-sucrose obesogenic diets [J]. The Journal of Nutrition, 2014, 144(9): 1385-1393.
[15] Rothenberg D O, Zhou C, Zhang L. A review on the weight-loss effects of oxidized tea polyphenols [J]. Molecules (Basel, Switzerland), 2018, 23(5): 1176. doi: 10.3390/molecules23051176.
[16] 王贵卿, 陈志雄, 彭建肯, 等. 一种金花香橼茶的制作方法: CN201710350052.5[P]. 2017-12-01[2021-09-29].
Wang G Q, Chen Z X, Peng J K, et al. A method of making Jinhua Xiangyuan tea: CN201710350052.5 [P]. 2017-12-01[2021-09-29].
[17] 侯粲, 杜昱光, 王曦, 等. 冠突散囊菌发酵对2种新工艺茶叶成分及活性的影响[J]. 食品科技, 2019, 44(10): 90-97.
Hou C, Du Y G, Wang X, et al. Effects ofon chemical compositions and activities of the new process teas [J]. Food Science and Technology, 2019, 44(10): 90-97.
[18] Xiao J, Wang X, Hou C, et al. Anti-obesity and hypolipidemic effects of fermented oolong tea water extracts in high-glucose and high-fat diet-induces obese rats [C]//State Key Laboratory Tea Plant Biology and Utilization. First International Congress on Cocoa, Coffee and Tea Asia. Hefei: [s.n.], 2018.
[19] He R R, Chen L, Lin B H, et al. Beneficial effects of oolong tea consumption on diet-induced overweight and obese subjects [J]. Chinese Journal of Integrative Medicine, 2009, 15(1): 34-41.
[20] 周小玲. 茶多糖的定量、定性及生物活性研究[D]. 青岛: 中国海洋大学, 2007: 10-15.
Zhou X L. Quantifying, characteristics and bioactivities of tea polysaccharide [D]. Qingdao: Ocean University of China, 2007: 10-15.
[21] Li H, Fang Q, Nie Q, et al. Hypoglycemic and hypolipidemic mechanism of tea polysaccharides on 2ype 2 diabetic rats via gut microbiota and metabolism alteration [J]. Journal of Agricultural and Food Chemistry, 2020, 68(37): 10015-10028.
[22] 葛华, 吴峰, 杜鹏, 等. 茶多酚心脑功能保护作用的研究进展[J]. 中国疗养医学, 2020, 29(9): 919-922.
Ge H, Wu F, Du P, et al. Research progress on cardio-cerebral function protection of tea polyphenols [J]. Chinese Journal of Convalescent Medicine, 2020, 29(9): 919-922.
[23] 杨俊, 王健宇, 陈茏, 等. 肠道菌群对糖脂代谢影响的研究进展[J]. 微生物学通报, 2019, 46(5): 1146-1154.
Yang J, Wang J Y, Chen L, et al. Advance in studying the effect of gut microflora on glycolipid metabolism [J]. Microbiology China, 2019, 46(5): 1146-1154.
[24] Saad M J, Santos A, Prada P O. Linking gut microbiota and inflammation to obesity and insulin resistance [J]. Physiology, 2016, 31(4): 283-293.
[25] Aron-wisnewsky J, Warmbrunn M V, Nieuwdorp M, et al. Metabolism and metabolic disorders and the microbiome: the intestinal microbiota associated with obesity, lipid metabolism, and metabolic health-pathophysiology and therapeutic strategies [J]. Gastroenterology, 2021, 160(2): 573-599.
[26] 应剑, 肖杰, 康乐, 等. 健康中国背景下的茶叶功能研究与生物技术在健康茶饮开发中的应用[J]. 生物产业技术, 2019(6): 75-86.
Ying J, Xiao J, Kang L, et al. Functional research on Chinese tea and the application of biological methods in the development of healthy tea products for the plan of healthy China [J]. Biotechnology and Business, 2019(6): 75-86.
[27] 蒋慧颖, 马玉仙, 周欢, 等. 茶叶调节肠道菌群作用研究进展[J]. 安徽农业科学, 2018, 46(15): 31-33.
Jiang H Y, Ma Y X, Zhou H, et al. Research advance in the effect of tea on intestinal flora [J]. Journal of Anhui Agricultural Sciences, 2018, 46(15): 31-33.
[28] Chen G, Xie M, Wan P, et al. Fuzhuan brick tea polysaccharides attenuate metabolic syndrome in high-fat diet induced mice in association with modulation in the gut microbiota [J]. Journal of Agricultural and Food Chemistry, 2018, 66(11): 2783-2795.
[29] 衣喆, 刘婷, 陈然, 等. 金花黑茶对BALB/c小鼠通便和调节肠道菌群的作用[J]. 食品科技, 2016, 41(6): 61-66.
Yi Z, Liu T, Chen R, et al. Effect offermented dark tea on defecation and gut microbiota in BALB/c mice [J]. Food Science and Technology, 2016, 41(6): 61-66.
[30] Albander Z, Nitert M D, Mousa A, et al. The gut microbiota and inflammation: an overview [J]. International Journal of Environmental Research and Public Health, 2020, 17(20): 7618. doi: 10.3390/ijerph17207618.
[31] 王保红, 姚铭飞, 吕龙贤, 等. 人体微生态与健康[J]. Engineering, 2017, 3(1): 154-178.
Wang B H, Yao M F, Lv L X, et al. The human microbiota in health and disease [J]. Engineering, 2017, 3(1): 154-178.
[32] Castaner O, Goday A, Park Y M, et al. The gut microbiome profile in obesity: a systematic review [J]. International Journal of Endocrinology, 2018, 2018: 1-9.
[33] Duncan S H, Lobley G E, Holtrop G, et al. Human colonic microbiota associated with diet, obesity and weight loss [J]. International Journal of Obesity, 2008, 32(11): 1720-1724.
[34] Schwiertz A, Taras D, Schaäfer K, et al. Microbiota and SCFA in lean and overweight healthy subjects [J]. Obesity, 2010, 18(1): 190-195.
[35] Jumpertz R, Le D S, Turnbaugh P J, et al. Energy-balance studies reveal associations between gut microbes, caloric load, and nutrient absorption in humans [J]. The American Journal of Clinical Nutrition, 2011, 94(1): 58-65.
[36] Guo Y, Huang Z P, Liu C Q, et al. Modulation of the gut microbiome: a systematic review of the effect of bariatric surgery [J]. European Journal of Endocrinology, 2018, 178(1): 43-56.
[37] 陈浩嘉, 陈有仁, 吴寿岭. 膳食纤维和肠道菌群与肥胖关系的研究进展[J]. 医学综述, 2019, 25(5): 839-844.
Chen H J, Chen Y R, Wu S L. Research progress in relationship between dietary fiber, intestinal flora and obesity [J]. Medical Recapitulate, 2019, 25(5): 839-844.
[38] 王阶平, 刘波, 刘欣, 等. 乳酸菌的系统分类概况[J]. 生物资源, 2019, 41(6): 471-485.
Wang J P, Liu B, Liu X, et al. Taxonomy of lactic acid bacteria [J]. Biotic Resources, 2019, 41(6): 471-485.
[39] Brennan C A, Garrett W S.: symbiont, opportunist and oncobacterium [J]. Nature Reviews Microbiology, 2019, 17(3): 156-166.
[40] Zhang J, Guo Z, Xue Z, et al. A phylo-functional core of gut microbiota in healthy young Chinese cohorts across lifestyles, geography and ethnicities [J]. The ISME Journal, 2015, 9(9): 1979-1990.
[41] Huang P, Jiang A, Wang X, et al. NMN maintains intestinal homeostasis by regulating the gut microbiota [J]. Frontiers in Nutrition, 2021, 8: 714604. doi: 10.3389/fnut. 2021.714604.
[42] Shi H, Chang Y, Gao Y, et al. Dietary fucoidan ofalters gut microbiota and mitigates intestinal mucosal injury induced by cyclophosphamide [J]. Food & Function, 2017, 8(9): 3383-3393.
[43] Jang J H, Yeom M J, Ahn S, et al. Acupuncture inhibits neuroinflammation and gut microbial dysbiosis in a mouse model of Parkinson's disease [J]. Brain, Behavior, and Immunity, 2020, 89: 641-655.
[44] Gao L, Xu T, Huang G, et al. Oral microbiomes: more and more importance in oral cavity and whole body [J]. Protein & Cell, 2018, 9(5): 488-500.
[45] Jia W, Rajani C, Xu H, et al. Gut microbiota alterations are distinct for primary colorectal cancer and hepatocellular carcinoma [J]. Protein & Cell, 2021, 12(5): 374-393.
[46] Muñiz pedrogo D A, Jensen M D, Van dyke C T, et al. Gut microbial carbohydrate metabolism hinders weight loss in overweight adults undergoing lifestyle intervention with a volumetric diet [J]. Mayo Clinic Proceedings, 2018, 93(8): 1104-1110.
[47] Gao J, Guo X, Wei W, et al. The association of fried meat consumption with the gut microbiota and fecal metabolites and its impact on glucose homoeostasis, intestinal endotoxin levels, and systemic inflammation: a randomized controlled-feeding trial [J]. Diabetes Care, 2021, 44(9): 1970-1979.
[48] González-sarrías A, Romo-vaquero M, García-villalba R, et al. The endotoxemia marker lipopolysaccharide-binding protein is reduced in overweight-obese subjects consuming pomegranate extract by modulating the gut microbiota: a randomized clinical trial [J]. Molecular Nutrition & Food Research, 2018, 62(11): e1800160. doi: 10.1002/mnfr.201800160.
[49] Liu Z, Liu H Y, Zhou H, et al. Moderate-intensity exercise affects gut microbiome composition and influences cardiac function in myocardial infarction mice [J]. Frontiers in Microbiology, 2017, 8: 1687. doi: 10.3389/fmicb.2017.01687.
Clinical Trial on the Effect of Drinking Jinhua Xiangyuan Tea for 3 Months on the Improvement of Glucose and Lipid Metabolism in A Small Sample Hyperlipidemia Population
SUN Ying1,3,4, CHEN Xin1,3,4, YANG Hua2, YING Jian1,3,4, SHAO Danqing1,3,4*, LÜ Xiaohua2*, XIAO Jie1,3,4, CHEN Zhixiong5, LI Song6, QIN Junjie7, ZHENG Bin5, GAO Jianshe5
1. Nutrition and Health Research Institute, COFCO Ltd., Beijing 102209, China; 2. West China School of Public Health and West China Fourth Hospital, Sichuan University, Chengdu 610041, China; 3. Beijing Key Laboratory of Nutrition & Health and Food Safety, Beijing 102209, China; 4. Beijing Engineering Laboratory for Geriatric Nutrition Food Research, Beijing 102209, China; 5. Xiamen Tea Import and Export Co., Ltd., Xiamen 361013, China; 6. China Tea Technology (Beijing) Co., Ltd., Beijing 102209, China; 7. Shenzhen Puyuan Technology Co., Ltd., Shenzhen 518000, China
This study is aimed at investigating the clinical effect of drinking Jinhua Xiangyuan tea for 3 months on the glucose and lipid metabolism in a small sample patients with hyperlipidemia (with/without non-alcoholic fatty liver). Jinhua Xiangyuan tea was produced by the new process usingIn this study, before-and-after control design was used. The body composition (body weight, BMI, waist hip ratio, percentage of body fat, visceral fat grade), blood biochemical indicators (fasting blood glucose, uric acid, blood lipid), fatty liver, and gut microbiota were examined before and after the test. After drinking Jinhua Xiangyuan tea for 3 months, the body weight, BMI, percentage of body fat, visceral fat grade, serum total cholesterol, low-density lipoprotein cholesterol, and fasting blood glucose of 38 volunteers were significantly reduced (<0.05).Fatty liver was less severe. Gut microbiota’s diversity and richness were increased. The relative abundance of,,andwere increased, andandwere decreased. Jinhua Xiangyuan tea could increase the relative abundance of short-chain fatty acid-producing bacteria, increasing short-chain fatty acids, and improving insulin resistance, then improving glucose and lipid metabolism. The results of this study still need to be further confirmed by more rigorous long-term experimental observation.
Jinhua Xiangyuan tea, glucose and lipid metabolism, gut microbiota, short-chain fatty acids
S571.1;TS272.5+5
A
1000-369X(2022)04-561-16
2022-02-08
2022-03-17
中粮集团重大项目-2017、云南科技专项-2021
孙颖,女,工程师,主要从事食物与营养方向研究。*通信作者:shaodanqing@cofco.com;luxiaohua@scu.edu.cn

