儿茶素生物医用纳米材料研究进展
俞蓉欣,郑芹芹,陈红平,张劲松,张相春*
儿茶素生物医用纳米材料研究进展
俞蓉欣1,2,3,郑芹芹2,3,陈红平2,3,张劲松1*,张相春2,3*
1. 安徽农业大学茶树生物学与资源利用国家重点实验室,安徽 合肥 230036;2. 中国农业科学院茶叶研究所,浙江 杭州 310008;3. 农业农村部茶叶质量安全控制重点实验室,浙江 杭州 310008
儿茶素具有抗氧化、抗肿瘤、抗病毒、抗炎和免疫调节等功能,是茶叶中含量丰富的一类生物活性物质。由于酚羟基的高活泼性导致儿茶素在生物体外及体内极易失去活性,致使其在生物体内利用度不高。近年来,纳米生物技术的发展有望通过配体设计、精准合成和智能调控等策略解决儿茶素低生物利用度的难题,并拓展其在生命健康领域中的应用。综述了近几年儿茶素生物医用纳米材料的研究进展,重点阐述了儿茶素生物医用纳米材料的抗肿瘤、抗菌、抗炎、药物递送和抗病毒等活性,对儿茶素生物医用纳米材料的构建和生物作用机制进行了探讨,并对儿茶素新材料设计及其应用前景进行了展望。
儿茶素;EGCG;纳米材料;生物医学;抗肿瘤
茶为中国传统饮品,是三大无酒精饮料之一,已成为世界公认的天然健康饮料。茶叶中含有丰富的对人体有益的化学成分,包括茶多酚、茶氨酸、茶多糖、茶色素、咖啡碱以及较丰富的微量元素。现代科学研究表明,这些功能成分具有杀菌、抗炎、抗氧化、抗病毒、降脂、预防心血管疾病和抗肿瘤等生物功能[1-7]。在这些功能性成分中,研究者们关注最早、研究最多的是茶多酚(Tea polyphenols)。茶多酚是从茶叶中提取的一种以2-苯基苯并吡喃结构为主体的天然多羟基酚类物质。茶叶中发现的多酚类物质主要包括类黄酮物质(儿茶素;黄酮、黄酮醇类;花色苷类)和酚酸及缩酚酸,占茶叶干重的18%~36%。茶多酚中研究者所关注的主要功能性成分儿茶素占总多酚含量的70%以上,主要包含表没食子儿茶素没食子酸酯(EGCG)、表没食子儿茶素(EGC)、表儿茶素没食子酸酯(ECG)、表儿茶素(EC)等组分[8]。
儿茶素具有抗肿瘤、抗菌、抗氧化、抗病毒、预防心脑血管疾病和调节免疫力等生物功能[9-15]。但是过去几十年,研究人员对儿茶素的研究大多只关注于单一功能成分或茶汤等直接处理细胞或者动物的生物基础研究。儿茶素含多个酚羟基,其发挥生物功能的原因之一是酚羟基的高活泼性,使其首先受到外来有害物质的攻击而保护正常组织不被损伤,从而达到保护作用。但是正是由于酚羟基的高活泼性使其体外很容易被氧化导致结构改变,或者在体内与蛋白、金属、离子聚合而失去生物活性,最终引起其在体内生物利用度低[16]。儿茶素的体外不稳定性和体内生物利用度低等问题仍然是研究者们一直需要解决的难题。
近年来,纳米技术在生物医学领域中的广泛应用有望提升茶功能性成分的生物利用度。利用纳米技术将植物天然活性成分或临床药物制备的纳米颗粒具有极大的比表面积和尺寸效应,具有改善药物溶解性、增强药物靶向性和缓释性、提高生物利用率和降低毒副作用等优势,因此得到了材料化学、生物化学和医学界等的极大关注[17-21]。利用纳米生物技术将茶多酚、茶氨酸、茶多糖等功能性成分构建成生物医用纳米材料具有很好的应用前景。目前已有部分研究采用不同材料作为配体,主要有金属[22]、壳聚糖[23]、脂质体[24]等,与茶多酚、茶氨酸等功能性成分构建成稳态的茶功能性纳米生物材料,可以保护茶功能成分在运输过程中不降解失活,并且通过功能修饰使其运输到目标部位进行可控释放,提高了其生物利用率,同时还可以负载抗肿瘤、抗菌、抗病毒等治疗药物,实现联合治疗[25]。这些研究为茶功能性成分在生命健康领域中的应用提供了新思路,对茶与健康研究以及茶叶高值化利用具有重大意义。
本文回顾了近年来利用纳米生物技术修饰儿茶素,获得不同生物功能的新型生物医用材料,并评价了这些生物材料在肿瘤、细菌感染、炎症和药物递送等生命健康领域中的应用研究(图1)。进一步对这些新型儿茶素生物材料所涉及的生物功能机制进行了归纳总结。这些通过配体设计和功能修饰的生物材料构建策略有望解决儿茶素体外易氧化失活以及体内生物利用度低等难题。
1 儿茶素生物纳米材料抗肿瘤研究进展
癌症是21世纪威胁人类健康的最大杀手,我国是人口大国,也是癌症高发国家,2020年我国新发病457万例,占全球癌症新发病人数的23.7%,中国2014年至2018年癌症死亡人数由230万增至260万,预计2024年将达约300万人[26]。随着医疗技术的发展,我国肿瘤诊疗水平得到显著提升,根据国家癌症中心统计数据显示,我国恶性肿瘤的五年生存率已经从十年前的30.9%提升到40.5%,但仍远低于美国的66%,与美国相比,中国癌症治疗方案更为有限[27]。在中国,化疗在肿瘤治疗中扮演着重要角色,前十位畅销肿瘤药物中有4种为传统化疗药物,然而,传统化疗效果不佳及其导致副作用等问题仍是我国抗癌路上的绊脚石。因此迫切需要开发安全、高效的抗肿瘤疗法。
儿茶素被认定为一种天然、高效、安全的生物活性物质,具有高效的抗肿瘤活性。Moseley等[28]研究发现,在EGCG浓度为150 µmol·L-1时,甲基化敏感的人结肠癌细胞HCT116中DNA甲基化转移酶(DNMT)和组蛋白去乙酰化酶(HDAC)蛋白转录被抑制,降低了在HCT116中的异常表达,从而抑制人结肠癌细胞生长;Qiao等[29]发现,EGCG可以通过调控基因表达抑制宫颈癌(CaSki)细胞生长和诱导细胞周期停滞;CaSki细胞24 h半抑制浓度为27.3 µmol·L-1,25 µmol·L-1EGCG诱导S期从38.3%显著增加到46.4%,G2/M期从7.4%增加到16.9%,而G0/G1期从54.2%下降到36.7%,此外,EGCG在CaSki细胞中将G0/G1期(G0/G1以下)之前的比例从2.24%增加到23.54%;然而,由于EGCG稳定性差,在光照、湿热、碱性等外界条件下容易使分子结构中具有生理活性的酚羟基发生氧化、缩合、聚合反应,极大降低了生物活性,使其应用具有很大局限性;在生物体内易受pH、金属离子、酶等生理环境变化的影响而导致生物活性改变[30],致使其无法在病灶部位达到有效浓度发挥生物活性。为了提高其生物利用度,研究人员往往会提高EGCG的口服或注射浓度,使其到达体内特定部位积累到有效浓度发挥生理功能。但是,高浓度EGCG剂量容易引发副作用。Lambert等[31]发现单剂量EGCG(1 500 mg·kg-1,灌胃)可以使CF-1小鼠的丙氨酸氨基转移酶(ALT)增加138倍,小鼠存活率降低到85%。同时,该研究也观察到了高浓度EGCG导致中度至重度肝坏死,并且肝毒性与氧化应激相关,包括肝脏脂质过氧化和金属硫蛋白增加等。Wang等[32]发现,逐步增加EGCG剂量(1~3 d,55 mg·kg-1;4~8 d,80 mg·kg-1;8~31 d,110 mg·kg-1)可导致亚急性肝功能衰竭伴腹水并发症,在试验32 d测得昆明鼠腹水发生率为100%,并且检测到大量的肝细胞坏死和肝纤维化形成。因此,提高EGCG的给药浓度并不是提高其体内生物利用度的有效策略。
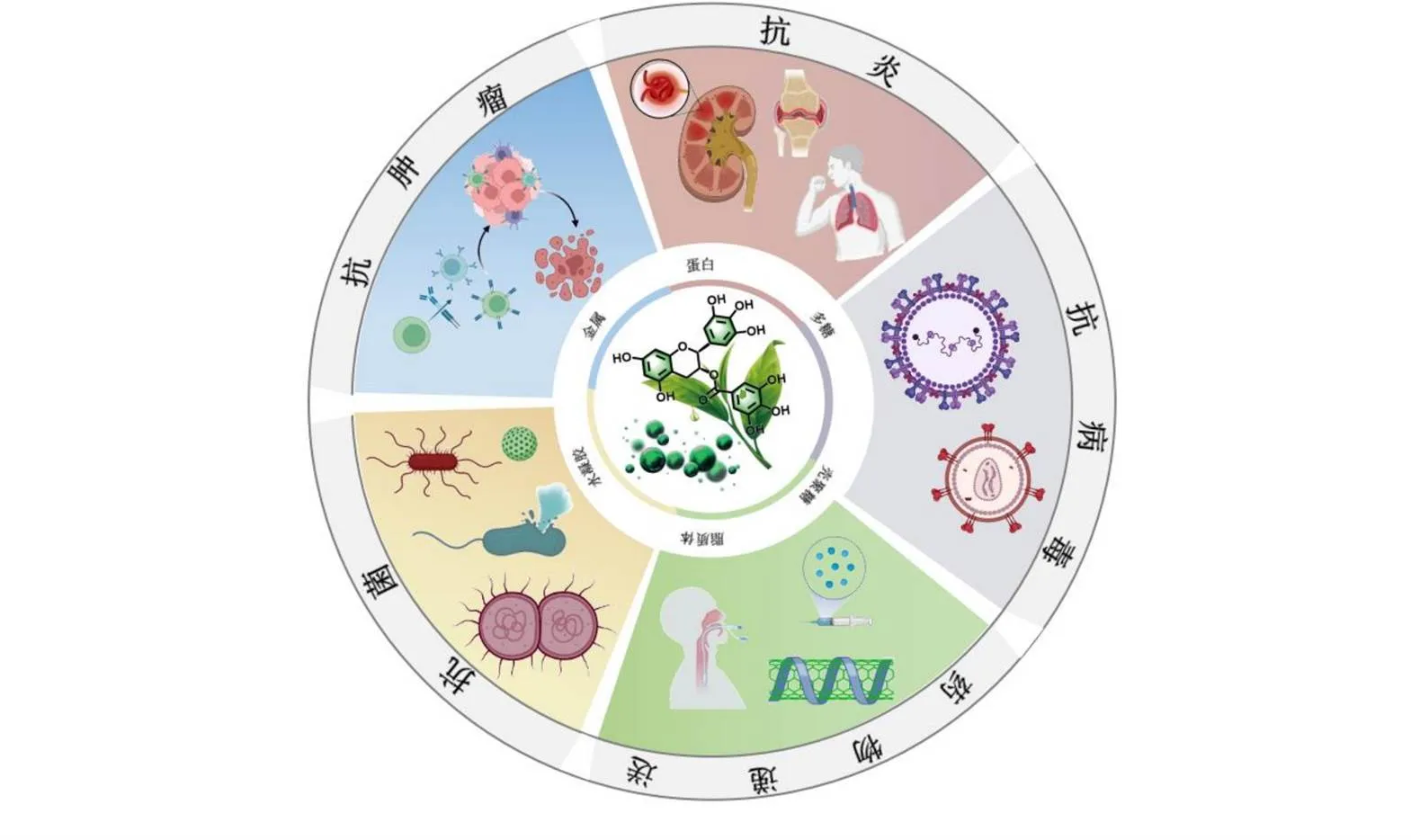
图1 儿茶素生物医用纳米材料应用示意图
近年来,纳米医学的兴起使纳米材料在生命医学领域发挥了重要作用,包括药物靶向递送、药物长效缓释、生物纳米分析和基于纳米材料的活体多模式成像等[33-35],这为提高EGCG在生物体内利用率和最大化发挥其生物活性提供了可能。因此,为了充分发挥EGCG生物活性,提高其在生物体内的利用度,很多研究者开始利用纳米生物技术将EGCG进行修饰,极大提高了其稳定性和生物利用度。如利用多糖、蛋白、聚合物、脂质等[36-39]不同材料为载体制备EGCG纳米颗粒,提高了其在体内的稳定性、生物安全性和生物活性。Cheng等[40]构建了含有阿霉素(Dox)和EGCG的新型绿茶儿茶素多离子复合物(PIC)胶束,EGCG和Dox联合治疗可以保护心肌细胞免受Dox介导的心脏毒性。这种PIC胶束由于EGCG对P-糖蛋白(P-gp)活性的调节,可以有效逆转癌细胞的多药耐药;Chen等[41]通过Cu2+和温度介导,EGCG氧化偶联组装,制备了聚合EGCG纳米球,可实现阿霉素的高效释放;Rahim等[42]使用绿茶茶汤与金属快速组装成多酚金属材料;Zhong等[43]利用氧化介导的动力学策略实现了可调的多酚金属网络设计。这些新兴的多酚纳米材料丰富了生物医学中材料的设计与选择,为生物医学中功能材料的选择提供了支撑。
1.1 儿茶素脂质体/胶束抗肿瘤进展
大量研究证实,儿茶素纳米脂质化后可以有效保持其生物活性,显著提高对食道癌、腺癌、乳腺癌、黑色素瘤、肝癌等多种癌症的预防和治疗作用[44-46]。Hu等[47]将EGCG和淀粉样原纤维进行封装,使EGCG纳米粒子可以在pH 2.5~7.0范围内保持活性,并显著提高EGCG在肠道的通透性和吸收;Smith等[48]利用单相液体共溶法制备出EGCG纳米脂类复合物,EGCG纳米脂质颗粒的生物利用度是大鼠口服游离EGCG的两倍以上,且不影响其他摄入物的吸收;Gomes等[49]以麦芽糊精-阿拉伯糖为生物载体,表面涂有蛋黄磷脂酰胆碱/硬脂胺双层膜制成EGCG纳米脂质颗粒,结果发现与未包覆的纳米颗粒相比,脂质包覆的纳米颗粒能更有效地保留EGCG,提高了EGCG在生理pH下的稳定性。纳米颗粒可以减少EGCG的暴露,减少酶促降解和非酶促降解,延长作用时间,提高生物利用度。Pace等[24]报道,EGCG壳聚糖纳米脂质体(CSLIPO-EGCG)在10 µmol·L-1浓度下对人乳腺癌细胞(MCF7)表现出抗增殖和促凋亡作用,而在此浓度下,游离EGCG没有任何有益作用。与顺铂单独给药相比,Bae等[50]构建的HA-EGCG-顺铂胶束材料有更好的抗肿瘤活性,且具有良好的生物安全性,该纳米药物由透明质酸和EGCG偶联构建,用于卵巢癌治疗,将这种共轭物和顺铂简单混合,可诱导具有球状核壳结构的胶束纳米复合物自发自组装,表面暴露的透明质酸能够通过受体介导的内吞作用将顺铂有效地传递到跨膜黏附糖蛋白(CD44)过表达的癌细胞中。其中,EGCG的抗氧化能力可保护由顺铂诱发的氧化应激引起的脱靶器官毒性。药代动力学和生物分布研究表明,静脉注射HA-EGCG-顺铂复合物可增加药物的体内长循环和在肿瘤部位高效富集。以绿茶儿茶素为基础的顺铂胶束纳米复合物有望成为一种安全高效的卵巢癌化疗药。
1.2 儿茶素纳米金属复合物抗肿瘤进展
Hsieh等[51]将EGCG与纳米金颗粒结合制备的纳米材料具有良好的抗肿瘤功效。在体外抗肿瘤活性试验中,与对照组相比,EGCG单体和pNG处理组的膀胱癌细胞(MBT-2)数量分别减少49.7%和48.1%,而EGCG-pNG处理下膀胱癌细胞(MBT-2)数量仅为对照组的25.5%,说明EGCG-pNG对膀胱癌细胞抑制有协同作用,在29 d肿瘤体积减少50%,说明EGCG-pNG可以有效抑制膀胱瘤生长。此外,Li等[52]制备自组装金属-酚类纳米复合物SmIII-EGCG,通过癌细胞活力、肿瘤体积、小鼠体重等各方面测定,发现SmIII-EGCG显著抑制小鼠黑色素瘤细胞(B16F10)的增殖,当SmIII-EGCG质量浓度为250 µg·mL-1时,癌细胞活力降低至39.7%;SmIII-EGCG治疗组在20 d时肿瘤平均大小为(878.91±71.14)mm3[5-氟尿嘧啶组为(1 120.90±117.32)mm3,未治疗组为(1 750±180)mm3]且体重无明显变化;Ren等[53]使用EGCG和酚酸铂前体药物合成的纳米球(PTCG)可以通过级联反应提升生物体内H2O2水平来协同杀伤肿瘤细胞(图2)。体外和体内研究表明,EGCG修饰后的铂类药物实现了化疗与化学动力学协同的抗肿瘤疗效,并且和单独的铂药相比,具有良好的生物安全性。Yuan等[54]制备了聚焦羧甲基壳聚糖(FU-CMC)与金纳米颗粒(GNPs)的纳米复合材料(FU-CMC-EGCG-GNPs),发现EGCG与金纳米粒子结合表现出比EGCG单体更好的抗癌效果,所制备的纳米复合材料成功抑制了胃癌细胞增殖。EGCG纳米复合物的高效抗肿瘤作用在多个试验模型中已经被证实。与传统化疗相比,纳米化后的EGCG,其抗癌的靶向性、安全性、高效性都有显著提升,此外,还可以联合临床上现有的抗癌药物实现靶向递送、协同治疗[55-56]。
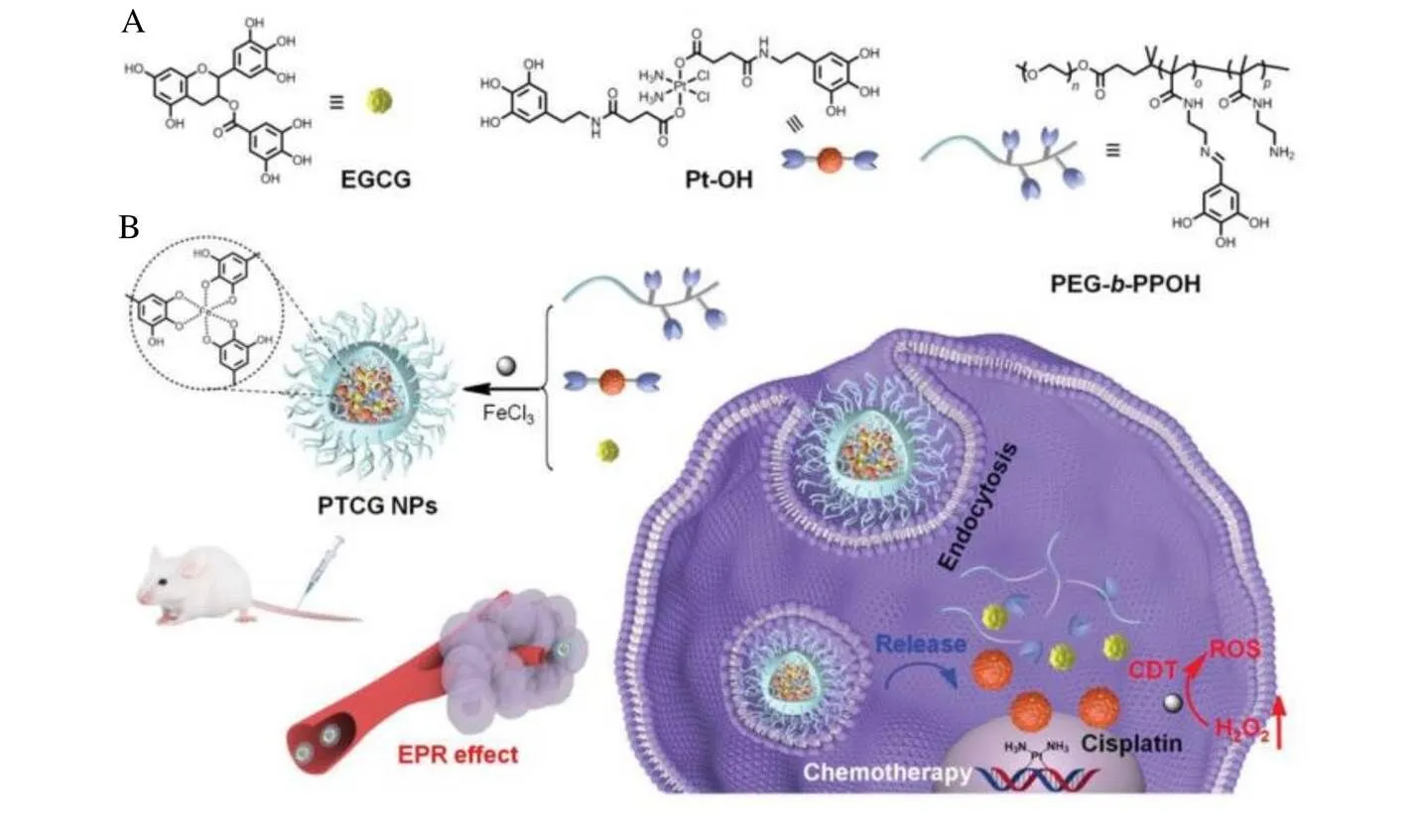
注:A为制备PTCG的构建块化学结构;B为EPR效应和细胞内化作用示意图
1.3 其他儿茶素生物纳米复合物抗肿瘤研究进展
虽然生物医用纳米材料为载药和减少药物毒副作用提供了解决策略,但体内稳定、成本低、可大量制备的刺激响应型纳米载体仍然是研究者们追求的目标。Yi等[57]开发了一种简单的药物递送系统构建方法,通过使用EGCG和天然的毛角蛋白制备出具有良好生物相容性、胶体稳定性和刺激响应型的纳米递送系统来递送Dox。构建的EGCG纳米颗粒大小为30~230 nm,这些纳米颗粒在生理介质中具有长期的胶体稳定性,但在病理条件下会被降解释放EGCG,为药物的靶向递送系统提供了天然优势。细胞试验证实这些纳米颗粒具有EGCG固有的生物活性,负载药物的纳米颗粒比小分子药物具有更高的癌细胞抑制率,说明EGCG和Dox具有协同抗肿瘤作用。体内试验证明了该纳米颗粒可以提高EGCG的生物利用度,增强抗癌功效,并且没有明显的系统毒性。EGCG可以增强抗肿瘤免疫,肿瘤的免疫耐受主要受细胞毒性T淋巴细胞浸润不足和肿瘤的免疫抑制微环境影响。Wang等[58]使用程序性死亡受体-1(PDL-1)抗体、EGCG、ICG和基质金属蛋白酶(MMP2)等构建了一种复合纳米颗粒,克服肿瘤免疫耐受,用于肿瘤的联合免疫治疗。小鼠体内试验表明,该复合纳米颗粒在近红外激光照射下有效地抑制了肿瘤的生长和向肺以及淋巴结的转移,为肿瘤免疫治疗新材料的构建提供了新型平台。Siddiqui等[59]通过聚乳酸-聚乙二醇封装的EGCG纳米颗粒在体内外均具有促凋亡和抗血管生成的作用,其有效性比未封装的EGCG具有10倍以上的剂量优势,证明了nano-EGCG对黑色素瘤细胞Mel 928具有良好的抗增殖和促凋亡作用。
2 儿茶素生物纳米材料抗菌研究进展
有害病原微生物侵染人体会引发各种疾病,如皮炎、肺炎、脑膜炎、败血症等,严重情况下可导致死亡[60-63]。随着抗生素的不合理使用,导致了耐药菌的暴发、高剂量抗生素使用带来的毒副作用和复发性感染等严重卫生问题,开发新型高效绿色的抗生素代替物是目前的研究热点。儿茶素是一种低毒、强效的抑菌物质,研究表明儿茶素对耐药性金黄色葡萄球菌、大肠杆菌、绿脓杆菌、结核杆菌等多种病菌具有抑制作用。Si等[64]研究发现,EGCG对甲氧西林敏感金黄色葡萄球菌(MSSA)和耐甲氧西林金黄色葡萄球菌(MRSA)的最低抑菌浓度分别为58 mg·L-1和37 mg·L-1;Ikigai[65]等发现,EGCG可以直接穿透脂质双分子层,破坏脂质双分子层结构,导致细菌细胞膜屏障功能发生变化和细胞内物质泄漏。但是,儿茶素由于体外易氧化变性,体内易聚集失活等原因限制了其在药物领域中的应用。因此,为了推进儿茶素在抗菌领域中的应用,在低浓度下发挥其最高抗菌活性,科学家开始利用儿茶素构建新型的生物抗菌材料,并且与其他抗菌离子组合,实现协同作用。
2.1 儿茶素纳米球的抗菌作用进展
Moreno-Vásquez等[66]研究发现,与EGCG单体和壳聚糖相比,EGCG壳聚糖纳米颗粒(EGCG-g-chitosan-P)对金黄色葡萄球菌的抑菌活性增加,EGCG-g-chitosan-P的最低抑制浓度(15.6 μg·mL-1)明显低于Chitosan-P(31.2 μg·mL-1)和EGCG(500 μg·mL-1),具有更高的生长抑制作用;Huang等[67]研究发现,EGCG负载HTCC/LMWFNPs(EGCG-loaded NPs)处理的金黄色葡萄球菌和大肠杆菌的存活率分别为2%和3%,而无EGCG的HTCC/LMWFNPs(Empty NPs)处理的存活率分别为19.6%和29.1%,明显低于Empty NPs处理,表明EGCG负载HTCC/LMWFNPs的抗菌活性显著升高。
2.2 儿茶素纳米金属复合物抗菌进展
Zhang等[68]将儿茶素(CAT)和儿茶素-Zn复合物(CAT-Zn)制备成不同粒径的-壳聚糖纳米粒子(-CS),研究表明,相比于未包裹的CAT和CAT-Zn,-CS包裹的CAT(-CS-CAT)和CAT-Zn(-CS-CAT-Zn)具有更强的抗菌活性,且小粒径的纳米粒抗菌活性更高,-CS-CAT-Zn对乳杆菌和大肠杆菌的最小抑菌浓度分别为0.031 mg·mL-1和0.063 mg·mL-1;Rónavári等[69]利用咖啡和绿茶提取物成功制备了银纳米颗粒(C-AgNP和GT-AgNP),测定不同银纳米颗粒浓度下大肠杆菌和新型隐球菌的存活率,发现GT-AgNP的抑菌效果明显优于C-AgNP。
2.3 儿茶素纳米生物高分子抗菌进展
天然高分子水凝胶因其生物安全和生产成本低而成为一类常用的生物材料。然而,较差的力学强度和易被细菌感染等缺陷限制了其在组织工程领域中的应用。Wu等[70]通过简单地浸泡方法将天然高分子浸泡在EGCG水溶液中构建了具有高力学性能和抗菌生物功能的生物材料。在水溶液中,经TP处理的水凝胶虽然随着TP的释放强度有所下降,但仍能保持较强的力学性能,提高了其含水量、抗菌和抗氧化活性。甲基丙烯酸-茶多酚水凝胶(GelMA-TP)被证明可以促进皮肤伤口愈合(图3)。Hu等[71]利用EGCG结合淀粉样原纤维自组装形成具有抗菌活性的可逆水凝胶,证实了EGCG水凝胶有抗菌活性,试验以革兰氏阴性大肠杆菌(EC)和革兰氏阳性单增李斯特氏菌(LM)为代表微生物,在0~50 μg·mL-1范围内有浓度效应,当质量浓度为50 μg·mL-1时,EC和LM的CFU在24 h和2 h下降超过4个数量级,对应的抑制率达到99.99%,使用人结肠上皮细胞(HCEC)进行安全性评估,在质量浓度高达125 μg·mL-1暴露48 h后对细胞活力没有任何影响。
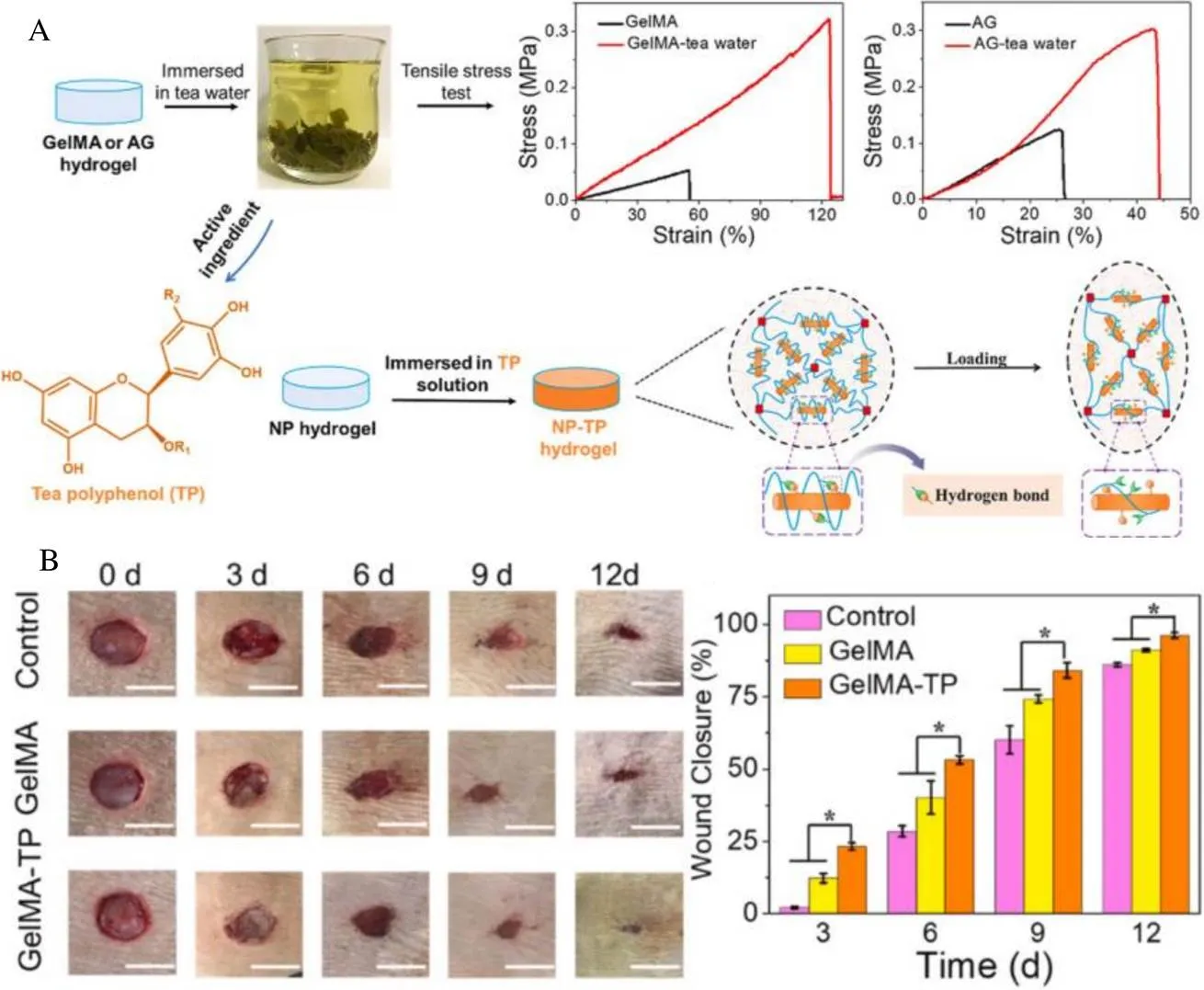
注:A为茶多酚水凝胶和增韧机理形成的示意图;B为不同处理组的伤口愈合能力评估
Fig. 3 Synthesis of tea polyphenols hydrogel and skin wound healing rate in mice[70]
3 儿茶素生物纳米材料抗炎和抗氧化活性研究进展
活性氧(ROS)是机体代谢过程中产生的重要中间产物,当ROS过度表达不能被及时清除时,过量的ROS可能和脂质、蛋白质、多糖以及核酸等具有生物活性的大分子相互作用,引发细胞代谢紊乱、细胞器功能异常,导致许多疾病的发生,包括炎症、癌症、心血管疾病和神经退行性疾病,以及衰老[72-74]。利用外源性抗氧化物质缓解氧化应激是治疗氧化应激损伤的一个重要策略。EGCG作为天然的抗氧化剂,由于其特殊的分子结构,可以和体内过量自由基反应,表现出很强的抗氧化性。Sekowski等[75]研究表明,在UVB辐射前添加浓度为1~20 µmol·L-1的EGCG可以通过防止脂质过氧化、还原型谷胱甘肽和血红蛋白氧化来保护红细胞免受紫外线诱导的氧化损伤,与对照组相比,EGCG试验组ROS产量下降约36%;UVB辐射会引起脂质过氧化,在照射前后,TBARS(硫代巴比妥酸反应物)产物增长了3倍、谷胱甘肽水平降低了58.3%,metHB水平增加了5倍,而在添加5~10 µmol·L-1EGCG时可以抑制膜脂过氧化,20 µmol·L-1EGCG可以使还原型谷胱甘肽增加两倍,metHB降低30%,表明EGCG能抑制UVB诱导的红细胞氧化应激。Zhang等[76]将EGCG与Cu2+和PLLA自组装负载雷帕霉素实现了对血管愈合和炎症的调控。目前制备生物抗氧化材料的过程通常需要加入金属离子或有机试剂,这可能本身会对生物体产生不良反应。为解决此难题,Yang等[77]提出了一种新型的绿色纳米颗粒制备策略,以EGCG为原料,通过绿色酶聚合化学方法制备绿色纳米颗粒;所得纳米颗粒具有均匀的球形形态,在水和生物介质中具有良好的稳定性,并表现出良好的自由基清除性能;构建的EGCG纳米颗粒可以有效预防细胞内氧化损伤,加速伤口恢复,并保护肾脏免受急性肾损伤模型中活性氧的损害。Hu等[47]将淀粉样蛋白和EGCG进行自组装成具有调节肠道微生物和抗炎作用的生物材料(图4),口服后,该材料可从胃到小肠,最后到达肠道(盲肠、结肠、直肠),在结肠内滞留时间较长,可显著改善由DSS诱导的小鼠结肠炎,促进肠道屏障功能,抑制促炎mRNA表达,具有广阔的胃肠道抗炎应用前景。
4 儿茶素药物递送系统研究进展
药物在病灶部位的精准释放是药物递送需要解决的一大难题。研究者们通常对药物进行抗体、靶向小肽或pH敏感分子修饰来提高药物在病灶部位的富集程度,从而实现高效低毒的治疗目标。但是这些修饰过程不仅复杂,而且还会引入新的分子,影响药物代谢,甚至会产生严重的毒副作用。因此,一种简单有效的药物递送系统的建立是亟需解决的难题。EGCG凭借其多酚羟基的结构特殊性和天然的生物活性,有望成为新型药物递送系统的备选物质,不仅能实现药物递送,还能起到协同作用。影响siRNA疗法临床转化的主要原因之一是无法将其精准递送到细胞内。虽然,目前已经开发了许多用于siRNA传递的聚合物,但其运输效率和细胞毒性关系调控仍然是科学家没有解决的难题。基于此,Shen等[78]开发了一种具有高效siRNA传递效率的核壳结构纳米颗粒的简便策略,该纳米颗粒是通过熵驱动的原理将siRNA与EGCG混合形成带负电的纳米球,再在其表面修饰带正电的低分子聚合物,该纳米球可以将siRNA高效的递送到细胞内部,使其能够选择性调控靶基因,有效治疗DSS诱导的结肠炎。Fan等[79]利用不同的直接聚合方法设计和合成了儿茶酚胺聚合物,用于siRNA在体外和体内的传递(图5)。研究发现,将多个邻苯二酚片段引入阳离子聚合物可以增强其siRNA结合能力,从而大大提高其复合物的生物稳定性、细胞递送和基因沉默效率。经筛选,邻苯二酚摩尔比为50%的先导阳离子多儿茶酚P1,即使在存在血清蛋白的情况下,也能有效地将siRNA传递到不同的细胞系,并下调各种靶基因。此外,P1还能在体内外成功沉默巨噬细胞中的肿瘤坏死因子TNF-,并能有效治疗结肠炎。这些结果表明,儿茶素有望被开发为一种简单通用的药物递送系统,用于疾病治疗。
5 儿茶素生物纳米材料抗病毒研究进展
人类科技在不断发展,但各种病毒性传染病仍时刻困扰着人类的正常生活。近年来禽流感、H7N9、新型冠状病毒等疫情的发生,严重危害了畜禽和人类的生命安全,阻碍了社会进一步发展。病毒由蛋白质外壳和遗传物质构成,通过侵染宿主细胞完成遗传和复制等生命活动,人们发现EGCG对一些病毒有高效抑制作用[80-85]。Ge等[86]研究EGCG抗猪繁殖与呼吸综合征病毒(PRRSV),发现无论是在PRRSV感染猪肺泡巨噬细胞(PAMs)前,还是感染后给药,EGCG均能有效抑制PRRSV复制,且有剂量依赖性,在浓度为125 µmol·L-1时,可以完全抑制病毒的感染。CD4是T细胞上表达的表面糖蛋白,在T细胞识别抗原和激活过程中发挥重要作用。Williamson等[87]研究发现,EGCG可以通过抑制HIV-1糖蛋白(gp)120与T细胞上CD4分子的结合,从而降低HIV-1的传染性;结果证明,在与服用绿茶相当的EGCG浓度下,能够将gp120附着CD4的能力减少90%~95%。有研究表明丙型肝炎病毒(HCV)的生命周期和脂质代谢密不可分,Calland等[88]证明了EGCG可以直接通过结合病毒颗粒和干预脂质代谢的方式来预防HCV感染细胞,结果显示50 µmol·L-1的EGCG在早期阶段抑制HCV感染率超过90%,但并不抑制HCV的转录和翻译。有研究认为EGCG是植物化学物质中最具有潜力的3CLpro抑制剂,体外研究表明,EGCG在200 µmol·L-1浓度下对3CLpro有85%的抑制作用,IC50值为(73±2)µmol·L-1,且研究发现SARS-CoV-2的3CLpro结构与SARS-CoV高度相似[89-92]。基于这些研究,EGCG有望成为3CLpro的潜在抑制剂,用于COVID-19的预防治疗。基于此,Zhang等[93]综述了EGCG的潜在抗新冠病毒机制(图6),EGCG可以通过直接抗氧化、激活Nrf2通路、调控炎症风暴等来抑制氧化应激和下调血管紧张素转换酶2(ACE2)的表达,从而抑制病毒的感染和复制。Reshamwala等[94]研究表明,EGCG与金纳米颗粒制备成EGCG金纳米颗粒(EGCG-AuNPs)后,不仅能显著降低EGCG的肝毒性,还能高效抑制柯萨奇病毒(CVB1)对A549细胞的感染,EGCG-AuNPs通过引起CVB1病毒颗粒团聚,阻止CVB1病毒释放RNA和阻止病毒与细胞表面结合来抵制病毒感染。
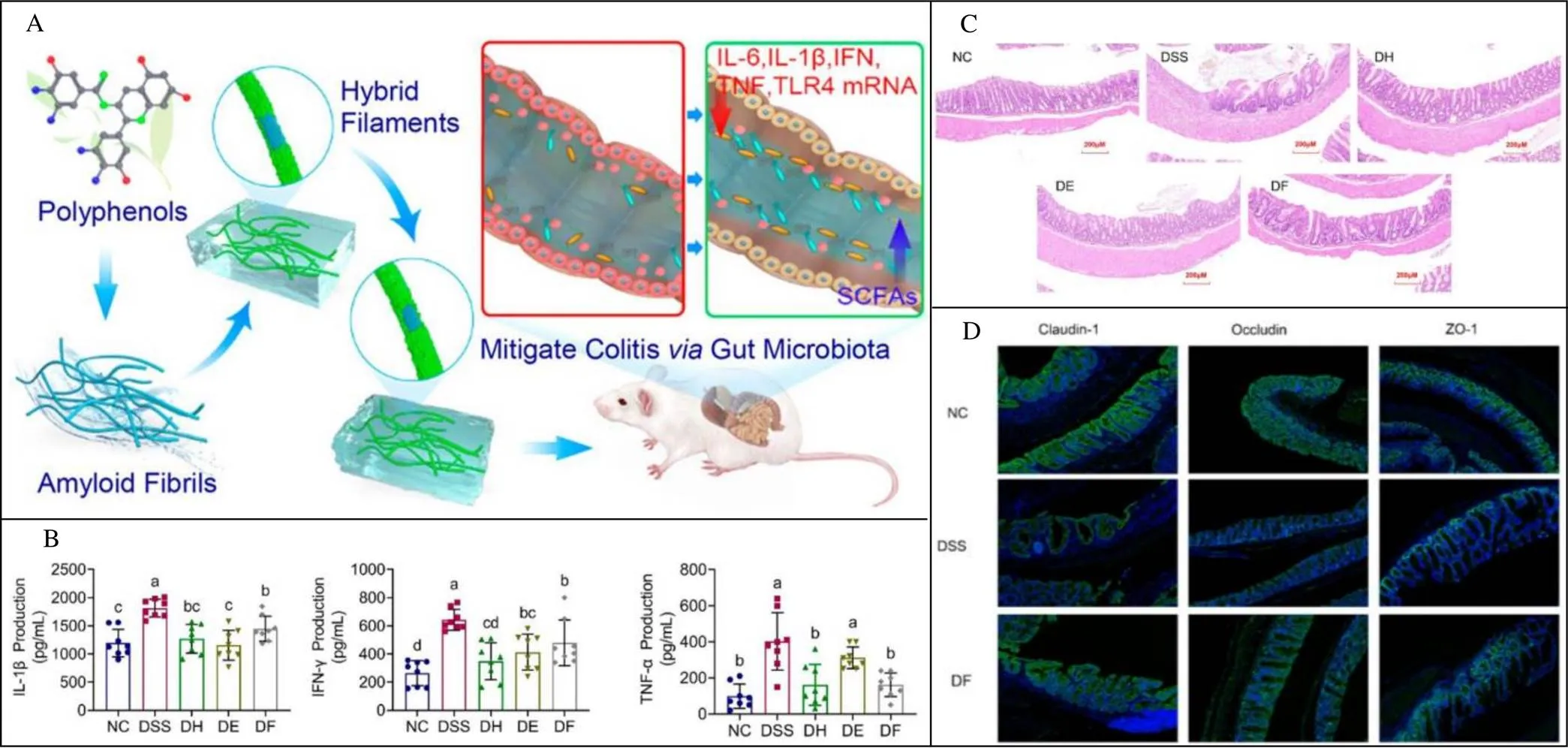
注:A为多酚纳米微丝减轻结肠炎和调节肠道微生物群失调示意图;B为不同处理对DSS引起的C57BL/6小鼠结肠炎临床症状的影响;C为结肠组织的苏木精和伊红染色结果;D为结肠组织紧密结蛋白的免疫荧光染色结果
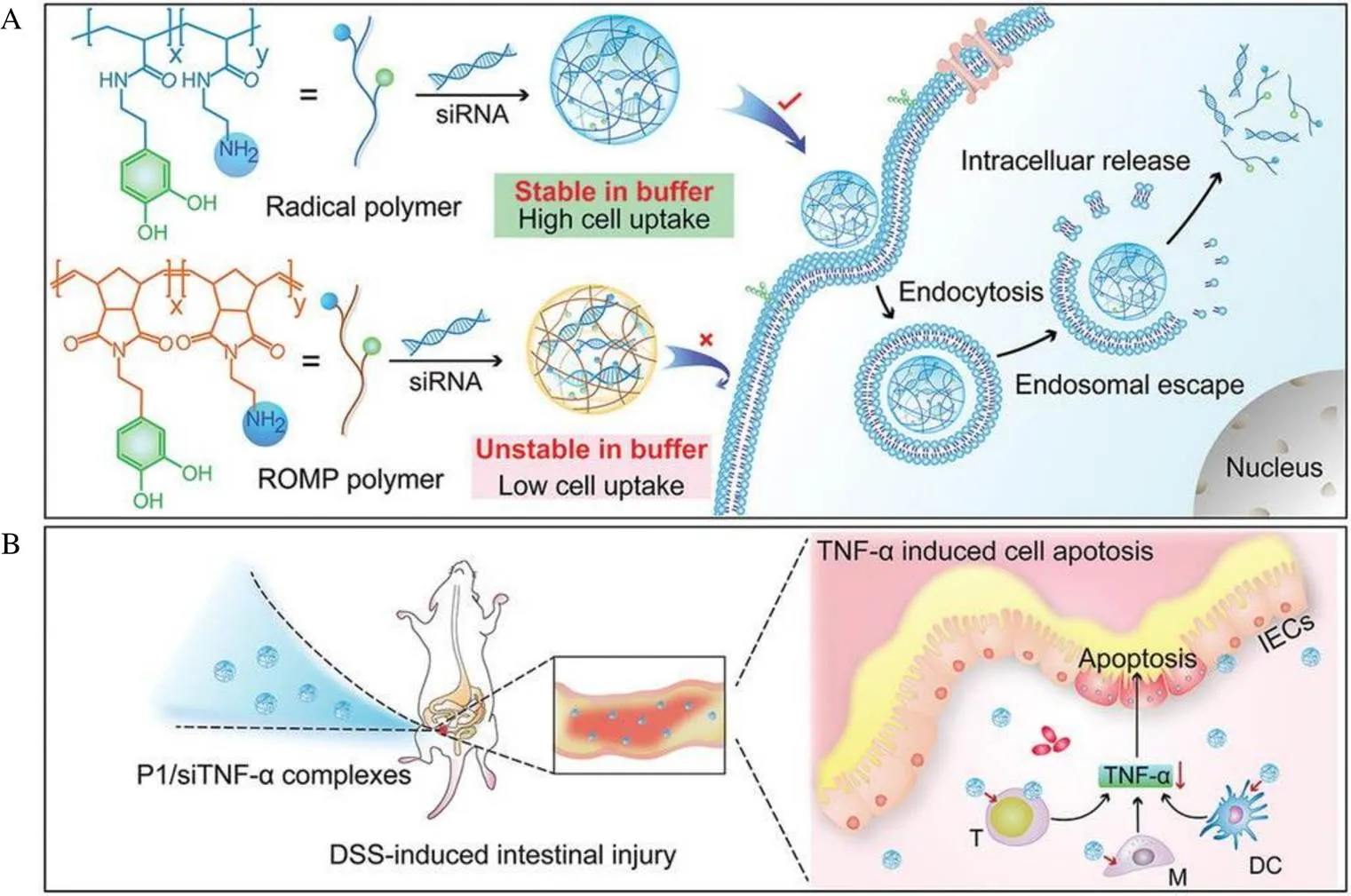
注:A为聚合物构建和细胞内siRNA传递基因沉默机制示意图;B为聚合物将siRNA递送到肠炎部位示意图
Fig. 5 Schematic representation of the polymer construction and targeted delivery[79]
6 总结与展望
借助纳米生物技术将儿茶素与金属、天然高分子、脂质体、壳聚糖等构建新型生物医用纳米材料,不仅提高了儿茶素的生物利用度,还能使其负载临床小分子药物达到协同作用。这种以儿茶素作为配体构建新型生物材料的策略拓展了儿茶素在新型生物医用材料构建中的应用,有望推动茶资源,特别是多酚含量高的夏秋茶资源的高效利用。尽管儿茶素在生物材料构建中有诸多优势,但为了推动儿茶素在生命健康领域中的进一步发展及其在功能食品和新型药物中的应用,还有以下问题需要解决。
首先是生物安全问题。生物安全的儿茶素纳米材料是应用于临床前研究的前提[22,95-98]。虽然通过功能配体的修饰可以有效提升儿茶素在生物体内的利用度,但是,由于这些生物材料复杂的设计工艺,使其在体内降解困难,Zelepukin等[99]报道核壳结构的多核磁性纳米颗粒与均一结构的多核磁性纳米颗粒相比,其在小鼠体内的药物半衰期(T1/2)分别为430 d和48 d,说明了结构越复杂的纳米材料在体内滞留时间越长,增加了安全风险;
其次,结构复杂的生物纳米材料也容易在血液循环过程中形成蛋白冠而失去功能,难以抵达病灶深层部位[100-102];而且复杂的结构设计很难解析儿茶素纳米药物在体内代谢规律以及发挥生物功能的分子机制;因此,针对特定的疾病模型,设计结构简单、生物安全和功能明确的个性化儿茶素生物材料是推进其应用的基础。
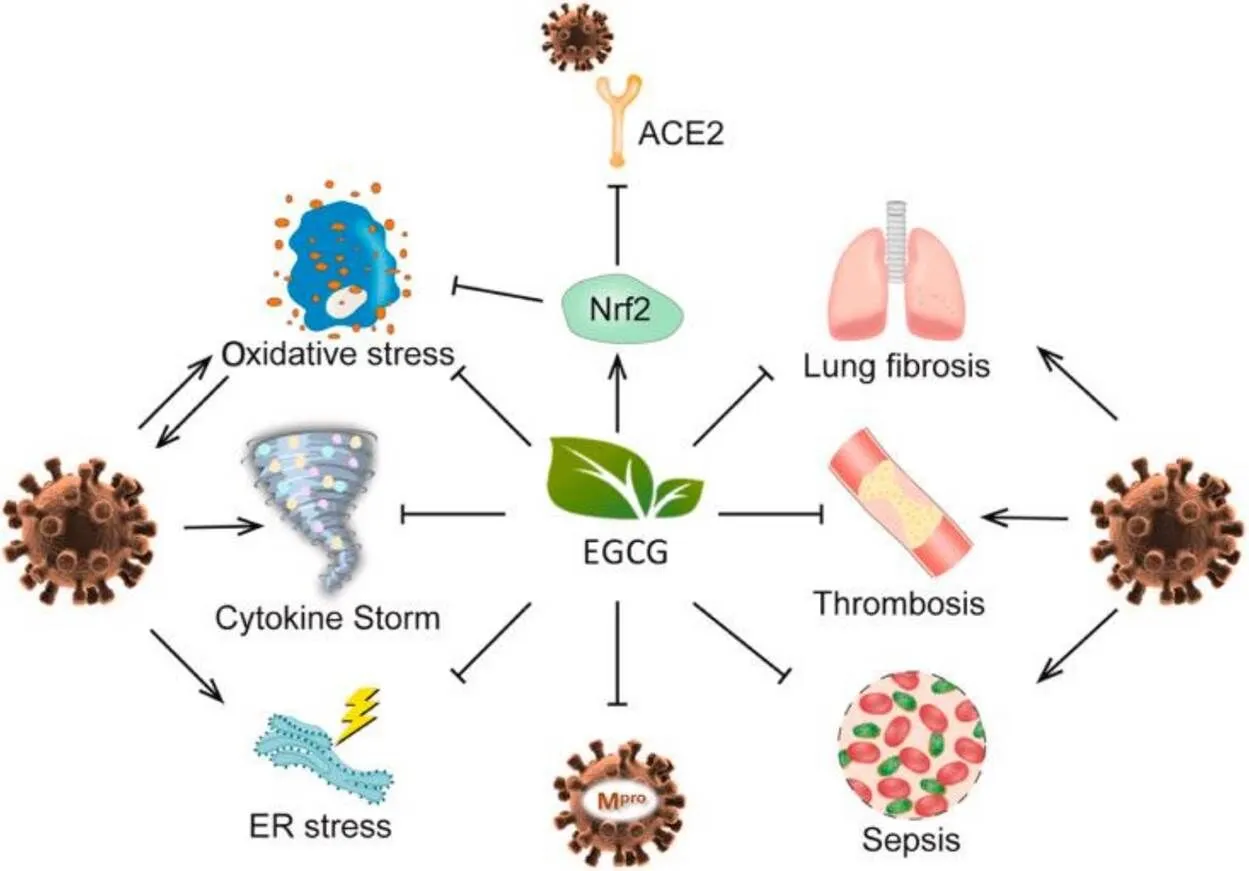
图6 EGCG抗新冠病毒的潜在分子机制[93]
具有稳态结构和高效递送能力的儿茶素纳米材料是应用于临床前研究的保障[103-105]。天然药物在病灶部位的靶向递送一直是近几年材料化学和生物医学研究的热点和难点[106-108]。将儿茶素精准递送到病灶部位,或者以儿茶素为递送系统将临床药物递送到病灶部位是提高药物疗效和降低毒副作用的有效手段[109]。靶向递送的前提是要构建稳态的递送体系或生物材料,使其在存储和运输过程中保持结构和活性稳定,且在体内递送过程中发挥高效作用。因此,通过纳米生物技术手段,设计稳态结构的生物材料,并使其在复杂的生物体内环境中保持活性,到达特定部位发挥生物功能是非常必要的;其次,在材料上修饰靶向基团,实现对特定病灶部位的靶向释放和精准治疗,或者设计刺激响应型的功能材料,如酸敏感、光热敏感或磁性敏感的儿茶素纳米材料,可以有效提高儿茶素或者药物的递送能力,实现低浓度下高效杀伤目的。
绿色合成、生产成本低、规模化制备是儿茶素纳米材料生产的关键支撑。复杂的材料设计和制备工艺可能会引入较多的不确定元素,不利于儿茶素纳米材料的安全性评估。因此,近年来倡导的一步法和绿色合成理念最终目的是在达到材料构建目标的同时避免产生有毒有害物质,这样会提高反应效率,降低反应成本。在保证儿茶素生物材料充分发挥活性的前提下,低成本实现规模化制备是推动儿茶素生物材料临床前大规模动物评价的关键。
[1] Sakanaka S, Juneja L R, Taniguchi M. Antimicrobial effects of green tea polyphenols on thermophilic spore-forming bacteria [J]. Journal of Bioscience and Bioengineering, 2000, 90(1): 81-85.
[2] Vazquez-Prieto M A, Bettaieb A, Haj F G, et al. (-)-Epicatechin prevents TNFα-induced activation of signaling cascades involved in inflammation and insulin sensitivity in 3T3-L1 adipocytes [J]. Archives of Biochemistry and Biophysics, 2012, 527(2): 113-118.
[3] Friedman M, Mackey B E, Kim H J, et al. Structure activity relationships of tea compounds against human cancer cells [J]. Journal of Agricultural and Food Chemistry, 2007, 55(2): 243-253.
[4] Ahmed N A, Radwan N M, Aboul Ezz H S, et al. The antioxidant effect of Green Tea Mega EGCG against electromagnetic radiation-induced oxidative stress in the hippocampus and striatum of rats [J]. Electromagnetic Biology and Medicine, 2017, 36(1): 63-73.
[5] Yang C S, Wang H, Sheridan Z P. Studies on prevention of obesity, metabolic syndrome, diabetes, cardiovascular diseases and cancer by tea [J]. Journal of Food and Drug Analysis, 2018, 26(1): 1-13.
[6] Sodagari H R, Bahramsoltani R, Farzaei M H, et al. Tea polyphenols as natural products for potential future management of HIV infection: an overview [J]. Journal of Natural Remedies, 2016, 16(2): 60-72.
[7] Truong V L, Jeong W S. Antioxidant and anti-inflammatory roles of tea polyphenols in inflammatory bowel diseases [J]. Food Science and Human Wellness, 2022, 11(3): 502-511.
[8] 宛晓春. 茶叶生物化学[M]. 3版. 北京: 中国农业出版社, 2003.
Wan X C. Biochemistry of tea [M]. 3rd ed. Beijing: China Agricultural Press, 2003.
[9] Bansal S, Syan N, Mathur P, et al. Pharmacological profile of green tea and its polyphenols: a review [J]. Medicinal Chemistry Research, 2012, 21(11): 3347-3360.
[10] Ohishi T, Goto S, Monira P, et al. Anti-inflammatory action of green tea [J]. Anti-Inflammatory and Anti-Allergy Agents in Medicinal Chemistry, 2016, 15(2): 74-90.
[11] Anshu M R, Manjeshwar S B, Santosh K K. Epigallocatechin-3-gallate induces apoptosis in estrogen receptor-negative human breast carcinoma cells via modulation in protein expression of p53 and Bax and caspase-3 activation [J].Molecular Cancer Therapeutics, 2005, 4(1): 81-90.
[12] Chyu K Y, Babbidge S M, Zhao X N, et al. Differential effects of green tea: derived catechin on developing versus established atherosclerosis in apolipoprotein E-null mice [J]. Circulation, 2004, 109(20): 2448-2453.
[13] Lorenz M, Wessler S, Follmann E, et al. A constituent of green tea, epigallocatechin-3-gallate, activates endothelial nitric oxide synthase by a phosphatidylinositol-3-OH-kinase-, cAMP-dependent protein kinase-, and Akt-dependent pathway and leads to endothelial-dependent vasorelaxation [J]. Journal of Biological Chemistry, 2004, 279(7): 6190-6195.
[14] Gordon N C, Wareham D W. Antimicrobial activity of the green tea polyphenol (-)-epigallocatechin-3-gallate (EGCG) against clinical isolates of[J]. International Journal of Antimicrobial Agents, 2010, 36(2): 129-131.
[15] 陈宗懋. 茶多酚类化合物抗癌的生物化学和分子生物学基础[J]. 茶叶科学, 2003, 23(2): 83-93.
Chen Z M. Biochemical and molecular biological basis on the anticarcinogenic activity of tea polyphenolic compounds [J]. Journal of Tea Science, 2003, 23(2): 83-93.
[16] Mereles D, Hunstein W. Epigallocatechin-3-gallate (EGCG) for clinical trials: more pitfalls than promises? [J]. International Journal of Molecular Sciences, 2011, 12(9): 5592-5603.
[17] Riehemann K, Schneider S W, Luger T A, et al. Nanomedicine: challenge and perspectives [J]. Angewandte Chemie International Edition, 2009, 48(5): 872-897.
[18] Zhao F F, Shen G Z, Chen C J, et al. Nanoengineering of stimuli-responsive protein-based biomimetic protocells as versatile drug delivery tools [J]. Chemistry A European Journal, 2014, 20(23): 6880-6887.
[19] Jain R K, Stylianopoulos T. Delivering nanomedicine to solid tumors [J]. Nature Reviews Clinical Oncology, 2010, 7(11): 653-664.
[20] Pryshchepa O, Pomastowski P, Buszewski B. Silver nanoparticles: synthesis, investigation techniques, and properties [J]. Advances in Colloid and Interface Science, 2020, 284: 102246. doi:10.1016/j.cis.2020.102246.
[21] Moritz M, Geszke-Moritz M. The newest achievements in synthesis, immobilization and practical applications of antibacterial nanoparticles [J]. Chemical Engineering Journal, 2013, 228: 596-613.
[22] Zhang X C, Zhang Z C, Shu Q M, et al. Copper clusters: an effective antibacterial for eradicating multidrug-resistant bacterial infection in vitro and in vivo [J]. Advanced Functional Materials, 2021, 31(14): 2008720. doi: 10.1002/adfm.202008720.
[23] Li W Q, Li W, Wan Y L, Wang L F, et al. Preparation, characterization and releasing property of antibacterial nano-capsules composed of epsilon-PL-EGCG and sodium alginate-chitosan [J]. International Journal of Biological Macromolecules, 2022, 204: 652-660.
[24] Pace D R C C, Liu X L, Sun M, et al. Anticancer activities of -epigallocatechin-3-gallate encapsulated nanoliposomes in MCF7 breast cancer cells [J]. Journal of Liposome Research, 2013, 23(3): 187-196.
[25] Yin C Y, Cheng L, Zhang X, et al. Nanotechnology improves delivery efficiency and bioavailability of tea polyphenols [J]. Journal of Food Biochemistry, 2020, 44(9): e13380. doi: 10.1111/jfbc.13380.
[26] 刘宗超, 李哲轩, 张阳, 等. 2020全球癌症统计报告解读[J]. 肿瘤综合治疗电子杂志, 2021, 7(2): 1-13.
Liu Z C, Li Z X, Zhang Y, et al. Interpretation on the report of Global Cancer Statistics 2020 [J]. Journal of Multidisciplinary Cancer Management (Electronic Version), 2021, 7(2): 1-13.
[27] 中新网. 中国恶性肿瘤5年生存率已提升至40.5%[J]. 现代医院, 2018, 18(6): 796.
Xinhuanet. The 5-year survival rate of malignant tumors in China has increased to 40.5% [J]. Modern Hospitals, 2018, 18(6): 796.
[28] Moseley V R, Morris J, Knackstedt R W, et al. Green tea polyphenol epigallocatechin 3-gallate, contributes to the degradation of DNMT3A and HDAC3 in HCT 116 human colon cancer cells [J]. Anticancer Research, 2013, 33: 5325-5334.
[29] Qiao Y Y, Cao J Y, Xie L Q, et al. Cell growth inhibition and gene expression regulation by (-)-epigallocatechin-3-gallate in human cervical cancer cells [J]. Archives of Pharmacal Research, 2009, 32(9): 1309-1315.
[30] 祁洁, 徐颖磊, 梁文怡, 等. EGCG纳米载体制备技术及其对EGCG活性影响的研究进展[J]. 茶叶科学, 2017, 37(2): 119-129.
Qi J, Xu Y L, Liang W Y, et al. Progress on the preparation technologies and the active improvement of EGCG nano-carriers [J]. Journal of Tea Science, 2017, 37(2): 119-129.
[31] Lambert J D, Kennett M J, Sang S M, et al. Hepatotoxicity of high oral dose (-)-epigallocatechin-3-gallate in mice [J]. Food and Chemical Toxicology, 2010, 48(1): 409-416.
[32] Wang X X, Yang L M, Wang J J, et al. A mouse model of subacute liver failure with ascites induced by step-wise increased doses of (-)-epigallocatechin-3-gallate [J]. Scientific Reports, 2019, 9(1): 18102. doi: 10.1038/s41598-019-54691-0.
[33] Vallet-Regí M, Balas F, Arcos D. Mesoporous materials for drug delivery [J]. Angewandte Chemie International Edition, 2007, 46(40): 7548-7558.
[34] Giljohann D A,Seferos D S,Daniel W L, et al. Gold nanoparticles for biology and medicine [J]. Angewandte Chemie International Edition, 2010, 49(19): 3280-3294.
[35] Caminade A M, Majoral J P. Nanomaterials based on phosphorus dendrimers [J]. Accounts of Chemical Research, 2004, 37(6): 341-348.
[36] Ding J, Liang T X Z, Min Q H, et al. "Stealth and fully-laden" drug carriers: self-assembled nanogels encapsulated with epigallocatechin gallate and siRNA for drug-resistant breast cancer therapy [J]. ACS Applied Materials and Interfaces, 2018, 10(12): 9938-9948.
[37] Chung J E, Tan S, Gao S J, et al. Self-assembled micellar nanocomplexes comprising green tea catechin derivatives and protein drugs for cancer therapy [J]. Nature Nanotechnology, 2014, 9(11): 907-912.
[38] Madhulika S, Priyanka B, Sanjay M, et al. PLGA-encapsulated tea polyphenols enhance the chemotherapeutic efficacy of cisplatin against human cancer cells and mice bearing Ehrlich ascites carcinoma [J]. International Journal of Nanomedicine, 2015, 10: 6789-6809.
[39] Zhang H Y, Zeng Y, Zhe S, et al. Functional nanoparticles of tea polyphenols for doxorubicin delivery in cancer treatment [J]. Journal of Materials Chemistry B, 2017, 5(36): 7622-7631.
[40] Cheng T J, Liu J J, Ren J, et al. Green tea catechin-based complex micelles combined with doxorubicin to overcome cardiotoxicity and multidrug resistance [J]. Theranostics, 2016, 6(9): 1277-1292.
[41] Chen Z H, Wang C H, Chen J Z, et al. Biocompatible, functional spheres based on oxidative coupling assembly of green tea polyphenols [J]. Journal of the American Chemical Society, 2013, 135(11): 4179-4182.
[42] Rahim M A, Björnmal M, Bertleff-Zieschang N, et al. Multiligand metal-phenolic assembly from green tea infusions [J]. ACS Applied Materials and Interfaces, 2018, 10(9): 7632-7639.
[43] Zhong Q Z, Li S Y, Chen J Q, et al. Oxidation-mediated kinetic strategies for engineering metal-phenolic networks [J]. Angewandte Chemie International Edition, 2019, 58(36): 12563-12568.
[44] Fang J Y, Lee W R, Shen S C, et al. Effect of liposome encapsulation of tea catechins on their accumulation in basal cell carcinomas [J]. Journal of Dermatological Science, 2006, 42(2): 101-109.
[45] Gülserenİ, Guri A, Corredig M. Encapsulation of tea polyphenols in nanoliposomes prepared with milk phospholipids and their effect on the viability of HT-29 human carcinoma cells [J]. Food Digestion, 2012, 3(1/3): 36-45.
[46] Liang K, Chung J E, Gao S J, et al. Highly augmented drug loading and stability of micellar nanocomplexes composed of doxorubicin and poly(ethylene glycol): green tea catechin conjugate for cancer therapy [J]. Advanced Materials, 2018, 30(14): e1706963. doi:10.1002/adma.201706963.
[47] Hu B, Yu S J, Shi C, et al. Amyloid−Polyphenol hybrid nanofilaments mitigate colitis and regulate gut microbial dysbiosis [J]. ACS Nano, 2020, 14: 2760-2776.
[48] Smith A, Giunta B, Bickford P C, et al. Nanolipidic particles improve the bioavailability and alpha-secretase inducing ability of epigallocatechin-3-gallate (EGCG) for the treatment of Alzheimer's disease [J]. International Journal of Pharmaceutics, 2010, 389(1/2): 207-212.
[49] Gomes J F P S, Rocha S, Pereira M D C, et al. Lipid/particle assemblies based on maltodextrin-gum arabic core as bio-carriers [J]. Colloids and Surfaces B: Biointerfaces, 2010, 76(2): 449-455.
[50] Bae K H, Tan S, Yamashita A, et al. Hyaluronic acid-green tea catechin micellar nanocomplexes: fail-safe cisplatin nanomedicine for the treatment of ovarian cancer without off-target toxicity [J]. Biomaterials, 2017, 148: 41-53.
[51] Hsieh D S, Wang H, Tan S W, et al. The treatment of bladder cancer in a mouse model by epigallocatechin-3-gallate-gold nanoparticles [J]. Biomaterials, 2011, 32(30): 7633-7640.
[52] Li K, Xiao G, Richardson J J, et al. Targeted therapy against metastatic melanoma based on self-assembled metal-phenolic nanocomplexes comprised of green tea catechin [J]. Advanced Science, 2019, 6(5): 1801688. doi: 10.1002/advs.201801688.
[53] Ren Z G, Sun S C, Sun R R, et al. A metal: polyphenol-coordinated nanomedicine for synergistic cascade cancer chemotherapy and chemodynamic therapy [J]. Advanced Materials, 2020, 32(6): e1906024. doi:10.1002/adma.201906024.
[54] Yuan X M, He Y, Zhou G G, et al. Target challenging-cancer drug delivery to gastric cancer tissues with a fucose graft epigallocatechin-3-gallate-gold particles nanocomposite approach [J]. Journal of Photochemistry and Photobiology B: Biology, 2018, 183: 147-153.
[55] Dai Y L, Yang Z, Cheng S Y, et al. Toxic reactive oxygen species enhanced synergistic combination therapy by self-assembled metal-phenolic network nanoparticles [J]. Advanced Materials, 2018, 30(8): 1704877. doi: 10.1002/adma.201704877.
[56] Zheng D W, Lei Q, Zhu J Y, et al. Switching apoptosis to ferroptosis: metal-organic network for high-efficiency anticancer therapy [J]. Nano Letters, 2016, 17(1): 284-291.
[57] Yi Z, Sun Z, Chen G C, et al. Size-controlled, colloidally stable and functional nanoparticles based on the molecular assembly of green tea polyphenols and keratins for cancer therapy [J]. Journal of Materials Chemistry B, 2018, 6(9): 1373-1386.
[58] Wang D G, Wang T T, Yu H J, et al. Engineering nanoparticles to locally activate T cells in the tumor microenvironment [J]. Science Immunology, 2019, 4(37): eaau6584. doi: 10.1126/sciimmunol.
[59] Siddiqui I A, Bharali D J, Nihal M, et al. Excellent anti-proliferative and pro-apoptotic effects of -epigallocatechin-3-gallate encapsulated in chitosan nanoparticles on human melanoma cell growth both in vitro and in vivo [J]. Nanomedicine Nanotechnology Biology and Medicine, 2014, 10(8): 1619-1626.
[60] Mintzer M A, Dane E L, O'Toole G A, et al. Exploiting dendrimer multivalency to combat emerging and re-emerging infectious diseases [J]. Molecular Pharmaceutics, 2012, 9(3): 342-354.
[61] 王迎军, 黄雪连, 陈军建, 等. 细菌感染微环境响应性高分子材料用于细菌感染性疾病的治疗[J]. 材料导报, 2019, 33(1): 5-15.
Wang Y J, Huang X L, Chen J J, et al. Bacterial infection-microenvironment responsive polymeric materials for the treatment of bacterial infectious diseases: a review [J]. Materials Reports, 2019, 33(1): 5-15.
[62] Ning X H, Lee S, Wang Z R, et al. Maltodextrin-based imaging probes detect bacteriawith high sensitivity and specificity [J]. Nature Materials, 2011, 10(8): 602-607.
[63] Moore E H. Atypical mycobacterial infectionin the lung: CT appearance [J]. Thoracic Radiology, 1993, 187(3): 777-782.
[64] Si W D, Gong J, Tsao R, et al. Bioassay-guided purification and identification of antimicrobial components in Chinese green tea extract [J]. Journal of Chromatography A, 2006, 1125(2): 204-210.
[65] Ikigai H, Nakae T, Hara Y, et al. Bactericidal catechins damage the lipid bilayer [J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1993, 1147(1): 132-136.
[66] Moreno-Vásquez M J, Plascencia-Jatomea M, Sánchez-Valdes S, et al. Characterization of epigallocatechin-gallate-grafted chitosan nanoparticles and evaluation of their antibacterial and antioxidant potential [J]. Polymers, 2021, 13(9): 1375. doi: 10.3390/polym13091375.
[67] Huang T W, Ho Y C, Tsai T N, et al. Enhancement of the permeability and activities of epigallocatechin gallate by quaternary ammonium chitosan/fucoidan nanoparticles [J]. Carbohydrate Polymers, 2020, 242: 116312. doi: 10.1016/j.carbpol.2020.116312.
[68] Zhang H C, Jung T, Zhao Y Y, et al. Preparation, characterization and evaluation of antibacterial activity of catechins and catechins-Zn complex loaded beta-chitosan nanoparticles of different particle sizes [J]. Carbohydrate Polymers, 2016, 137: 82-91.
[69] Rónavári A, Kovács D, Lgaz N, et al. Biological activity of green-synthesized silver nanoparticles depends on the applied natural extracts: a comprehensive study [J]. International Journal of Nanomedicine, 2017, 12: 871-883.
[70] Wu T L, Cui C Y, Fan C C, et al. Tea eggs-inspired high-strength natural polymer hydrogels [J]. Bioactive Materials, 2021, 6(9): 2820-2828.
[71] Hu B, Shen Y, Adamcik J, et al. Polyphenol-binding amyloid fibrils self-assembleinto reversible hydrogels with antibacterial activity [J]. ACS Nano,2018,12(4):3385-3396.
[72] Yang C S, Ho C T, Zhang J S, et al. Antioxidants: differing meanings in food science and health science [J]. Journal of Agricultural and Food Chemistry, 2018, 66(12): 3063-3068.
[73] Zuo J, Zhang Z, Luo M C, et al. Redox signaling at the crossroads of human health and disease [J]. MedComm, 2022, 3(2): e127. doi: 10.1002/mco2.127.
[74] Sies H, Jones D P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents [J]. Nature Reviews Molecular Cell Biology, 2020, 21(7): 363-383.
[75] Sekowski S, Terebka M, Veiko A, et al. Epigallocatechin gallate (EGCG) activity against UV light-induced photo damages in erythrocytes and serum albumin: theoretical and experimental studies [J]. Journal of Photochemistry and Photobiology A: Chemistry, 2018, 356: 379-388.
[76] Zhang B, Qin Y M, Yang L, et al. A polyphenol-network-mediated coating modulates inflammation and vascular healing on vascular stents [J]. ACS Nano, 2022, 16(4): 6585-6597.
[77] Yang P, Zhang J H, Xiang S Y, et al. Green nanoparticle scavengers against oxidative stress [J]. ACS Applied Materials and Interfaces, 2021, 13(33): 39126-39134.
[78] Shen W W, Wang Q W, Shen Y, et al. Green tea catechin dramatically promotes RNAi mediated by low-molecular-weight polymers [J]. ACS Central Science, 2018, 4(10): 1326-1333.
[79] Fan Q Q, Yang Z, Li Y H, et al. Polycatechol mediated small interfering RNA delivery for the treatment of ulcerative colitis [J]. Advanced Functional Materials, 2021, 31(24): 2101646. doi: 10.1002/adfm.202101646.
[80] Xu J, Wang J, Deng F, et al. Green tea extract and its major component epigallocatechin gallate inhibits hepatitis B virus[J]. Antiviral Research, 2008, 78(3): 242-249.
[81] Weber J M, Umunyana A R, Imbeault L, et al. Inhibition of adenovirus infection and adenain by green tea catechins [J]. Antiviral Research, 2003, 58(2): 167-173.
[82] Zu M, Yang F, Zhou W L, et al. In vitro anti-influenza virus and anti-inflammatory activities of theaflavin derivatives [J]. Antiviral Research, 2012, 94(3): 217-224.
[83] Bettuzzi S, Gabba L, Cataldo S. Efficacy of a po1ypheno1ic standardized green tea extract for the treatment of covid 19 syndrome a proof of princip1e study [J]. COVID, 2021, 1(1): 2-12.
[84] Song J M, Lee K H, Seong B L. Antiviral efffect of catechins in green tea on influenza virus [J]. Antiviral Research, 2005, 68(2): 66-74.
[85] 熊立瑰, 刘思慧, 黄建安, 等. 茶的抗病毒作用研究进展[J]. 茶叶科学, 2021, 41(2): 143-158.
Xiong L G, Liu S H, Huang J A, et al. The antiviral properties of tea [J]. Journal of Tea Science, 2021, 41(2): 143-158.
[86] Ge M Y, Xiao Y, Chen H J, et al. Multiple antiviral approaches of (-)-epigallocatechin-3-gallate (EGCG) against porcine reproductive and respiratory syndrome virus infection in vitro [J]. Antiviral Research, 2018, 158: 52-62.
[87] Williamson M, Mccormick T, Nance C, et al. Epigallocatechin gallate, the main polyphenol in green tea, binds to the T-cell receptor, CD4: potential for HIV-1 therapy [J]. Journal of Allergy and Clinical Immunology, 2006, 118(6): 1369-1374.
[88] Calland N, Albecka A, Belouzard S, et al. (-)-Epigallocatechin-3-gallate is a new inhibitor of hepatitis C virus entry [J]. Hepatology, 2012, 55(3): 720-729.
[89] Khaerunnisa S, Kurniawan H, Awaluddin R, et al. Potential inhibitor of COVID-19 main protease (Mpro) from several medicinal plant compounds by molecular docking study [J]. Preprints, 2020: 2020030226. doi: 10.20944/preprints202003.
0226.v1.
[90] Nguyen T T H, Woo H J, Kang H K, et al. Flavonoid-mediated inhibition of SARS coronavirus 3C-like protease expressed in[J]. Biotechnology Letters, 2012, 34(5): 831-838.
[91] Qamar M T, Alqahtani S M, Alamri M A, et al. Structural basis of SARS-CoV-2 3CL(pro) and anti-COVID-19 drug discovery from medicinal plants [J]. Journal of Pharmaceutical Analysis, 2020, 10(4): 313-319.
[92] Mhater S, Srivastava T, Naik S, et al. Antiviral activity of green tea and black tea polyphenols in prophylaxis and treatment of COVID-19: a review [J]. Phytomedicine, 2021, 85: 153286. doi: 10.1016/j.phymed.2020.153286.
[93] Zhang Z C, Zhang X C, Bi K Y, et al. Potential protective mechanisms of green tea polyphenol EGCG against COVID-19 [J]. Trends in Food Science and Technology, 2021, 114: 11-24.
[94] Reshamwala D, Shroff S, Amamuddy O S, et al. Polyphenols epigallocatechin gallate and resveratrol, and polyphenol-functionalized nanoparticles prevent enterovirus infection through clustering and stabilization of the viruses [J]. Pharmaceutics, 2021, 13(8): 1182. doi: 10.3390/pharmaceutics13081182.
[95] Zhu S, Li L L, Gu Z J, et al. 15 years of small: research trends in nanosafety [J]. Small, 2020, 16(36): 2000980. doi: 10.1002/smll.202000980.
[96] Zhang C Y, Gao L, Yuan Q, et al. Is GSH chelated Pt molecule inactive in anti-ancer treatment? A case study of Pt 6 GS 4 [J]. Small, 2020, 16(26): 2002044. doi: 10.1002/smll.202002044.
[97] Lin A, Liu Y N, Zhu X F, et al. Bacteria-responsive biomimetic selenium nanosystem for multidrug-resistant bacterial infection detection and inhibition [J]. ACS Nano, 2019, 13(12): 13965-13984.
[98] Malhotra N, Audira G, Castillo A L, et al. An update report on the biosafety and potential toxicity of fullerene-based nanomaterials toward aquatic animals [J]. Oxidative Medicine and Cellular Longevity, 2021: 7995223. doi: 10.1155/2021/7995223.
[99] Zelepukin I V, Yaremenko A V, Ivanov I N, et al. Long-term fate of magnetic particles in mice: a comprehensive study [J]. ACS Nano, 2021, 15(7): 11341-11357.
[100] Sun D X, Zhou S, Gao W. What went wrong with anticancer nanomedicine design and how to make it right [J]. ACS Nano, 2020, 14(10): 12281-12290.
[101] Cai R, Chen C Y. The crown and the scepter: roles of the protein corona in nanomedicine [J]. Advanced Materials, 2019, 31(45): 1805740. doi: 10.1002/adma.201805740.
[102] Hussain S, Joo J, Kang J, et al. Antibiotic-loaded nanoparticles targeted to the site of infection enhance antibacterial efficacy [J]. Nature Biomedical Engineering, 2018, 2: 95-103.
[103] Qiao Y Q, Liu X M, Li B, et al. Treatment of MRSA-infected osteomyelitis using bacterial capturing, magnetically targeted composites with microwave-assisted bacterial killing [J]. Nature Communications, 2020, 11: 4446. doi: 10.1038/s41467-020-18268-0.
[104] Liu Y, Shi L Q, Su L Z, et al. Nanotechnology-based antimicrobials and delivery systems for biofilm-infection control [J]. Chemical Society Reviews, 2019, 48(2): 428-446.
[105] Fan Y M, Lüchow M, Zhang Y N, et al. Nanogel encapsulated hydrogels as advanced wound dressings for the controlled delivery of antibiotics [J]. Advanced Functional Materials, 2021, 31(7): 2006453. doi: 10.1002/adfm.202006453.
[106] Cheng X T, Xu H D, Ran H H, et al. Glutathione-depleting nanomedicines for synergistic cancer therapy [J]. ACS Nano, 2021, 15(5): 8039-8068.
[107] Han S, Zal T, Sokolov K V. Fate of antibody-targeted ultrasmall gold nanoparticles in cancer cells after receptor-mediated uptake [J]. ACS Nano, 2021, 15(9): 9495-9508.
[108] Zhe W, Duan Y, Duan Y W. Application of polydopamine in tumor targeted drug delivery system and its drug release behavior [J]. Journal of Controlled Release, 2018, 290: 56-74.
[109] Zhang X C, He J, Qiao L. 3D printed PCLA scaffold with nano-hydroxyapatite coating doped green tea EGCG promotes bone growth and inhibits multidrug-resistant bacteria colonization [J]. Cell Proliferation, 2022: e13289. doi: 10.1111/cpr.13289.
Recent Advances in Catechin Biomedical Nanomaterials
YU Rongxin1,2,3, ZHENG Qinqin2,3, CHEN Hongping2,3, ZHANG Jinsong1*, ZHANG Xiangchun2,3*
1. State Key Laboratory of Tea Plant Biology and Utilization, Anhui Agricultural University, Hefei 230036, China; 2. Tea Research Institute, Chinese Academy of Agriculture Sciences, Hangzhou 310008, China; 3. Key Laboratory of Tea Quality and Safety Control, Ministry of Agriculture and Rural Affairs, Hangzhou 310008, China
Catechins are a kind of bioactive substances rich in tea, which have the functions of anti-oxidation, anti-tumor, anti-virus, anti-inflammatory and immune regulation. However, due to the high activity of phenolic hydroxyl groups, catechins are easy to loseandactivities, resulting in lower bioavailability. The recent development of nanobiotechnologies is expected to solve the problem of low bioavailability of catechins through ligand design, accurate synthesis and intelligent regulation, which can expand its application in the field of life and health. In this review, a summary on the progress of catechin biomedical nanomaterials in recent years, including the anti-tumor, antibacterial, anti-inflammatory, drug delivery and anti-virus activities,was firstly made. Later, the construction and biological mechanism of catechin biomedical nanomaterials were discussed in detail. Finally, future perspectives on the design and application of novel catechin nanomaterials were provided.
catechin, EGCG, nanomaterials, biomedicine, anti-tumor
S571.1;Q946.84+1
A
1000-369X(2022)04-447-16
2022-05-05
2022-06-07
国家自然科学基金(32001013)、中国农业科学院创新工程和青年创新专项(CAAS-ASTIP-2021-TRI、Y2022QC24)
俞蓉欣,女,硕士研究生,主要从事茶功能性生物纳米材料研究。*通信作者:zjs@ahau.edu.cn;zhangxc@tricaas.com

