基于气相色谱-静电场轨道阱高分辨质谱的四种植物精油成分分析及其抗氧化活性评价
孙明朝,杨悠悠,余雅男, ,陈 晗,赵青余,张军民,赵金山
(1.青岛农业大学动物科技学院,山东青岛 266109;2.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193;3.中国农业科学院北京畜牧兽医研究所,农业农村部华北动物遗传资源与营养科学观测实验站,北京 100193)
精油是芳香植物经水蒸馏、溶剂提取等技术获得的次生代谢产物,是一种粘稠的亲脂性液体,能够集中芳香植物的特有香味,其主要成分为萜类化合物、苯丙素类化合物、以及少量的脂肪族化合物和含硫含氮化合物。精油的亲脂特性以及复杂的活性组分使得其具有多种生物活性,在制药、卫生、化妆品、农业和食品工业中得到广泛应用。
辣椒、姜黄、小茴香、香茅是在食品行业具有广泛应用的芳香植物,由四种植物提取而得的精油均已被食品添加剂目录(允许使用的食品用天然香料名单)收录。辣椒精油是由一年生草本植物辣椒提取浓缩获得的含有色素和辣椒素的油状液体,具有多种功能活性,例如抗氧化、抗炎、抗糖尿病、抗肿瘤、抗癌和抗真菌特性。姜黄,原产于亚洲南部,是姜科植物姜黄的根茎,其精油具有相当高的抗氧化能力,且抗氧化能力与其化学成分密切相关。香茅草,别称柠檬草,禾本科香茅属芳香植物,其精油是一种混合物,包括香茅醛、香茅醇、香叶醇等,具有多种生物活性如抗菌、抗氧化、抗惊厥、驱蚊等。小茴香,是伞形科的一种二年生药用植物,常被用作饮料、面包、泡菜、糕点和奶酪等食品的调味剂。小茴香精油具有利尿、抗炎、镇痛和抗氧化等活性,多被用作化妆品和医药产品的成分。由于环境和遗传因素,如植物品种、生长阶段、地理来源、使用部位和提取工艺等,使得植物精油在定性和定量方面都具有很高的组分变异性,因此很多精油的成分并不明确,导致其生物活性不稳定,限制了精油产品的深入开发应用。
目前,有文献报道植物精油中挥发性成分的鉴定方法,有高效液相色谱法(HPLC)、气相色谱-质谱法(GC-MS)、HPLC 结合化学计量学解析法、二维气相色谱法(GC×GC)和衰减全反射傅里叶变换中红外光谱(ATR FTIR)等。气相色谱-静电场轨道阱高分辨质谱联用仪(GC-Orbitrap-MS)是一种相对较新的技术,具有高分辨率(200 m/z 时达120 K)以及高质量精度(>1/1000000)的优点,在成分精确分析、痕量成分鉴定等方面优势明显,已被广泛应用于靶向和非靶向代谢组学以及药毒残留分析。电子鼻是模仿人类嗅觉系统的芳香气味检测系统,本质上是一个具有部分特定性和适当模式识别系统的阵列式电子气体传感器,可区分、识别、量化气体或气体混合物,用于香料混合物的掺假鉴定及成分分类,是一种更经济实惠且不具破坏性地鉴别不同种类及来源精油的方法。
合成抗氧化剂存在不稳定性,使得其在食品中的使用受限,因此从植物中提取精油作为天然抗氧化剂得到了深入的研究。最近,多篇文献通过不同的体外抗氧化评价方法对植物精油的抗氧化能力进行全面评价。不同抗氧化测定方法的机理存在差异,仅使用一种方法对抗氧化物质的抗氧化活性进行检测,得到的结果不太全面和准确。目前植物提取物抗氧化活性的体外评价一般是利用基于氢原子转移和单电子转移原理的不同测定方法对待测物质进行抗氧化评定。
精油具备广阔的应用前景,但由于其成分组成不明确,活性差异较大,限制了其进一步的开发应用。本研究利用气相色谱--静电场轨道阱高分辨质谱联用技术对辣椒、姜黄、香茅、小茴香四种常用植物精油进行全面的成分分析,利用电子鼻技术进行快速鉴别,并采用DPPH、ABTS 和FRAP 抗氧化分析方法对四种植物精油进行抗氧化活性测定与比较,为植物精油在食品行业中的深入开发提供理论依据。
1 材料与方法
1.1 材料与仪器
植物精油(见表1) 由三家精油公司(公司编号为来源一S1、来源二S2、来源三S3)提供,均采用水蒸汽蒸馏法提取,购买后于-4 ℃密封冷藏避光保存;正己烷、甲醇 色谱纯,赛默飞世尔科技公司;乙醇 分析纯,国药集团;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2’-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸(ABTS) 北京酷来搏科技有限公司;总抗氧化能力(FRAP 法)试剂盒 苏州格锐思生物科技有限公司;L-抗坏血酸 分析纯,上海麦克林生化科技有限公司;2,6-二叔丁基对甲酚(BHT) 大于99%,西格玛奥德里奇贸易有限公司。

表1 精油中英文名称及FEMA 号Table 1 Plant essential oil English and Chinese name and FEMA number
气相色谱--静电场轨道阱高分辨质谱联用仪(Q Exactive GC-Orbitrap-MS),配有电子轰击离子源(EI)及Xcalibur4.3 数据处理系统,TriPlus RSH 自动进样器和Trace1310 气相色谱仪 赛默飞世尔科技公司;PEN3 型电子鼻,配有10 种金属氧化物传感器(传感器如表2 所示) 德国施维林公司。

表2 PEN3 电子鼻传感器及其性能描述Table 2 Sensor array and performance characteristics of PEN3 electronic nose
1.2 实验方法
1.2.1 GC-MS 分析
1.2.1.1 样品前处理 精油成分通过气相色谱--静电场轨道阱高分辨质谱(GC-Oribitrap-MS)测定。利用正己烷将样品稀释至100 μL/L,取1 mL 于棕色进样瓶待测。
1.2.1.2 GC 条件 姜黄精油、香茅精油、小茴香精油检测条件:参考色谱柱:VF-WAX 毛细管柱(60 m×0.25 mm×0.25 μm,安捷伦公司);进样口温度250 ℃;传输线温度280 ℃;升温程序:初始温度80 ℃,保持3 min,以8 ℃/min 升至280 ℃,保持10 min;载气为高纯氦气,载气流量1 mL/min;分流比10:1;自动进样器进样,进样量1 μL。
辣椒精油检测GC 条件:色谱柱:毛细管色谱柱DB-5(60 m×0.25 mm×0.25 μm,Agilent);进样口温度250 ℃;传输线温度250 ℃;程序升温初始温度80 ℃,保持3 min,以8 ℃/min 升至230 ℃,保持10 min;高纯氦气为载气,载气流量1 mL/min;分流比5:1;动进样器进样,进样量为1 μL。
1.2.1.3 MS 条件 电子轰击(EI)离子源,离子源温度280 ℃,传输线温度280 ℃(辣椒精油250 ℃),电子能量70 eV;采用全扫描采集模式,扫描质量范围为30~550 amu。GC-Orbitrap-MS 数据采用Thermo Scientific Trace Finder 进行处理,对数据进行解卷积后再将质谱图与NIST 2017 谱库比对,通过谱库比对的正/反向匹配度和保留指数(retention index,RI)确证未知化合物的定性结果,保留匹配度大于700(最大值1000)以内的成分。RI 以C~C的系列正构烷烃在相同实验条件下计算得到。化合物相对含量采用峰面积归一化法计算,保留含量大于0.1%的成分。
1.2.2 电子鼻分析
1.2.2.1 采集方法 取样品5 μL 于10 mL 顶空进样瓶中,密封进样瓶,放置于24 ℃避光平衡30 min 待测,每个样品重复采集三次。
1.2.2.2 仪器条件 试验参考Chen 等的方法并稍作修改。传感器在使用前经过校准和充分洗脱,待传感器响应信号稳定后将平衡好的顶空瓶顶部气体以300 mL/min 的恒定速度泵入传感器阵列;样品采集时间400 s;传感器清洗时间480 s;调零时间10 s。
1.2.3 抗氧化活性测定
1.2.3.1 DPPH 自由基清除率测定 根据Kebede,Nazir 等的方法进行测定,称取24 mg DPPH溶解于100 mL 无水乙醇中,制成DPPH 溶液。取精油0.256 mL 溶于39.744 mL 无水乙醇配成浓度为6400 μL/L 的精油储备液,逐倍稀释,配制成浓度为6400、3200、1600、800、400、200、100、50 μL/L 的精油(另配制同种浓度梯度的抗氧化剂抗坏血酸与BHT 作为阳性对照)。吸取不同浓度样品稀释液1 mL,与DPPH 溶液1:1 混合,摇匀后将混合溶液室温避光30 min。通过分光度计在波长517 nm 处测量吸光度值,平行测定两次,重复三次试验。结果以平均值表示。DPPH 清除率计算公式如下:
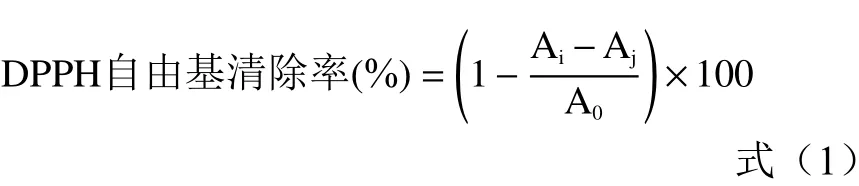
式中:A指混合溶液(样品溶液与DPPH 溶液1:1 混合)的吸光度值;A指对应的样品溶液吸光度值;A指空白对照溶液(无水乙醇与DPPH 溶液1:1 混合)的吸光度值。
1.2.3.2 ABTS 自由基清除率测定 根据Jamuna,Huang 等的方法稍作修改后进行测定,取ABTS 0.0384 g,配制10 mL 浓度为7 mmol/L 的水溶液A,取过硫酸钾0.0378 g,配制1 mL 浓度为140 mmol/L 的水溶液B。取178 μL B 溶液加入A 溶液中使得混合溶液的浓度体系为ABTS 浓度7 mmol/L、KSO浓度2.45 mmol/L。混合溶液在黑暗中孵育过夜(12~16 h)以产生自由基。加入无水乙醇将混合溶液在745 nm 下将光度值调节至0.7,配成ABTS 工作液。取96 孔板进行加样(样品稀释液浓度同上),分别取20 μL 配制好的精油、抗坏血酸以及BHT 样品溶液加入180 μL ABTS 工作液中,加样完成后混合摇匀,避光孵育6 min,于734 nm处测定吸光度值。用酶标仪记录混合物的吸光度。抗坏血酸及BHT 用作阳性对照。其他条件不变,以无水乙醇为对照,用20 μL 无水乙醇替代样品溶液,以此为空白组。所有测试样品重复3 次分析,并使用公式计算ABTS 清除能力百分比。计算公式如下:
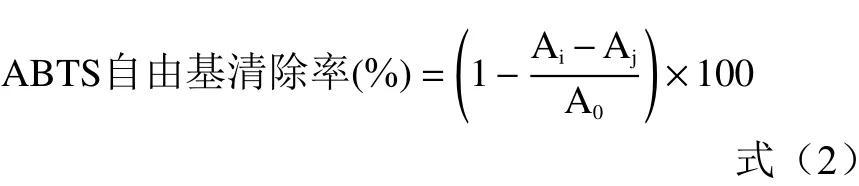
式中:A指混合反应溶液(样品溶液与ABTS 工作液混合)的吸光度值;A指对应的样品溶液吸光度值;A指空白对照溶液(无水乙醇与ABTS 工作液混合)的吸光度值。
1.2.3.3 FRAP 法抗氧化能力评价 使用总抗氧化能力(FRAP 法)试剂盒进行测定精油(80%乙醇稀释)总抗氧化能力。分析结果以总抗氧化能力(μmol Trolox/mL)表示。
1.3 数据处理
所有试验均做三次重复,使用Excel 2019(微软公司)对数据进行统计,结果用平均值±标准差表示,使用MetaboAnalyst 5.0 在线进行主成分分析(PCA),用Origin2018 软件对数据进行拟合并绘图。
2 结果与分析
2.1 四种植物精油挥发性成分的GC-Oribitrap-MS测定
辣椒精油的成分分析结果及化合物种类如表3和图1 所示。辣椒精油共鉴定出33 种化合物,其中32 种化合物相对含量>0.1%(表1),三种来源的共有成分19 种,主要成分均为辣椒碱、二氢辣椒碱、降二氢辣椒碱以及少量的酯类化合物。这与朱晓兰,季德胜等的实验结果相符合,三种不同来源的辣椒精油共有成分为辣椒碱类化合物。从图1 可以看出,辣椒精油中脂肪族化合物和芳香族化合物占检出化合物的80%以上,其中芳香族化合物占比超过60%,主要是辣椒碱,脂肪族化合物主要为脂肪酸甘油酯、乙烯基乙酸、正烷烃、棕榈酸甲酯及呋喃等。
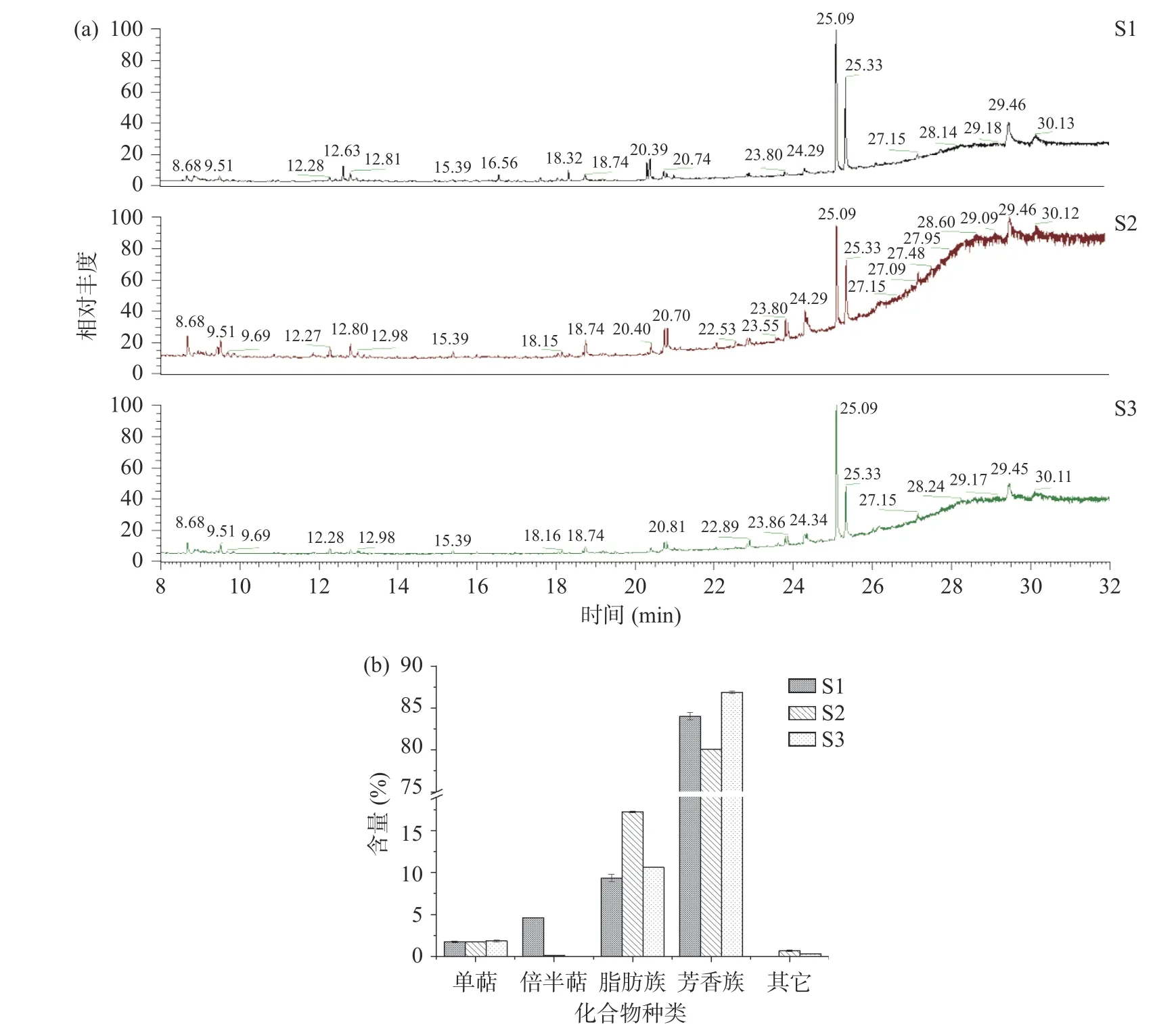
图1 辣椒精油的总离子流图及各类化合物含量Fig.1 Total ion current chromatogram and the content of various classes compounds of essential oil from Capsicum annuum L.

表3 辣椒精油的成分分析结果(相对含量≥0.1%)Table 3 Chemical components analysis results in essential oil from Capsicum annuum L. (relative content≥0.1%)
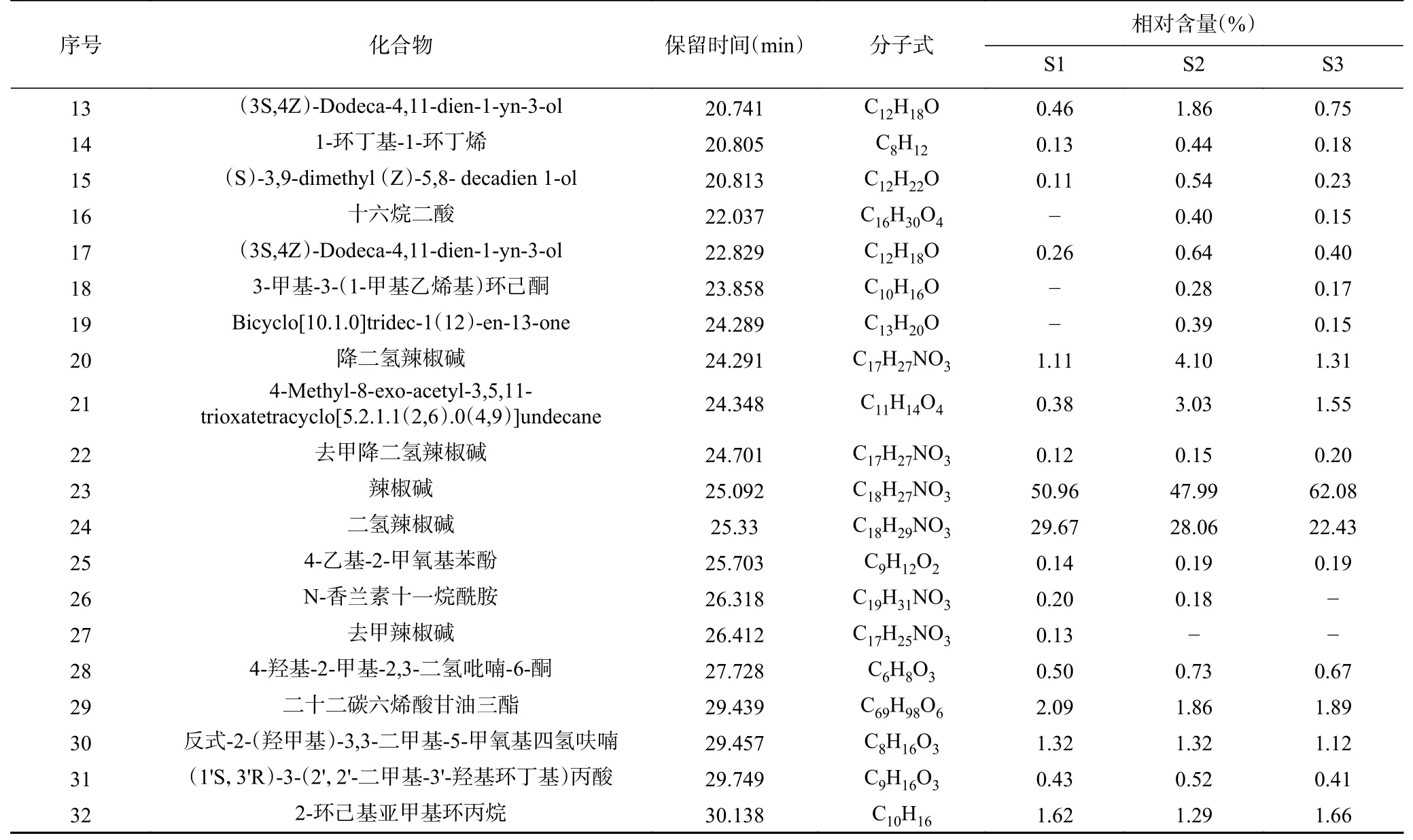
续表 3
姜黄精油的成分分析结果及化合物种类如图2和表4 所示。姜黄精油共鉴定出95 种化合物,其中77 种化合物相对含量>0.1%(表4),三种来源的共有成分12 种,姜黄精油中大多数成分都为萜类化合物及芳香化合物,三种来源姜黄精油均含有主要成分姜烯、长叶烯、菖蒲烯等倍半萜化合物,S1 主要成分为花侧柏烯,去氢白菖烯、姜烯、姜酮等,S2、S3 主要成分为姜烯、-姜黄烯、-杜松烯等。不同来源的姜黄精油在成分种类及含量上差异明显,杨海艳等采用GC-MS 技术对贵州产的姜黄精油进行鉴定,共鉴定出47 种化合物,主要成分为芳姜黄酮、-姜黄烯、-倍半水芹烯、姜黄酮。同种精油不同种类之间化合物种类及含量的巨大差异,与提取方法、部位、原料来源以及不同生长阶段有着极为密切的关系。
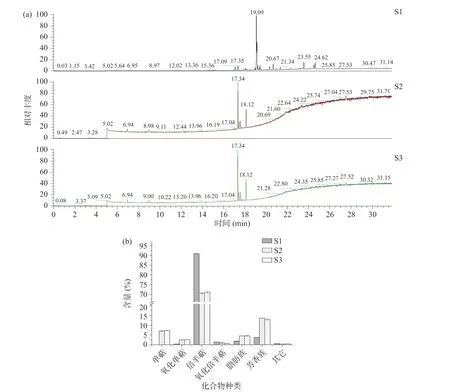
图2 姜黄精油的GC-MS 总离子流图及各类化合物含量Fig.2 Total ion current chromatogram and the content of various classes compounds of essential oil from Curcuma longa L.
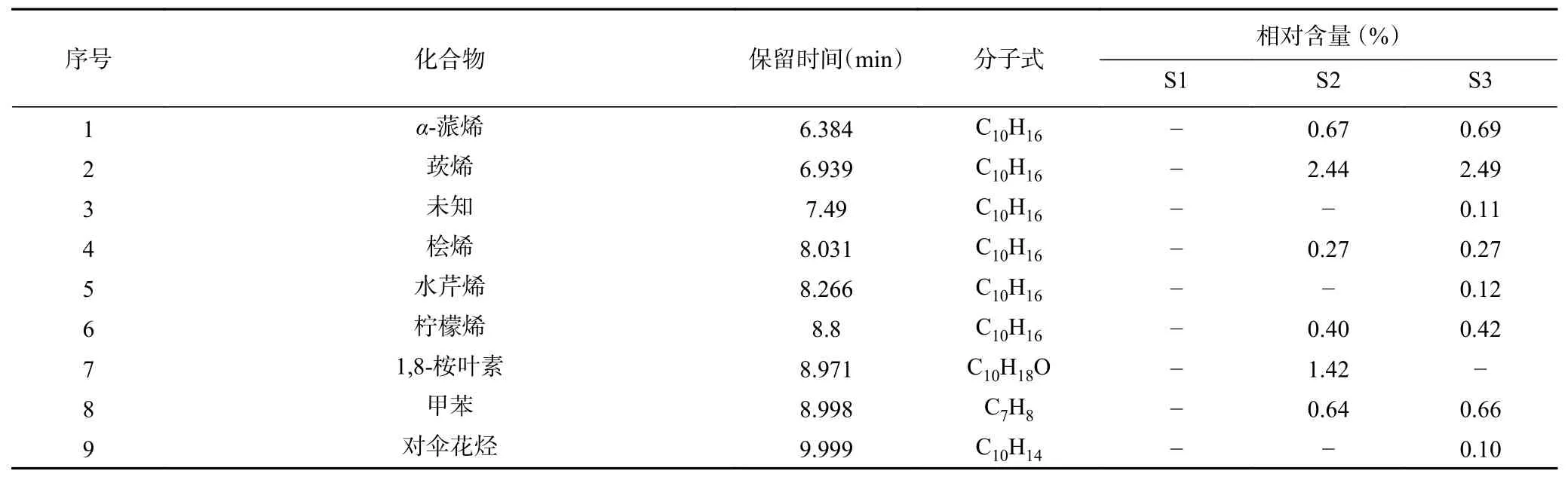
表4 姜黄精油的成分分析结果(相对含量≥0.1%)Table 4 Chemical components analysis results in essential oil from Curcuma longa L. (relative content≥0.1%)
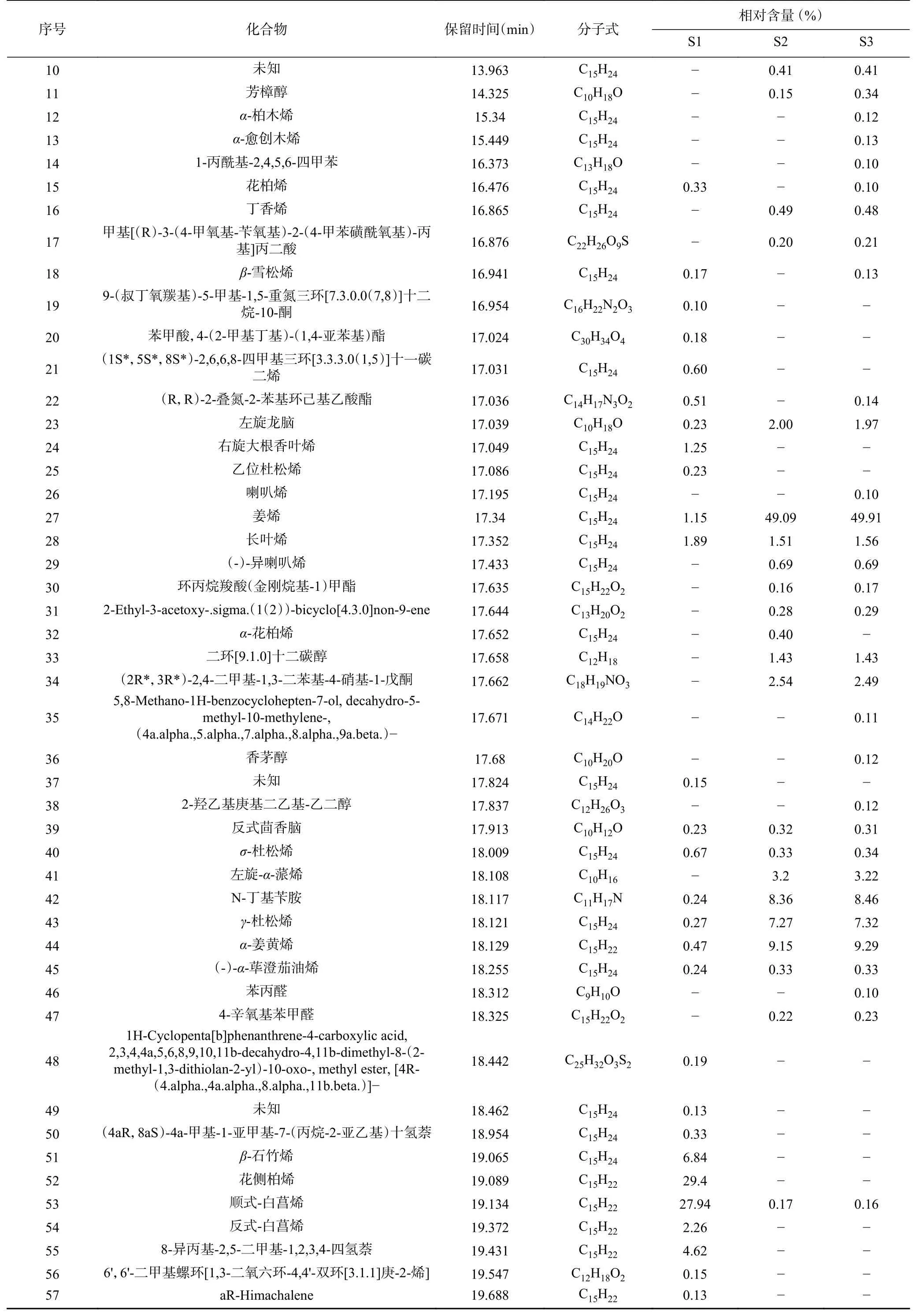
续表 4
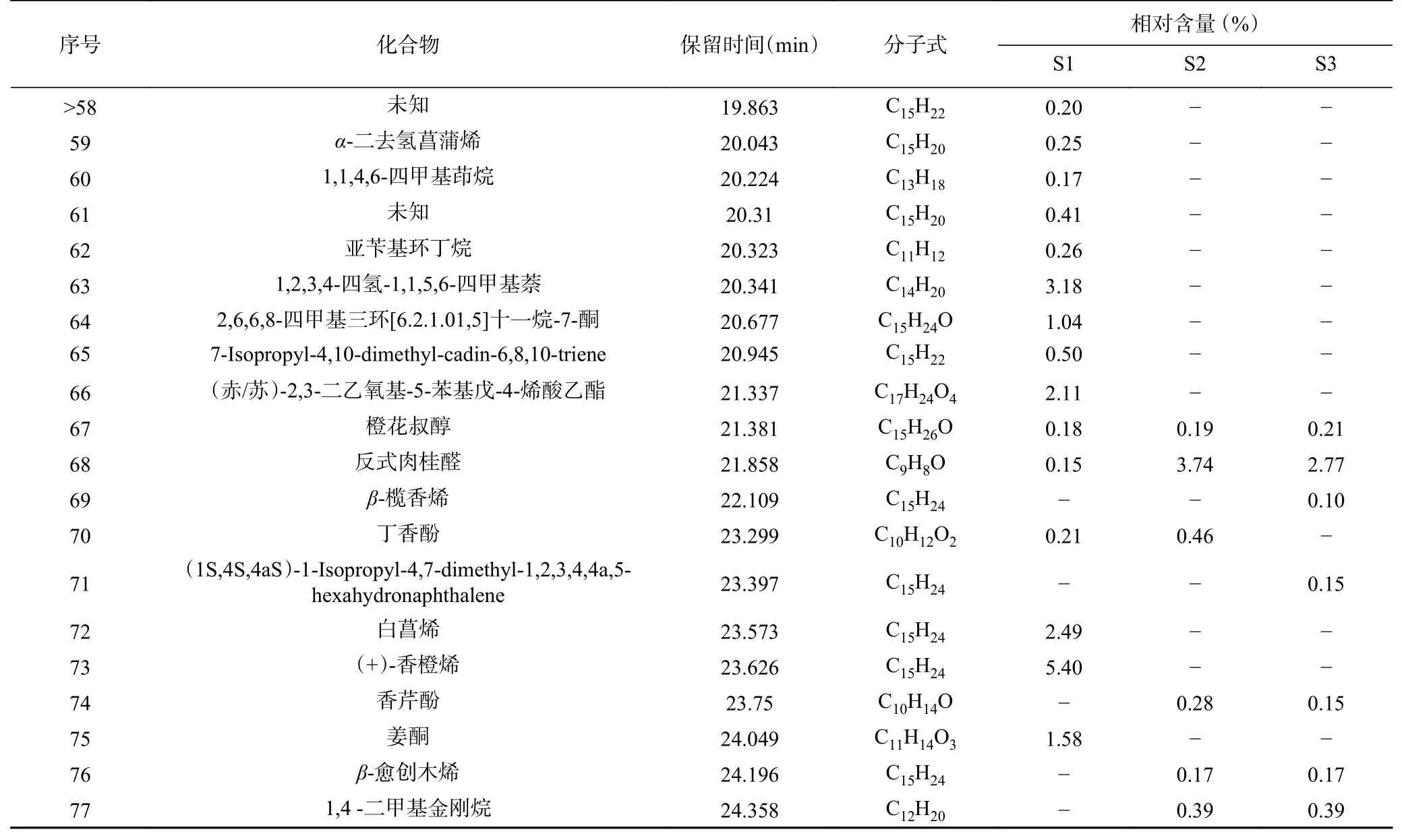
续表 4
香茅精油的成分分析结果及化合物种类如图3和表5 所示,香茅精油共鉴定出137 种化合物,其中102 种化合物相对含量>0.1%(表5),三种来源的共有成分30 种,主要成分为香茅醛、丁香烯、香茅醇、橙花醇、Δ-杜松烯等化合物。S1 香茅精油成分主要化合物为单萜化合物,含有较高的1-异丁基-1-环己烯、2-甲基丙基-1-环己烯,柠檬烯、对伞花烃等,S2、S3 主要化合物为倍半萜化合物,含有较高的丁香烯、甲基丁香酚、橙花叔醇、檀香烯、-檀香烯、-柏木烯、-石竹烯等,与石小翠等报道的主要成分相似,S1 与S2、S3 在萜烯化合物及脂肪族化合物的组成上差异极大。
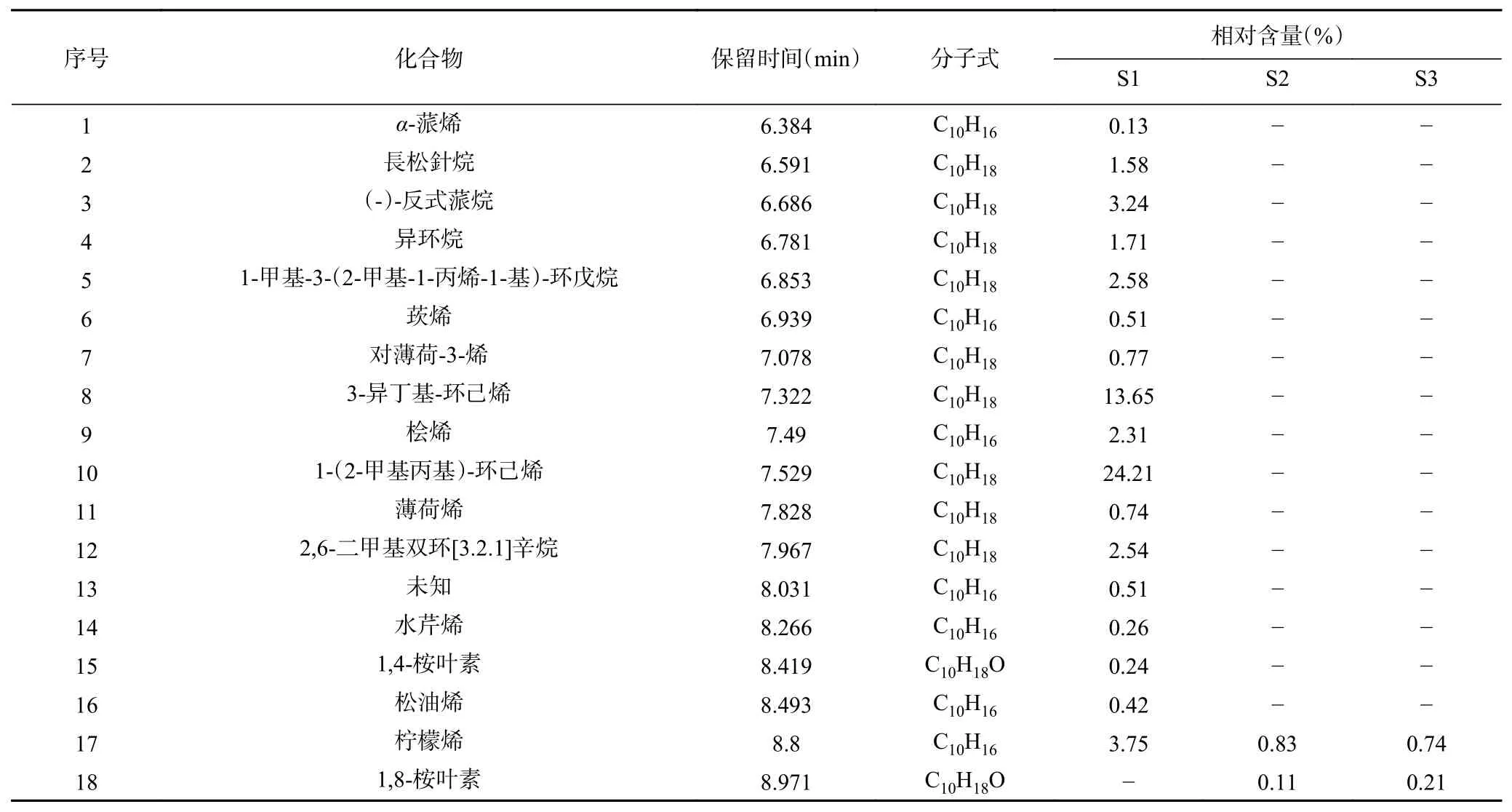
表5 香茅精油的成分分析结果(相对含量≥0.1%)Table 5 Chemical components analysis results in essential oil from Cymbopogon nardus Rendle (relative content≥0.1%)
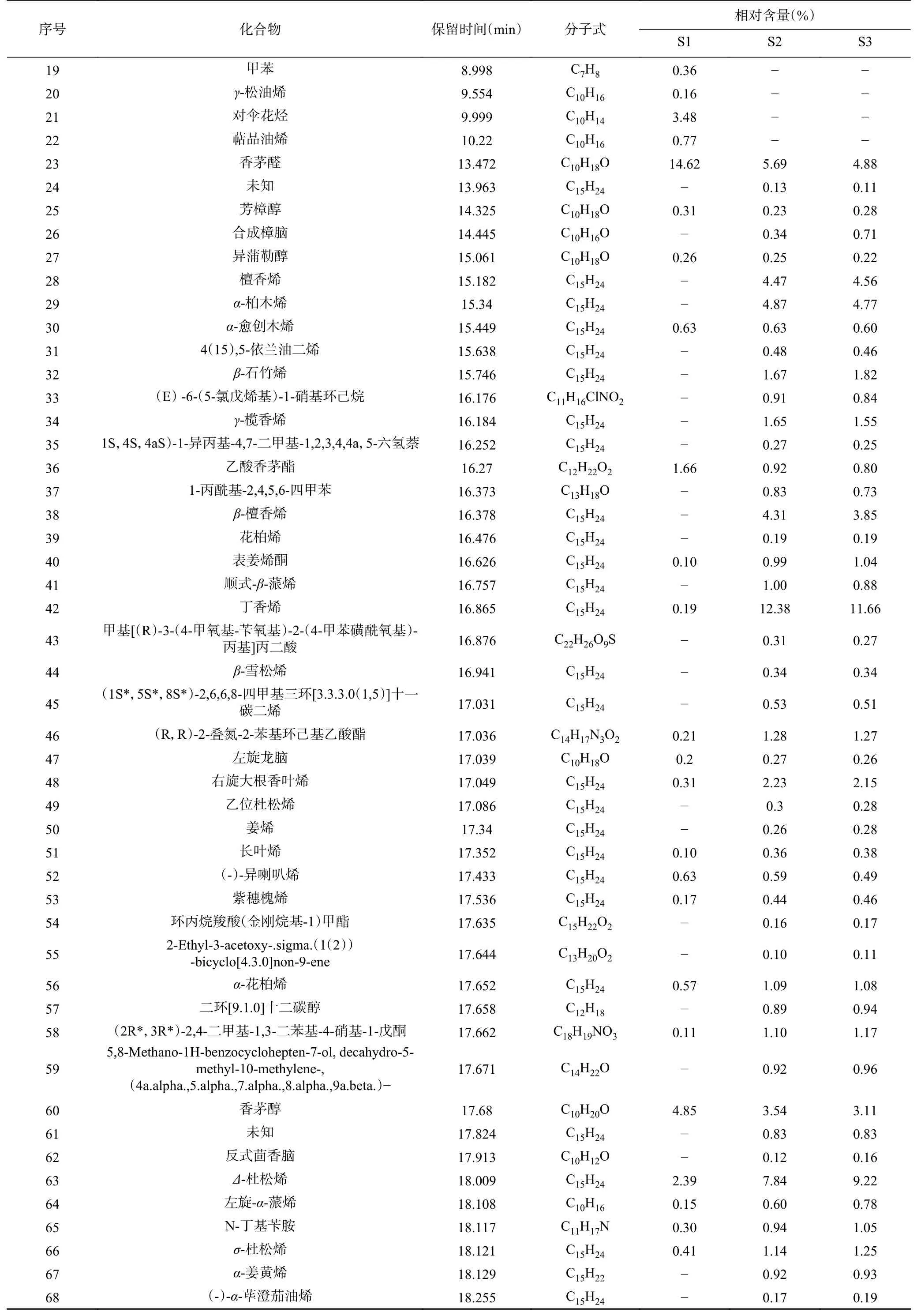
续表 5
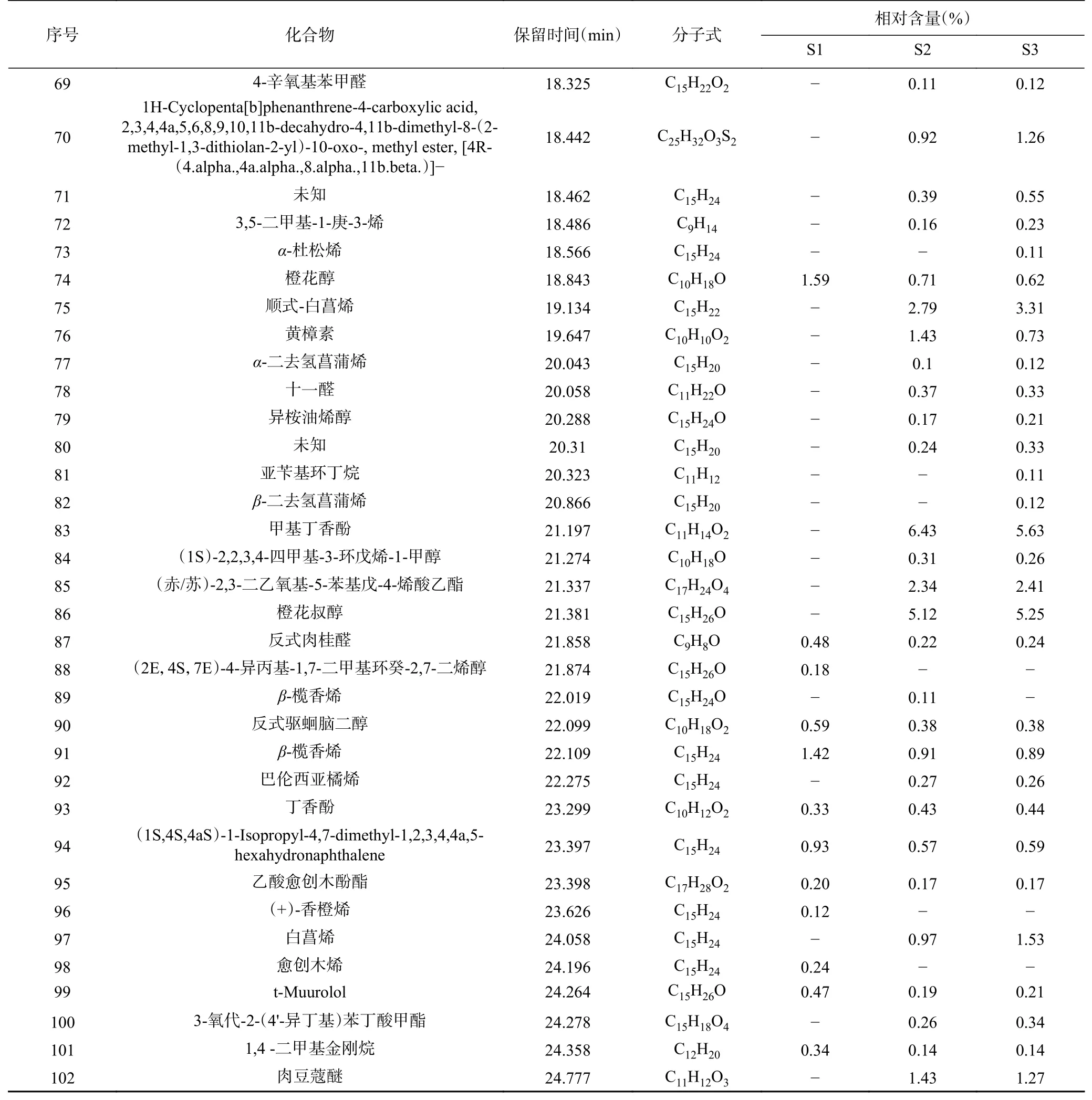
续表 5
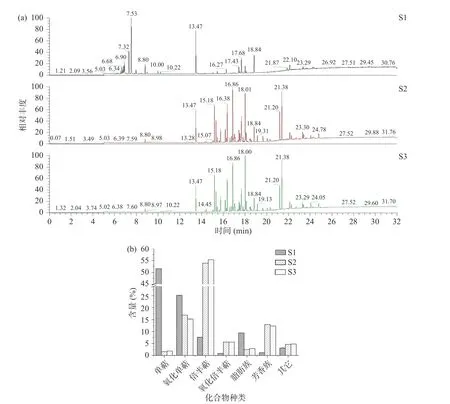
图3 香茅精油的GC-MS 总离子流图及各类化合物含量Fig.3 Total ion current chromatogram and the content of various classes compounds of essential oil from Cymbopogon nardus Rendle
小茴香精油的成分分析结果及化合物种类如图4 和表6 所示,小茴香精油共鉴定出56 种化合物,其中21 种化合物相对含量>0.1%(表6),三种来源的共有成分13 种,主要成分为反式茴香脑、茴香醚、5-茚醇等芳香族化合物,与姜楠楠,Ghasemian等报道的小茴香精油成分相一致。S1 含有较高的萜烯类化合物如-蒎烯、对伞花烃、1,8-桉叶素等,但反式茴香脑(77.12%)含量低于S2(89.4%)、S3(89.51%)。

表6 小茴香精油的成分分析结果(相对含量≥0.1%)Table 6 Chemical components analysis results in essential oil from Foeniculum vulgare Mill. (relative content≥0.1%)
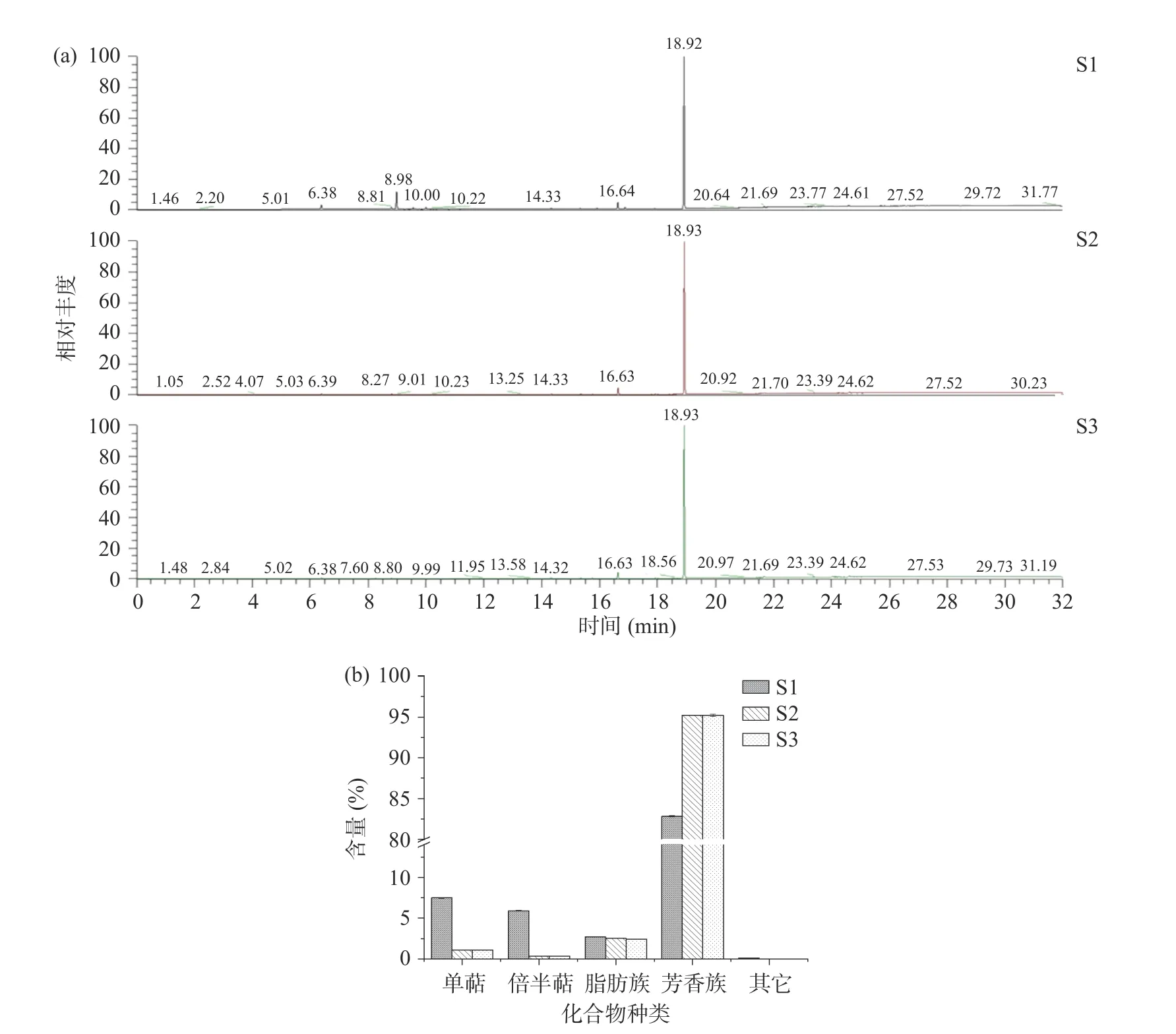
图4 小茴香精油的GC-MS 总离子流图及各类化合物含量Fig.4 Total ion current chromatogram and the content of various classes compounds of essential oil from Foeniculum vulgare Mill
2.2 电子鼻测定
挥发性物质在电子鼻的检测过程中,其电子鼻传感器的电导率为G,经过电子鼻活性炭过滤后的标准气体其电导率为G0,电子鼻的系统将得到的2 个数据进行比对,得到G/G0,即为响应值,响应值的大小反映了挥发性物质含量的变化。辣椒精油、姜黄精油、香茅精油、小茴香精油的电子鼻传感器响应值见图5,由图可知,辣椒精油中S1 与S2、S3 有明显的区分,且在W1W(萜烯化合物、硫化物)传感器有较高的响应值,这与成分分析结果相一致;姜黄精油中S1 与S2、S3 在W5S(氮氧化物),W1W(萜烯化合物),W2W(芳香化合物)有明显的区分,GC-MS 结果中发现S1 的姜黄精油与S2、S3 成分差异较大;香茅精油中S1 在W5S(氮氧化物),W1W(萜烯化合物),W2W(芳香化合物)传感器上的响应值远高于S2、S3,成分分析结果发现三种来源香茅精油在萜烯化合物及脂肪族化合物的组成上有明显差异;小茴香精油S1 中W1W(萜烯类化合物)响应值高于S2、S3。同种精油不同来源之间传感器响应值有差异,主要集中在对氮氧化物(W5S)、含硫化合物、萜烯以及吡嗪类化合物(W1W)、芳香化合物及含硫有机物(W2W)敏感的三个传感器中,结果表明电子鼻可通过精油气味的综合信息特征来判别,同种精油不同来源区分明显。

图5 电子鼻传感器响应值雷达图Fig.5 Radar graph for sensors response values of E-nose
PCA 是将多变量线性转换选出较少重要变量的一种多元统计分析方法,可将传感器获取的多指标信息进行数据转换和降维,并对特征向量进行线性分类,最终在PCA 图上显示主要的二维图,贡献率越大越能更好地反映样品信息。图6 为四种植物精油的PCA 分析,由图6 可知,辣椒精油中第一主成分PC1 贡献率为72.6%,第二主成分PC2 贡献率为19.4%;姜黄精油中第一主成分PC1 贡献率为97.1%,第二主成分PC2 贡献率为2.5%;小茴香精油中第一主成分PC1 贡献率为87.3%,第二主成分PC2 贡献率为10%;香茅精油中第一主成分PC1 贡献率为95.7%,第二主成分PC2 贡献率为3.5%。通过PCA分析,可以很清楚的将不同来源的同种精油区分开。因此电子鼻技术有望作为一种快速便捷的分析方法应用到市售精油的品质鉴别中。
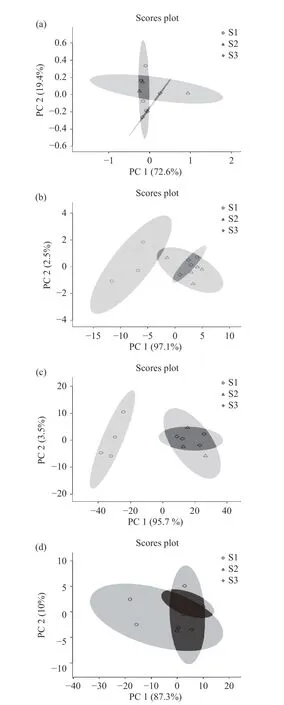
图6 四种精油的主成分分析Fig.6 Principal component analysis (PCA) of four essential oil
2.3 抗氧化活性测定
由图7 可以看出,阳性对照以及辣椒精油、姜黄精油、香茅精油均对DPPH、ABTS 自由基表现出良好的清除能力,而小茴香精油未表现出明显的清除能力。方差分析结果表明,各个浓度平行之间清除率并无明显的差异性,基本处于平衡状态。精油的自由基清除效果在试验浓度范围内,随着浓度的增加,清除率增大且变化明显。综合精油的清除率曲线(图7)以及精油的半数抑制率(表7),可以得出,DPPH 自由基清除能力:抗坏血酸>BHT>姜黄精油>辣椒精油、香茅精油>小茴香精油,且不同来源的同种精油之间存在DPPH 清除效果之间的差异,这与成分存在差异关系密切。ABTS 自由基可通过KSO氧化ABTS获得,抗氧化物质与其反应使溶液发生颜色反应,褪色越明显表明抗氧化能力越强,其特征吸光度值越小。研究发现,样品对ABTS 自由基的清除趋势与对DPPH 自由基的清除趋势一致,DPPH、ABTS 自由基的清除主要依靠抗氧化剂的供氢能力来实现,随着样品浓度的提高,精油对两类自由基的清除能力逐渐增强。
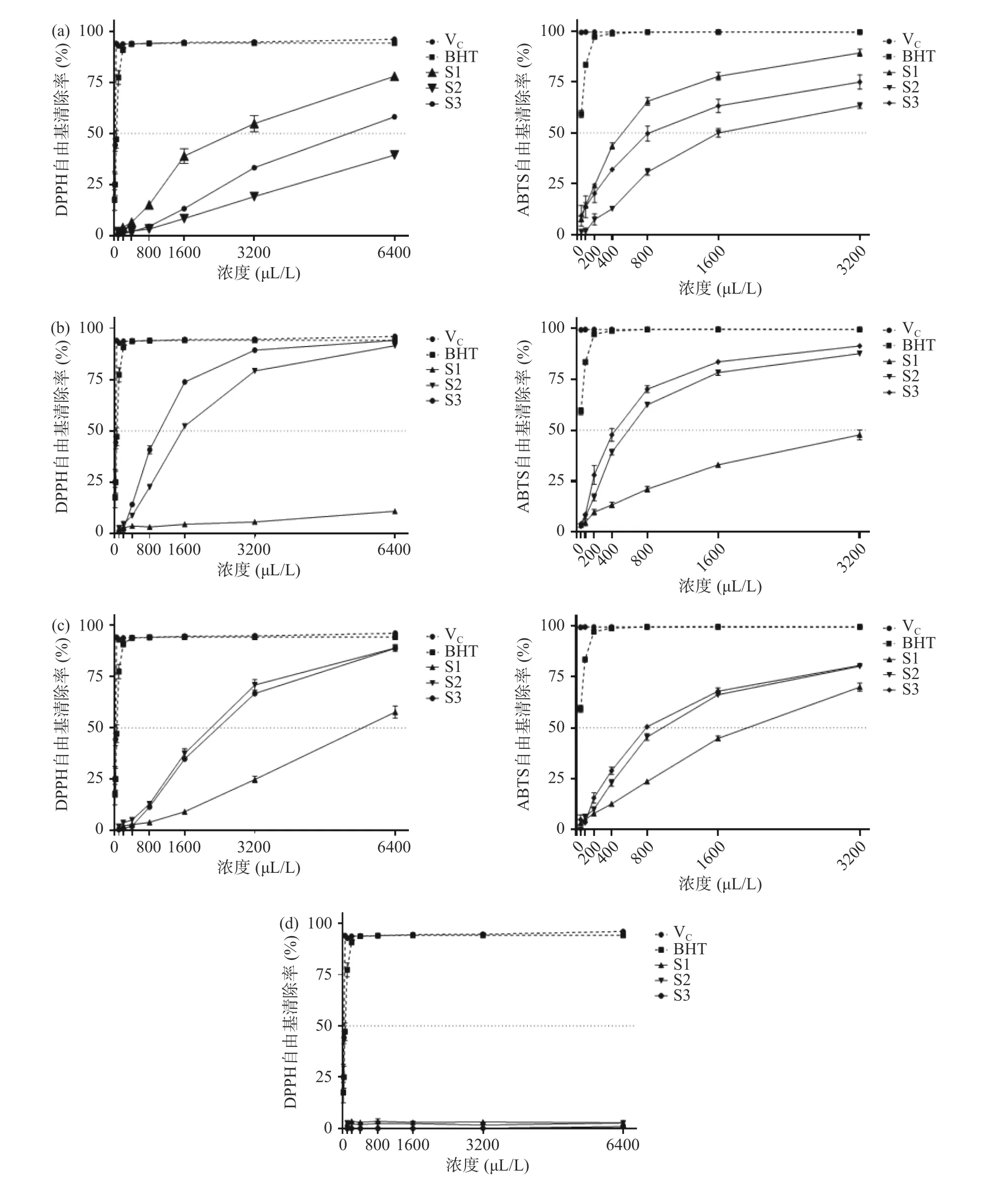
图7 不同精油浓度下DPPH、ABTS 自由基清除活性Fig.7 DPPH and ABTS radical-scavenging activity at different essential oil concentrations
FRAP 法是指酸性条件下抗氧化物质还原(Fe-TPTZ)复合物,并产生蓝紫色的(Fe-TPTZ),利用酶标仪测定其吸光度,吸光度变化与还原物质的含有量呈比例关系。由Trolox 标准曲线可知,样品在0~2.8 nmol/μL 之间线性关系良好,回归方程为Y=0.8899X-0.0449(=0.9959),通过对4 种精油总抗氧化能力测定计算得出精油的FRAP 值如图表7 所示,结果表明辣椒精油、姜黄精油、香茅精油具有抗氧化能力,抗氧化能力:V>BHT>姜黄精油>香茅精油>辣椒精油,而小茴香精油在检测浓度范围内未体现出抗氧化能力。
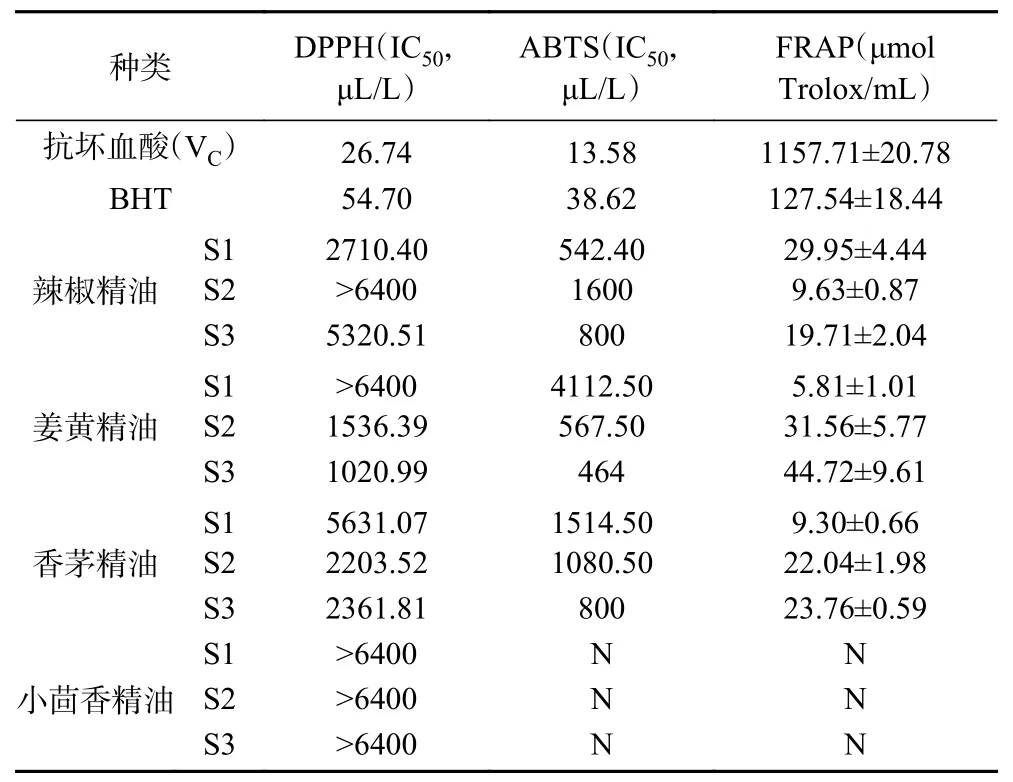
表7 4 种精油的抗氧化活性Table 7 Antioxidant activity of four essential oil
实验结果显示,辣椒精油中,抗氧化能力从强到弱依次为S1、S3、S2,其差异可能源于辣椒碱含量的不同,辣椒碱具有典型的酚类结构,可以清除自由基,猝灭单态氧,缓解脂质氧化,是一种天然的植物抗氧化成分。姜黄精油中,S3 的DPPH、ABTS 自由基的IC以及FRAP 值分别为1020.99 μL/L、464 μL/L、44.72 μmol Trolox/mL,与Gounder 等的结果稍有不同,其DPPH 自由基阳离子的IC为3.5 mg/mL,ABTS 自由基阳离子的IC为1.9 mg/mL,FRAP 检测的TEAC 值为276 μmol/mL,该研究中的姜黄精油主要成分为芳姜黄酮,成分上的不同是生物活性出现差异的根本原因。研究发现姜黄精油的自由基清除能力可能由于姜烯、-姜黄烯等化合物,姜烯在防止植物自身氧化中起到重要作用。综合香茅精油的自由基清除活性及Fe还原能力,抗氧化活性S2、S3>S1,这可能是因为S2、S3 的香茅精油中含有较高的丁香烯、甲基丁香酚、香茅醛等含有易氧化基团亚甲基、羟基的化合物,这类化合物具有供氢能力,可有效消除活性氧,倍半萜类化合物也被报道为强抗氧化成分。小茴香精油在检测范围内未检测出有效抗氧化活性,这与Shahat 等的研究结果有所不同,该研究得出小茴香(伞形科)精油的DPPH自由基IC为15.33 mg/mL,其主要成分与本研究一致,但试验浓度超过本研究,这可能是造成差异的主要原因。
脂质氧化会引起食物变质,导致腐臭、酸败等不良气味的产生,还会造成营养成分的损失。本研究发现,姜黄精油、香茅精油、辣椒精油具有良好的抗氧化活性,不同来源的精油其成分和抗氧化活性存在差异。Djerrad 等对阿尔及利亚十个不同地区产的黑松精油进行了GC-MS 分析以及DPPH、还原力、-胡萝卜素漂白试验以及亚铁离子螯合能力等抗氧化测定,发现地理来源和生长条件显著影响了精油的成分组成和抗氧化活性。体外抗氧化活性测定的一般原理是基于单电子的转移和氢原子的供应,两者均能打断自由基反应链,减少自由基的产生。根据不同抗氧化测定方法对精油进行测定发现,精油中存在能够清除DPPH 自由基、ABTS 自由基并减少铁离子的成分,即抗氧化成分,精油所含的化合物种类繁多,生物活性成分存在质和量上的区别,这种成分的差别造成了抗氧化能力的高变异性。本研究显示,抗氧化能力良好的精油,含氧萜类化合物以及部分芳香族化合物含量较高。精油的强抗氧化能力主要是由于它们的酚类化合物和一些其他次生代谢物,这些物质在结构上类似于具有强抗氧化潜力的酚类如香芹酚、丁香酚等。精油显著的抗氧化效果可以作为天然的抗氧化剂、食品防腐剂预防脂质氧化,保护食品质量,其独特风味对消费者来说是一种有吸引力的品质。
3 结论
采用GC-Oribitrap-MS 对四种植物精油的成分进行了全面分析,其中辣椒精油共鉴定出33 种化合物(32 种化合物相对含量>0.1%),主要成分为辣椒碱、二氢辣椒碱、降二氢辣椒碱;姜黄精油共鉴定出95 种化合物(77 种化合物相对含量>0.1%),主要成分为姜烯、-姜黄烯、花侧柏烯、去氢白菖烯等萜烯化合物;香茅精油共鉴定出137 种化合物(102 种化合物相对含量>0.1%),主要成分为香茅醛、丁香烯、Δ-杜松烯、香茅醇;小茴香共鉴定出56 种化合物(21 种化合物相对含量>0.1%),主要成分为反式茴香脑、草茴香脑、茴香醛、-蒎烯。不同来源精油的成分差异极大,市场上的精油质量参差不齐,因此开发精油的快速鉴定技术,为市场提供便捷有效的精油质量控制方法是当前精油产业亟待解决的问题。本研究利用电子鼻技术对植物精油进行快速辨别,发现该技术可有效区分不同来源的植物精油。抗氧化研究结果表明,四种精油的抗氧化活性从强到弱依次为姜黄精油,香茅精油,辣椒精油,小茴香精油,不同来源的同种精油其抗氧化活性有极大不同。综上,GCOribitrap-MS 技术可以对精油成分进行全面准确的鉴定,电子鼻技术可用于植物精油的快速鉴别,姜黄精油S3 的抗氧化活性最强,DPPH、ABTS 自由基的半数清除率以及FRAP 值分别为1020.99 μL/L、464 μL/L、44.72 μmol Trolox/mL。本研究为植物精油在食品行业中的深入开发提供理论依据。

